Method Article
Intubación endotraqueal mediante traqueotomía y posterior toracotomía en ratas para aplicaciones no relacionadas con la supervivencia
En este artículo
Resumen
Aquí presentamos un procedimiento estandarizado para la intubación endotraqueal a través de traqueotomía seguida de toracotomía en ratas, destinado a mejorar la precisión y la reproducibilidad de las aplicaciones de no supervivencia que requieren ventilación invasiva y exposición de órganos torácicos en modelos de ratas in vivo .
Resumen
La intubación endotraqueal y la ventilación posterior suelen ser requisitos básicos para la investigación traslacional en modelos de ratas para diversas intervenciones que requieren presiones de ventilación controladas o altas o acceso a la cavidad torácica y a los órganos. La intubación endoorotraqueal convencional utilizando la ruta anatómicamente existente a través de la boca es muy adecuada para los experimentos de supervivencia. Sin embargo, este procedimiento plantea algunos desafíos, que incluyen niveles generalmente más altos de la experiencia y habilidad técnica requeridas, equipos más avanzados y un mayor esfuerzo de tiempo con tasas de fracaso de la intubación relevantes y complicaciones como perforación traqueal, hipooxigenación sistémica temporal y fugas aéreas relevantes.
Por lo tanto, este manuscrito presenta un protocolo detallado paso a paso para la intubación endotraqueal a través de traqueotomía en modelos de ratas no sobrevivientes cuando se requiere un éxito de intubación garantizado, niveles de oxigenación constantes, altas presiones de ventilación o toracotomía abierta.
El protocolo enfatiza la importancia de una técnica quirúrgica meticulosa para garantizar resultados consistentes y confiables, especialmente para los investigadores que no tienen experiencia o carecen de rutina en la técnica de intubación endoorotraqueal mediante laringoscopia directa. Por lo tanto, se espera que este procedimiento minimice el sufrimiento de los animales y las pérdidas innecesarias de animales.
Introducción
En general, los roedores son capaces de compensar la dificultad respiratoria durante mucho más tiempo de lo que lo harían los pacientes. Pueden permanecer cardiocirculatorios estables y suficientes bajo ventilación espontánea durante mucho más tiempo y durante procedimientos más invasivos, por ejemplo, incluso mediante trasplante de hígado, que se sabe que es uno de los procedimientos más estresantes para la circulación cardiopulmonar 1,2,3.
Sin embargo, la intubación endotraqueal es un requisito básico para la investigación traslacional en modelos de ratas para diversos entornos e intervenciones originadas en una variedad de campos biomédicos y es esencial en el panorama científico actual 4,5,6,7,8,9,10,11 . Si bien la mayoría de los trabajos experimentales con animales de laboratorio realizados en ratas en general todavía no requieren ventilación invasiva12, hay ciertas configuraciones experimentales que requieren intubación y asistencia ventilatoria controlada. Estas configuraciones experimentales incluyen cualquier experimento que requiera una vía aérea segura, altas presiones de ventilación y laparoscopia o acceso directo a la cavidad torácica y los órganos.
Especialmente en el caso de acceso requerido a la cavidad torácica y a los órganos, la intubación endotraqueal es imperativa, ya que el colapso del pulmón resultará en una insuficiencia respiratoria fatal una vez que se pierda la presión negativa en el espacio intrapleural y el mecanismo de inspiración por los músculos intercostales y el diafragma13.
Si bien existen muchas publicaciones sobre métodos para la intubación endoorotraqueal no invasiva en roedores 14,15,16,17, parece haber una falta de protocolos de procedimiento para la intubación endotraqueal invasiva por traqueotomía. A pesar de lo invasivo de esta última, que solo permite su aplicación en modelos animales no supervivientes, existen grandes ventajas de la intubación mediante traqueotomía. Estos incluyen una curva de aprendizaje más pronunciada, tasas de éxito más altas y persistentes, menos equipos técnicos necesarios y mejores oportunidades de seguimiento del éxito18,19.
El éxito de la intubación es esencial para el resultado. Mientras que varias intubaciones falsas, así como intentos repetidos de intubación en los pacientes, están claramente asociados con eventos adversos y complicaciones tan graves como la muerte20,21, tales eventos también son deletéreos en animales de experimentación. En el mejor de los casos, representan una fuerte variable de confusión en el experimento, pero también pueden conducir a la pérdida innecesaria del animal. Por lo tanto, tiene sentido aumentar las tasas de éxito de la intubación a costa de la no invasividad si la configuración y la estrategia experimental lo permiten.
Este protocolo estandarizado de intubación mediante traqueotomía quirúrgica ofrece varias ventajas, incluida la menor variabilidad en las tasas de éxito de la intubación, la minimización de los efectos sobre los parámetros de la fisiología cardiorrespiratoria y el control y la manipulación completos de los parámetros. Ayuda a proporcionar una vía aérea segura, especialmente para investigadores sin experiencia en el procedimiento de intubación endotraqueal a través de laringoscopia directa, y permite a los investigadores realizar estudios de no supervivencia con condiciones altamente controladas. Destacamos los puntos de referencia anatómicos clave y brindamos información sobre la resolución de problemas comunes encontrados durante el procedimiento.
Protocolo
Todas las actividades con animales descritas aquí han sido aprobadas por el comité institucional de cuidado y uso de animales (IACUC) del Consejo Regional de Baden-Württemberg en Karlsruhe, Alemania. Los animales de experimentación se gestionaron de acuerdo con las normas institucionales y de acuerdo con las leyes alemanas para el uso y cuidado de los animales y de acuerdo con las directivas del Consejo de la Comunidad Europea (2010/63/UE), así como con las directrices ARRIVE, y se llevaron a cabo en instalaciones acreditadas. Se utilizaron ratas macho Spraque Dawley de Janvier Labs con un peso de pedido de 400 g.
1. Preparación del procedimiento (Figura 1)
- Prepare los ganchos de preparación quirúrgica doblando las cánulas en un ángulo de 135° a 1 cm con respecto a la punta, conectándolas a tubos de perfusión de plástico mediante Luer-lock y aplicando tensión con una pinza quirúrgica para mosquitos (Figura 1A, B).
- Prepare un aparato quirúrgico de exposición a roedores.
NOTA: Además de la disponibilidad de plataformas comerciales, éstas también pueden ser fácilmente autoconstruidas de manera rentable, como en este estudio.- Para ello, utilice una placa de acero de 40 cm x 50 cm con un grosor de 4 mm. Cree varios agujeros de 8 mm con un taladro de acero en la ubicación deseada para los puntos de tensión posteriores. Coloque las varillas de fijación en forma de Y en estos lugares.
- Coloque una almohadilla térmica encima de la placa de acero del aparato de exposición quirúrgica para proporcionar soporte térmico.
- Prepare los ganchos de preparación quirúrgica con tubos de plástico adjuntos y pinzas quirúrgicas para mosquitos para luego aplicar tensión al tejido para la exposición quirúrgica.
- Retire el tapón de una jeringa de plástico de 10 ml con un extremo Luer-lock macho y corte el extremo proximal de la jeringa. Inserte la parte distal en la bolsa de ventilación como se muestra y séllela herméticamente cubriéndola con un tubo termorretráctil y aplicando calor suave con un soplete de laboratorio (Figura 1D-F).
- Acortar y biselar diferentes tamaños de catéteres intravenosos e insertar una guía de un conjunto de catéteres líderes arteriales con el extremo de alambre flexible en la punta en el tamaño de catéter más apropiado para el tamaño respectivo del animal (presumiblemente 14 G) para la técnica de Seldinger posterior22,23 durante la intubación (Figura 1G, H).
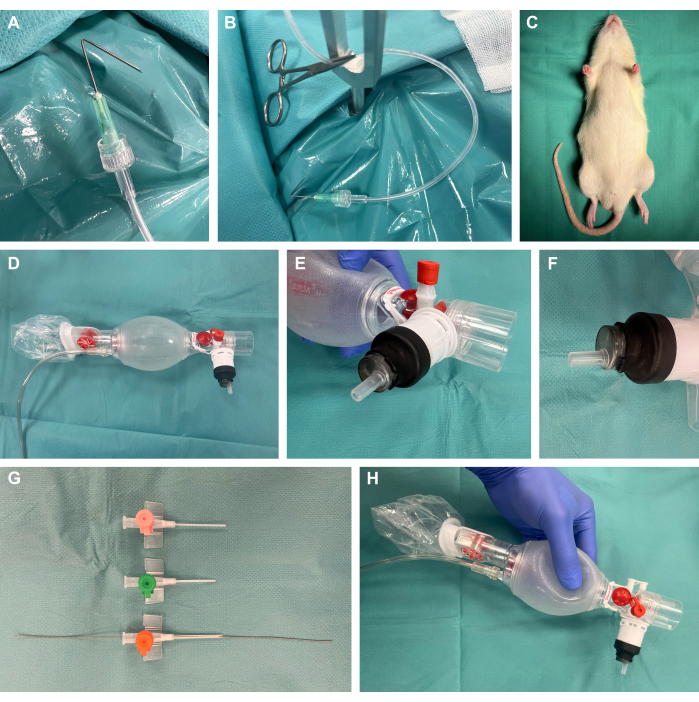
Figura 1: Configuración experimental. (A) Una cánula plegada conectada a un tubo de perfusión utilizado como gancho de preparación quirúrgica. (B) Gancho de preparación con abrazadera colocada en una varilla de fijación metálica. C) Animal sedado antes de la intervención. (D) Bolsa de ventilación de neonatología. (E-F) Montaje hermético de una jeringa Luer-lock en la bolsa de ventilación mediante un tubo termorretráctil. (G) Catéteres intravenosos acortados y biselados en diferentes tamaños con un alambre guía de un conjunto de cateterismo líder arterial para la técnica de Seldinger. (H) Construcción final a medida. Haga clic aquí para ver una versión más grande de esta figura.
2. Anestesia y analgesia
- Anestesia a la rata con el medicamento de su elección.
NOTA: En este caso, la anestesia y la analgesia se establecieron utilizando ketamina al 10% (100 mg/mL), xilacina al 2% (20 mg/mL), carprofeno 50 mg/mL e isoflurano. Se utilizó una dilución 1:10 de xilacina y carprofeno como soluciones madre para la aplicación.- Inducir la anestesia colocando al animal en una caja de inducción inundada con oxígeno al 100% a una tasa de entrada de 5 L/min complementada con un 4% (v) de isoflurano utilizando un vaporizador.
- Una vez alcanzado el conocimiento, saque al animal de la caja de inducción e indíquelo (i.p.) con 100 mg/kg de ketamina de peso corporal y 4 mg/kg de xilacina de peso corporal.
NOTA: Esto corresponde a 40 mg de ketamina (0,4 mL de la solución original) y 1,6 mg de xilacina (0,08 mL de la solución original o 0,8 mL de la solución 1:10) para un animal de 400 mg. - Vuelva a colocar al animal en la caja de inducción inundada con isoflurano hasta que se establezca el efecto de la inyección i.p.
- Garantice la profundidad anestésica adecuada probando la falta de respuesta de la rata a un pellizco firme del dedo del pie.
- Aplique ungüento oftálmico en los ojos.
- Evaluar y mantener la profundidad de la anestesia durante la cirugía.
- Cuando los efectos narcóticos parecieron disminuir con el tiempo (aproximadamente cada hora), inyecte (s.c) al animal 50 mg/kg de ketamina de peso corporal adicional y 1 mg/kg de xilacina de peso corporal. Esto corresponde a 20 mg de ketamina (0,2 mL de la solución original) y 0,4 mg de xilacina (0,2 mL de la solución 1:10) para un animal de 400 mg.
- Proporcionar analgesia adicional antes de la toracotomía con una inyección s.c. de 5 mg/kg de carprofeno de peso corporal. Esto corresponde a 2 mg de carprofeno (0,04 mL de la solución original o 0,4 mL de la solución 1:10) para un animal de 400 mg.
3. Preparación quirúrgica (Figura 2)
- Saturar la circulación animal con oxígeno ofreciendo inhalación de oxígeno al 100% a través de una mascarilla neonatal transnasal (Figura 2A).
- Después de 5 minutos, cambie la mascarilla neonatal transnasal por la construcción de una bolsa de ventilación neonatal con una jeringa de plástico macho con punta Luer-lock como se describió anteriormente y ofrezca oxígeno en rebosadero con la punta de la jeringa cerca de la punta nasal del animal (Figura 2B).
- Realice una incisión en la piel toracocervical mediana a lo largo de la longitud deseada y exponga el situs quirúrgico con los ganchos de preparación quirúrgica (Figura 2C, D).
- Avance la preparación mediante disección roma con tijeras finas a través de la fascia cervical. Exponga el músculo esternocleidomastoideo e infrahioideo, y lateralice el músculo infrahioidal mediano hacia la derecha después de la disección de la membrana lateral izquierda (Figura 2E-G).
- Realice una disección roma hacia la tráquea y un túnel de la tráquea utilizando pinzas overholt (Figura 2H-I).
- Eslingar la tráquea con un asa de silicona y doble eslinga de la tráquea distal con una sutura de polifilamento para la posterior fijación de la cánula endotraqueal (Figura 2J-N).

Figura 2: Preparación de la tráquea. (A) Inhalación de oxígeno a través de la mascarilla. (B) Cambie de mascarilla a jeringa Luer-lock macho para la aplicación de oxígeno. (C) Incisión en la piel toracocervical. (D) Preparación a través de la fascia cervical. (E) exposición del músculo esternocleidomastoideo y del músculo infrahioideo. (F) Lateralización del músculo infrahioidal mediano. (G) Disección roma hacia la tráquea. (H) Tunelización de la tráquea mediante abrazaderas overholt. (I) Eslingado de la tráquea usando un lazo de silicona para el vaso. (J-N) Doble eslingado caudal de la tráquea mediante sutura de polifilamento para su posterior fijación de la cánula endotraqueal. Haga clic aquí para ver una versión más grande de esta figura.
4. Procedimiento de intubación (Figura 3)
- Alargar caudalmente la tráquea con unos alicates atraumáticos (Figura 3A,B).
- Realice una incisión parcial de la tráquea de 180° de circunferencia con unas tijeras (Figura 3C-F).
- Introducir una guía de Seldinger con el extremo flexible en la tráquea (Figura 3G-H) y posteriormente introducir el catéter intravenoso modificado de circunferencia adecuada en la tráquea guiado por la mula de Seldinger (Figura 3I-N).
- Retire el cable de Seldinger (Figura 3O), conecte la punta Luer-lock del catéter traqueal a la bolsa de ventilación modificada e inicie una ventilación manual suave con protección pulmonar con alta frecuencia y bajo volumen corriente (Figura 3P). Realizar ventilación manual siempre y cuando no se haya realizado una toracotomía mediana y el pulmón no esté a la vista.
- Ate la sutura de bloqueo previamente colocada con un nudo deslizante para evitar fugas aéreas y la extracción accidental del catéter (Figura 3Q-T).

Figura 3: Intubación endotraqueal mediante traqueotomía. (A) Situación inicial después de la preparación. (B) Alargamiento caudal de la tráquea con alicates atrauónicos. (C-F) Incisión parcial de la tráquea de 180° de circunferencia. (G,H) Introducción de una guía Seldinger en la tráquea. (I-M) Introducción del catéter intravenoso modificado en la tráquea guiado por el alambre de Seldinger. (N-O) Extracción del alambre Seldinger. (P) Conexión Luer-lock del catéter traqueal a la bolsa de ventilación modificada. (Q-T) Atado de la sutura de bloqueo previamente colocada para evitar la extracción accidental del catéter. Haga clic aquí para ver una versión más grande de esta figura.
5. Ventilación manual y toracotomía mediana (Figura 4)
- Comience la toracotomía mediana desde el xifoides con unas tijeras de material romo y estable (Figura 4A, B) y continúe cranealmente a través del esternón. Siempre detenga la ventilación durante unos segundos cuando se avance con las tijeras por debajo del esternón y cuando se corte para evitar traumatismos en el pulmón (Figura 4C-E).
- Aumentar la exposición torácica con ganchos de preparación quirúrgica y retirar las membranas serosas mediastínicas (Figura 4F-H).
- Continuar con la ventilación manual con la frecuencia y el volumen corriente deseados y ampliar la monitorización (p. ej., estableciendo una medición de la presión arterial intraarterial, instalando un catéter arterial central venoso o pulmonar según el propósito o la pregunta de investigación respectiva) (Figura 4I-L).

Figura 4: Ventilación manual y toracotomía mediana. (A) Situación inicial después de la intubación. (B-E) Toracotomía mediana a partir del xifoides. (F-I) Exposición torácica mediante ganchos de preparación quirúrgica. (J) Montaje final durante la ventilación. (K-L) el proceso de ventilación manual. Haga clic aquí para ver una versión más grande de esta figura.
6. Eutanasia
- Lograr la eutanasia mediante cardiectomía brusca y aguda con tijeras en el animal profundamente anestesiado.
Resultados
Se realizó intubación endotraqueal mediante traqueotomía y posterior toracotomía en 10 ratas macho (peso medio 405 ± 30 g) para aplicaciones no supervivencia. El procedimiento fue realizado por un residente de cirugía de segundo año. La tasa de éxito definida por la supervivencia a lo largo de 20 min de intubación y ventilación fue del 100%. La duración media del procedimiento de preparación e intubación desde la incisión cutánea hasta la fijación del tubo de intubación fue de 6:55 ± 0:53 min (Tabla 1).
| Número de animales utilizados | 10 |
| Peso corporal (media y desviación estándar) | 405 ± 30 g |
| Tasa de éxito de la intubación | 100% |
| Duración del procedimiento (media y desviación estándar) | 6:55 ± 0:53 min |
| Saturación media de oxígeno | 96% |
| Saturación mínima de oxígeno | 92% |
Tabla 1: Resultados representativos. Resultados representativos del protocolo en 10 animales.
La saturación se controló a través de una sonda de pulsioximetría autoadhesiva de un solo uso en la pata trasera y nunca bajó del 92%. La ventilación espontánea fue contenida hasta la incisión del diafragma. Todas las ratas sobrevivieron a los 20 min necesarios para las mediciones experimentales hasta la eutanasia intencional mediante cardiectomía brusca y aguda (Figura 5).

Figura 5: Saturación periférica de oxígeno. Saturación periférica de oxígeno medida durante toda la duración de este procedimiento. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Solo en los Estados Unidos, alrededor de 110 millones de ratas y ratones se utilizan en experimentos con animales por año24. Si bien no se pueden encontrar estadísticas confiables, un porcentaje relevante de estos recibirán ventilación asistida, especialmente en los campos de la investigación pulmonar y cardíaca, así como en la anestesiología. La mayoría de estos animales reciben intubación endoorotraqueal no invasiva, lo que conlleva una serie de desafíos. Estos incluyen curvas de aprendizaje más lentas, tasas más altas de fracaso de la intubación, mayor número de reintubaciones y complicaciones respiratorias asociadas, así como fugas respiratorias25. Por lo tanto, la intubación no invasiva generalmente requerirá personal de investigación más experimentado, tecnología más avanzada como fibra óptica, capnometría y ventiladores mecánicos, y mayores recursos financieros y materiales26. Todo el aspecto de la intubación es, por lo tanto, un factor de confusión significativo relevante en el análisis estadístico posterior y la heterogeneidad interindividual de los resultados. Sin embargo, la intubación endoorotraqueal no invasiva es a menudo la única opción factible en los diseños de experimentos longitudinales.
Las alternativas son la traqueostomía para el acceso traqueal requerido a largo plazo en experimentos longitudinales o la traqueotomía quirúrgica de "uso único" en experimentos sin supervivencia. Si bien se dispone de protocolos sobre la técnica microquirúrgica para la traqueostomía en ratas27, actualmente no existen protocolos para la intubación endotraqueal mediante traqueotomía en modelos de ratas no sobrevivientes.
Por lo tanto, el procedimiento estandarizado descrito en este documento para la intubación endotraqueal a través de traqueotomía y la posterior toracotomía en ratas representa un método valioso para los investigadores que participan en estudios de no supervivencia. Este procedimiento no requiere personal experto ni una amplia formación. Tiene una tasa de éxito de la intubación que es mucho más alta que la intubación endoorotraqueal y permite pasos del procedimiento mucho más controlados.
Las limitaciones de las técnicas presentadas incluyen principalmente la invasividad del procedimiento y, consecutivamente, la compatibilidad exclusiva con experimentos de no supervivencia. Debido a los grandes defectos en la piel y los tejidos blandos, así como a la fístula traqueal incisional, la extubación y la recuperación de este procedimiento no son factibles ni recomendables, especialmente cuando se combina con la toracotomía.
Al solucionar los problemas comunes encontrados durante el procedimiento, nos gustaría llamar la atención sobre los siguientes puntos y recomendaciones: uno debe preparar el equipo y la medicación lo más extensamente posible. El experimentador debe realizar el control hemostático meticulosamente mediante una preparación fina y el uso de hisopos de algodón no traumáticos. El experimentador debe preparar la tráquea a lo largo de al menos 0,5 cm para permitir una movilidad suficiente y utilizar el asa del vaso de silicona para no perder la tráquea después de la incisión, ya que esto puede resultar en aspiración y asfixia cuando la tráquea se pierde en la profundidad del tejido debido al fenómeno del fondo. Solo incida parcialmente la tráquea con un trazo claro de las tijeras. Lo ideal es hacer una incisión de 180° de circunferencia. Por debajo de esto, podría resultar en la falla de intubato. Por encima de esto, puede resultar en el chasquido de la tráquea con retracción de ambos extremos en la profundidad del tejido y la posterior asfixia. Al atar la sutura de polifilamento para asegurar el tubo de intubación, se debe usar un nudo deslizante para garantizar la estanqueidad suficiente para evitar fugas de aire o dislocaciones accidentales del tubo y, al mismo tiempo, evitar el cierre involuntario del tubo. Dejar el alambre Seldinger en su lugar durante la sutura puede evitar un cierre involuntario. Al realizar la ventilación manual con la bolsa de ventilación, se debe evitar estrictamente el barotrauma del pulmón por volúmenes corrientes altos. En su lugar, se debe optar más bien por la ventilación protectora de los pulmones, de alta frecuencia y de baja corriente, especialmente mientras no se haya realizado una toracotomía y los volúmenes pulmonares no puedan evaluarse visualmente.
Al ofrecer una metodología detallada y reproducible, este protocolo facilita la estandarización de los procedimientos experimentales, mejorando la fiabilidad de los datos y la comparabilidad entre estudios. Como resultado, este método contribuye al refinamiento de las técnicas científicas en la investigación preclínica, mejorando en última instancia la relevancia traslacional de los hallazgos en los campos de la fisiología, la farmacología, las ciencias quirúrgicas y biomédicas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen el servicio de almacenamiento de datos SDS@hd apoyado por el Ministerio de Ciencia, Investigación y Artes de Baden-Württemberg (MWK) y la Fundación Alemana de Investigación (DFG) a través de las subvenciones INST 35/1314-1 FUGG e INST 35/1503-1 FUGG. Además, los autores agradecen el apoyo del NCT (Centro Nacional de Enfermedades Tumorales de Heidelberg, Alemania) a través de su programa estructurado de postdoctorado y el programa de Oncología Quirúrgica. También reconocemos el apoyo a través de fondos estatales aprobados por el Parlamento del Estado de Baden-Württemberg para la Alianza de Ciencias de la Vida + Salud del Campus de Innovación de Heidelberg Mannheim del programa postdoctoral estructurado para Alexander Studier-Fischer: Inteligencia Artificial en la Salud (AIH) - Una colaboración de DKFZ, EMBL, Universidad de Heidelberg, Hospital Universitario de Heidelberg, Hospital Universitario de Mannheim, Instituto Central de Salud Mental, y el Instituto Max Planck de Investigación Médica. Además, agradecemos el apoyo a través del Instituto de Cáncer DKFZ Hector en el Centro Médico Universitario de Mannheim. Por la tarifa de publicación, agradecemos el apoyo financiero de la Deutsche Forschungsgemeinschaft dentro del programa de financiación "Open Access Publikationskoste", así como de la Universidad de Heidelberg.
Materiales
| Name | Company | Catalog Number | Comments |
| Ambu Spur II Single-Use ventilation bag for neonates | Meier Medizintechnik | 335 102 000 | Ventilation bag |
| BD Microlance 3 cannula 20 G | BD (Beckton, Dickinson) | 301300 | Cannula |
| BD Microlance Discardit II 20 mL Syringe | BD (Beckton, Dickinson) | 300296 | Plastic syringe |
| Fixation rods | Legefirm | 500343896 | Tuning forks used as y-shaped metal fixation rods |
| Heat-shrinking tube | Sekesoer | RSG-400 | Heat-shrinking tube |
| Intravenous catheter | BD (Beckton, Dickinson) | 393230 | BD Venflon Pro Safety intravenous catheter 14 G; shortened using scissors; alternatively 16 G or 18 G can be used |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | Connecting tube COEX 150 cm |
| Polyfilament suture | COVIDIEN | CL331 | Polyfilament surgical suture recommended with a strength of 1 to 2; needle can be removed |
| Royal Gardineer Heating Pad Size S, 20 Watt | Royal Gardineer | IP67 | Heating pad |
| Seldinger guide wire | VYGON | 115.798 | Metal guide wire from the arterial leadercath set |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | Silicone vessel loop tie 2.5 mm red |
| Spraque Dawley rats | Janvier Labs | Male rats weighing 400 grams | |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
Referencias
- Czigany, Z., et al. Limb remote ischemic conditioning of the recipient protects the liver in a rat model of arterialized orthotopic liver transplantation. PLoS One. 13 (4), e0195507 (2018).
- Czigány, Z., et al. Improving research practice in rat orthotopic and partial orthotopic liver transplantation: A review, recommendation, and publication guide. Eur Surg Res. 55 (1-2), 119-138 (2015).
- Nagai, K., Yagi, S., Uemoto, S., Tolba, R. H. Surgical procedures for a rat model of partial orthotopic liver transplantation with hepatic arterial reconstruction. J Vis Exp. 73, e4376 (2013).
- Jahshan, F., et al. A novel rat model for assessment of laryngotracheal injury following transoral intubation. Int J Pediatr Otorhinolaryngol. 113, 4-10 (2018).
- Lamoureux, L., Radhakrishnan, J., Gazmuri, R. J. A rat model of ventricular fibrillation and resuscitation by conventional closed-chest technique. J Vis Exp. 98, 52413 (2015).
- Wang, Z., et al. Autoinducer-2 of streptococcus mitis as a target molecule to inhibit pathogenic multi-species biofilm formation in vitro and in an endotracheal intubation rat model. Front Microbiol. 7, 88 (2016).
- Jahshan, F., et al. A novel rat model for tracheal mucosal damage assessment of following long term intubation. Int J Pediatr Otorhinolaryngol. 128, 109738 (2020).
- Rivard, A. L., et al. Rat intubation and ventilation for surgical research. J Invest Surg. 19 (4), 267-274 (2006).
- Na, N., Zhao, D. Q., Huang, Z. Y., Hong, L. Q. An improved method for rat intubation and thymectomy. Chin Med J (Engl). 124 (17), 2723-2727 (2011).
- Cicero, L., Fazzotta, S., Palumbo, V. D., Cassata, G., Lo Monte, A. I. Anesthesia protocols in laboratory animals used for scientific purposes. Acta Biomed. 89 (3), 337-342 (2018).
- Fuentes, J. M., et al. Videoendoscopic endotracheal intubation in the rat: A comprehensive rodent model of laparoscopic surgery. J Surg Res. 122 (2), 240-248 (2004).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Lazopoulos, A., et al. Open thoracotomy for pneumothorax. J Thorac Dis. 7 (S1), S50-S55 (2015).
- Rendell, V. R., Giamberardino, C., Li, J., Markert, M. L., Brennan, T. V. Complete thymectomy in adult rats with non-invasive endotracheal intubation. J Vis Exp. 94, 52152 (2014).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. 86, 50269 (2014).
- Nelson, A. M., Nolan, K. E., Davis, I. C. Repeated orotracheal intubation in mice. J Vis Exp. 157, 60844 (2020).
- Das, S., Macdonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. 73, e50318 (2013).
- Massick, D. D., et al. Quantification of the learning curve for percutaneous dilatational tracheotomy. Laryngoscope. 110 (2 Pt 1), 222-228 (2000).
- Giugliano, G., et al. Learning curve for translaryngeal tracheotomy in head and neck surgery. Laryngoscope. 111 (4 Pt 1), 628-633 (2001).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesth Analg. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Ann Emerg Med. 60 (6), 749-754.e742 (2012).
- Titu, I. M., Delaca, G. B., Teterea, F., Ciulic, S. A., Palade, E. Percutaneous tracheostomy using the Seldinger technique. Multimed Man Cardiothorac Surg. 2023, (2023).
- Garry, B. P., Bivens, H. E. The Seldinger technique. J Cardiothorac Anesth. 2 (3), 403 (1988).
- Carbone, L. Estimating mouse and rat use in American laboratories by extrapolation from animal welfare act-regulated species. Sci Rep. 11 (1), 493 (2021).
- Su, C. S., et al. Efficacious and safe orotracheal intubation for laboratory mice using slim torqueable guidewire-based technique: Comparisons between a modified and a conventional method. BMC Anesthesiol. 16, 5 (2016).
- Clary, E. M., O'halloran, E. K., De La Fuente, S. G., Eubanks, S. Videoendoscopic endotracheal intubation of the rat. Lab Anim. 38 (2), 158-161 (2004).
- Ghali, M. G. Z. Microsurgical technique for tracheostomy in the rat. MethodsX. 5, 61-67 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados