Method Article
אינטובציה אנדוטרכאלית באמצעות טרכאוטומיה ולאחר מכן ניתוחי בית החזה בחולדות ליישומים שאינם הישרדותיים
In This Article
Summary
כאן אנו מציגים הליך סטנדרטי לאינטובציה אנדוטרכאלית באמצעות טרכאוטומיה ואחריה בית החזה בחולדות, שמטרתו לשפר את הדיוק והשחזור של יישומים שאינם הישרדותיים הדורשים הנשמה פולשנית וחשיפה של איברי בית החזה במודלים של חולדות in vivo .
Abstract
אינטובציה אנדוטרכאלית ואוורור לאחר מכן הן לעתים קרובות דרישות בסיסיות למחקר תרגומי במודלים של חולדות עבור התערבויות שונות הדורשות לחצי אוורור מבוקרים או גבוהים או גישה לחלל החזה ולאיברים. אינטובציה אנדואורוטרכאלית קונבנציונלית באמצעות המסלול האנטומי הקיים דרך הפה מתאימה היטב לניסויי הישרדות. עם זאת, הליך זה מציב כמה אתגרים, כולל בדרך כלל רמות גבוהות יותר של הניסיון והמיומנות הטכנית הנדרשים, ציוד מתקדם יותר ומאמץ זמן גדול יותר עם שיעורי כישלון אינטובציה רלוונטיים וסיבוכים כגון ניקוב קנה הנשימה, תת-חמצון מערכתי זמני ודליפה אווירית רלוונטית.
כתב יד זה, אם כן, מציג פרוטוקול מפורט שלב אחר שלב לאינטובציה אנדוטרכאלית באמצעות טרכאוטומיה במודלים של חולדות שאינן הישרדותיות כאשר נדרשת הצלחה מובטחת באינטובציה, רמות חמצון קבועות, לחצי אוורור גבוהים או בית חזה פתוח.
הפרוטוקול מדגיש את החשיבות של טכניקה כירורגית קפדנית כדי להבטיח תוצאות עקביות ואמינות, במיוחד עבור חוקרים חסרי ניסיון או חסרי שגרה בטכניקה של אינטובציה אנדואורוטרכאלית באמצעות לרינגוסקופיה ישירה. הליך זה צפוי, אם כן, למזער את סבלם של בעלי חיים ואת אובדן בעלי החיים המיותרים.
Introduction
באופן כללי, מכרסמים מסוגלים לפצות על מצוקה נשימתית למשך זמן רב יותר מאשר החולים. הם יכולים להישאר יציבים ומספיקים תחת הנשמה ספונטנית למשך זמן רב יותר ובמהלך הליכים פולשניים יותר, למשל, אפילו באמצעות השתלת כבד, אשר ידוע כאחד ההליכים המלחיצים ביותר עבור מחזור הלב ריאה 1,2,3.
עם זאת, אינטובציה אנדוטרכאלית היא דרישה בסיסית למחקר תרגומי במודלים של חולדות עבור סביבות והתערבויות שונות שמקורן במגוון תחומים ביו-רפואיים והיא חיונית בנוף המדעי של ימינו 4,5,6,7,8,9,10,11 . בעוד שרוב עבודות המעבדה הניסיוניות המבוצעות בחולדות באופן כללי עדיין אינן דורשות הנשמה פולשנית12, ישנם מערכי ניסוי מסוימים הדורשים אינטובציה וסיוע הנשמה מבוקר. מערכי ניסוי אלה כוללים כל ניסוי הדורש נתיב אוויר מאובטח, לחצי אוורור גבוהים, לפרוסקופיה או גישה ישירה לחלל החזה ולאיברים.
במיוחד במקרה של גישה נדרשת לחלל החזה ואיברים, אינטובציה אנדוטרכאלית היא הכרחית מכיוון שקריסת הריאה תגרום לאי ספיקה נשימתית קטלנית ברגע שהלחץ השלילי בחלל התוך פלאורלי ומנגנון ההשראה של השרירים הבין-קוסטליים והסרעפת יאבדו13.
בעוד שישנם פרסומים רבים על שיטות לאינטובציה אנדואורוטרכאלית לא פולשנית במכרסמים 14,15,16,17, נראה כי חסרים פרוטוקולים לאינטובציה אנדוטרכאלית פולשנית על ידי טרכאוטומיה. למרות הפולשנות של האחרון, אשר מאפשר יישום רק מודלים בעלי חיים שאינם הישרדות, ישנם יתרונות גדולים של אינטובציה באמצעות tracheotomy. אלה כוללים עקומת למידה תלולה יותר, שיעורי הצלחה גבוהים ומתמידים יותר, ציוד טכני פחות נדרש, והזדמנויות משופרות לניטור הצלחה18,19.
הצלחת האינטובציה חיונית לתוצאה. בעוד דגירות שווא שונות, כמו גם ניסיונות אינטובציה חוזרים ונשנים בחולים, קשורים בבירור עם תופעות לוואי וסיבוכים חמורים כמו מוות20,21, אירועים כאלה מזיקים גם בחיות ניסוי. במקרה הטוב, הם מייצגים משתנה מבלבל חזק בניסוי, אבל הם יכולים גם להוביל לאובדן מיותר של החיה. לכן, הגיוני להגדיל את שיעורי ההצלחה של אינטובציה במחיר של אי-פולשניות אם מערך הניסוי והאסטרטגיה מאפשרים זאת.
פרוטוקול סטנדרטי זה של אינטובציה באמצעות טרכאוטומיה כירורגית מציע מספר יתרונות, כולל שונות מופחתת בשיעורי ההצלחה של אינטובציה, השפעות ממוזערות על הפרמטרים של פיזיולוגיה לב-נשימתית, ובקרה מחקרית מלאה ומניפולציה של פרמטרים. הוא מסייע במתן נתיב אוויר מאובטח, במיוחד עבור חוקרים חסרי ניסיון בהליך של אינטובציה אנדוטרכאלית באמצעות לרינגוסקופיה ישירה, ומאפשר לחוקרים לנהל מחקרים שאינם הישרדות עם תנאים מבוקרים מאוד. אנו מדגישים ציוני דרך אנטומיים מרכזיים ומספקים תובנות לגבי פתרון בעיות נפוצות בהן נתקלים במהלך ההליך.
Protocol
כל פעילויות בעלי החיים המתוארות כאן אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) של המועצה האזורית באדן-וירטמברג בקרלסרוהה, גרמניה. חיות ניסוי נוהלו על פי תקנים מוסדיים ועל פי החוקים הגרמניים לשימוש וטיפול בבעלי חיים ועל פי הנחיות מועצת הקהילה האירופית (2010/63/EU) וכן הנחיות ARRIVE ונערכו במתקנים מוכרים. חולדות ספראק דולי זכרים ממעבדות Janvier עם משקל הזמנה של 400 גרם שימשו.
1. הכנת ההליך (איור 1)
- הכינו ווים להכנה כירורגית על-ידי קיפול צינוריות בזווית של 135° ב-1 ס"מ לקצה, חיבורן לצינורות זילוח פלסטיק באמצעות Luer-lock, והפעלת מתח באמצעות מהדק יתושים כירורגי (איור 1A,B).
- הכינו מכשיר חשיפה כירורגי למכרסמים.
הערה: מלבד הזמינות של פלטפורמות מסחריות, אלה יכולים בקלות גם להיות בנייה עצמית חסכונית, כמו במחקר זה.- לשם כך, השתמש צלחת פלדה 40 ס"מ x 50 ס"מ עם עובי 4 מ"מ. צור מספר חורים בקוטר 8 מ"מ באמצעות מקדח פלדה במיקום הרצוי לנקודות מתח עוקבות. הניחו את מוטות הקיבוע בצורת Y במקומות אלה.
- הניחו כרית חימום על גבי פלטת הפלדה של מנגנון החשיפה הכירורגי על מנת לספק תמיכה תרמית.
- הכינו את ווי ההכנה הכירורגיים עם צינורות פלסטיק מחוברים ומהדקי יתושים כירורגיים כדי להפעיל מאוחר יותר מתח על הרקמה לחשיפה כירורגית.
- הסר את התקע של מזרק פלסטיק 10 מ"ל עם קצה Luer-lock זכר וחתך את הקצה הפרוקסימלי של המזרק. הכניסו את החלק הדיסטלי לשקית האוורור כפי שמתואר ואטמו אותה אטומה על-ידי כיסויו בצינור מתכווץ חום והפעלת חום עדין באמצעות פנס מעבדה (איור 1D-F).
- קצרו ושיפעו גדלים שונים של צנתרים תוך ורידיים והכניסו חוט מנחה מסט מוביל עורקי עם קצה חוט גמיש בקצה לגודל הצנתר המתאים ביותר לגודל בעל החיים המתאים (ככל הנראה 14 גרם) לטכניקת סלדינגר22,23 במהלך אינטובציה (איור 1G,H).
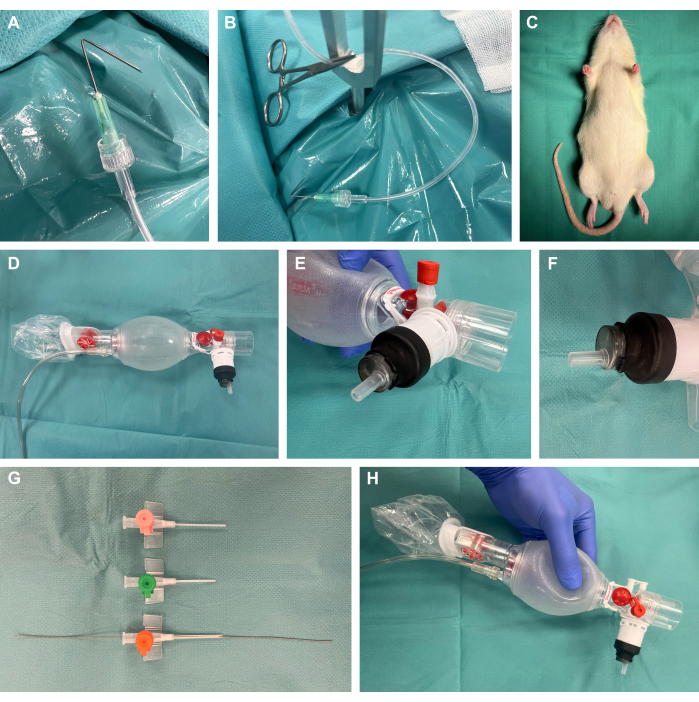
איור 1: מערך ניסויי. (A) צינורית מקופלת המחוברת לצינור זילוח המשמש כוו הכנה כירורגי. (B) וו הכנה עם מהדק הממוקם במוט קיבוע מתכת. (ג) בעל חיים מורדם לפני התערבות. (ד) שקית אוורור מנאונטולוגיה. (ה-ו) הרכבה אטומה של מזרק Luer-lock על שקית האוורור באמצעות צינור מתכווץ חום. (G) צנתרים תוך ורידיים מקוצרים ומשופעים בגדלים שונים עם חוט מנחה מעורק-מוביל-קתות שנקבע לטכניקת סלדינגר. (ח) בנייה סופית בהתאמה אישית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. הרדמה ושיכוך כאבים
- מרדימים את החולדה עם התרופה המועדפת.
הערה: כאן, הרדמה ושיכוך כאבים הוקמו באמצעות קטמין 10% (100 מ"ג / מ"ל), xylazine 2% (20 מ"ג / מ"ל), carprofen 50 מ"ג / מ"ל, ו isoflurane. דילול 1:10 של קסילזין וקרפרופן שימשו כפתרונות מלאי ליישום.- יש להשרות הרדמה על ידי הנחת בעל החיים בקופסת אינדוקציה מוצפת ב-100% חמצן בקצב זרימה של 5 ליטר/דקה, בתוספת 4% (v) איזופלורן באמצעות וופורייזר.
- לאחר שהושגה איבוד הכרה, הוציאו את בעל החיים מקופסת האינדוקציה והזריקו לו (כלומר) קטמין במשקל גוף של 100 מ"ג/ק"ג וקטמין במשקל גוף של 4 מ"ג/ק"ג קסילזין.
הערה: זה מתאים ל-40 מ"ג קטמין (0.4 מ"ל של התמיסה המקורית) ו-1.6 מ"ג של קסילזין (0.08 מ"ל של התמיסה המקורית או 0.8 מ"ל של תמיסת 1:10) עבור חיה של 400 מ"ג. - החזירו את בעל החיים לקופסת האינדוקציה המוצפת באיזופלורן עד להופעת השפעת הזרקת האיי.פי.
- הבטיחו עומק הרדמה תקין על ידי בדיקת חוסר התגובה של החולדה לצביטת בוהן יציבה.
- החל משחה אופתלמית על העיניים.
- להעריך ולשמור על עומק ההרדמה במהלך הניתוח.
- כאשר נראה שההשפעות הנרקוטיות פוחתות עם הזמן (בערך כל שעה), הזריקו לחיה (s.c) קטמין נוסף של 50 מ"ג/ק"ג משקל גוף ו-1 מ"ג/ק"ג משקל גוף קסילזין. זה מתאים 20 מ"ג של קטמין (0.2 מ"ל של הפתרון המקורי) ו 0.4 מ"ג של xylazine (0.2 מ"ל של פתרון 1: 10) עבור חיה 400 מ"ג.
- לספק שיכוך כאבים נוסף לפני בית החזה עם זריקת s.c. של 5 מ"ג / ק"ג משקל גוף carprofen. זה מתאים 2 מ"ג של carprofen (0.04 מ"ל של הפתרון המקורי או 0.4 מ"ל של פתרון 1: 10) עבור חיה 400 מ"ג.
3. הכנה כירורגית (איור 2)
- הרוו את זרימת הדם של בעלי החיים בחמצן על-ידי מתן שאיפה של 100% חמצן דרך מסכת יילודים טרנס-נזאלית (איור 2A).
- לאחר 5 דקות, עברו ממסכת היילוד הטרנס-אפית לבניית שקית אוורור ליילודים עם קצה מזרק פלסטיק זכרי Luer-lock כמתואר לעיל, והציעו חמצן בהצפה כשקצה המזרק קרוב לקצה האף של החיה (איור 2B).
- בצעו חתך חציוני בעור בית החזה לאורך הרצוי וחשפו את הסיטוס הניתוחי באמצעות ווים להכנת הניתוח (איור 2C,D).
- מקדמים את ההכנה על ידי דיסקציה קהה עם מספריים עדינים דרך הפאשיה הצווארית. חשוף את שריר הסטרנוקלידומסטואיד והשריר האינפראהיואידלי והפוך את השריר האינפראה-יואידלי החציוני לימין לאחר דיסקציה של הקרום הלטרלי השמאלי (איור 2E-G).
- בצעו דיסקציה קהה לכיוון קנה הנשימה ומנהור קנה הנשימה באמצעות מלחציים עיליים (איור 2H-I).
- קלע את קנה הנשימה באמצעות לולאת כלי סיליקון וקלע כפול את קנה הנשימה הדיסטלי באמצעות תפר פוליפילמנט לקיבוע מאוחר יותר של צינורית אנדוטרכאלית (איור 2J-N).

איור 2: הכנת קנה הנשימה. (A) שאיפת חמצן באמצעות מסכה. (B) יש לעבור ממסכה למזרק Luer-lock זכר למריחת חמצן. (C) חתך בעור בית החזה. (D) הכנה דרך הפאשיה הצווארית. (E) חשיפה של שריר הסטרנוקלידומסטואיד והשריר האינפראהיואידי. (F) לטרליזציה של השריר האינפראהיואידלי החציוני. (ז) דיסקציה קהה לכיוון קנה הנשימה. (H) מנהור קנה הנשימה באמצעות מהדקים אוברהולט. (I) קלע קנה הנשימה באמצעות לולאת כלי סיליקון. (י-נ) קלע כפול קאודלי של קנה הנשימה באמצעות תפר נימה פולי לקיבוע צינורית אנדוטרכאלית מאוחרת יותר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. הליך אינטובציה (איור 3)
- האריכו את קנה הנשימה בעזרת צבת א-טראומטית (איור 3A,B).
- בצעו חתך חלקי בקנה הנשימה בהיקף של 180° באמצעות מספריים (איור 3C-F).
- הכניסו חוט מנחה של סלדינגר עם הקצה הגמיש לתוך קנה הנשימה (איור 3G-H) ולאחר מכן הכניסו את הצנתר התוך-ורידי המותאם בהיקף המתאים לתוך קנה הנשימה בהנחיית חוט סלדינגר (איור 3I-N).
- הסירו את חוט הסלדינגר (איור 3O), חברו את קצה מנעול הלואר של צנתר קנה הנשימה לשקית האוורור שעברה שינוי, והתחילו אוורור ידני עדין להגנה על הריאות בתדירות גבוהה ובנפח גאות נמוך (איור 3P). בצע הנשמה ידנית כל עוד החזה החציוני לא בוצע והריאה אינה גלויה לעין.
- קשרו את תפר הנעילה שהונח קודם לכן עם קשר הזזה כדי למנוע דליפה אווירית והוצאת קטטר בשוגג (איור 3Q-T).

איור 3: אינטובציה אנדוטרכאלית באמצעות טרכאוטומיה. (A) מצב ראשוני לאחר הכנה. (B) הארכה קאודלית של קנה הנשימה באמצעות צבת א-טראומטית. (ג-ו) חתך חלקי בקנה הנשימה של 180° של היקף. (ז,ח) הכנסת חוט מנחה של סלדינגר לקנה הנשימה. (ט-מ) החדרת קטטר תוך ורידי שונה לתוך קנה הנשימה מונחה על ידי חוט Seldinger. (נ-ו) הסרת חוט הסלדינגר. (P) חיבור Luer-lock של קטטר קנה הנשימה לשקית האוורור המותאמת. (כ-ט) קשירת תפר הנעילה שהונח בעבר כדי למנוע הוצאת קטטר בשוגג. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. אוורור ידני וחציון בית החזה (איור 4)
- התחילו את בית החזה החציוני מהקסיפואיד באמצעות מספריים קהים ויציבים (איור 4A,B) והמשיכו בגולגולת דרך עצם החזה. יש להשהות תמיד את האוורור למספר שניות כאשר מתקדמים עם המספריים בצורה תת-מהותית ובעת חיתוך כדי למנוע טראומה לריאה (איור 4C-E).
- השג חשיפה לבית החזה באמצעות ווים להכנה כירורגית והסר את קרומי הסרוסל המדיאסטינליים (איור 4F-H).
- המשך אוורור ידני בתדירות הרצויה ובנפח הגאות הרצוי והרחבת הניטור (למשל, קביעת מדידת לחץ דם תוך עורקי, התקנת צנתר ורידי מרכזי או עורקי ריאה בהתאם למטרה או לשאלת המחקר המתאימה) (איור 4I-L).

איור 4: אוורור ידני וחציון בית החזה. (A) מצב ראשוני לאחר אינטובציה. (ב-ה) חציון בית החזה החל מהקסיפואיד. (פ-י) חשיפה לבית החזה באמצעות ווים להכנה כירורגית. (י) התקנה סופית במהלך האוורור. (K-L) תהליך של אוורור ידני. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
6. המתת חסד
- להשיג המתת חסד על ידי כריתת לב חדה פתאומית באמצעות מספריים בחיה מורדמת עמוק.
תוצאות
אינטובציה אנדוטרכאלית באמצעות טרכאוטומיה ולאחר מכן בית החזה בוצעה ב-10 חולדות זכרים (משקל ממוצע 405 ±-30 גרם) ליישומים שאינם הישרדותיים. ההליך בוצע על ידי מתמחה שנה שנייה בכירורגיה. שיעור ההצלחה שהוגדר על ידי הישרדות מעל 20 דקות של אינטובציה והנשמה היה 100%. משך הזמן הממוצע של הליך ההכנה והאינטובציה מהחתך בעור ועד לקיבוע צינור האינטובציה היה 6:55 ± 0:53 דקות (טבלה 1).
| מספר בעלי החיים בשימוש | 10 |
| משקל גוף (ממוצע וסטיית תקן) | 405 ± 30 גרם |
| שיעור הצלחה באינטובציה | 100% |
| משך ההליך (ממוצע וסטיית תקן) | 6:55 ± 0:53 דקות |
| ריווי חמצן ממוצע | 96% |
| ריווי חמצן מינימלי | 92% |
טבלה 1: תוצאות מייצגות. תוצאות מייצגות של הפרוטוקול ב-10 בעלי חיים.
הרוויה נוטרה באמצעות בדיקה חד-פעמית של דופק-אוקסימטריה עצמית ברגל האחורית ומעולם לא ירדה מתחת ל-92%. אוורור ספונטני נבלם עד החתך של הסרעפת. כל החולדות שרדו את 20 הדקות שנדרשו למדידות הניסוי עד להמתת חסד מכוונת באמצעות כריתת לב חדה ופתאומית (איור 5).

איור 5: רוויית חמצן היקפית. ריווי חמצן היקפי נמדד לאורך כל תקופת הליך זה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
בארה"ב לבדה, כ-110 מיליון חולדות ועכברים משמשים בניסויים בבעלי חיים בשנה24. אמנם לא ניתן למצוא נתונים מהימנים, אך אחוז רלוונטי מהם יקבל הנשמה נתמכת, במיוחד בתחומי מחקר ריאות ולב, כמו גם הרדמה. רוב בעלי החיים הללו מקבלים אינטובציה אנדואורוטרכאלית לא פולשנית, הכרוכה במספר אתגרים. אלה כוללים עקומות למידה איטיות יותר, שיעורים גבוהים יותר של כישלון אינטובציה, מספר גדול יותר של אינטובציות, סיבוכים נשימתיים הקשורים, כמו גם דליפות נשימתיות25. אינטובציה לא פולשנית תדרוש אפוא בדרך כלל אנשי מחקר מנוסים יותר, טכנולוגיות מתקדמות יותר כגון סיבים אופטיים, קפנומטריה ומכונות הנשמה, ומשאבים כספיים וחומרניים גדולים יותר26. כל ההיבט של אינטובציה הוא, אם כן, בלבול משמעותי הרלוונטי בניתוח סטטיסטי עוקב ובהטרוגניות בין-אישית של תוצאות. עם זאת, אינטובציה אנדואורוטרכאלית לא פולשנית היא לעתים קרובות האפשרות המעשית היחידה בתכנוני ניסויים אורכיים.
חלופות הן טרכאוסטומיה לגישה ארוכת טווח לקנה הנשימה בניסויים אורכיים או טרכאוטומיה כירורגית ל"שימוש חד-פעמי" בניסויים שאינם הישרדותיים. בעוד פרוטוקולים על טכניקה מיקרוכירורגית עבור tracheostomy בחולדות זמינים27, אין כיום פרוטוקולים עבור אינטובציה endotracheal באמצעות tracheotomy במודלים חולדות שאינם הישרדות.
ההליך הסטנדרטי המתואר כאן עבור אינטובציה אנדוטרכאלית באמצעות טרכאוטומיה ולאחר מכן thoracotomy בחולדות, אם כן, מייצג שיטה רבת ערך עבור חוקרים העוסקים במחקרים שאינם הישרדות. הליך זה אינו דורש כוח אדם מומחה או הכשרה מקיפה. יש לו שיעור הצלחה באינטובציה שהוא הרבה יותר גבוה מאשר אינטובציה אנדואורוטרכאלית ומאפשר צעדים פרוצדורליים הרבה יותר מבוקרים.
מגבלות הטכניקות המוצגות כוללות בעיקר את הפולשנות של ההליך, וברצף, את התאימות הבלעדית עם ניסויים שאינם הישרדות. בשל הפגמים הגדולים בעור וברקמות רכות, כמו גם פיסטולה בקנה הנשימה החתך, אקסטובציה והתאוששות מהליך זה אינם אפשריים ואינם מומלצים, במיוחד בשילוב עם תוראקוטומיה.
בעת פתרון בעיות נפוצות בהן נתקלים במהלך ההליך, ברצוננו להפנות את תשומת הלב לנקודות ולהמלצות הבאות: יש להכין ציוד ותרופות באופן נרחב ככל האפשר. על הנסיין לבצע בקרה המוסטטית בקפדנות על ידי הכנה עדינה ושימוש במקלוני צמר גפן לא טראומטיים. על הנסיין להכין את קנה הנשימה לאורך של לפחות 0.5 ס"מ על מנת לאפשר ניידות מספקת ולהשתמש בלולאת כלי הסיליקון על מנת לא לאבד את קנה הנשימה לאחר החתך, שכן הדבר עלול לגרום לשאיפה וחנק כאשר קנה הנשימה הולך לאיבוד בעומק הרקמה עקב תופעת רקע. חותכים רק חלקית את קנה הנשימה במשיכת מספריים אחת ברורה. באופן אידיאלי, יש לחתוך 180° של היקף. מתחת לזה עלול לגרום לכישלון באינטובציה. מעל זה עלול לגרום הצמדה של קנה הנשימה עם נסיגה של שני הקצוות לתוך עומק הרקמה ולאחר מכן חנק. בעת קשירת תפר הפוליפילמנט לאבטחת צינור האינטובציה, יש להשתמש בקשר הזזה על מנת להבטיח הידוק מספיק כדי למנוע דליפת אוויר או נקע צינור בשוגג ובו בזמן להימנע מסגירה לא מכוונת של הצינור. השארת חוט סלדינגר במקומו במהלך התפירה יכולה למנוע סגירה לא מכוונת. בעת ביצוע אוורור ידני באמצעות שקית האוורור, יש להימנע לחלוטין מברוטראומה של הריאה על ידי נפחי גאות גבוהים. במקום זאת, יש לשאוף להנשמה מגינה על הריאות, בתדירות גבוהה ובגאות נמוכה, במיוחד כל עוד בית החזה לא בוצע ולא ניתן להעריך את נפחי הריאות באופן חזותי.
על ידי הצעת מתודולוגיה מפורטת וניתנת לשחזור, פרוטוקול זה מאפשר סטנדרטיזציה של הליכים ניסיוניים, שיפור אמינות הנתונים ויכולת השוואה בין מחקרים. כתוצאה מכך, שיטה זו תורמת לחידוד הטכניקות המדעיות במחקר הפרה-קליני, ובסופו של דבר משפרת את הרלוונטיות התרגומית של ממצאים בתחומי הפיזיולוגיה, הפרמקולוגיה, המדעים הכירורגיים והביו-רפואיים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מודים בהכרת תודה לשירות אחסון הנתונים SDS@hd הנתמך על ידי משרד המדע, המחקר והאמנויות באדן-וירטמברג (MWK) וקרן המחקר הגרמנית (DFG) באמצעות מענק INST 35/1314-1 FUGG ו- INST 35/1503-1 FUGG. יתר על כן, המחברים מודים בהכרת תודה על התמיכה של NCT (המרכז הלאומי למחלות גידולים בהיידלברג, גרמניה) באמצעות תוכנית הפוסט-דוקטורט המובנית שלו והתוכנית לאונקולוגיה כירורגית. אנו מכירים גם בתמיכה באמצעות כספי מדינה שאושרו על ידי הפרלמנט הממלכתי של באדן-וירטמברג עבור קמפוס החדשנות בריאות + מדעי החיים הברית היידלברג מנהיים מתוכנית הפוסט-דוקטורט המובנית של אלכסנדר סטודייה-פישר: בינה מלאכותית בבריאות (AIH) - שיתוף פעולה של DKFZ, EMBL, אוניברסיטת היידלברג, בית החולים האוניברסיטאי היידלברג, בית החולים האוניברסיטאי מנהיים, המכון המרכזי לבריאות הנפש, ומכון מקס פלנק למחקר רפואי. יתר על כן, אנו מכירים בתמיכה באמצעות מכון הסרטן DKFZ הקטור במרכז הרפואי האוניברסיטאי מנהיים. עבור דמי הפרסום, אנו מכירים בתמיכה כספית על ידי Deutsche Forschungsgemeinschaft במסגרת תוכנית המימון "Open Access Publikationskoste" וכן על ידי אוניברסיטת היידלברג.
Materials
| Name | Company | Catalog Number | Comments |
| Ambu Spur II Single-Use ventilation bag for neonates | Meier Medizintechnik | 335 102 000 | Ventilation bag |
| BD Microlance 3 cannula 20 G | BD (Beckton, Dickinson) | 301300 | Cannula |
| BD Microlance Discardit II 20 mL Syringe | BD (Beckton, Dickinson) | 300296 | Plastic syringe |
| Fixation rods | Legefirm | 500343896 | Tuning forks used as y-shaped metal fixation rods |
| Heat-shrinking tube | Sekesoer | RSG-400 | Heat-shrinking tube |
| Intravenous catheter | BD (Beckton, Dickinson) | 393230 | BD Venflon Pro Safety intravenous catheter 14 G; shortened using scissors; alternatively 16 G or 18 G can be used |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | Connecting tube COEX 150 cm |
| Polyfilament suture | COVIDIEN | CL331 | Polyfilament surgical suture recommended with a strength of 1 to 2; needle can be removed |
| Royal Gardineer Heating Pad Size S, 20 Watt | Royal Gardineer | IP67 | Heating pad |
| Seldinger guide wire | VYGON | 115.798 | Metal guide wire from the arterial leadercath set |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | Silicone vessel loop tie 2.5 mm red |
| Spraque Dawley rats | Janvier Labs | Male rats weighing 400 grams | |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
References
- Czigany, Z., et al. Limb remote ischemic conditioning of the recipient protects the liver in a rat model of arterialized orthotopic liver transplantation. PLoS One. 13 (4), e0195507 (2018).
- Czigány, Z., et al. Improving research practice in rat orthotopic and partial orthotopic liver transplantation: A review, recommendation, and publication guide. Eur Surg Res. 55 (1-2), 119-138 (2015).
- Nagai, K., Yagi, S., Uemoto, S., Tolba, R. H. Surgical procedures for a rat model of partial orthotopic liver transplantation with hepatic arterial reconstruction. J Vis Exp. 73, e4376 (2013).
- Jahshan, F., et al. A novel rat model for assessment of laryngotracheal injury following transoral intubation. Int J Pediatr Otorhinolaryngol. 113, 4-10 (2018).
- Lamoureux, L., Radhakrishnan, J., Gazmuri, R. J. A rat model of ventricular fibrillation and resuscitation by conventional closed-chest technique. J Vis Exp. 98, 52413 (2015).
- Wang, Z., et al. Autoinducer-2 of streptococcus mitis as a target molecule to inhibit pathogenic multi-species biofilm formation in vitro and in an endotracheal intubation rat model. Front Microbiol. 7, 88 (2016).
- Jahshan, F., et al. A novel rat model for tracheal mucosal damage assessment of following long term intubation. Int J Pediatr Otorhinolaryngol. 128, 109738 (2020).
- Rivard, A. L., et al. Rat intubation and ventilation for surgical research. J Invest Surg. 19 (4), 267-274 (2006).
- Na, N., Zhao, D. Q., Huang, Z. Y., Hong, L. Q. An improved method for rat intubation and thymectomy. Chin Med J (Engl). 124 (17), 2723-2727 (2011).
- Cicero, L., Fazzotta, S., Palumbo, V. D., Cassata, G., Lo Monte, A. I. Anesthesia protocols in laboratory animals used for scientific purposes. Acta Biomed. 89 (3), 337-342 (2018).
- Fuentes, J. M., et al. Videoendoscopic endotracheal intubation in the rat: A comprehensive rodent model of laparoscopic surgery. J Surg Res. 122 (2), 240-248 (2004).
- Bryda, E. C. The mighty mouse: The impact of rodents on advances in biomedical research. Mo Med. 110 (3), 207-211 (2013).
- Lazopoulos, A., et al. Open thoracotomy for pneumothorax. J Thorac Dis. 7 (S1), S50-S55 (2015).
- Rendell, V. R., Giamberardino, C., Li, J., Markert, M. L., Brennan, T. V. Complete thymectomy in adult rats with non-invasive endotracheal intubation. J Vis Exp. 94, 52152 (2014).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. 86, 50269 (2014).
- Nelson, A. M., Nolan, K. E., Davis, I. C. Repeated orotracheal intubation in mice. J Vis Exp. 157, 60844 (2020).
- Das, S., Macdonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. 73, e50318 (2013).
- Massick, D. D., et al. Quantification of the learning curve for percutaneous dilatational tracheotomy. Laryngoscope. 110 (2 Pt 1), 222-228 (2000).
- Giugliano, G., et al. Learning curve for translaryngeal tracheotomy in head and neck surgery. Laryngoscope. 111 (4 Pt 1), 628-633 (2001).
- Mort, T. C. Emergency tracheal intubation: Complications associated with repeated laryngoscopic attempts. Anesth Analg. 99 (2), 607-613 (2004).
- Hasegawa, K., et al. Association between repeated intubation attempts and adverse events in emergency departments: An analysis of a multicenter prospective observational study. Ann Emerg Med. 60 (6), 749-754.e742 (2012).
- Titu, I. M., Delaca, G. B., Teterea, F., Ciulic, S. A., Palade, E. Percutaneous tracheostomy using the Seldinger technique. Multimed Man Cardiothorac Surg. 2023, (2023).
- Garry, B. P., Bivens, H. E. The Seldinger technique. J Cardiothorac Anesth. 2 (3), 403 (1988).
- Carbone, L. Estimating mouse and rat use in American laboratories by extrapolation from animal welfare act-regulated species. Sci Rep. 11 (1), 493 (2021).
- Su, C. S., et al. Efficacious and safe orotracheal intubation for laboratory mice using slim torqueable guidewire-based technique: Comparisons between a modified and a conventional method. BMC Anesthesiol. 16, 5 (2016).
- Clary, E. M., O'halloran, E. K., De La Fuente, S. G., Eubanks, S. Videoendoscopic endotracheal intubation of the rat. Lab Anim. 38 (2), 158-161 (2004).
- Ghali, M. G. Z. Microsurgical technique for tracheostomy in the rat. MethodsX. 5, 61-67 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved