Method Article
小型猪单期组织工程尿路上皮管手术模型
摘要
由于费力的 离体 培养,用于重建手术的组织工程植入物很少会超过临床前试验,其中包括复杂且昂贵的支架组件。在这里,我们提出了一种专为尿流改道而设计的单阶段程序,该程序使用包含自体微移植物的可接近的基于胶原蛋白的管状支架。
摘要
重建手术经常受到缺乏移植组织的挑战。在泌尿生殖系统畸形的治疗中,常规解决方案是收集胃肠道组织用于非原位重建,因为它丰富,可以重建患者的正常功能。重新排列体内天然组织后的临床结果通常与显着的发病率相关;因此,组织工程在该外科领域具有特定的潜力。尽管取得了重大进展,但组织工程支架尚未被确立为有效的手术治疗替代方案,这主要是由于材料、生产和植入的要求昂贵且复杂。在该协议中,我们提出了一种简单易用的基于胶原蛋白的管状支架,该支架嵌入了自体器官特异性组织颗粒,设计为尿路分流的管道。支架是在初次外科手术过程中建造的,由常见的手术材料组成,需要传统的手术技能。其次,该方案描述了一种动物模型,旨在评估植入后的短期 体内 结果,并有可能对程序进行其他变化。本出版物旨在逐步演示该程序,特别注意自体组织和管状形式的使用。
引言
在泌尿生殖系统畸形中,可能需要重建手术来恢复功能解剖结构,通常具有重要指征 1,2。传统的手术方法利用来自其他器官系统(如胃肠道)的天然组织来重建畸形或缺失的器官;然而,通常存在严重术后并发症的风险 3,4。对于需要长期导尿的神经源性膀胱功能障碍患者进行尿流改道治疗,通常使用阑尾或重新定制的小肠段来构建尿路导管 5,6。组织工程提供了一种替代的移植组织,可以根据器官特异性特征进行定制,从而最大限度地减少患者的术后发病率 7,8。虽然各种支架可以自行植入,但额外的支架细胞化(最好是自体细胞)已被证明可以改善植入后的再生结果 9,10,11,12,13,14。然而,组织工程支架通常由复杂且昂贵的组件组成,其次,离体细胞培养和支架接种的要求既费力又耗费资源。尽管在该领域进行了数十年的研究,但这些因素阻碍了组织工程支架的临床转化。通过降低复杂性以及金钱和材料要求,组织工程支架可以在现代外科手术中广泛实施,解决罕见和更常见的手术问题。
胶原蛋白以前已被确定为细胞扩增的可行平台,此外,在将细胞或组织附着到支架上以进行手术植入时,胶原蛋白可作为有利的生物粘合剂 15,16,17。围手术期自体微移植通过在初次手术中收获感兴趣的组织并直接重新植入来避免离体细胞培养的需要。通过将切除的组织切碎成更小的颗粒,表面积和生长潜力增加,从而允许在支架上实现更大的膨胀率18。基于胶原蛋白的支架并不专门粘附于泌尿生殖系统重建,但理论上可以应用于空心器官重建的多个区域。
在这份手稿中,我们提出了一种构建管状支架的方案,将胶原蛋白与嵌入的自体尿路上皮微移植物相结合,以及一个小型猪模型,该模型评估了支架的技术可行性和安全性,以及体内支架的再生 性能。使用此处介绍的方案和方法在 10 只成年雌性迷你猪中评估了该模型。支架的主要优点是结构简单和单阶段植入,使患者免于几次后续外科手术。该程序可以由常规手术人员在常规手术环境中进行,并且需要标准设备和材料。动物模型允许在受控环境中研究植入,同时动物很容易恢复正常行为,并增加了对支架和程序实施变化的可能性。
研究方案
该实验是根据欧洲关于实验室使用动物受试者的立法,并在获得丹麦食品和农业部的道德许可(参考编号 2022-15-0201-01206)后在 AAALAC 认可的实验设施中进行的。
1. 外科手术
- 动物准备
- 雌性成年哥廷根迷你猪术前禁食至少 12 小时。
- 如下所述,准备装有所有无菌器具的手术台。
- 对于成年的标准规格小型猪,肌肉注射 1.0-1.4 mL/10 kg,加入 125 mg 唑拉西泮和 125 mg 瓦替他明悬浮在 1.25 mL 氯胺酮 (100 mg/mL)、6.25 mL 甲苯噻嗪 (20 mg/mL)、1.25 mL 美沙酮 (10 mg/mL) 和 2 mL 布托啡诺 (10 mg/mL) 溶液中(后来称为镇静混合物)。
- 进行视觉引导下气管插管。通过生命体征以及眼和趾间反射测试确认麻醉。双侧涂抹眼药膏。
- 安装双侧耳静脉导管并用异丙酚 (10-15 mg/kg/h) 和芬太尼 (5-15 mg/kg/h) 维持麻醉。
- 插入一根 8 Fr 导尿管,并使用适当大小的鲁尔锁注射器用 250 mL 生理温和等渗盐水填充膀胱。
- 将猪置于仰卧位,然后擦洗腹部。用 70% 乙醇再清洁两轮皮肤后,用无菌悬垂皮框住手术区域。
- 组织采集和手术支架植入
- 用手术刀和烧灼术进行标准的下中线剖腹手术,分开皮肤、肌肉和腹膜,并将腹膜内膀胱拉至伤口。
- 在膀胱前壁上进行预防性止血,切除 2 cm2 的全壁段,留下 1 cm2 的近端开口,同时用快速可吸收的编织运行缝合线封闭剩余的膀胱壁。
- 仔细解剖切除标本的粘膜层,并将 2 cm2 粘膜标本切碎成 1 mm2 的微移植物以进行支架包埋(如下文第 2 节所述)。
- 完成支架后,用缓慢可吸收的单丝运行缝合线将管状结构吻合到膀胱前壁上的剩余开口。
- 使用耻骨膀胱韧带的腹膜瓣修补管状支架,并将腔内 14 Fr 顺行结肠灌肠 (ACE) 塞入管状支架中。
- 用缓慢可吸收的 4-0 单丝缝合线连接导管的远端,以防止尿液泄漏,并通过膀胱导管用注射器注入总共 250 mL 无菌盐水,以确认吻合口通畅。
- 钝性解剖中线外侧的跨筋膜通道,右侧尾部乳腺尾部 2-3 cm,并将导管放入皮下袋中。用两条经皮不可吸收的单丝缝合线固定远端导管,以标记皮肤水平的位置。
- 用慢速可吸收单丝跑步缝合线闭合腹肌前筋膜,用快速可吸收的编织跑步缝合线适应皮下,用不可吸收的单丝跑步缝合线闭合皮肤。
- 停止麻醉后,将动物拔管并在马厩中观察,直到它完全可以活动并能够安全地饮水和进食。
2. 脚手架施工
- 复合脚手架的准备
- 手术前(最多 2 小时),如前所述17 制备大鼠尾胶原 I 型的液体溶液。简而言之,向胶原蛋白溶液中加入 4:1 的 10x 最低必需培养基 (MEM),用 1 M NaOH 将 pH 值近似为 7.4,最后加入 1x MEM,目标是最终胶原蛋白浓度为 1.64 mg/mL。将溶液储存在冰上的无菌小瓶中,直至进一步使用。
- 手术组织切除和切碎后,使用镊子将粘膜颗粒(即微移植物)手动放置在 2 cm x 6 cm 贴合的可生物降解网上,膨胀率为 1:6(例如,2 cm2 粘膜组织膨胀至 12cm2 网眼)。
- 在无菌钢板顶部准备一个尺寸为 1 厘米 x 3 厘米 x 6 厘米(高 x 宽 x 长)的无菌矩形钢模具,然后将网片放入钢模具中,微嫁接物朝上。将 20 mL 胶原蛋白溶液轻轻倒入模具中,确保不要将微移植物从网片上冲走。将整个构建体转移到 38 °C 无菌加热室中,静置 5 分钟以凝固。
- 充分凝固后,将水凝胶滑到放在多孔钢板上的尼龙网上,然后轻轻取出模具。
- 通过在凝胶顶部放置尼龙网和钢板从水凝胶中排出水分,然后用放置在钢板顶部的 120 g 重物(在这种情况下相当于用于嵌入的钢模)被动压缩 5 分钟。
- 压缩后,将扁平的支架围绕可生物降解的支架滚动,微移植物面向支架,尺寸为 5 cm x 0.6 cm(长度 x 内径),并用缓慢可吸收的单丝缝合线纵向缝合支架。完成的导管现在可以进行手术植入。
3. 术后管理
- 镇痛和抗生素预防
- 前 3 天施用丁丙诺啡(0.05-0.1 mg/kg/8 小时静脉注射),前 4 天施用美洛昔康(0.4 mg/kg/天肌内注射或口服),甲氧苄啶(2.7 mg/kg/天肌内注射或 4.2 mg/kg/天口服)和磺胺多辛(13.3 mg/kg/天肌内注射或 20.8 mg/kg/天口服)前 5 天。在动物仍处于麻醉状态时,在术后进行肌肉注射。
- 将动物单独饲养,以避免啃咬外静脉导管和缝合材料。通过有机玻璃窗提供与邻近迷你猪的视觉接触,以及围栏之间鼻子接触的可能性。每天提供新鲜的稻草和干草,以及 玩具 和水供应,每天喂食两次。
- 每天监测动物的自然行为、饮食习惯、尿液和粪便的产生,并每周评估体重。
- 在观察期结束时(6 周),用 1-1.4 mL/10 kg 肌肉注射镇静混合物使动物镇静,并用致命的戊巴比妥注射(100 mg/kg 静脉注射)终止动物。
4. 尸检评估
- 大体解剖学
- 端接后,在皮肤水平解剖远端导管并去除 ACE 塞子。用塑料夹关闭尿道,并使用导管通过远端导管开口注入 250 mL 碘海醇的 1:20 造影剂等渗盐水溶液。
- 使用 64 层计算机断层扫描扫描仪评估动物。使用多平面重建可视化图像,并使用医学影像处理软件分析所有影像。
- 使用 16.2 Fr 可弯曲膀胱镜通过自体尿道对膀胱和导管管腔进行内窥镜检查。
- 在仔细评估任何大体解剖发现的同时,整块切除导管。此外,切除全壁膀胱活检,边缘距导管吻合口 2 cm,并以类似的方式处理以获得参考值。
- 组织学加工
- 将切除的标本固定在 10% 福尔马林中 24 小时。
- 用手术刀将导管正交分成近端、内侧和远端导管段的大小相等的单独部分。在切片机切片之前,增加乙醇浓度对标本进行脱水,并将其包埋在石蜡中。
- 用苏木精和伊红 (H&E) 和全细胞角蛋白 CK-AE 对 5 μm 切片进行染色,并用数字组织学载玻片扫描仪扫描。
结果
在这项研究 中,体内 尿路上皮组织扩增是在基于胶原蛋白的管状支架中实现的。通过将自体组织颗粒嵌入支架,在围手术期收获和加工,该程序允许单阶段支架植入,而无需术后伴随免疫抑制治疗。通过使用可生物降解的网和支架加固支架,可以进行手术处理(图 1)。观察 6 周后,大眼组织评估显示没有宿主排斥或感染的迹象,肾小管支架呈通畅且无阻塞(图2)。从组织学评估中,可以看到尿路上皮来源的分层管腔上皮覆盖了整个支架,并且 6 周后仍然可以看到增强生物材料的残留物(图 3)。
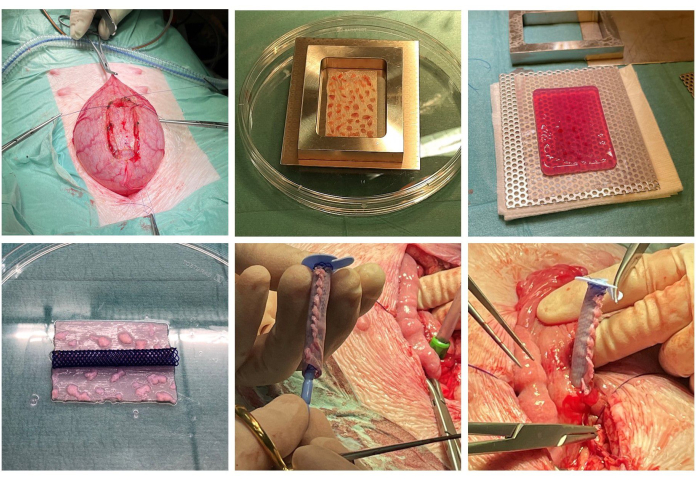
图 1:脚手架构建和植入。 围手术期解剖膀胱组织(左上)。将切碎的粘膜微移植物扩展到手术网片(中上)上,并嵌入凝固的胶原蛋白中(右上)。胶原蛋白被压缩以排出水分,并准备支架(左下)。支架在支架周围管状化,并在支架内放置 ACE 塞子(底部中间)。膀胱部分闭合,最终在组织切除的原始部位(右下)将结构整合到膀胱中。 请单击此处查看此图的较大版本。
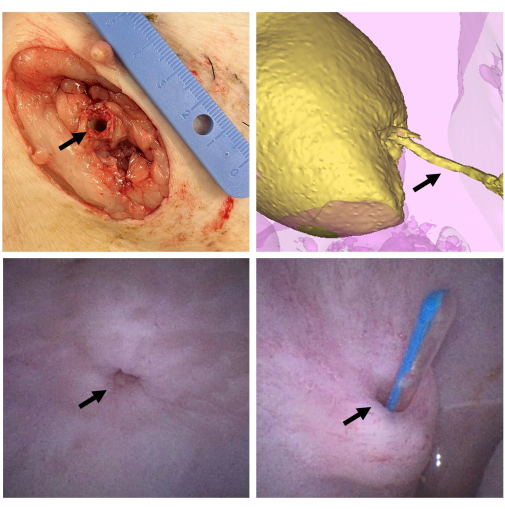
图 2:支架宏观评估。 6 周后,对动物实施安乐死,并在皮肤水平(左上)解剖支架(箭头)。膀胱充满造影剂(黄色),并进行 CT 扫描以评估导管(箭头)的通畅性和狭窄形成的迹象(右上)。6 周后,通过尿道进行膀胱镜检查以评估膀胱和吻合口(箭头)(左下角)。通过外部开口将导管(箭头)插入膀胱(右下角),再次测试导管的通畅性。 请单击此处查看此图的较大版本。
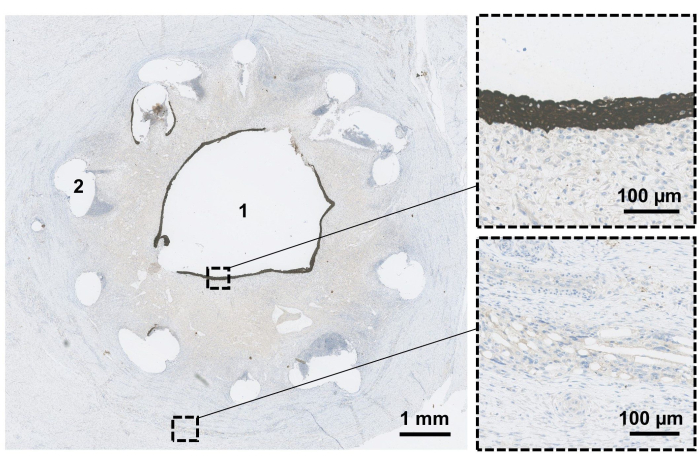
图 3:支架显微镜评估。 固定切除的导管,并进行正交横切面以评估近端-远端方向的导管。6 周后,评估导管腔 (1) 以确认上皮化(放大的顶部)。此时,可生物降解支架 (2) 和网状材料(放大的底部)的残留物仍然可见。 请单击此处查看此图的较大版本。
讨论
该协议为未来的重建手术提供了一种简单易懂的技术。组织工程的一个常见缺点,包括自体细胞扩增,是手术植入前需要昂贵且大量的准备步骤。自体微移植可以简化其中许多步骤,并可能允许单阶段手术。通过自体移植复杂的组织学实体,诱导促再生旁分泌信号转导18。在以前的研究中,我们体验到除非适当地连接到支架上,否则单独的微移植物很容易受到物理环境的影响15,19。胶原蛋白已被研究为体外组织扩增的可行环境,由于其良好的生物相容性和商业可用性而被我们选择用于我们的目的。此处介绍的复合支架之前已在评估微移植物包埋和胶原蛋白浓度变化的体外实验中进行了优化 20,21,22。在体内测试之前,已经在体外评估了有关渗透性、生物力学和降解的支架特性 20。此外,基于体内支架的组织扩增先前已在啮齿动物和兔子模型中得到验证21,22。
选择手术模型来评估支架的管状版本,模拟儿科或青少年患者神经源性膀胱功能障碍的尿流改道临床设置。关键步骤包括精确解剖粘膜微移植物,以及从切除到支架包埋保持湿润环境。另一个关键步骤包括适当的水凝胶固化;仔细移液胶原蛋白可确保凝胶内不会形成气泡,正确的温度设置和组分溶液可确保凝胶正确凝固。未能获得凝固的凝胶会增加胶原蛋白分层和微移植物脱落的风险。对于手术部分,植入过程中的小心处理对于避免因机械创伤或解离而损坏微移植物至关重要。在闭合腹部之前,应通过向膀胱注入液体来小心解决液体通畅问题。
该技术的局限性包括支架的厚度,这在营养物质从外部环境扩散到微移植物方面直观地具有上限。另一方面,支架厚度的减少可能会导致不适当的高渗透性和漏尿。我们目前的组成基于之前的 体外 评估,其中比较了不同胶原蛋白浓度的细胞再生20。自体组织的微移植也依赖于健康的移植组织,这使得目前的手术不适用于无法正确排除癌性再移植风险的恶性疾病23;尽管如此,目前的技术是为功能性排尿障碍的病例设计的,在这种情况下这不被认为是一种风险。尽管该模型模拟了临床环境(即阑尾膀胱造口术)的几个步骤,但该实验并未使用功能齐全的造口进行尿流,因为导管是在远端结扎的。此外,由于临床并发症可能终生发生,因此 6 周的观察期可能对狭窄和尿失禁的具体结局提供有限的了解。因此,在将愈合的导管吻合到皮肤水平后,可以在研究中增加额外的 6 个月随访。
该技术的视角与简单的设计有关,在微移植组织来源和支持生物材料被其他相关替代品取代的情况下,可实现普遍应用。这些成分可以进行改性,以适应与支架强度、弹性和生物降解相关的器官特定用途。最后,可及且低成本的费用允许可重复性和更广泛的技术翻译。
披露声明
作者没有需要声明的利益冲突。
致谢
作者要感谢哥本哈根大学实验医学系 (AEM) 的工作人员在规划和实施动物手术和饲养方面的帮助,以及捷克共和国 Hradec Kralove 的 ELLA-CS, s.r.o 提供用于研究的定制可生物降解支架。瑞典医学研究学会、Promobilia 基金会、Rydbeck 基金会、Samariten 基金会、儿科保健基金会、斯德哥尔摩 Frimurare Barnhuset 基金会和诺和诺德基金会 (NNFSA170030576) 提供了财政支持。
材料
| Name | Company | Catalog Number | Comments |
| 10x MEM | Gibco, Thermo Fisher Scientific, Waltham, US | 2517592 | Collagen preparation |
| 1x MEM | Gibco, Thermo Fisher Scientific, Waltham, US | 2508924 | Collagen preparation |
| Ambu aScope 4 Cysto | Ambu A/S, Ballerup, DK | 1000682507 | Cystoscope |
| Aquaflush ACE stopper | Abena, Taastrup, DK | ACE12/220501 | ACE stopper |
| Borgal vet inj opl 200 + 40 mg/mL | Ceva Animal Health A/S | 510460 | Sulfonamide/Trimethoprim |
| Bupaq multidose vet 0.3 mg/mL | Salfarm Danmark A/S, DK | 502763 | Buprenorphin |
| Butomidor vet inj 10 mg/mL | Salfarm Danmark A/S, DK | 531943 | Buthorphanol |
| Comfortan vet inj 10 mg/mL | Dechra Veterinary Products A/S, DK | 492312 | Metadone |
| Ethilon suture 3-0 | Ethicon, Johnson & Johnson, New Brunswick, US | SGBCXV | Monofilament non-resorbable |
| Fentanyl inj 50 µg/mL(hamel) | Hameln Pharma ApS, DK | 432520 | Fentanyl |
| Ketador vet inj 100 mg/mL | Salfarm Danmark A/S, DK | 115727 | Ketamine |
| Metacam inj 20 mg/mL t.cattle/pig/horse | Boehringer Ingelheim Animal, DE | 6443 | Meloxcicam |
| Metacam oral suspension 15 mg/mL pigs | Boehringer Ingelheim Animal, DE | 482780 | Meloxcicam |
| Omnipaque | GF Healthcare, Oslo, NO | 16173849 | Contrast for CT |
| Pancytokeratin CK-AE | DAKO Agilent, US | GA053 | Clone AE1/AE3 |
| PDS suture 3-0 | Ethicon, Johnson & Johnson, New Brunswick, US | SEMMTQ | Monofilament slow-resorbable |
| Prolene suture 4-0 | Ethicon, Johnson & Johnson, New Brunswick, US | PGH187 | Monofilament non-resorbable |
| Propolipid t.inj/inf 10 mg/mL | Fresenius Kabi, DK | 21636 | Propofol |
| Rat-tail collagen type I | First Link Ltd, Wolverhampton, UK | 60-30-810 | 2.06 mg/mL protein in 0.6% acetic acid |
| Suprim vet 20 + 100 mg (Solution for use in drinking water) | Dechra Veterinary Products A/S, DK | 33661 | Sulfonamide/Trimethoprim |
| SX-ELLA Degradable Biliary DV stent | ELLA-CS, Trebes, CZ | S23000056-01 | ø 6 mm x 60 mm |
| Vicryl mesh | Ethicon, Johnson & Johnson, New Brunswick, US | VM1208 | Mesh |
| Vicryl suture 4-0 | Ethicon, Johnson & Johnson, New Brunswick, US | SMBDGDR0 | Braided fast-resorbable |
| Xysol vet inj 20 mg/mL | ScanVet Animal Health A/S, DK | 54899 | Xylazine |
| Zoletil 50 vet plv/sol t.inj 25 + 25 mg/mL | Virbac Danmark A/S, DK | 568527 | Tiletamine and Zolazepam |
参考文献
- Surer, I., Ferrer, F. A., Baker, L. A., Gearhart, J. P. Continent urinary diversion and the exstrophy-epispadias complex. J Urol. 169 (3), 1102-1105 (2003).
- Cranidis, A., Nestoridis, G. Bladder augmentation. Int Urogynecol J Pelvic Floor Dysfunct. 11 (1), 33-40 (2000).
- Atala, A., Bauer, S. B., Hendren, W. H., Retik, A. B. The effect of gastric augmentation on bladder function. J Urol. 149 (5), 1099-1102 (1993).
- Husmann, D. A. Mortality following augmentation cystoplasty: A transitional urologist's viewpoint. J Pediatr Urol. 13 (4), 358-364 (2017).
- Mitrofanoff, P. Trans-appendicular continent cystostomy in the management of the neurogenic bladder. Chir Pediatr. 21 (4), 297-305 (1980).
- Leslie, B., Lorenzo, A. J., Moore, K., Farhat, W. A., Bägli, D. J., Pippi Salle, J. L. Long-term followup and time to event outcome analysis of continent catheterizable channels. J Urol. 185 (6), 2298-2302 (2011).
- Horst, M., Eberli, D., Gobet, R., Salemi, S. Tissue engineering in pediatric bladder reconstruction-The road to success. Front Pediatr. 7, 91(2019).
- Ajalloueian, F., Lemon, G., Hilborn, J., Chronakis, I. S., Fossum, M. Bladder biomechanics and the use of scaffolds for regenerative medicine in the urinary bladder. Nat Rev Uro. 15 (3), 155-174 (2018).
- Dorin, R. P., Pohl, H. G., De Filippo, R. E., Yoo, J. J., Atala, A. Tubularized urethral replacement with unseeded matrices: what is the maximum distance for normal tissue regeneration. World J Uro. 26 (4), 323-326 (2008).
- El Kassaby, A. W., AbouShwareb, T., Atala, A. Randomized comparative study between buccal mucosal and acellular bladder matrix grafts in complex anterior urethral strictures. J Urol. 179 (4), 1432-1436 (2008).
- Casarin, M., et al. Porcine small intestinal submucosa (SIS) as a suitable scaffold for the creation of a tissue-engineered urinary conduit: Decellularization, biomechanical and biocompatibility characterization using new approaches. Int J Mol Sci. 23 (5), 2826(2022).
- Casarin, M., et al. A novel hybrid membrane for urinary conduit substitutes based on small intestinal submucosa coupled with two synthetic polymers. J Funct Biomater. 13 (4), 222(2022).
- Drewa, T. The artificial conduit for urinary diversion in rats: a preliminary study. Transplant Proc. 39 (5), 1647-1651 (2007).
- Liao, W., et al. Tissue-engineered tubular graft for urinary diversion after radical cystectomy in rabbits. J Surg Res. 182 (2), 185-191 (2013).
- Reinfeldt Engberg, G., Lundberg, J., Chamorro, C. I., Nordenskjöld, A., Fossum, M. Transplantation of autologous minced bladder mucosa for a one-step reconstruction of a tissue engineered bladder conduit. Biomed Res Int. 2013, 212734(2013).
- Ajalloueian, F., Nikogeorgos, N., Ajalloueian, A., Fossum, M., Lee, S., Chronakis, I. S. Compressed collagen constructs with optimized mechanical properties and cell interactions for tissue engineering applications. Int J Biol Macromol. 108, 158-166 (2018).
- Chamorro, C. I., Zeiai, S., Engberg, G. R., Fossum, M. Minced tissue in compressed collagen: A cell-containing biotransplant for single-staged reconstructive repair. J Vis Exp. (108), e53061(2016).
- Juul, N., et al. Insights into cellular behavior and micromolecular communication in urothelial micrografts. Sci Rep. 13 (1), 13589(2023).
- Reinfeldt Engberg, G., Chamorro, C. I., Nordenskjöld, A., Fossum, M. Expansion of submucosal bladder wall tissue in vitro and in vivo. Biomed Res Int. 2016, 5415012(2016).
- Juul, N., Ajalloueian, F., Willacy, O., Chamorro, C. I., Fossum, M. Advancing autologous urothelial micrografting and composite tubular grafts for future single-staged urogenital reconstructions. Sci Rep. 13 (1), 15584(2023).
- Willacy, O., Juul, N., Taouzlak, L., Chamorro, C. I., Ajallouiean, F., Fossum, M. A perioperative layered autologous tissue expansion graft for hollow organ repair. Heliyon. 10 (3), e25275(2024).
- Chamorro, C. I., et al. Exploring the concept of in vivo guided tissue engineering by a single-stage surgical procedure in a rodent model. Int J Mol Sci. 23 (20), 12703(2022).
- Casarin, M., Morlacco, A., Dal Moro, F. Bladder substitution: The role of tissue engineering and biomaterials. Process. 9 (9), 1643(2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。