Method Article
Modello chirurgico per tubi uroteliali di ingegneria tissutale a stadio singolo in minipig
In questo articolo
Riepilogo
Gli impianti di ingegneria tissutale per la chirurgia ricostruttiva raramente progrediscono oltre gli studi preclinici a causa della laboriosa coltura ex vivo , che include componenti di scaffold complessi e costosi. Qui, presentiamo una procedura in un'unica fase progettata per la diversione urinaria con un'impalcatura tubulare accessibile a base di collagene contenente microinnesti autologhi.
Abstract
Gli interventi chirurgici ricostruttivi sono spesso messi alla prova dalla mancanza di tessuto da innesto. Nel trattamento delle malformazioni urogenitali, la soluzione convenzionale è stata la raccolta di tessuto gastrointestinale per la ricostruzione non ortotopica grazie alla sua abbondanza per ristabilire la normale funzione nel paziente. Gli esiti clinici dopo il riarrangiamento dei tessuti nativi all'interno del corpo sono spesso associati a una morbilità significativa; Pertanto, l'ingegneria tissutale ha un potenziale specifico in questo campo della chirurgia. Nonostante i sostanziali progressi, gli scaffold di ingegneria tissutale non si sono ancora affermati come una valida alternativa al trattamento chirurgico, principalmente a causa dei requisiti costosi e complessi di materiali, produzione e impianto. In questo protocollo, presentiamo un'impalcatura tubulare semplice e accessibile a base di collagene incorporata con particelle di tessuto autologhe organo-specifiche, progettata come condotto per la diversione urinaria. L'impalcatura viene costruita durante la procedura chirurgica primaria, comprende materiali chirurgici comunemente disponibili e richiede competenze chirurgiche convenzionali. In secondo luogo, il protocollo descrive un modello animale progettato per valutare gli esiti a breve termine in vivo post-impianto, con la possibilità di ulteriori variazioni alla procedura. Questa pubblicazione ha lo scopo di illustrare la procedura passo dopo passo, con particolare attenzione all'uso di tessuto autologo e di una forma tubulare.
Introduzione
Nelle malformazioni urogenitali, la chirurgia ricostruttiva può essere necessaria per ripristinare l'anatomia funzionale, spesso su indicazione vitale 1,2. Gli approcci chirurgici convenzionali hanno utilizzato tessuti nativi di altri sistemi di organi (come il tratto gastrointestinale) per ricostruire gli organi malformati o mancanti; tuttavia, spesso con il rischio di gravi complicanze postoperatorie 3,4. Nel caso della diversione urinaria per i pazienti con disfunzione neurogena della vescica che necessitano di cateterismo a lungo termine, l'appendice o i segmenti dell'intestino tenue riadattati vengono spesso utilizzati per costruire un condotto urinario 5,6. L'ingegneria tissutale offre un tessuto di innesto alternativo che può essere adattato per soddisfare le caratteristiche specifiche dell'organo, riducendo così al minimo la morbilità postoperatoria per i pazienti 7,8. Mentre scaffold di vario tipo possono essere impiantati da soli, è stato dimostrato che un'ulteriore cellularizzazione dello scaffold, preferibilmente con cellule autologhe, migliora i risultati rigenerativi dopo l'impianto 9,10,11,12,13,14. Tuttavia, gli scaffold di ingegneria tissutale sono spesso costituiti da componenti complessi e costosi e, in secondo luogo, i requisiti per la coltura cellulare ex vivo e la semina di scaffold sono laboriosi e dispendiosi in termini di risorse. Questi fattori hanno ostacolato la traduzione clinica degli scaffold di ingegneria tissutale nonostante diversi decenni di ricerca in questo settore. Riducendo la complessità e i requisiti monetari e materialistici, gli scaffold di ingegneria tissutale potrebbero essere implementati nella chirurgia moderna su larga scala, affrontando sia le procedure rare che quelle più comuni.
Il collagene è stato precedentemente stabilito come una piattaforma praticabile per l'espansione cellulare e, inoltre, agisce come un bioadesivo favorevole quando si attaccano cellule o tessuti su un'impalcatura per l'impianto chirurgico 15,16,17. Il microinnesto autologo perioperatorio elude la necessità di coltura cellulare ex vivo prelevando il tessuto di interesse durante la procedura primaria e reimpiantandolo direttamente. Tritando il tessuto resecato in particelle più piccole, la superficie e il potenziale di crescita aumentano, consentendo un rapporto di espansione maggiore sullo scaffold18. L'impalcatura a base di collagene non aderisce specificamente alle ricostruzioni urogenitali, ma può teoricamente applicarsi a più aree di ricostruzione di organi cavi.
In questo manoscritto, presentiamo sia un protocollo per la costruzione di uno scaffold tubulare, che combina il collagene con microinnesti uroteliali autologhi incorporati, sia un modello minipig che valuta la fattibilità tecnica e la sicurezza, nonché le prestazioni rigenerative, dello scaffold in vivo. Il modello è stato valutato in 10 maialini femmine adulte utilizzando il protocollo e il metodo qui presentati. Il vantaggio principale dello scaffold è la semplicità del costrutto e l'impianto in un'unica fase, risparmiando al paziente diverse procedure chirurgiche successive. La procedura può essere eseguita in contesti chirurgici convenzionali da personale chirurgico regolare e richiede attrezzature e materiali standard. Il modello animale consente un ambiente controllato per lo studio dell'impianto mentre l'animale ritorna prontamente al comportamento normale, con l'aggiunta della possibilità di implementare variazioni allo scaffold e alla procedura.
Protocollo
Questo esperimento è stato condotto in una struttura sperimentale accreditata AAALAC in conformità con la legislazione europea sull'uso in laboratorio di soggetti animali e dopo l'autorizzazione etica concessa dal Ministero danese dell'Alimentazione e dell'Agricoltura (Rif. n. 2022-15-0201-01206).
1. Procedura chirurgica
- Preparazione degli animali
- Veloce una femmina di maialino di Göttingen adulto per almeno 12 ore prima dell'intervento.
- Preparare il tavolo operatorio con tutti gli utensili sterili come descritto di seguito.
- Per i maialini adulti di taglia standard, sedare l'animale mediante iniezione intramuscolare con 1,0-1,4 ml/10 kg con una soluzione di 125 mg di zolazepam e 125 mg di tiletamina sospesi in 1,25 ml di ketamina (100 mg/mL), 6,25 ml di xilazina (20 mg/mL), 1,25 ml di metadone (10 mg/mL) e 2 ml di butorfanolo (10 mg/mL) (in seguito indicato come miscela di sedazione).
- Eseguire l'intubazione endotracheale guidata visivamente. Confermare l'anestesia con i segni vitali e il test degli occhi e dei riflessi interdigitali. Applicare l'unguento oftalmico bilateralmente.
- Installare cateteri venosi auricolari bilaterali e sostenere l'anestesia con propofol (10-15 mg/kg/h) e fentanil (5-15 mg/kg/h).
- Inserire un catetere urinario da 8 Fr e riempire la vescica con 250 mL di soluzione fisiologica fisiologica isotonica moderata utilizzando una siringa luer lock di dimensioni adeguate.
- Metti il maiale in posizione supina, quindi rade al suolo e strofina l'addome. Dopo altri due cicli di pulizia della pelle con etanolo al 70%, incorniciare il campo chirurgico con un drappeggio sterile.
- Prelievo di tessuti e impianto di scaffold chirurgici
- Eseguire una laparotomia standard della linea mediana inferiore con bisturi e cauterizzazione, dividendo la pelle, il muscolo e il peritoneo, e tirare la vescica urinaria intraperitoneale verso la ferita.
- Eseguire l'emostasi profilattica sulla parete anteriore della vescica e asportare un segmento di 2 cm2 a tutta parete, lasciando un'apertura prossimale di 1 cm2 mentre si chiude la parete vescicale rimanente con una sutura da corsa intrecciata a rapido riassorbimento.
- Sezionare con cura lo strato mucoso del campione resecato e tritare un campione di mucosa di 2 cm2 in microinnesti da 1 mm2 per l'inclusione di scaffold (descritto di seguito nella sezione 2).
- Dopo aver completato l'impalcatura, anastomizzare il costrutto tubulare fino all'apertura rimanente sulla parete anteriore della vescica con una sutura in monofilamento a lento riassorbimento.
- Utilizzare un lembo peritoneale del legamento pubocavescicale per rattoppare l'impalcatura tubulare e posizionare un tappo intraluminale da 14 Fr per clistere prerodato del colon (ACE) nell'impalcatura tubulare.
- Legare l'estremità distale del condotto con una sutura monofilamento 4-0 a lento riassorbimento per evitare la fuoriuscita di urina e iniettare un totale di 250 ml di soluzione fisiologica sterile con siringhe attraverso il catetere vescicale per confermare la pervietà anastomotica.
- Sezionare senza mezzi termini un canale trans-fasciale lateralmente alla linea mediana, 2-3 cm caudalmente alla ghiandola mammaria caudale sul lato destro, e posizionare il condotto in una tasca sottocutanea. Fissare il condotto distale con due suture monofilamento transcutanee non riassorbibili per marcare la posizione a livello della pelle.
- Chiudere la fascia muscolare anteriore del muscolo addominale con una sutura da corsa in monofilamento riassorbibile lento, adattare il sottocute con una sutura da corsa intrecciata a rapido riassorbimento e chiudere la pelle con una sutura da corsa in monofilamento non riassorbibile.
- Dopo aver interrotto l'anestesia, estubare l'animale e osservarlo nelle stalle fino a quando non è completamente deambulante e in grado di bere e mangiare in sicurezza.
2. Costruzione di impalcature
- Preparazione del ponteggio in composito
- Prima dell'intervento chirurgico (massimo 2 ore), preparare una soluzione liquida di collagene di coda di topo di tipo I come precedentemente descritto17. In breve, aggiungere 4:1 di 10x il terreno essenziale minimo (MEM) alla soluzione di collagene e approssimare il pH a 7,4 con 1 M di NaOH, e infine aggiungere 1x MEM, con l'obiettivo di ottenere una concentrazione finale di collagene di 1,64 mg/mL. Conservare la soluzione in un flaconcino sterile con ghiaccio fino a nuovo utilizzo.
- Dopo la resezione chirurgica del tessuto e la macinazione, posizionare manualmente le particelle di mucosa (cioè i microinnesti) su una rete biodegradabile di 2 cm x 6 cm con una velocità di espansione 1:6 (ad esempio, un tessuto mucoso di 2 cm2 viene espanso a una rete di 12 cm2 ) utilizzando una pinza.
- Preparare uno stampo rettangolare sterile in acciaio di 1 cm x 3 cm x 6 cm (altezza x larghezza x lunghezza) sopra una piastra di acciaio sterile e posizionare la rete nello stampo di acciaio con i microinnesti rivolti verso l'alto. Versare delicatamente 20 ml di soluzione di collagene nello stampo, facendo attenzione a non lavare i microinnesti dalla rete. Trasferire l'intero costrutto in una camera di riscaldamento sterile a 38 °C e lasciare solidificare per cinque minuti.
- Dopo una solidificazione sufficiente, far scivolare l'idrogel su una rete di nylon appoggiata su una piastra di acciaio forata e rimuovere delicatamente lo stampo.
- Espellere l'acqua dall'idrogel posizionando una rete di nylon e poi una piastra d'acciaio sopra il gel, quindi comprimere passivamente con un peso di 120 g (in questo caso equivalente allo stampo in acciaio utilizzato per l'inclusione) posto sopra la piastra d'acciaio per 5 minuti.
- Dopo la compressione, arrotolare l'impalcatura appiattita attorno a uno stent biodegradabile, con i microinnesti rivolti verso lo stent, che misura 5 cm x 0,6 cm (lunghezza x diametro interno), e suturare l'impalcatura in posizione longitudinalmente con una sutura in monofilamento a lento riassorbimento. Il condotto completato è ora pronto per l'impianto chirurgico.
3. Gestione postoperatoria
- Analgesia e profilassi antibiotica
- Somministrare buprenorfina (0,05-0,1 mg/kg/8 ore per via endovenosa) per i primi 3 giorni, meloxicam (0,4 mg/kg/die per via intramuscolare o orale) per i primi 4 giorni e trimetoprim (2,7 mg/kg/die per via intramuscolare o 4,2 mg/kg/die per via orale) e sulfadossina (13,3 mg/kg/die per via intramuscolare o 20,8 mg/kg/die per via orale) per i primi 5 giorni. Somministrare le iniezioni intramuscolari dopo l'intervento mentre l'animale è ancora anestetizzato.
- Alloggiare gli animali da soli per evitare di rosicchiare i cateteri venosi esterni e il materiale di sutura. Fornire un contatto visivo con i maialini vicini attraverso finestre in plexiglass e la possibilità di contatto del muso tra i recinti. Fornire ogni giorno paglia e fieno freschi, nonché giocattoli e acqua ad libitum e nutrire due volte al giorno.
- Monitorare quotidianamente gli animali per il comportamento naturale, le abitudini alimentari, la produzione di urina e feci e valutare il peso corporeo settimanalmente.
- Al termine del periodo di osservazione (6 settimane), sedare gli animali con un'iniezione intramuscolare di 1-1,4 ml/10 kg di miscela sedativa e terminare l'animale con un'iniezione letale di pentobarbital (100 mg/kg per via endovenosa).
4. Valutazioni post mortem
- Anatomia macroscopica
- Dopo l'interruzione, sezionare il condotto distale a livello della pelle e rimuovere il tappo ACE. Chiudere l'uretra con una pinza di plastica e iniettare 250 mL di una soluzione di contrasto 1:20 di ioesolo in soluzione salina isotonica attraverso l'apertura del condotto distale utilizzando un catetere.
- Valutare l'animale con uno scanner per tomografia computerizzata a 64 fette. Visualizza le immagini utilizzando la ricostruzione multiplanari e analizza tutte le immagini utilizzando il software di elaborazione delle immagini mediche.
- Eseguire un esame endoscopico della vescica e della lumina del condotto con un cistoscopio flessibile da 16,2 Fr attraverso l'uretra nativa.
- Resecare il condotto in blocco valutando attentamente eventuali reperti anatomici grossolani. Inoltre, resecare le biopsie vescicali a parete intera con un margine di 2 cm rispetto all'anastomosi del condotto e procedere in modo simile per i valori di riferimento.
- Elaborazione istologica
- Fissare il campione asportato in formalina al 10% per 24 ore.
- Dividere il condotto ortogonalmente con un bisturi in sezioni separate di uguali dimensioni di segmenti di condotto prossimale, mediale e distale. Disidratare i campioni con concentrazioni crescenti di etanolo e incorporarli in paraffina prima del sezionamento del microtomo.
- Colorare sezioni da 5 μm con ematossilina ed eosina (H&E) e pancitocheratina CK-AE ed eseguire la scansione con uno scanner istologico digitale per vetrini.
Risultati
In questo studio, l'espansione del tessuto uroteliale in vivo è ottenuta in uno scaffold tubulare a base di collagene. Incorporando lo scaffold con particelle di tessuto autologo, raccolte e lavorate perioperatoriamente, la procedura consente l'impianto di scaffold in un'unica fase senza la necessità di un trattamento immunosoppressivo concomitante dopo l'intervento. La manipolazione chirurgica è resa possibile rinforzando l'impalcatura con una rete e uno stent biodegradabili (Figura 1). Dopo 6 settimane di osservazione, la valutazione macroscopica del tessuto non ha rivelato segni di rigetto o infezione dell'ospite e l'impalcatura tubulare si presenta pervio e non ostruita (Figura 2). Dalle valutazioni istologiche, si osserva un epitelio luminale stratificato di origine uroteliale che copre l'intero scaffold e i resti dei biomateriali di rinforzo sono ancora visibili dopo 6 settimane (Figura 3).
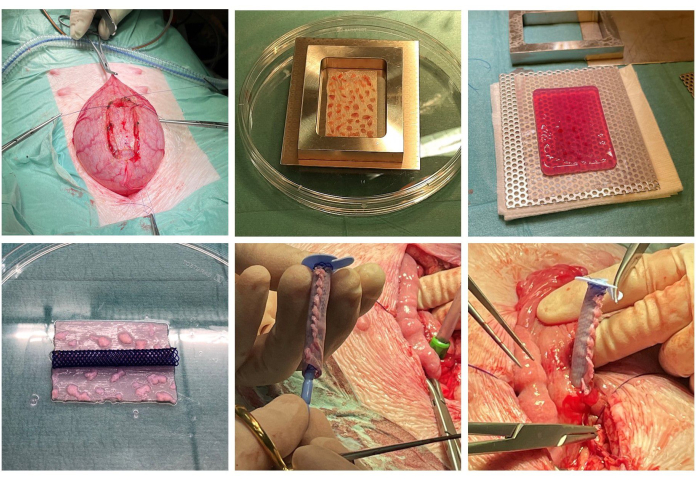
Figura 1: Costruzione e impianto dell'impalcatura. Il tessuto vescicale viene sezionato perioperatoriamente (in alto a sinistra). I microinnesti di mucosa tritata vengono espansi su una rete chirurgica (in alto al centro) e incorporati in collagene solidificato (in alto a destra). Il collagene è stato compresso per espellere l'acqua ed è stato preparato uno stent (in basso a sinistra). L'impalcatura è tubolarizzata attorno allo stent e un tappo ACE è posizionato all'interno dello stent (in basso al centro). La vescica è parzialmente chiusa e il costrutto è infine incorporato nella vescica nel sito originale di escissione del tessuto (in basso a destra). Clicca qui per visualizzare una versione più grande di questa figura.
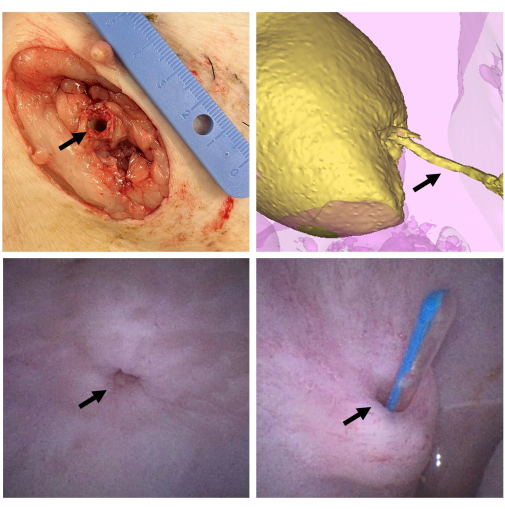
Figura 2: Valutazione macroscopica dello scaffold. Dopo 6 settimane, l'animale viene soppresso e l'impalcatura (freccia) viene sezionata a livello della pelle (in alto a sinistra). La vescica viene riempita con mezzo di contrasto (giallo) e viene eseguita una TAC per valutare il condotto (freccia) per la pervietà e i segni di formazione di stenosi (in alto a destra). Una cistoscopia viene eseguita attraverso l'uretra per valutare la vescica e l'anastomosi (freccia) dopo 6 settimane (in basso a sinistra). Il condotto viene nuovamente testato per la pervietà inserendo un catetere (freccia) attraverso l'apertura esterna e nella vescica (in basso a destra). Clicca qui per visualizzare una versione più grande di questa figura.
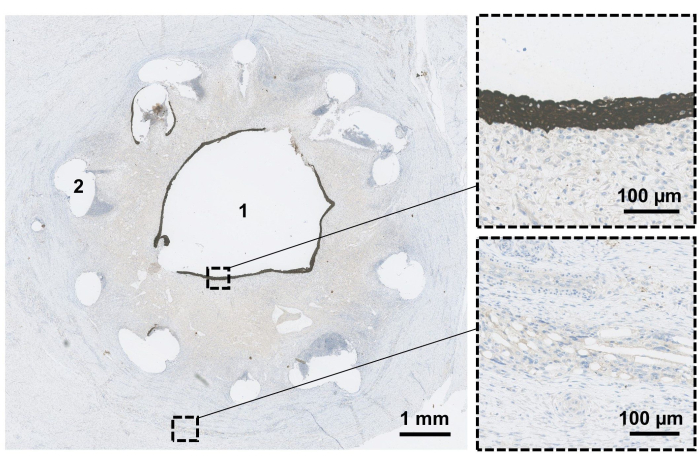
Figura 3: Valutazione microscopica dell'impalcatura. Il condotto resecato viene fissato e vengono eseguite sezioni trasversali ortogonali per valutare il condotto in direzione prossimale-distale. Dopo 6 settimane, il lume del condotto (1) viene valutato per confermare l'epitelizzazione (parte superiore ingrandita). A questo punto sono ancora visibili i resti dello stent biodegradabile (2) e dei materiali a rete (fondo ingrandito). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo presenta una tecnica semplice e accessibile per futuri interventi di chirurgia ricostruttiva. Uno svantaggio comune nell'ingegneria tissutale, compresa l'espansione delle cellule autologhe, sono i costosi e sostanziali passaggi prefatori necessari prima dell'impianto chirurgico. Il microinnesto autologo può semplificare molti di questi passaggi e potenzialmente consentire procedure in un'unica fase. Attraverso l'autotrapianto di entità istologiche complesse, viene indotta la segnalazione paracrina pro-rigenerativa18. In studi precedenti, abbiamo sperimentato che i microinnesti da soli sono vulnerabili agli ambienti fisici a meno che non siano adeguatamente attaccati a un'impalcatura15,19. Il collagene è stato studiato come un ambiente praticabile per l'espansione dei tessuti in vitro ed è stato scelto per il nostro scopo grazie alla sua favorevole biocompatibilità e disponibilità commerciale. L'impalcatura in composito qui presentata è stata precedentemente ottimizzata durante esperimenti in vitro che valutano le variazioni nell'inclusione del microinnesto e nelle concentrazioni di collagene 20,21,22. Prima dei test in vivo, le proprietà dello scaffold relative alla permeabilità, alla biomeccanica e alla degradazione sono state valutate in vitro20. Inoltre, l'espansione tissutale in vivo basata su scaffold è stata precedentemente convalidata in modelli di roditori e conigli21,22.
Il modello chirurgico è stato scelto per valutare una versione tubulare dell'impalcatura, imitando il contesto clinico di una diversione urinaria per la disfunzione neurogena della vescica in pazienti pediatrici o adolescenti. Le fasi critiche includono l'esatta dissezione dei microinnesti di mucosa e il mantenimento di un ambiente umido dal momento della resezione all'inclusione dello scaffold. Un altro passaggio critico include la corretta solidificazione dell'idrogel; Un attento pipettaggio del collagene assicura che non si formino bolle d'aria all'interno del gel, mentre le corrette impostazioni di temperatura e le soluzioni dei componenti assicurano che il gel si solidifichi correttamente. Il mancato ottenimento di un gel solidificato aumenterà il rischio di delaminazione del collagene e distacco del microtrapianto. Per la parte chirurgica, un'attenta manipolazione durante l'impianto è fondamentale per evitare di danneggiare i microinnesti a causa di traumi meccanici o dissociazione. Prima di chiudere l'addome, la pervietà dei liquidi deve essere attentamente affrontata insufflando la vescica con liquidi.
I limiti alla tecnica includono lo spessore dello scaffold, che intuitivamente ha dei limiti superiori per quanto riguarda la diffusione dei nutrienti dall'ambiente esterno ai microinnesti. D'altra parte, una riduzione dello spessore dell'impalcatura può portare a una permeabilità inappropriatamente elevata e a perdite di urina. La nostra composizione attuale si basa su precedenti valutazioni in vitro , in cui la rigenerazione cellulare in concentrazioni variabili di collagene è stata confrontata20. Il microinnesto di tessuti autologhi si basa anche su tessuto di innesto sano, rendendo l'attuale procedura inadatta per le malattie maligne in cui il rischio di re-trapianto canceroso non può essere adeguatamente escluso23; Tuttavia, l'attuale tecnica è stata progettata per i casi con disabilità funzionali da svuotamento in cui questo non è considerato un rischio. Sebbene il modello imiti diversi passaggi dell'impostazione clinica (ad esempio, la procedura di appendicovesicostomia), questo esperimento non utilizza uno stoma completamente funzionale per la diversione urinaria poiché il condotto è legato distale. Inoltre, poiché le complicanze cliniche possono verificarsi per tutta la vita, un periodo di osservazione di 6 settimane può fornire conoscenze limitate sugli esiti specifici su stenosi e continenza. Pertanto, un ulteriore follow-up di 6 mesi potrebbe essere aggiunto allo studio dopo l'anastomosi del condotto guarito a livello cutaneo.
La prospettiva di questa tecnica si riferisce alla semplicità del design, che consente applicazioni universali nel caso in cui l'origine del tessuto del microinnesto e il biomateriale di supporto vengano sostituiti con altre alternative pertinenti. Questi componenti possono essere modificati per adattarsi a scopi specifici dell'organo relativi alla resistenza, all'elasticità e alla biodegradazione dell'impalcatura. Infine, le spese accessibili e a basso costo consentono la riproducibilità e una traduzione più ampia della tecnica.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Gli autori desiderano ringraziare il personale del Dipartimento di Medicina Sperimentale (AEM) dell'Università di Copenaghen, per l'assistenza nella pianificazione e nell'esecuzione di interventi chirurgici e zootecnici, e ELLA-CS, s.r.o, Hradec Kralove, Repubblica Ceca, per aver fornito stent biodegradabili personalizzati utilizzati nello studio. Il sostegno finanziario è stato fornito dalla Società Svedese di Ricerca Medica, dalla Fondazione Promobilia, dalla Fondazione Rydbeck, dalla Fondazione Samariten, dalla Fondazione per l'Assistenza Sanitaria Pediatrica, dalla Fondazione Frimurare Barnhuset di Stoccolma e dalla Fondazione Novo Nordisk (NNFSA170030576).
Materiali
| Name | Company | Catalog Number | Comments |
| 10x MEM | Gibco, Thermo Fisher Scientific, Waltham, US | 2517592 | Collagen preparation |
| 1x MEM | Gibco, Thermo Fisher Scientific, Waltham, US | 2508924 | Collagen preparation |
| Ambu aScope 4 Cysto | Ambu A/S, Ballerup, DK | 1000682507 | Cystoscope |
| Aquaflush ACE stopper | Abena, Taastrup, DK | ACE12/220501 | ACE stopper |
| Borgal vet inj opl 200 + 40 mg/mL | Ceva Animal Health A/S | 510460 | Sulfonamide/Trimethoprim |
| Bupaq multidose vet 0.3 mg/mL | Salfarm Danmark A/S, DK | 502763 | Buprenorphin |
| Butomidor vet inj 10 mg/mL | Salfarm Danmark A/S, DK | 531943 | Buthorphanol |
| Comfortan vet inj 10 mg/mL | Dechra Veterinary Products A/S, DK | 492312 | Metadone |
| Ethilon suture 3-0 | Ethicon, Johnson & Johnson, New Brunswick, US | SGBCXV | Monofilament non-resorbable |
| Fentanyl inj 50 µg/mL(hamel) | Hameln Pharma ApS, DK | 432520 | Fentanyl |
| Ketador vet inj 100 mg/mL | Salfarm Danmark A/S, DK | 115727 | Ketamine |
| Metacam inj 20 mg/mL t.cattle/pig/horse | Boehringer Ingelheim Animal, DE | 6443 | Meloxcicam |
| Metacam oral suspension 15 mg/mL pigs | Boehringer Ingelheim Animal, DE | 482780 | Meloxcicam |
| Omnipaque | GF Healthcare, Oslo, NO | 16173849 | Contrast for CT |
| Pancytokeratin CK-AE | DAKO Agilent, US | GA053 | Clone AE1/AE3 |
| PDS suture 3-0 | Ethicon, Johnson & Johnson, New Brunswick, US | SEMMTQ | Monofilament slow-resorbable |
| Prolene suture 4-0 | Ethicon, Johnson & Johnson, New Brunswick, US | PGH187 | Monofilament non-resorbable |
| Propolipid t.inj/inf 10 mg/mL | Fresenius Kabi, DK | 21636 | Propofol |
| Rat-tail collagen type I | First Link Ltd, Wolverhampton, UK | 60-30-810 | 2.06 mg/mL protein in 0.6% acetic acid |
| Suprim vet 20 + 100 mg (Solution for use in drinking water) | Dechra Veterinary Products A/S, DK | 33661 | Sulfonamide/Trimethoprim |
| SX-ELLA Degradable Biliary DV stent | ELLA-CS, Trebes, CZ | S23000056-01 | ø 6 mm x 60 mm |
| Vicryl mesh | Ethicon, Johnson & Johnson, New Brunswick, US | VM1208 | Mesh |
| Vicryl suture 4-0 | Ethicon, Johnson & Johnson, New Brunswick, US | SMBDGDR0 | Braided fast-resorbable |
| Xysol vet inj 20 mg/mL | ScanVet Animal Health A/S, DK | 54899 | Xylazine |
| Zoletil 50 vet plv/sol t.inj 25 + 25 mg/mL | Virbac Danmark A/S, DK | 568527 | Tiletamine and Zolazepam |
Riferimenti
- Surer, I., Ferrer, F. A., Baker, L. A., Gearhart, J. P. Continent urinary diversion and the exstrophy-epispadias complex. J Urol. 169 (3), 1102-1105 (2003).
- Cranidis, A., Nestoridis, G. Bladder augmentation. Int Urogynecol J Pelvic Floor Dysfunct. 11 (1), 33-40 (2000).
- Atala, A., Bauer, S. B., Hendren, W. H., Retik, A. B. The effect of gastric augmentation on bladder function. J Urol. 149 (5), 1099-1102 (1993).
- Husmann, D. A. Mortality following augmentation cystoplasty: A transitional urologist's viewpoint. J Pediatr Urol. 13 (4), 358-364 (2017).
- Mitrofanoff, P. Trans-appendicular continent cystostomy in the management of the neurogenic bladder. Chir Pediatr. 21 (4), 297-305 (1980).
- Leslie, B., Lorenzo, A. J., Moore, K., Farhat, W. A., Bägli, D. J., Pippi Salle, J. L. Long-term followup and time to event outcome analysis of continent catheterizable channels. J Urol. 185 (6), 2298-2302 (2011).
- Horst, M., Eberli, D., Gobet, R., Salemi, S. Tissue engineering in pediatric bladder reconstruction-The road to success. Front Pediatr. 7, 91(2019).
- Ajalloueian, F., Lemon, G., Hilborn, J., Chronakis, I. S., Fossum, M. Bladder biomechanics and the use of scaffolds for regenerative medicine in the urinary bladder. Nat Rev Uro. 15 (3), 155-174 (2018).
- Dorin, R. P., Pohl, H. G., De Filippo, R. E., Yoo, J. J., Atala, A. Tubularized urethral replacement with unseeded matrices: what is the maximum distance for normal tissue regeneration. World J Uro. 26 (4), 323-326 (2008).
- El Kassaby, A. W., AbouShwareb, T., Atala, A. Randomized comparative study between buccal mucosal and acellular bladder matrix grafts in complex anterior urethral strictures. J Urol. 179 (4), 1432-1436 (2008).
- Casarin, M., et al. Porcine small intestinal submucosa (SIS) as a suitable scaffold for the creation of a tissue-engineered urinary conduit: Decellularization, biomechanical and biocompatibility characterization using new approaches. Int J Mol Sci. 23 (5), 2826(2022).
- Casarin, M., et al. A novel hybrid membrane for urinary conduit substitutes based on small intestinal submucosa coupled with two synthetic polymers. J Funct Biomater. 13 (4), 222(2022).
- Drewa, T. The artificial conduit for urinary diversion in rats: a preliminary study. Transplant Proc. 39 (5), 1647-1651 (2007).
- Liao, W., et al. Tissue-engineered tubular graft for urinary diversion after radical cystectomy in rabbits. J Surg Res. 182 (2), 185-191 (2013).
- Reinfeldt Engberg, G., Lundberg, J., Chamorro, C. I., Nordenskjöld, A., Fossum, M. Transplantation of autologous minced bladder mucosa for a one-step reconstruction of a tissue engineered bladder conduit. Biomed Res Int. 2013, 212734(2013).
- Ajalloueian, F., Nikogeorgos, N., Ajalloueian, A., Fossum, M., Lee, S., Chronakis, I. S. Compressed collagen constructs with optimized mechanical properties and cell interactions for tissue engineering applications. Int J Biol Macromol. 108, 158-166 (2018).
- Chamorro, C. I., Zeiai, S., Engberg, G. R., Fossum, M. Minced tissue in compressed collagen: A cell-containing biotransplant for single-staged reconstructive repair. J Vis Exp. (108), e53061(2016).
- Juul, N., et al. Insights into cellular behavior and micromolecular communication in urothelial micrografts. Sci Rep. 13 (1), 13589(2023).
- Reinfeldt Engberg, G., Chamorro, C. I., Nordenskjöld, A., Fossum, M. Expansion of submucosal bladder wall tissue in vitro and in vivo. Biomed Res Int. 2016, 5415012(2016).
- Juul, N., Ajalloueian, F., Willacy, O., Chamorro, C. I., Fossum, M. Advancing autologous urothelial micrografting and composite tubular grafts for future single-staged urogenital reconstructions. Sci Rep. 13 (1), 15584(2023).
- Willacy, O., Juul, N., Taouzlak, L., Chamorro, C. I., Ajallouiean, F., Fossum, M. A perioperative layered autologous tissue expansion graft for hollow organ repair. Heliyon. 10 (3), e25275(2024).
- Chamorro, C. I., et al. Exploring the concept of in vivo guided tissue engineering by a single-stage surgical procedure in a rodent model. Int J Mol Sci. 23 (20), 12703(2022).
- Casarin, M., Morlacco, A., Dal Moro, F. Bladder substitution: The role of tissue engineering and biomaterials. Process. 9 (9), 1643(2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon