流细胞学和荧光活化细胞分拣(FACS):血性B淋巴细胞的分离
Overview
资料来源:佩尔切特·蒂鲍特1,2,3,穆尼尔·西尔万1,2,3,苏菲·诺沃4,雷切尔·戈卢布1,2,3
1法国巴黎巴斯德研究所免疫学系淋巴病系
2 INSERM U1223, 巴黎, 法国
3巴黎迪德罗大学,索邦巴黎城,大提琴巴斯德,巴黎,法国
4流式细胞测定,细胞学和生物标志物 UtechS,转化科学中心,巴斯德研究所,法国巴黎
免疫系统的整体功能是保护身体免受传染性生物和其他入侵者的攻击。白血球,或白细胞,是免疫系统的关键角色。感染后,它们被激活并启动免疫反应。白细胞可以分为不同的亚群(例如,骨髓细胞、淋巴细胞、树突状细胞),根据不同的参数,可以是生物、物理和/或功能(例如,大小、粒度和分泌)。描述白细胞的一个方法是通过其表面蛋白,主要是受体。每个白细胞群表示受体(例如细胞毒性、活化、迁移受体)的特定组合,这些受体可以定义种群中的子集。由于免疫系统包含广泛的细胞群,因此必须描述它们,以破译它们参与免疫反应。
流式细胞学(FC或FCM)是一种广泛使用的方法,用于分析细胞表面和细胞内分子的表达,在异质细胞混合物中描述和定义不同的细胞类型。流式细胞计由三个主要子系统组成:流体、光学和电子。流体系统将细胞在溪流中传输,以便它们逐一在激光前通过。光学系统由光源(激光器)照明粒子、光学滤光片将产生的光和荧光信号定向到适当的探测器。最后,电子系统将检测到的光信号转换成计算机可以处理的电子信号。当单个细胞在激光束前经过时,它会散射光。光束前面的探测器测量正向散射 (FS),侧测量侧散射 (SC) 的多个探测器测量。FS 与细胞大小相关,SC 与细胞粒度成正比。通过这种方式,通常可以仅根据细胞大小和粒度的差异来区分细胞群。
除了分析细胞的大小、形状和复杂性外,流式细胞仪还广泛用于检测细胞表面受体的表达(1)。这是通过使用含氟铬标记的单克隆抗体,结合已知的细胞特异性受体来实现。在激发时,这些结合的氟铬会发出一种特定波长的光,称为发射波长,可以检测并评分。荧光测量提供有关含氟铬标记细胞表面受体的定量和定性数据。血液学家首先使用FC对免疫细胞群进行治疗随访(2)。现在,它用于广泛的应用,如免疫分体、细胞活力、基因表达、细胞计数和GFP分析。
FACS(荧光活化细胞分拣机)是一种专门类型的流式细胞测定法,它使用荧光标记将细胞群分为亚群。与传统的流式细胞仪一样,首先收集FS、SC和荧光数据。然后,机器施加电荷(负或正),静电偏转系统(电磁铁)便于将含有电池的带电液滴收集到适当的管中。
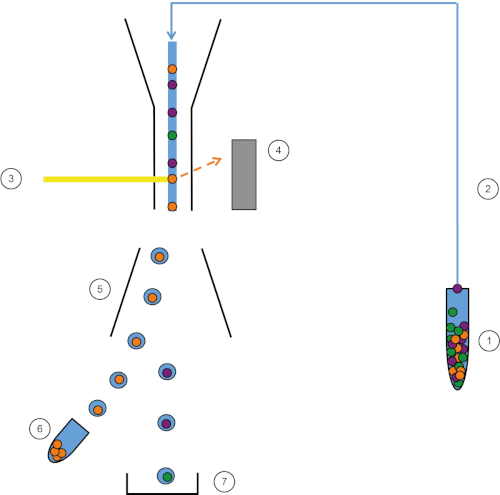
图1:FACS的原理图表示形式。样品 (1) 在 FACS (2) 中吸进,并在激光 (3) 前面通过。细胞荧光由荧光检测器(4)检测。最后,细胞被整合到液滴中,感兴趣的细胞被偏转板(5)偏转,并收集在收集管(6)中。其余的细胞进入垃圾箱 (7)。请点击此处查看此图的较大版本。
FACS 的排序方面具有许多优点。许多测试可以帮助了解特定细胞在免疫系统中的作用,例如分析基因表达,如RT-qPCR、细胞周期或细胞因子分泌。然而,细胞应经过上游纯化,以获得明确和具体的结果。在这里,FACS有用,所需的细胞可以分类与高纯度,产生高度可靠和可重复的结果。FACS还可用于根据核或其他细胞内染色和表面受体的存在、缺失和密度对细胞进行排序。FACS现在是一种标准技术,用于纯化细胞亚群,能够同时对四个种群进行分类。
本实验室练习演示如何分离脾白细胞,然后如何使用 FACS 从脾白细胞混合物中具体分类 B 淋巴细胞。
Procedure
1. 准备
- 开始之前,戴上实验室手套和适当的防护服。
- 消毒所有解剖工具,首先用洗涤剂,然后用70%乙醇,然后彻底干燥。
- 准备50mL的汉克平衡盐溶液(HBSS),含有2%的胎儿小牛血清(FCS)。
2. 解剖
- 使用二氧化碳输送系统,用缺氧对小鼠实施安乐死。将安乐死小鼠固定在上部位置的解剖板上,并使用剪刀和钳子进行纵向腹腔切除术。
- 使用钳子,移动腹部右侧的肠道和胃,露出胃和脾脏。脾脏附着在胃上。
- 使用钳子,小心地从胃分离脾脏,并将其放入含有5mL的HBSS 2%FCS的培养皿中。
3. 免疫细胞隔离
- 将脾脏放在40μm细胞滤网中,放在同一个培养皿上。用柱塞压碎脾脏,将其分离在同一道菜中。
- 将分离的脾脏和液体转移到15mL的离心管中。
- 在 370 x g下在 10°C 下将管离心 7 分钟,然后丢弃上清液,避免颗粒。
- 在2mL的醋酸钾中重新悬浮颗粒,以赖化红细胞。等待 2 分钟,然后用 HBSS 2% FCS 将音量补至 15mL。
- 在 10°C 下,在 370 x g下再次将管离心 7 分钟。丢弃上清液,在 5mL 的 HBSS 2% FCS 中重新悬浮颗粒。
- 使用锥蓝色染色测定对细胞进行计数,并使用适当的HBSS 2%FCS量将最终细胞浓度调整到107细胞/mL。
4. 细胞染色
- 将200μL的细胞悬浮液转移到6个FACS管中,标有1至6。
- 在 370 x g下在 10°C 下将管离心 7 分钟,并丢弃上清液,避免颗粒。
- 接下来,根据表1,通过在200μL HBSS 2%FCS中加入适量的抗体,制备6种新型抗体混合物。
- 然后,将这些抗体混合物转移到相应的编号FACS管中。
- 在黑暗中的冰上孵育与抗体混合的细胞悬浮液20分钟。
- 在每个管中加入 1mL 的 HBSS 2% FCS,然后在 370 x g下在 10°C 下再次离心 3 分钟。
- 丢弃上清液,在 200μL 的 HBSS 2% FCS 中重新悬浮颗粒。
- 将重新悬浮的颗粒转移到新的 FACS 管中。
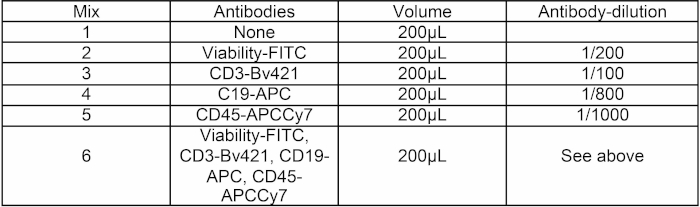
表1:抗体混合组合。为实验准备了六种200μL的HBSS+抗体混合物。混合 1 用于 PMT 设置,混合 2 到 5 用于补偿设置,混合 6 用于单元格排序。
5. FACS 校准
- 首先,打开分拣机并执行"流体启动"。
- 打开流,然后等待 15 分钟,使流稳定下来。
- 调整流的振幅以获得分离的跌落形成。然后单击"甜蜜点"以完成振幅调整。
- 将中性密度 (N.D.) 滤波器 - 1.0 打开代表细胞仪设置和跟踪的"CST"接口。
- 要执行日常质量控制,首先按照制造商的说明,使用 FACS 介质稀释 CST 磁珠,然后执行 CST 控制。
- CST 控制完成后,将 N.D. 1.0 过滤器替换为细胞仪上的 N.D. 2.0 滤波器。
- 接下来,按照制造商的说明在 FACS 介质中稀释滴延迟磁珠,然后加载到 FACS 中。
- 确保正确排序执行放置延迟-
- 首先单击"电压",然后单击"光学滤波器"。右侧象限应等于 100%。如有必要,向左或向右调整细胞仪上的红色激光螺钉,以获得 100% 的右侧象限。
- 接下来,执行测试排序以确保流落入收集管。为此,请单击"废物抽屉",然后开始"测试排序"。检查侧流落入收集管。如果没有,请调整电压,直到调整电压。
- 导航到实验模板。然后,打开"Aaccdrop 丢弃延迟"实验,然后单击"排序布局"。
- 更改流速以每秒获取 1000 到 3000 个事件。
- 单击"电压",然后单击"光学滤波器"。左象限应等于 0,右象限应等于 100。
- 在"排序布局"窗口中单击"排序",然后单击"取消"。左象限应等于 100,右象限应等于 0。如果左象限小于 95,请单击"自动延迟"以自动调整它。
6. 流动细胞测定和纯度控制
- 从管1(未染色的细胞)开始流动细胞测定,以定义细胞形态和氟铬的负峰。设置正向和侧面散射,并定义每个荧光参数的电压。使用每个点图上的网格,在第一个十年中放置负总体。
- 接下来,在细胞仪中加载管2(单色控制)。调整光谱重叠,直到负总体和正总体中位数对齐或使用自动计算软件。保持信号的刻度非常重要。补偿控制必须与实验荧光铬和探测器设置相匹配。记录 10,000 个事件。
- 使用管 3、4 和 5(其他单色控件)重复这些步骤。
- 接下来,加载管6(多染色细胞),并使用特定的浇注策略定义感兴趣的细胞群。
- 在"排序布局"窗口中,选择感兴趣的单元格总体。在"目标事件"中选择单元格阈值,在"精度"中选择精度级别。这里只有一个人口被排序,但是,四个不同的人口可以同时排序。
- 准备好后,单击"排序"和"确定",然后等待单元格排序。
- 细胞分拣完成后,首先将10μL的分类细胞移入带有90微升HBSS 2%FCS的新FACS管中,从而进行纯度控制。
- 然后,将管装入细胞仪。记录和分析细胞的表型,以验证浇注策略是否按预期工作。
7. 数据分析
- 打开"FlowJo"软件,在"所有样本"窗口中拖动每个管的文件。
- 双击文件以在新窗口中打开该文件。
- 单击"多边形"并重新创建以前使用到的浇注策略。
- 对所有其他文件重复这些步骤。
- 要可视化点图,请单击"布局编辑器",然后从管 6 和布局编辑器选项卡中的纯度控制中拖动感兴趣的人群。
- 要检查已排序单元格中 B 淋巴细胞的纯度,请单击"表编辑器"。从管6中拖动B淋巴细胞群和表中的纯度控制。
- 在"统计"菜单上选择CD45+细胞的频率以测试这个细胞群的纯度,然后单击"创建表"。
- 参数值将显示在新表中。在纯度控制窗口中,检查CD45+细胞内B淋巴细胞的频率,应高于98%(见图2,底部面板)。
Results
在此协议中,我们使用FACS技术纯化了脾B淋巴细胞。我们首先从脾脏中分离出白细胞并染色。使用 B 细胞表面标记的组合,我们创建了一个门控策略来对它们进行排序(图 2,顶部面板)。在实验结束时,我们通过"纯度测试"验证了收集管中的细胞是否为B细胞。我们保持相同的浇注策略,并观察到超过98%的细胞确实是B细胞(图2,底部面板)。因此,FACS是分离高纯度免疫细胞群的有效方案。采集的细胞可用于下游实验,如细胞培养、RT-qPCR和细胞毒性测定。
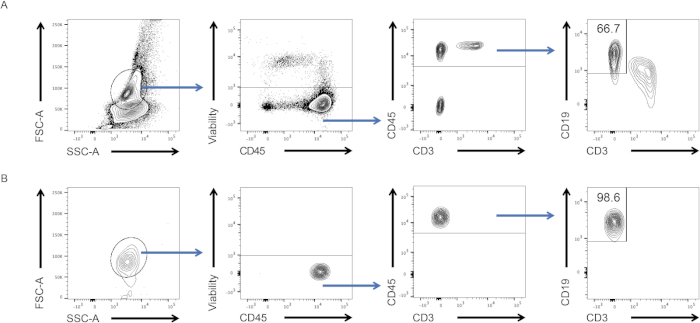
图 2:门控策略和测试后排序纯度。(A) 细胞首先根据其形态(左:FSC-A、SSC-A)进行封闭,然后仅针对CD19和CD3绘制活细胞(左中:生存能力,CD45)、CD45+细胞(CD45、CD3)。仅对 CD19+单元格进行排序。(B) 细胞分类后获得一小部分细胞的纯度测试结果。请点击此处查看此图的较大版本。
Application and Summary
流式细胞仪是一种第一手技术,用于对具有高纯度的免疫细胞群进行表征和分类。它是研究领域的原始工具,因为它允许丰富特定的细胞群,并破译对病原体的免疫反应。随着可用氟铬和细胞仪数量的增加,可检测参数的数量大大增加。因此,对FACS数据的生物信息分析已经开始出现,为流式细胞学开辟了新的视野(3)。流式细胞仪提供血液学和肿瘤学 (4) 的其他应用,用于开发诊断工具。
Tags
跳至...
此集合中的视频:

Now Playing
流细胞学和荧光活化细胞分拣(FACS):血性B淋巴细胞的分离
Immunology
93.2K Views

磁性活细胞分拣 (MACS): 胸腺 T 淋巴细胞的分离
Immunology
23.1K Views

ELISA Asas :间接、三明治和竞争
Immunology
239.3K Views

ELISPOT 分析:检测 IFN-- 分泌性细胞
Immunology
28.8K Views

免疫组织化学和免疫细胞化学:通过光显微镜进行组织成像
Immunology
79.1K Views

抗体生成:使用杂交瘤生产单克隆抗体
Immunology
43.7K Views

免疫荧光显微镜:石蜡内嵌组织部分的免疫荧光染色
Immunology
54.0K Views

共聚焦荧光显微镜:确定小鼠纤维细胞中蛋白质定位的技术
Immunology
43.4K Views

基于免疫沉淀的技术:使用阿加玫瑰珠纯化内源性蛋白质
Immunology
87.9K Views

细胞周期分析:使用CFSE染色和流细胞测定法评估刺激后CD4和CD8 T细胞增殖
Immunology
24.3K Views

收养细胞转移:将供体小鼠孢子细胞引入宿主小鼠,并通过FACS评估成功
Immunology
22.6K Views

细胞死亡测定:细胞毒性能力的铬释放测定
Immunology
151.5K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。