Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Linearisierung der Bradford Protein Assay
In diesem Artikel
Zusammenfassung
Die Genauigkeit und Empfindlichkeit der Protein-Bestimmung durch die schnelle und bequeme Bradford Assay wird durch intrinsische Nichtlinearität beeinträchtigt. Wir zeigen eine einfache Linearisierung Verfahren, das erhöht die Genauigkeit, verbessert die Sensitivität des Tests zu 10-fach, und reduziert Störungen durch Reinigungsmittel.
Zusammenfassung
Bestimmung von Mikrogramm-Mengen des Proteins in der Bradford Coomassie Brilliant Blue Assay wird durch Messung der Absorption bei 590 nm erreicht. Das häufigste Assay ermöglicht die schnelle und einfache Proteinquantifizierung in Zelllysaten, Zellfraktionen oder rekombinantes Protein-Proben, zum Zweck der Normalisierung der biochemischen Messungen. Doch Kompromisse eine intrinsische Nichtlinearität der Empfindlichkeit und Genauigkeit dieser Methode. Es wird gezeigt, dass unter normalen Testbedingungen, das Verhältnis der Absorptionsmessungen bei 590 nm und 450 nm streng linear mit Protein-Konzentration ist. Dieses einfache Verfahren erhöht die Genauigkeit und verbessert die Sensitivität des Tests zu 10-fach, erlauben die Quantifizierung bis zu 50 ng Rinderserumalbumin. Darüber hinaus ist die Störung häufig von Reinigungsmitteln verwendet werden, um den Zelllysaten erstellen eingeführt stark durch das neue Protokoll reduziert. Eine lineare Gleichung auf der Basis von Massenaktionen und Beer-Gesetz entwickelt passt perfekt zu den experimentellen Daten.
Protokoll
Linearisierung der Bradford Protein Eichkurve:
Die Coomassie Brilliant Blue-Protein-Assay, die gemeinhin als Bradford-Assay 1 bekannt, ist weithin wegen seiner schnellen und komfortablen Protokoll sowie die relative Empfindlichkeit eingesetzt. Leider gibt es ein großes Maß an Krümmung über ein breites Spektrum von Protein-Konzentrationen (Abb. 1). Daher ist nur ein schmales Spektrum von relativ hohen Protein-Konzentrationen, 2-10 mg / ml BSA, für die Eichkurve, die dann besser passt lineare Regression (Abb. 1, grün) verwendet. Allerdings erfordert die Nichtlinearität Proteinkonzentration der unbekannten Proben innerhalb der begrenzten Reichweite der Eichkurve fallen, um einen großen Fehler zu vermeiden, und es reduziert auch die Genauigkeit innerhalb der begrenzten Reichweite. Die Nichtlinearität stellt ein ernstes Problem insbesondere bei Mikrogramm-Mengen des Proteins nicht zur Verfügung stehen, und es erfordert oft mehrere Verdünnungen der unbekannten Proben.
Wie in der ursprünglichen Bradford Papier darauf hingewiesen, "die Quelle der Nichtlinearität ist im Reagens selbst, da gibt es eine Überschneidung in das Spektrum der beiden anderen Farbe Formen des Farbstoffs." 1. In der Tat sind drei Formen des Coomassie Brilliant Blue Farbstoff in Säure-Basen-Gleichgewicht bei den üblichen sauren pH-Wert des Tests 2. Die roten, blauen und grünen Formen haben Absorptionsmaxima bei 470, 590 und 650 nm (Abb. 2). Das Blau ist die Form, die das Protein bindet, einen Komplex bilden, die sich intensiv absorbiert Licht bei 594 nm 3, 4 (Abb. 2). Bradford auch darauf hingewiesen, dass "die Hintergrund-Wert für das Reagens kontinuierlich abnimmt, da mehr Farbstoff an Protein gebunden ist" 1 (Abb. 3). Deshalb haben wir versucht, die Reduzierung der 590 nm Hintergrund zu berechnen, als zunehmende Protein Mengen zugesetzt werden, durch Messung der Änderung der Absorption bei 450 nm, wobei die Protein-Farbstoff-Komplex nicht absorbiert. Wir fanden, dass die abnehmende Hintergrund teilweise, aber nicht vollständig, Konten für die Nichtlinearität (Abb. 4).
Wir haben dann vermutet, dass die Abnahme der freien Farbstoffkonzentration weitere Verzerrung der linearen Antwort produziert, weil sie als Protein-Farbstoff-Bindung ist im Gleichgewicht 5, hängt Komplexbildung nicht nur von der Konzentration des freien Proteins, sondern auch auf, dass der freie Farbstoff (Abb. 5). Unter Berücksichtigung sowohl der Fragen im Zusammenhang mit der variablen Konzentration des freien Farbstoffes, entwickelten wir eine mathematische Gleichung, die eine lineare Beziehung zwischen Proteinkonzentration und das Verhältnis von Absorptionsmessungen, 590 nm auf 450 nm (Abb. 6) beschreibt. Eine detaillierte Beschreibung der theoretischen und experimentellen Studie finden Sie in unserem 1996 Publikation in Analytical Biochemistry 6 zu finden. Die mathematische Gleichung wurde experimentell getestet und eine lineare Eichkurve über den gesamten Protein-Konzentrationen Bereich (Abb. 7) ergeben. Darüber hinaus wurde die Gleichung auch durch eine unabhängige Ermittlung der richtigen pH-abhängige Wert der Y-Achsenabschnitt 6 validiert.
Detaillierte Protokoll für die Verbesserung der Bradford Protein Assay, mit einem Mikrotiterplatten-Absorption Reader:
- Bereiten Sie eine 0,1 mg / ml Stammlösung von der Norm, Rinderserumalbumin. Jede andere Norm kann gewählt werden, aber beachten Sie, dass den gleichen Standard in allen Experimenten verwendet werden muss.
- Verdünnen Sie die unbekannten Proben in deionisiertem Wasser. Aim auf 5-50 pg / ml. Dennoch sind höher oder niedriger Proteinkonzentrationen akzeptabel, da es anscheinend keine Begrenzung für die lineare Bereich des Assays. Allerdings muss die Messung im linearen Bereich der Absorption Leser.
- Verdünnen Sie die Bradford-Reagenz (Bio-Rad) 2,5-fach in deionisiertem Wasser.
- Add 0 und 10-50 ul BSA-Stammlösung zu dreifachen Wells (Erstellen einer 0-5 pg BSA Eichkurve). Ergänzung mit deionisiertem Wasser auf 100 ul / well erreichen.
- In verschiedenen Vertiefungen, 100 ul der unbekannten Probe in dreifacher Ausführung. Mehrere Konzentrationen der unbekannten Probe kann verwendet werden, um die Genauigkeit zu erhöhen.
- 100 l der verdünnten Bradford-Reagenz in alle Vertiefungen. Das Gesamtvolumen beträgt 200 ul / well.
- Warten Sie mindestens 5 min, aber nicht mehr als 60 min zur Farbentwicklung.
- Der Blank muss 200 ul entionisiertem Wasser (und nicht die Null-Protein-Farbstoff gut) sein.
- Die Absorption bei 590 nm und 450 nm.
- Bereiten Sie eine Eichkurve, indem das Nettovermögen Absorptionswerte bei 590 nm und 450 nm. Beachten Sie, dass die Null-Protein (Farbstoff nur) Wert als einen Datenpunkt (Abb. 8) einbezogen werden sollten.
- Berechnen Sie die Konzentration der unbekannten Probe auf der linearen Gleichung der Eichkurve (Abb. 9).
Repräsentative Ergebnisse:
Anders als die Absorption bei einer Wellenlänge von 590 nm, das Verhältnis der Absorptionswerte, 590 nm auf 450 nm, ist linear wit-Protein-Konzentration (Abb. 10).
Die Proteinkonzentration der unbekannten Probe kann einfach berechnet werden nach der linearen Gleichung der Eichkurve (Abb. 10, Gleichung).
Allerdings ist eine höhere Genauigkeit durch Messung mehrere unbekannte Probenverdünnungen erhalten. Zu diesem Zweck bereiten zwei Graphen. Die erste ist eine Eichkurve für den Standard mit ug Protein auf der X-Achse (Abb. 11, rechts). Die zweite Grafik ist für die unbekannte Probe mit ul der ursprünglichen Probe unverdünnt auf die X-Achse (Abb. 11, links). Der Farbstoff nur Wert sollte in beiden Diagrammen aufgenommen werden (Abb. 11). Die Proteinkonzentration der unbekannten Probe wird ermittelt, indem die Hänge der unbekannten Probe und die Standard-(Abb. 11, Gleichung) abgeleitet.
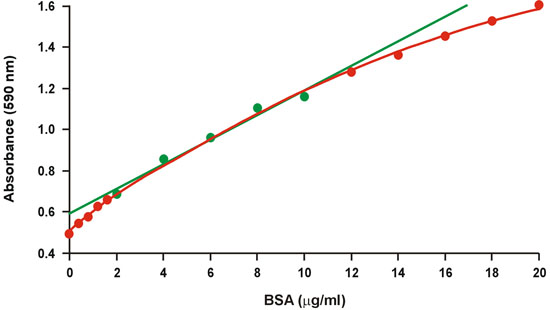
Abbildung 1. Konventionelle Bradford Eichkurve. Der lineare Bereich ist von grünen Symbolen dargestellt.

Abbildung 2. Spectra der Protein-Farbstoff-Komplexes und der Farbstoff allein.

Abbildung 3. Protein-Farbstoff-Gleichgewicht.
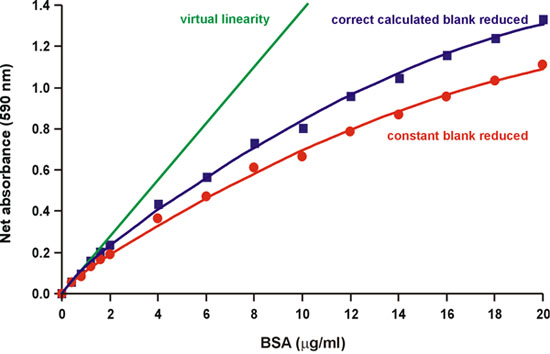
Abbildung 4. Reduktion der korrekten Berechnung Hintergrund teilweise abnimmt Nichtlinearität.
Abbildung 5. Protein-Farbstoff-Gleichgewicht.

Abbildung 6. Mathematische Grundlage für die Linearisierung des Bradford-Protein-Assay.
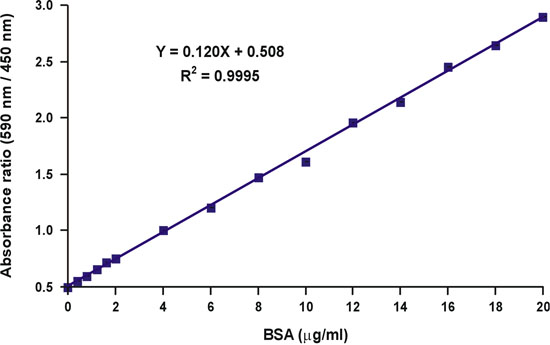
Abbildung 7. Linearisierung der Bradford Eichkurve.

Abbildung 8. Berechnung der Absorption Ratio-Werte.

Abbildung 9. Eine lineare Bradford Eichkurve.
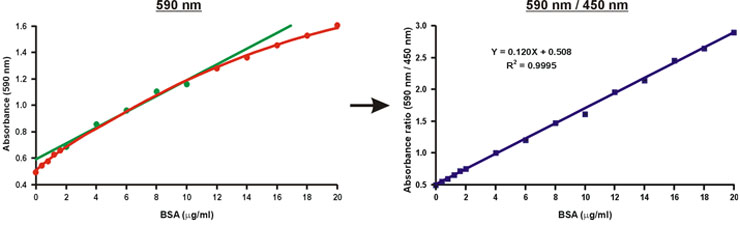
Abbildung 10. Linearisierung der Bradford Eichkurve.
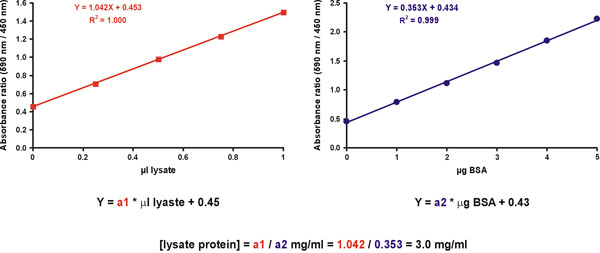
Abbildung 11. Unknown Probe-Konzentration Berechnung.
Diskussion
Die Bradford-Protein-Assay ist beliebt wegen seiner einfachen Leistung und relative Empfindlichkeit. Die Linearisierung über den gesamten Protein-Konzentrationen Bereich durch das Protokoll erhalten hier vorgestellten weiter vereinfacht den Test, wie die unbekannten Proben müssen sich nicht innerhalb des Bereiches der Eichkurve fallen.
Wichtig ist, dass die verbesserte Protokoll weiteren bietet die folgenden Vorteile gegenüber dem ursprünglichen Bradford-Protokoll:
- Erhöhte ...
Danksagungen
Dieses Papier ist dem Andenken des verstorbenen Dr. Zvi Selinger, der das Original hier beschriebenen Untersuchungen gehostet gewidmet.
Materialien
| Name | Company | Catalog Number | Comments |
| Bradford reagent | Bio-Rad | 500-0006 | |
| Bovine Serum Albumin | Amersco | 0332 | |
| Multiplate absorbance reader | BioTek | Synergy2 |
Referenzen
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Chial, H. J., Thompson, H. B., Splittgerber, A. G. A spectral study of the charge forms of Coomassie blue G. Anal Biochem. 209, 258-266 (1993).
- Chial, H. J., Splittgerber, A. G. A comparison of the binding of Coomassie brilliant blue to proteins at low and neutral pH. Anal Biochem. 213, 362-369 (1993).
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Anal Biochem. 151, 369-374 (1985).
- Congdon, R. W., Muth, G. W., Splittgerber, A. G. The binding interaction of Coomassie blue with proteins. Anal Biochem. 213, 407-413 (1993).
- Zor, T., Selinger, Z. Linearization of the Bradford protein assay increases its sensitivity: theoretical and experimental studies. Anal Biochem. 236, 302-308 (1996).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten