Method Article
Intraperitoneale Injektion in Adult Zebrafisch
In diesem Artikel
Zusammenfassung
Wir zeigen, intraperitoneale Injektion in das Erwachsenenleben Zebrafisch. Wir verwenden eine 10 ul Nanofil Mikrospritze durch eine Micro4 Controller und UltraMicroPump III geregelt. Diese Demonstration umfasst den Einsatz von kaltem Wasser als Betäubungsmittel.
Zusammenfassung
Ein praktisches Verfahren zur chemischen Behandlung von Zebrafisch ist das Reagens in den Tank Wasser, wo sie von den Fischen genommen wird eingeführt. Allerdings macht diese Methode ist es schwierig zu wissen, wie viel Reagenz absorbiert wird oder bis pro Fisch entnommen. Einige experimentelle Fragen, insbesondere im Zusammenhang mit metabolischen Studien kann besser durch die Bereitstellung einer definierten Menge zu jedem Fisch, auf das Gewicht angesprochen werden. Hier präsentieren wir eine Methode für die intraperitoneale (ip) Injektion in das Erwachsenenleben Zebrafisch. Injection in die Bauchhöhle, hinter dem Beckengürtel. Dieses Verfahren wird von veterinärmedizinischen Methoden für größere Fische abgestimmt sind. Es ist sicher, wie wir Null-Mortalität beobachtet haben. Zusätzlich haben wir gesehen, Blutungen an der Injektionsstelle in nur 5 von 127 Injektionen, und in jedem dieser Fälle die Blutung war kurz, mehrere Sekunden dauert, und die Menge Blut verloren war klein. Erfolg mit diesem Verfahren erfordert schonende Behandlung der Fische in mehreren Schritten einschließlich Fasten, Wäge-, Anästhesie, Einspritzung und Erholung. Vorsichtsmaßnahmen sind erforderlich, um Stress während des gesamten Verfahrens zu minimieren. Unsere Vorsichtsmaßnahmen gehören mit einem kleinen Injektionsvolumen und eine 35G Nadel. Wir verwenden Cortland Salzlösung als das Fahrzeug, das osmotisch für Süßwasserfische ist ausgewogen. Die Belüftung der Kiemen während der Injektion durch erste bringt die Fische in eine chirurgische Ebene der Anästhesie, die langsamen Bewegungen Operculum erlaubt gehalten, und zweitens, indem die Fische in einer Wanne in einem mit Wasser gesättigten Schwamm während der Injektion selber. Wir demonstrieren den Nutzen von IP Injektion durch die Injektion von Glucose und Überwachung der Anstieg des Blutzuckerspiegels und die anschließende Rückkehr zur Normalität. Wie Stress ist bekannt, dass Blutzucker in Knochenfische erhöhen, vergleichen wir den Blutzuckerspiegel in Fahrzeug-Injektion und nicht gespritzt Erwachsene und zeigen, dass das Verfahren nicht zu einem signifikanten Anstieg des Blutzuckerspiegels.
Protokoll
1. Pre-Injektion Vorbereitungen
- Schnell den Fisch für mindestens 24 Stunden vor der Injektion. Dies wird der Darm leer Glühlampe (Magen) Inhalt. Die grundlegende Fasten-Protokoll ist, um die Fische zu übertragen, um ihre normale Dichte, um einen sauberen Tank, dann zurückzuhalten Essen. Für längerfristige Fasten, dass strengere Bedingungen erfordert (z. B. für Blutzucker-Studien), siehe zusätzliche Überlegungen in die Diskussion.
- Bereiten Cortland Salzlösung (Perry et al., 1984).
Für eine 100 ml Volumen, lösen sich die folgenden in destilliertem Wasser:
725 mg NaCl (124,1 mM)
38 mg KCl (5,1 mM)
41 mg Na 2 HPO 4 (2,9 mm)
24 mg MgSO 4 ∙ 7H 2 O (1,9 mm)
16 mg CaCl 2 ∙ 2H 2 O (1,4 mM)
100 mg NaHCO 3 (11,9 mm)
4 g Polyvinylpyrrolidon (PVP) (4%)
1.000 USP Einheiten Heparin
Filter, sterilisieren und bei 4 ° C. - Bereiten Sie das Mikroskop.
- Decken Sie die Mikroskop-Basis mit Plastikfolie zum Schutz im Falle von Leckagen.
- Legen Sie ein Papiertuch auf der Oberseite des Plastikverpackung. Der OP-Tisch wird auf der Oberseite des Papiertuch zu sitzen.
- Pre-adjust konzentrieren, indem Sie die OP-Tisch und die Konzentration auf den Schwamm.
- Wiegen der Fische.
- Füllen Sie ein 500 mL Becherglas etwa 1 / 3 voll mit Fisch Betriebswasser.
- Tarieren.
- Sammeln Sie die Fische mit einem Netz. Wick überschüssige Wasser weg aus dem Netz und Fisch durch kurzes Betupfen das Netz auf Papierhandtücher. Übertragen Sie die Fische in das Becherglas.
- Wiegen der Fische.
- Übertragen Sie die Fische, um eine saubere Tank.
- Übertragen Sie jede wog Fisch seine eigene Bezeichnung Tank.
- Berechnen Sie das Injektionsvolumen für jeden Fisch auf Fisch Gewicht.
- Bereiten Sie die Spritze und verwandte Injektionsmaterial. Für die Injektion, empfehlen wir eine 35G abgeschrägte Stahlnadel und einem 10 ul Nanofil Mikrospritze. Bereiten Sie die Nanofil Spritze und Schlauch Silflex folgenden Anweisungen des Herstellers. Es ist wichtig, keine Blasen aus der Spritze und Schlauch entfernen. Nach dem Befüllen der Spritze und Schlauch, montieren Sie die Spritze an der Pumpe, und das Programm das Injektionsvolumen für die ersten Fische.
- Bereiten Sie den OP-Tisch.
- Schneiden Sie einen weichen Schwamm (z. B. # L800-D, Jaece Industries), so dass es ungefähr 20 mm in der Höhe ist. Auf dem flachen Gesicht, machen einen Schnitt, 10-15 mm tief ist. Dieser Schnitt wird der Trog, dass der Fisch für die Injektion hält.
- Setzen Sie den Schwamm in eine 60 mm Petrischale.
- Stellen Sie die Petrischale mit Schwamm in einen angemessen dimensionierten Pipettenspitze box Deckel. Der Deckel muss groß genug sein, um Wasser zu halten, um zur Erhaltung der Schwamm Temperatur, aber es sollte flach genug, um nicht in die Quere kommen. Wir verwenden einen Deckel von einem P200 Spitze Box, 11,4 cm L x 7,7 cm B x 1,5 cm ist D.
- Bereiten Sie die Narkose.
- Machen Sie mit crushed ice cubes aus Fisch-Anlage Wasser.
- Füllen Sie ein sauberes Eiskübel mit zerstoßenem Eis.
- Setzen Sie den OP-Tisch in einen größeren Behälter wie ein 2,4-Liter-Rubbermaid Lebensmittel Vorratsbehälter.
- Gießen Sie etwas Wasser Anlage (warm) in den äußeren Behälter und dem OP-Tisch. Halten Sie eine Reserve von warmen Anlage Wasser in der Nähe.
- Legen Sie ein Thermometer in den äußeren Behälter.
2. Anästhesie, Injection und Recovery
- Legen Sie die Betäubung äußeren Behälters plus OP-Tisch neben dem Mikroskop. Haben die Eimer mit Eis-Chips in der Nähe.
- Bringen Sie die Wassertemperatur auf 17 ° C durch Zugabe von Eis-Chips. Wichtig: Nicht unter 17 ° C gehen für diesen Schritt.
- Verwenden Sie ein Netz, um die Fische zu den äußeren Container übertragen.
- Langsam Eis-Chips auf den Behälter, um die Temperatur zu senken, um 12 ° C im Laufe von mehreren Minuten.
- Monitor Fisch Verhalten: Bei 17 ° C oder etwas tiefer, die Fische in der Regel seine Brustflossen horizontal ausbreiten, Keuchen, und haben eine schnelle Operculum Bewegungen. Als die Temperatur sinkt, wird der Fisch langsamer und schließlich schwimmen stoppen Schwimmen. Da die chirurgische Ebene der Narkose kam, wird keuchend zu stoppen und Operculum Bewegungen werden langsamer. Der Fisch ist fertig für die Injektion, wenn sie nicht reagieren, mit denen umgegangen wird. Für die meisten Fische, 12 ° C ausreichend ist. Größere Fische erfordern kälter water.
- Da die erforderliche Temperatur (~ 12 ° C oder kälter), drücken Sie auf den Schwamm, um es zu sättigen erreicht.
- Halten Sie Ihre Finger in das kalte Wasser ausreichend, so dass sie sich nicht erwärmen die Fische und bringen sie aus der Narkose während der Handhabung.
- Mit kalten Fingern sanft Transfer der Fische in den Trog des Schwammes. Positionieren Sie den Fisch mit dem Bauch nach oben und die Kiemen in den Trog.
- Schnelle Übertragung der OP-Tisch mit dem Mikroskop Bühne.
- Arbeiten schnell, vorsichtig die Nadel in der Mittellinie zwischen den Bauchflossen. Die Nadel sollte kranial Punkt und näher an den Beckengürtel als den Anus eingeführt werden. Sie sollten in der Lage zu fühlen, wenn die Nadel tief ist, um den Körper Wand. Spritzen Sie das entsprechende Volumen und ziehen Sie die Nadel.
- Nach der Injektion sofort in den Fisch wieder in die Warm-Wasser (~ 28,5 ° C) Tank für die Verwertung durch die Freigabe der Fisch aus dem Schwamm über dem Tank Wasser.
Tipp: Wenn der Fisch nicht beginnen Schwimmen sofort, ihm helfen, indem Sie vorsichtig wirbelnde Wasser zu den Kiemen zu erholen. - Überprüfen Sie die Nadel. Gelegentlich einer Skala können beigefügt werden und sollten vor der nächsten Injektion entfernt werden.
- Für nachfolgende Injektionen, mit warmem Wasser Anlage zur Betäubung Kammer Wassertemperatur wieder zu erhöhen, um 17 ° C vor der Einführung der nächsten Fisch.
3. Repräsentative Ergebnisse:
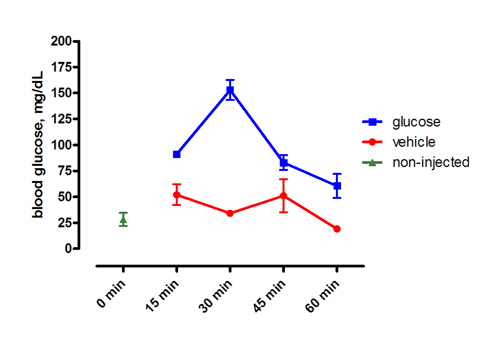
Abbildung 1. Repräsentative Ergebnisse nach intraperitonealer Injektion von 0,5 mg / g Glucose oder Fahrzeug. Die Fische wurden für 72 Stunden vor der Injektion gefastet. Die x-Achse zeigt die Zeit, nach der Injektion. Mittelwert ± SEM.
Diskussion
Intraperitoneale Injektion erfolgt in fünf Schritten: Fasten, Wäge-, Anästhesie, Einspritzung und Erholung. Für jeden Schritt gibt es Best Practices, die den Erfolg sicherstellen können. Success beinhaltet eine gesunde Fische Patienten sowie eine gute experimentelle Ergebnis.
Fasten: Ein 24-stündigem Fasten sollte der Darm leer Glühbirne. Diese Praxis ist aus dem Fisch veterinärmedizinischen Literatur (zB Brown 1993) übernommen. Zusätzliche Fasten Überlegungen werden im Folgenden erörtert.
Längerfristige Fasten: Wir haben festgestellt, dass ein 72-stündigem Fasten erforderlich ist, um den Blutzucker zu einem Basisniveau vor der Injektion zu verringern (Eames et al, 2010.). Wir haben auch festgestellt, dass für die Glucose-Studien gibt es mehrere Verfahren, die erforderlich sind, um sicherzustellen, dass die Fische richtig gefastet werden. Beginnen Sie mit einem sauberen Behälter (kein Schmutz auf der Unterseite). Tanks sollten offline, klar als "Fasten" bezeichnet und in einem Ort, wo begeisterte Fisch Pflegepersonal nicht zu füttern. Beurteilen Sie die äußere Umgebung des Tanks und Schritte unternehmen, um den Fisch ins von Störungen betonte verhindern, denn Stress ist bekannt, Blutzucker (Chavin und Young, 1970.; Groff et al, 1999) zu erhöhen. Zum Beispiel hatten wir ein Fasten Experiment, in dem ein Radio täglich auf der Bank, die halten den Fischbecken wurde betrieben wurde. Wir fanden, dass Blutzucker war ungewöhnlich hoch und festgestellt, dass die Fische durch die Vibrationen wurden betont. Ein weiterer Stressfaktor ist Überbelegung. Fische sollten in einer Dichte, die mit guten Fisch Tierhaltung entspricht gehalten werden. Für Empfehlungen, siehe Brand et al. (2002) und Westerfield (1995). Wir haben gute Ergebnisse Fasten unsere Fische bei einer Dichte von 10-12 Fische in einem 9-Liter-Tank (mit 3 Schichten von Marmor nimmt einige dieser Lautstärke) hatte. Die Trennung der Geschlechter kann Stress verursachen, so dass wir empfehlen, einen Mixed-sex Bevölkerung während des Fastens. Dies bedeutet, dass Eier gelegt werden können, und die Eier müssen abgesondert, so dass sie nicht gegessen werden. Ein einfacher Weg, um Eier absondern zu den Tankboden mit 2-3 Lagen von Kugeln zu decken. Die Wasserqualität muss durch die Beseitigung Eier und Abfall und durch den Austausch etwa 10-15% des Beckenwassers, täglich gepflegt werden. Zum Entfernen von Eiern und Abfall, Siphon funktioniert gut.
Wiegen: Bei der Abwägung Fische, die nicht betäubt, sollte darauf geachtet werden, um Wasser zu übertragen aus dem Netz zu minimieren und in das Becherglas, um genaue Gewicht zu gewährleisten. Wenn das Netz (mit Fisch) auf Küchenpapier abgetupft wird, kann die Mehrheit der überschüssiges Wasser entfernt werden, und das Gewicht genau gemessen werden kann. Es kann einfacher sein, um die Fische vor dem Wiegen zu betäuben, aber wir haben nicht die möglichen Auswirkungen der Anästhesie ein Fisch zweimal an einem Tag getestet. Wir haben unsere Technik durch Wiegen der Fische zuerst mit dem Netting / Blot-Methode und dann wieder den Fisch wiegt, nachdem es wurde betäubt getestet und sanft trocken getupft. Wir fanden keinen signifikanten Unterschied im Gewicht zwischen den Methoden (P = 0,7927, t-Test). Darüber hinaus haben wir getestet, ob das Netzwerk / Blotting-Verfahren betroffen Blutzucker im Vergleich zu lediglich die Übertragung der Fische in den Becher so schnell wie es saldiert (kein Löschpapier). Wir fanden keinen signifikanten Unterschied in Blutzuckerspiegel zwischen den beiden Methoden der Übertragung (P = 0,2241, t-Test).
Betäubende: Chemische Anästhesie kann für viele Studien. Hier haben wir kaltes Wasser Anästhesie als Alternative gezeigt, weil viele Anästhetika (einschließlich tricaine/MS-222 (Brown, 1993)), den Blutzuckerspiegel erhöhen. In früheren Studien haben wir festgestellt, dass kaltes Wasser nicht den Blutzuckerspiegel erhöhen im Zebrafisch (Eames et al., 2010).
Für Kaltwasser Anästhesie, sollte die Temperatur langsam gesenkt werden. Die Rate der Abnahme scheint sich auf die Größe des Fisches ab, wobei kleinere Fische gehen unter schneller als größere Fische. Nach der Injektion, können Sie beobachten, dass der Fisch ist zu langsam erholt sich von der Narkose (siehe unten). Dies kann auftreten, wenn entweder die Starttemperatur zu niedrig ist, oder wenn die Temperatur zu schnell abnimmt. Der Ausgangspunkt ist zu niedrig, wenn die Fische Kurven seitlich beim Betreten des Wassers. Wenn die Starttemperatur korrekt ist, wird der Fisch aus dem Gleichgewicht zunächst aufrecht zu erhalten. Sie wird ihre Brustflossen in eine horizontale Position drehen, Keuchen, und haben eine schnelle Operculum Bewegungen. In der Regel wird es schwimmen. Da die Temperatur abnimmt, wird Bewegungen zu verringern und die Fische werden das Gleichgewicht zu verlieren. Ein chirurgischer Ebene der Anästhesie ist erreicht, wenn die Fische ohne Reaktion behandelt werden kann. Um die Fische unter Narkose, müssen Sie Ihre Finger kalt werden, so halten sie in dem Wasser vor dem Umgang mit dem Fisch. Der Schwamm muss auch kalt gehalten werden bei der gleichen Temperatur wie das Wasser für die Betäubung der Fische benutzt. Es ist wichtig, um den Schwamm mit Wasser, das sufficie ist gesättigtntly kalt Narkose zu halten, wenn die Fische auf sie gelegt wird.
Injection: Vor der Durchführung von Injektionen, möchten Sie vielleicht wenigstens ein Fisch sezieren, um ein Gefühl für Körper Wandstärke bekommen. Dies kann Ihnen helfen zu beurteilen, wie weit die Nadel muss einfügen, um die Bauchhöhle gelangen. Darüber, wie man die Nadel legen, können Sie sich die Wand des Körpers "geben", wenn die Nadel in die Bauchhöhle. Während der Injektion Schritte, damit die Patienten zufrieden. Achten Sie darauf, den Schwamm mit der richtigen Temperatur kaltes Wasser gesättigt ist, um die Fische aus Wiederbelebung während der Injektion zu verhindern. Ein gut gesättigt und weichen Schwamm ist zur Minimierung der Schäden an der Waage und Schleim Abdeckung der Haut wichtig. Ein gut gesättigten Schwamm ist auch für die Führung der Kiemen belüftet wichtig. Wir empfehlen den Schaum Schwamm unten unter Materialien aufgeführt. Schließlich, sobald der Fisch betäubt, schnell zu arbeiten, um die Zeit, dass die Fische unter sich zu minimieren.
Recovery: Die Fische sollten aus der Narkose praktisch beim Eintritt in die warme Beckenwasser zu erholen. Wenn der Fisch beginnt nicht schwimmen sofort vorsichtig schwenken, das Wasser zu den Kiemen zur Erholung beschleunigen. Wenn die Wiederherstellung langsam ist, dann den Fisch ging unter viel zu schnell und Sie sollten die Anästhesieverfahren entsprechend anpassen. Die möglichen Ursachen für die langsame Erholung sind unter Betäubung diskutiert.
Offenlegungen
Danksagungen
Diese Studie wurde von Juvenile Diabetes Research Foundation zu gewähren 5-2007-97 (zum VEP), National Institute of Diabetes and Digestive und Nierenkrankheiten unterstützt gewährt R01DK064973 (zum VEP), R01DK48494 (bis LHP), T32DK07074 (unterstützt SCE), K01DK083552 (zu MDK) und durch P60DK20595 an die University of Chicago Diabetes Research and Training Center. Der Inhalt ist ausschließlich in der Verantwortung der Autoren und stellen nicht notwendigerweise die offizielle Meinung der NIDDK oder die NIH.
Materialien
| Name | Company | Catalog Number | Comments |
| Foam Sponge | Jaece Industries | L800-D | |
| 60 mm Petri dish | |||
| Pipet tip box lid | not too deep, e.g. 1.5 cm | ||
| Plastic storage container | deep, e.g. 7 cm | ||
| Thermometer | |||
| Crushed ice | made from facility water | ||
| Warm facility water | 1 liter or more | ||
| 500 ml beaker | for weighing | ||
| NanoFil syringe | World Precision Instruments, Inc. | NANOFIL | or Hamilton syringe |
| 35 gauge needle | World Precision Instruments, Inc. | NF35BV-2 | beveled |
| Silflex tubing | World Precision Instruments, Inc. | SILFLEX-2 | |
| UltraMicroPump III and Micro4 controller | World Precision Instruments, Inc. | UMPS-1 | |
| Foot switch | World Precision Instruments, Inc. | 15867 | |
| Dissecting microscope | |||
| Plastic wrap | |||
| Paper towels | |||
| Cortland salt solution |
Referenzen
- Perry, S. F., Davie, P. S., Daxboeck, C., Ellis, A. G., Smith, D. G., Hoar, W. S., Randall, D. J. Perfusion methods for the study of gill physiology. Fish Physiology Volume X: Gills, Part B: Ion and Water. , 325-388 (1984).
- Brown, L. A., Stoskopf, M. K. Anesthesia and restraint. Fish Medicine. , 79-90 (1993).
- Eames, S. C., Philipson, L., Prince, V. E., Kinkel, M. D. Blood sugar measurement in zebrafish reveals dynamics of glucose homeostastis. Zebrafish. 7, 205-213 (2010).
- Chavin, W., Young, J. E. Factors in the determination of normal serum glucose levels of goldfish Carassius auratus L. Comp Biochem Physiol. 33, 629-653 (1970).
- Groff, J. M., Zinkl, J. G. Hematology and clinical chemistry of cyprinid fish. Common carp and goldfish. Vet Clin North Am Exot Anim Pract. 2, 741-776 (1999).
- Brand, M., Granato, M., Nusslein-Volhard, C., Nusslein-Volhard, C., Dahm, R. Keeping and raising zebrafish. Zebrafish: A Practical Approach. , 7-37 (2002).
- Westerfield, M. . The Zebrafish Book. , (1995).
- Iwama, G. K., Ackerman, P. A., Hochachka, P. W., Mommsen, T. P. Anaesthetics. Biochemistry and Molecular Biology of Fishes, Volume 3: Analytical Techniques. , 1-15 (1994).
- Reavill, D. R. Common diagnostic and clinical techniques for fish. Vet Clin North Am Exot Anim Pract. 9, 223-235 (2006).
- Stoskopf, M. K., Stoskopf, M. K. Surgery. Fish Medicine. , 91-97 (1993).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten