Method Article
Live Cell Imaging mit Calcium siRNA vermittelte Gene Silencing Combined Identifiziert Ca 2 + Leck-Kanäle in der ER-Membran und deren Regulationsmechanismen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das endoplasmatische Retikulum spielt eine wichtige Rolle in Protein Biogenese und in Calcium-Homöostase. Wir haben ein experimentelles System, das uns auf die Rolle der Ca2 +-Kanäle Leck-Adresse und ihrer vermeintlichen Regulationsmechanismen charakterisieren lässt etabliert. Dieses System beinhaltet siRNA-vermittelten Gen-Silencing-und Live-Cell-Ca2 +-Imaging.
Zusammenfassung
In Säugerzellen spielt das endoplasmatische Retikulum (ER) eine wichtige Rolle in Protein Biogenese sowie in Calcium-Signalgebung 1. Die heterotrimeren Sec61-Komplex in der ER-Membran ist ein wässriges Weg für neu synthetisierte Polypeptide in das Lumen des ER. Neuere Arbeiten aus verschiedenen Laboratorien vorgeschlagen, dass diese heterotrimeren Komplex kann auch Form transiente Ca 2 +-Kanäle undicht 2-8. Die wichtigste Beobachtung für diese Vorstellung war, dass die Freisetzung des entstehenden Polypeptide aus dem Ribosom und Sec61-Komplex durch Puromycin führt zu transienten Freisetzung von Ca 2 + aus dem ER. Außerdem hatte es in vitro beobachtet worden, dass die ER luminalen Protein BiP bei der Verhinderung Ionenpermeabilität auf der Ebene der Sec61-Komplex 9,10 beteiligt ist. Wir haben ein experimentelles System, das uns direkt auf die Rolle des Sec61-Komplex als potentielle Ca 2 + Leckkanal und zu charakterisieren seine vermeintlichen Regulationsmechanismen 11-13 ermöglicht gegründet. Dieses System kombiniert siRNA-vermittelten Gen-Silencing und Live-Ca 2 +-Imaging-13. Die Zellen werden mit siRNAs gegen die Codierung und untranslatierten Region (UTR), bzw. der SEC61A1 Gen oder eine negative Kontrolle siRNA gerichtet behandelt werden. In Ergänzung der Analyse werden die Zellen mit einem IRES-GFP Vektor, der die siRNA-resistente Ausdruck des Wildtyp-Gen ermöglicht SEC61A1 co-transfiziert. Dann werden die Zellen mit dem ratiometrische Ca 2 +-Indikator Fura-2 beladen, gleichzeitig Veränderungen in der cytosolischen Ca 2 +-Konzentration in einer Reihe von Zellen über ein Fluoreszenz-Mikroskop zu überwachen. Die kontinuierliche Messung der cytosolischen Ca 2 + ermöglicht auch die Evaluierung der Auswirkungen von verschiedenen Mitteln, wie Puromycin, kleines Molekül-Inhibitoren und Thapsigargin auf Ca 2 + Leckage. Dieses experimentelle System gibt uns die einzigartige Gelegenheit, i) Beurteilung des Beitrags der einzelnen ER-Membran-Proteinen auf passive Ca 2 +-Efflux aus dem ER in verschiedenen Zelltypen, ii) charakterisieren die Proteine und Mechanismen, die diese passive Ca 2 +-Efflux zu begrenzen und iii) die Auswirkungen von Erkrankungen im Zusammenhang Mutationen in den entsprechenden Komponenten.
Protokoll
1. Vorbereitung der Stammlösungen
- Bereiten Sie Calcium-freien Puffer (140 mM NaCl, 5 mM KCl, 1 mM MgCl 2, 0,5 mM EGTA, 10 mM Glukose in 10 mM HEPES-KOH (pH 7,35)).
- Solubilisieren FURA-2 AM in DMSO zu einer 1 mM Stammlösung zu erhalten. Mix mit einem Vortex, bis die Lösung homogen hellgelb. Schützen Kelch von Licht. Verdünnen Sie die FURA-2 AM Stammlösung in 1 ml Dulbecco modifiziertem Eagle Medium (DMEM) mit 10% fötalem Rinderserum (FBS) und 1% Penicillin / Streptomycin in einer Endkonzentration von 4 uM für das Laden von HeLa-Zellen.
- Bereiten Sie eine 12,5 mM Puromycin Stammlösung in destilliertem Wasser (pH 7,0). Shop Aliquots bei -20 ° C. Verdünnen Sie die 12,5 mM Puromycin Stammlösung in der Calcium-freien Puffer zu einer Endkonzentration von 500 nM Puromycin.
- Lösen Sie Thapsigargin in DMSO zu einer 1 mM Stammlösung zu erhalten.
- Solubilisieren 1 mg ophiobolin A in 20 ul Chloroform und anschließend mit 25 ul DMSO mischen. Die Mikrozentrifugenröhrchen bleibt geöffnet, bis Chloroform verdampft. So ist die endgültige ophiobolin Eine Konzentration von 100 mM. Shop Aliquots bei -20 ° C. Vor dem Gebrauch zu verdünnen Stammlösungen in Calcium-freien Puffer zu einer Endkonzentration von 100 nM. So funktioniert endgültige DMSO-Konzentration für Live Cell Imaging 0,1% nicht überschreiten.
- Lösen Sie Trifluoperazin in DMSO zu einer Konzentration von 10 mM und speichern Aliquots bei -20 ° C. Verdünnen Stammlösungen in Calcium-freien Puffer zu einer Endkonzentration von 10 uM vor dem Gebrauch. So endgültige DMSO-Konzentration für Live Cell Imaging, wie zum ophiobolin A, nicht mehr als 0,1%.
- Lösen Sie den siRNAs (SEC61A1 siRNA, SEC61A1-UTR siRNA und Kontroll-siRNA) in RNase freiem Wasser auf ein 20 uM Stammlösung. Mix mit einem Vortex und beobachten Solubilisierung durch Auge. Store 50 ul Aliquots bei -20 ° C.
2. Gene Silencing in HeLa-Zellen
Um den Beitrag eines bestimmten Proteins zu ER Ca 2 +-Efflux-Studie hat das jeweilige Gen effizient mit zwei verschiedenen siRNAs (Abb. 1) zum Schweigen gebracht werden. Darüber hinaus hat die Wirkung von silencing durch Expression des jeweiligen Wildtyp-Gen zu überwinden. In der Regel verwenden wir siRNAs, die gegen die kodierenden und nicht-kodierenden (UTR) Region bzw. des Gens von Interesse gerichtet sind. Der Einsatz UTR-directed siRNA bietet eine bequeme Möglichkeit für die Komplementierung.
- Seed 5,2 x 10 5 HeLa-Zellen (ATCC-Nr. CCL-2) in einer 6 cm Kulturschale mit einem 25 mm Deckglas (mit 200 ul von Poly-L-Lysin (1 mg / ml) für 1 h vorbehandelt) in Dulbecco modifiziertem Eagle Medium (DMEM) mit 10% fötalem Rinderserum (FBS) und 1% Penicillin / Streptomycin und bei 37 ° C in eine feuchte Umgebung mit 5% CO 2 (Endvolumen 3,9 ml).
- Transfizieren die Zellen mit SEC61A1 siRNA, SEC61A1-UTR siRNA, oder eine negative Kontroll-siRNA mit HiPerFect Reagenz nach den Anweisungen des Herstellers (Endkonzentration von siRNA: 20 nM). Kurz gesagt, bereiten siRNAs frisch in einem separaten Reaktionsgefäß vor der eigentlichen Transfektion Verfahren: In 20 pl HiPerFect Transfektionsreagenz bis 4 ul jeder siRNA (20 nM), die in 80 ul OptiMEM gelöst ist. Diese Mischung wird vorsichtig gevortext und bei Raumtemperatur inkubiert für 10 min. Fügen Sie die siRNA-Mix (104 ul) tropfenweise zu dem ausgesät 5,2 x 10 5 HeLa-Zellen (3,9 ml).
- Nach 24 h, ändern das Medium (3,9 ml) und schleusen die Zellen ein zweites Mal mit der gleichen siRNA-Mix (104 ul).
- Bewerten silencing mittels Western-Blot-Analyse. Es sollte über 80% betragen. Wash-Zellen von der Zellkulturschale in Phosphat-gepufferter Salzlösung (PBS) und ernten in DMEM. Zählen Sie die Zellen durch den Einsatz der Gräfin Automated Cell Counter. Lyse der Zellen in Zell-Lyse-Puffer (10 mM NaCl, 10 mM Tris-HCl, pH 8,0, 3 mM MgCl 2, 0,5% NP40) ergänzt mit einem Protease-Inhibitor-Cocktail (3 pg / ml Pepstatin A, 3 g / ml Leupeptin, 3 pg / ml Antipain, 3 pg / ml Chymastatin) zugeben und mit SDS-Probenpuffer (60 mM Tris-HCl, pH 6,8, 2% SDS, 10% Glycerin, 5% β-Mercaptoethanol, 0,01% Bromphenolblau ), um eine endgültige Konzentration von 10.000 Zellen / ul. Wärme-Proben bei 56 ° C für 15 min und anschließend fügen Sie einige Glasperlen und Vortex für 20 min zu fragmentieren DNA. Separate 20 ul jeder Probe von einem Laemmli-Typ SDS-PAGE (in der Regel 15% für das Trenngel Polyacrylamid). Transfer getrennten Proteine auf eine PVDF-Membran durch Elektroblotting ("Wet-Blot") bei konstanten 400 mA für 3 h oder über Nacht in Transfer-Puffer (100 mM Glycin, 12,5 mM Tris-HCl). Danach setzen Block mit 5% (w / v) fettarmer Trockenmilch in PBS für 30 min bei Raumtemperatur und anschließend den Fleck an den primären Antikörper gegen den C-Terminus von Sec61α aus Kaninchen gerichtet und ein Anti-β-Aktin- Antikörper aus der Maus. Waschen Sie den Fleck in PBS-TritonX-100 (0,05%) und tWICE in PBS für 5 min, jeweils. Visualisieren Sie die primäre Antikörper mit ECL Plex Ziege-Anti-Kaninchen-IgG-Cy5-oder ECL Plex Ziege-anti-Maus IgG-Cy3-Konjugat und der Typhoon-Trio Imaging-System in Kombination mit dem Bild Quant TL-Software 7.0. Im Falle der SEC61A1 Gen, ist die maximale schalldämpfende Wirkung in der Regel 96 h nach der ersten Transfektion gesehen. Ein repräsentatives Experiment ist in Abb.. 2.
3. Die Komplementation von HeLa-Zellen
Um den Phänotyp SEC61A1 Schweigen zu retten, war die SEC61A1 cDNA in die multiple Klonierungsstelle (MCS) von pcDNA3-interne Ribosomenbindungsstelle (IRES)-GFP-Vektor, der Cytomegalovirus-(CMV)-Promotor, der MCS enthaltenen eingefügt, der IRES, plus die grüne fluoresecent Protein (GFP) kodierenden Sequenz.
- 48 h nach der ersten siRNA-Transfektion, Austausch des Mediums (3,9 ml) ein zweites Mal und verwandeln die Zellen entweder mit leerem Vektor oder SEC61A1 Expressionsplasmid mit Fugene HD nach dem Protokoll des Herstellers (final Verhältnis von Vektor zu Fugene HD ist 4 ug Vektor zu 16 ul Fugene HD). Kurz gesagt, bereiten Plasmide frisch in einem separaten Reaktionsgefäß vor der Transformation vor: Fügen Sie 16 ul Fugene HD Transformation Reagenz bis 4 pg jedes Plasmid, das in 80 ul OptiMEM gelöst ist. Gently Wirbel dieser Mischung und Inkubation bei Raumtemperatur für 10 min. Fügen Sie die Plasmid-Mix (0,1 ml) tropfenweise zu dem ausgesät 5,2 x 10 5 HeLa-Zellen (3,9 ml).
- Nach 48 h von Plasmid-Ausdruck, vorbehaltlich Kulturschalen zur Fluoreszenz-Mikroskopie vor Kalzium-Imaging und Ernte. Bei Bedarf ersetzen DMEM von PBS für eine bessere Fluoreszenzsignale. Rekord Fluoreszenzbilder auf einem Fluoreszenz-Mikroskop mit CCD-Kamera ausgestattet. Transformation Effizienz, indem die Anzahl der Zellen, die GFP-Fluoreszenz von Zellen in der Hellfeld-Modus gezählt und sollte über 80% bestimmt werden. Ein typisches Ergebnis ist in Abb.. 3.
4. Live-Cell Calcium Imaging
- Vor der Messung, Transfer das Deckglas mit transfizierten HeLa-Zellen in einem separaten 3,5 cm Kulturschale beschichtet. Laden Sie die Zellen mit 4 uM FURA-2 AM in 1 ml DMEM für 45 min bei 25 ° C im Dunkeln 11,12.
- Fix ein 25 mm Deckglas in der iMIC Metall Kammer und waschen Sie die Zellen zweimal und inkubieren in einem Calcium-freien Puffer (jeweils 300 ul).
- Starten Sie das Sammeln von Daten auf einem iMIC Mikroskop mit polychromen V durch abwechselndes spannend bei 340 nm und 380 nm und Messung der emittierten Fluoreszenz bei 510 nm (Filter gesetzt: Strahlteiler, 565 nm; Emitter, 605/70 nm). Beispiel-Bilder mit 20-50 Zellen / Frame alle 3 s. Rekord FURA-2-Signale als das Verhältnis F340/F380, wo F340 und F380 in den Hintergrund-subtrahiert Fluoreszenzintensität entspricht bei 340 und 380 nm auf.
- Nach 1 min, behandeln Zellen mit Puromycin (500 uM) in Calcium-freiem Puffer oder mit dem gleichen Puffer. Alternativ behandeln Zellen mit einem kleinen Molekül-Hemmer (z. B. 10 uM Trifluoperazin oder 100 uM ophibolin A) oder mit dem Calcium-freien Puffer.
- Nach ratiometrische Messungen für 2 oder 10 min durchgeführt werden, fügen Thapsigargin (1 pM) und setzen Sie die Messungen.
- Schließlich cytoslic [Ca 2 +] wird aus Verhältnis-Messungen von einem etablierten Kalibriermethode geschätzt. 2. Analysieren von Daten von Excel 2007 und Origin 6.1.
5. Repräsentative Ergebnisse:
Bisher haben wir uns die Frage, ob Schweigen der SEC61A1 Gen beeinflusst Kalzium (Ca 2 +) Leckage aus dem ER (Abb. 1). Die SEC61A1 Gen wurde durch zwei verschiedene siRNAs in HeLa-Zellen 96 Stunden lang zum Schweigen gebracht. Während silencing kaum beeinflusst das Zellwachstum und die Lebensfähigkeit wurde Protein-Transport in das ER von semi-permeabilisierten Zellen nahezu vollständig gehemmt. Darüber hinaus wurden die SEC61A1 Schweigen Zellen stark in Bezug auf Ca 2 + Leckage aus dem ER betroffen. Die Wirkung von Gen-Silencing wurde durch die Expression des Gens SEC61A1 umgekehrt. So bilden Sec61-Komplexe, die in der ER-Membran von allen kernhaltigen Zellen sind Ca 2 +-Kanäle undicht, die voraussichtlich eine entscheidende Rolle in der Ca 2 +-Homöostase spielen können. Dagegen ist die Anwesenheit von großen, mit Wasser gefüllten Poren mit unkontrollierten Ionendurchlässigkeit, wie von Sec61-Komplexe in der ER-Membran gebildet, ernsthaft mit der geregelten Freisetzung von Ca 2 + stört aus dem ER-Lumen in das Cytosol, ein wesentlicher Mechanismus für die intrazelluläre Signalisierung. Wir identifizierten eine Calmodulin (CaM)-Bindungsmotiv in der cytosolischen N-Terminus von Säugetieren Sec61α dass gebunden CaM aber nicht Ca 2 +-freien apocalmodulin mit nanomolaren Affinität und Sequenz-Spezifität. Auf zellulärer Ebene, stimuliert zwei verschiedene CaM-Antagonisten Ca 2 +-Freisetzung aus dem ER in der Gegenwart, aber nicht in der Abwesenheit von Sec61-Kanäle (Abb. 4 und 5). Letztere wurde nicht beobachtet, wenn Sec61-Kanäle vorhanden waren, die enthaltenen Mutationen im IQ-Motiv Sec61α. So, Ca 2 +-CaM ist bei der Begrenzung Ca 2 + Leckage aus dem ER (Abb. 6) beteiligt.
Abbildung 1. Ablaufschema. Siehe Text für Details.
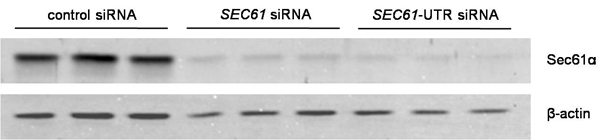
Abbildung 2. Datenanalyse zum Schweigen zu Effizienz. Silencing wurde durch Western-Blot-Analyse unter Verwendung von Antikörpern, die gegen Sec61α und β-Aktin (Ladekontrolle) gerichtet wurden ausgewertet. Die primären Antikörper wurden durch Verwendung von ECL Plex Sekundärantikörper und Fluoreszenz-Bildgebung.
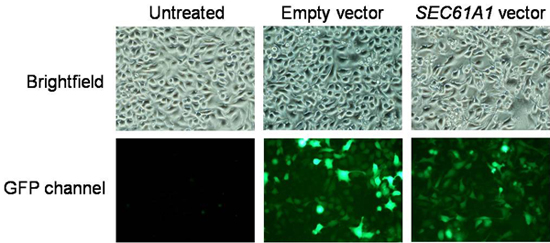
Abbildung 3. Datenanalyse für die Transfektionseffizienz. Die Bilder wurden auf einem Fluoreszenz-Mikroskop mit CCD-Kamera ausgestattet aufgezeichnet. Transformation Effizienz, indem die Anzahl der Zellen, die GFP-Fluoreszenz von Zellen in der Hellfeld-Modus gezählt bestimmt werden.

Abbildung 4. Screenshots aus lebenden Zellen Kalzium-Imaging von HeLa-Zellen in Anwesenheit von Kontroll-oder SEC61A1-siRNA und das Vorhandensein oder Fehlen der CaM-Antagonist ophiobolin A. HeLa-Zellen wurden mit siRNA gegen SEC61A1 (B) oder eine gezielte Behandlung negativen Kontroll-siRNA (A) für 96 h wie angegeben. Diese Zellen wurden mit dem Calcium-Indikator FURA-2 AM beladen und inkubiert in einem Ca 2 + freiem Puffer mit 0,5 mM EGTA, dann Puffer oder ophiobolin A (Ophio A) in Puffer wurde zugegeben und die Inkubation fortgesetzt. Nach 10 min, Ca 2 +-Freisetzung wurde durch Aufbringen von Thapsigargin (TG) in Abwesenheit von externen Ca 2 + ausgelöst und die Inkubation fortgesetzt. Screenshots aus dem kontinuierlichen Kalzium-Imaging wurden zu den angegebenen Zeiten entnommen.
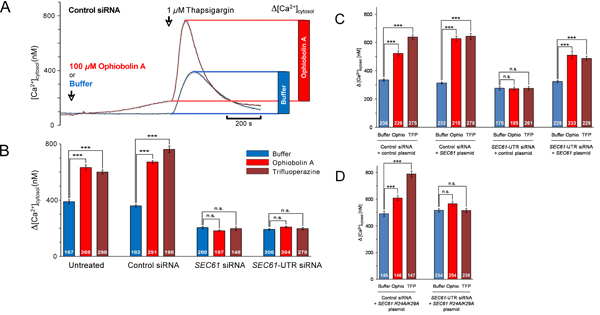
Abbildung 5. Datenanalyse für Live Cell Calcium Imaging Experimente. (A) Kinetik und quantitative Analyse einer Reihe von Experimenten, wie in Abb. dargestellt. 4A. Cytoslic [Ca 2 +] wurde von Ratio-Messungen von einem etablierten Kalibriermethode 2 geschätzt. Die Wirkung von Thapsigargin ist als Balkendiagramm dargestellt. (BD) Die Zellen wurden mit Kontroll-siRNA oder die angegebene SEC61A1-siRNA für 48 h behandelt und dann entweder mit Kontroll-Vektor (C), oder SEC61A1 Expressionsplasmid (C), oder Mutante SEC61A1 Expressionsplasmid (D) wie verwandelt. Nach 48 h wurden Kalzium-Imaging Experimente wie in Abb. 4 und 5A durchgeführt. Die statistische Analyse der Veränderungen in der cytosolischen Ca 2 +-Konzentration nach der Zugabe von Thapsigargin in Experimenten wie dargestellt in A gezeigt. P-Werte <0,001 wurden als signifikant von ungepaarten t-Test definiert und werden durch drei Sternchen (***), ns, nicht signifikant angegeben. Die Zahl der Zellen, analysiert werden angezeigt. Durchschnittliche Werte angegeben sind, sind auf Fehler und Bars Standardfehler der Mittelwerte (SEM). Wir stellen fest, dass diese Beispiele aus Lit. wurden angepasst. 13.
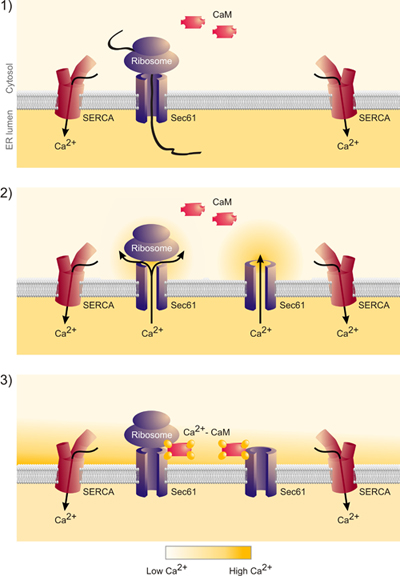
Abbildung 6. Diese Daten zeigen, dass die Freisetzung von naszierenden Ketten aus den Sec61-Komplex in der Tat führt zu Calcium-Freisetzung aus dem ER und die Bildung eines Calcium-Nanodomänenstruktur rund um die cytosolische Mündung des Sec61-Komplex. Das Kalzium wird durch Calmodulin gebunden und Calcium-Calmodulin schließt den Sec61-Komplex. "
Diskussion
In Säugerzellen spielt das endoplasmatische Retikulum (ER) eine wichtige Rolle in Protein Biogenese sowie in Calcium-Signalgebung. Hier haben wir ein experimentelles System, das uns direkt auf die Rolle eines potentiellen Ca 2 + Leckkanal und seine mutmaßlichen regulatorischen Mechanismen 13 charakterisieren lässt beschrieben. Dieses experimentelle System gibt uns die einzigartige Gelegenheit, i) Beurteilung des Beitrags der einzelnen ER-Membran-Proteinen auf passive Ca 2 +-Efflux aus dem ER in verschiedenen Zelltypen, ii) charakterisieren die Proteine und Mechanismen, die diese passive Ca 2 +-Efflux zu begrenzen und iii) die Auswirkungen von Erkrankungen im Zusammenhang Mutationen in den entsprechenden Komponenten.
Wir stellen fest, dass nur lebensfähige Zellen analysiert werden sollten und dass insgesamt die Lebensfähigkeit sollte über 80% betragen. Daher ist die Lebensfähigkeit der Zellen routinemäßig ausgewertet beschäftigt Nuclear-ID blau / grün Lebensfähigkeit der Zellen Reagenz nach dem Protokoll des Herstellers. Darüber hinaus statistische Analyse der Veränderungen in der cytosolischen Ca 2 +-Konzentration ist obligatorisch. Deshalb haben die Experimente für vier verschiedene Chargen von Zellen und zwei Deckgläsern durchgeführt werden mit mindestens 20 Zellen für jede Bedingung in einem einzigen Experiment untersucht werden müssen. Wir nehmen zur Kenntnis, dass die verschiedenen Experimente an der gleichen Zeit nach der Aussaat auf dem Deckgläschen durchgeführt werden müssen.
Offenlegungen
Danksagungen
SL wurde von einem Stipendium der DFG (Graduate Research School 845) unterstützt. Diese Arbeit wurde durch Fördermittel der DFG (SFB 530/C1 & FOR 967) und durch HOMFOR unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
|---|---|---|---|
| DMEM + Glutamax | Invitrogen | 31966 | |
| OptiMEM + Glutamax | Invitrogen | 51985 | |
| FBS | Biochrom | S0115 | |
| Penicillin / Streptomycin | PAA | P11-010 | |
| HiPerFect | Qiagen | 301707 | |
| Fugene HD | Roche Diagnostics | 04709713 | |
| Nuclear-ID Blau / Grün die Lebensfähigkeit der Zellen Reagenz | Enzo Life Sciences | ENZ-53004 | |
| FURA-2 AM | Invitrogen | F-1221 | |
| Puromycin | Sigma | P 7255 | |
| Thapsigargin | Invitrogen | T-7459 | |
| Ophiobolin A | Enzo Life Sciences | ALX-270 bis 109 | |
| Trifluoperazine | Sigma | T 6062 | |
| Gräfin ® Automated Cell Counter | Invitrogen | ||
| Typhoon-Trio Imaging-System | GE Healthcare | ||
| TE2000-S-Mikroskop mit DS-5MC Kamera | Nikon | ||
| iMIC Mikroskop mit polychromen V | Till Photonics |
Referenzen
- Clapham, D. E. Calcium signalling. Cell. 131, 1047-1058 (2007).
- Lomax, R. B., Camello, C., Van Coppenolle, F., Petersen, O. H., Tepikin, A. V. Basal and physiological Ca2+ leak from the endoplasmic reticulum of pancreatic acinar cells. J. Biol. Chem. 277, 26479-26485 (2002).
- Van Coppenolle, F. Ribosome-translocon complex mediates calcium leakage from endoplasmic reticulum stores. J. Cell Sci. 117, 4135-4142 (2004).
- Flourakis, M. Passive calcium leak via translocon is a first step for iPLA2-pathway regulated store operated channel activation. FASEB J. 20, 1215-1217 (2006).
- Giunti, R., Gamberucci, A., Fulceri, R., Banhegyi, G. Both translocon and a cation channel are involved in the passive Ca2+ leak from the endoplasmic reticulum: a mechanistic study on rat liver microsomes. Arch. Biochem. Biophys. 462, 115-121 (2007).
- Ong, H. L., Liu, X., Sharma, A., Hegde, R. S., Ambudkar, I. S. Intracellular Ca2+ release via the ER translocon activates store operated calcium entry. Pflugers Arch. Eur. J. Physiol. 453, 797-808 (2007).
- Amer, M. S. Translocon closure to Ca2+ leak in proliferating vascular smooth muscle cells. Am. J. Physiol. Heart Circ. Physiol. 296, 910-916 (2009).
- Tu, H. Presenilins form ER Ca2+ leak channels, a function disrupted by familial Alzheimer's disease-linked mutations. Cell. 126, 981-993 (2006).
- Hamman, B. D., Hendershot, L. M., Johnson, A. E. BiP maintains the permeability barrier of the ER membrane by sealing the lumenal end of the translocon pore before and early in translocation. Cell. 92, 747-758 (1998).
- Alder, N. N., Shen, Y., Brodsky, J. L., Hendershot, L. M., Johnson, A. E. The molecular mechanism underlying BiP-mediated gating of the Sec61 translocon of the endoplasmic reticulum. J. Cell Biol. 168, 389-399 (2005).
- Aneiros, E., Philipp, S. E., Lis, A., Freichel, M., Cavalie, A. Modulation of Ca2+ signalling by Na+/Ca2+ exchangers in mast cells. J. Immunol. 174, 119-130 (2005).
- Gross, S. A. TRPC5 is a Ca2+-activated channel functionally coupled to Ca2+-selective ion channels. J. Biol. Chem. 284, 34423-34432 (2009).
- Erdmann, F. Interaction of calmodulin with Sec61a limit Ca2+ leakage from the endoplasmic reticulum. EMBO J. 30, 17-31 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten