Method Article
Direct imagerie calcique cellulaire Combiné avec Gene Silencing siARN Mediated Identifie Ca 2 + Canaux de fuite dans la membrane du RE et de leurs mécanismes de régulation
Dans cet article
Résumé
Le réticulum endoplasmique joue un rôle clé dans la biogenèse des protéines et dans l'homéostasie calcique. Nous avons établi un système expérimental qui nous permet d'aborder le rôle des canaux Ca2 + de fuite et de caractériser leur putatifs mécanismes de régulation. Ce système implique gene silencing siRNA médiation et de cellules vivantes Ca2 + imagerie.
Résumé
Dans les cellules de mammifères, le réticulum endoplasmique (RE) joue un rôle clé dans la biogenèse des protéines ainsi que dans la signalisation calcique 1. Le hétérotrimériques Sec61 complexe dans la membrane du RE fournit une voie aqueuse pour les polypeptides nouvellement synthétisés dans la lumière du RE. De récents travaux de différents laboratoires a suggéré que ce complexe peut également hétérotrimériques forme transitoire canaux Ca 2 + fuite de 2-8. L'observation clé de cette idée était que la libération des polypeptides naissants du ribosome et Sec61 complexes par la puromycine conduit à libération transitoire de Ca 2 + du RE. Par ailleurs, il avait été observé in vitro que la protéine de ER luminale BiP est impliqué dans la prévention de la perméabilité aux ions au niveau de l'Sec61 9,10 complexes. Nous avons établi un système expérimental qui nous permet d'aborder directement le rôle du complexe Sec61 que le potentiel de Ca 2 + canal de fuite et de caractériser les mécanismes de régulation de ses putatifs 11-13. Ce système combine gene silencing siRNA médiation et de cellules vivantes de Ca 2 + imagerie 13. Les cellules sont traitées avec des siRNA qui sont dirigées contre le codage et la région non traduite (UTR), respectivement, du gène ou de SEC61A1 un siRNA contrôle négatif. Dans l'analyse de complémentation, les cellules sont co-transfectées avec un vecteur d'IRES-GFP qui permet à l'ARNsi résistant expression de type sauvage SEC61A1 gènes. Puis les cellules sont chargées avec le ratiométrique Ca 2 +-indicateur de fura-2 pour surveiller simultanément les changements dans les cytosolique de Ca 2 + concentration dans un nombre de cellules au moyen d'un microscope à fluorescence. La mesure en continu de Ca 2 + cytosolique permet également à l'évaluation de l'impact de divers agents, tels que la puromycine, inhibiteurs de petites molécules, et thapsigargine le Ca 2 + de fuite. Ce système expérimental nous donne l'occasion unique de i) évaluer la contribution des différentes protéines de la membrane passive ER à l'efflux de Ca 2 + du RE dans divers types cellulaires, ii) de caractériser les protéines et les mécanismes qui limitent cette passive de Ca 2 + efflux, et iii) étudier les effets des mutations dans les maladies liées composantes pertinentes.
Protocole
1. Préparation des solutions mères
- Préparer sans calcium tampon (140 mM NaCl, 5 mM de KCl, 1 mM de MgCl2, 0,5 mM EGTA, 10 mM de glucose dans 10 mM HEPES-KOH (pH 7,35)).
- Solubiliser FURA-deux heures dans le DMSO pour obtenir une solution à 1 mM. Mélanger à l'aide d'un vortex jusqu'à ce que la solution est jaune clair homogène. Protéger la Coupe de la lumière. Diluer le FURA-deux heures solution mère dans 1 ml Eagle modifié par Dulbecco (DMEM) contenant 10% de sérum fœtal bovin (FBS) et 1% de pénicilline / streptomycine à une concentration finale de 4 uM pour le chargement des cellules HeLa.
- Préparer une solution stock de 12,5 mM puromycine dans l'eau distillée (pH 7,0). Aliquotes Conserver à -20 ° C. Diluer la solution 12,5 mM puromycine stock dans la mémoire tampon sans calcium à une concentration finale de 500 uM puromycine.
- Dissoudre thapsigargine dans le DMSO pour obtenir une solution à 1 mM.
- Solubiliser 1 mg ophiobolin A dans 20 ul de chloroforme et, ultérieurement, mélanger avec 25 ul de DMSO. Le microtube reste ouverte jusqu'à chloroforme est évaporé. Ainsi, la dernière ophiobolin Une concentration est de 100 mm. Aliquotes Conserver à -20 ° C. Avant l'utilisation, des solutions diluées d'actions en calcium sans tampon à une concentration finale de 100 uM. Ainsi, la concentration finale de DMSO pour l'imagerie de cellules vivantes ne dépasse pas 0,1%.
- Dissoudre trifluopérazine dans le DMSO à une concentration de 10 mM et stocker des aliquotes à -20 ° C. Des solutions diluées d'actions en calcium sans tampon à une concentration finale de 10 uM avant l'utilisation. Ainsi concentration finale de DMSO pour l'imagerie de cellules vivantes, comme pour ophiobolin A, ne dépasse pas 0,1%.
- Dissoudre les siRNA (SEC61A1 siARN, SEC61A1-UTR siRNA et siRNA contrôle) en eau libre de RNase pour préparer une solution stock de 20 pM. Mélanger à l'aide d'un vortex et d'observer la solubilisation par l'œil. Magasin de 50 aliquotes à -20 ° C.
2. Extinction de gène dans les cellules HeLa
Afin d'étudier l'apport d'une certaine protéine d'ER d'efflux de Ca 2 +, le gène respectives doit être efficacement réduit au silence avec deux siRNA différents (Fig. 1). En outre, l'effet de l'inactivation doit être surmontée par l'expression du gène de type sauvage respectif. Typiquement, nous utilisons des siRNA qui sont dirigées contre le codage et la non-codantes (UTR) région, respectivement, du gène d'intérêt. Employant UTR-dirigé siARN fournit un moyen commode pour la complémentation.
- Seed 5,2 x 10 5 cellules HeLa (ATCC pas. CCL-2) dans une boîte de culture de 6 cm avec un glissement de 25 mm de couverture (pré-traitées avec 200 pi de poly-L-lysine (1 mg / ml) pendant 1 h) dans Eagle modifié par Dulbecco (DMEM) contenant 10% de sérum fœtal bovin (FBS) et 1% de pénicilline / streptomycine et incuber à 37 ° C dans un environnement humidifié avec 5% de CO 2 (volume final 3,9 ml).
- Transfecter les cellules avec SEC61A1 siARN, SEC61A1-UTR siARN, ou un siRNA contrôle négatif en utilisant le réactif HiPerFect conformément aux instructions du fabricant (concentration finale de siRNA: 20 nM). En bref, préparer siRNA fraîchement dans un microtube distincte avant la procédure de transfection réelle: Ajouter 20 ul de réactifs de transfection HiPerFect à 4 pl de chaque siARN (20 uM), qui est dissous dans 80 ul de OptiMEM. Ce mélange est doucement agité et incubé à température ambiante pendant 10 min. Ajouter le mélange de siRNA (104 ul) goutte à goutte à l'5,2 ensemencé x 10 5 cellules HeLa (3,9 ml).
- Après 24 h, changer le milieu (3,9 ml) et transfecter des cellules pour une deuxième fois avec le mélange de siARN mêmes (104 pl).
- Évaluer taire par analyse Western blot. Il devrait être supérieure à 80%. Laver les cellules de la boîte de culture de cellules dans un tampon phosphate salin (PBS) et les récolter en DMEM. Compter les cellules en utilisant le compteur cellulaire automatisé comtesse. Lyse des cellules dans un tampon de lyse cellulaire (10 mM NaCl, 10 mM Tris-HCI, pH 8,0, MgCl2 3 mM, 0,5% NP40) complété avec un cocktail de protéase-inhibiteur (3 ug / ml pepstatine A, 3 mg / ml de leupeptine, 3 pg / ml antidouleur, 3 ug / ml Chymastatin) et mélanger avec SDS-tampon d'échantillon (60 mM Tris-HCI, pH 6,8, SDS 2%, glycérol 10%, 5% β-mercaptoéthanol, 0,01% bleu de bromophénol ) pour obtenir une concentration finale de 10.000 cellules / ul. Échantillons de chaleur à 56 ° C pendant 15 minutes et, ensuite, ajouter quelques perles de verre et de vortex pendant 20 min pour un fragment d'ADN. Séparée 20 ul de chaque échantillon par un type Laemmli SDS-PAGE (typiquement 15% de polyacrylamide pour le gel de séparation). Transfert protéines séparées sur une membrane de PVDF par électrotransfert («wet-blot") à prix constants 400 mA pendant 3 h ou toute la nuit dans un tampon de transfert (100 mM glycine, 12,5 mM de Tris-HCl). Ensuite, un bloc de 5% (p / v) lait faible en gras séché dans du PBS pendant 30 min à température ambiante, puis d'exposer la tache à l'anticorps primaires dirigés contre l'extrémité C-terminale Sec61α de lapin et un anti-β-actine d'anticorps de souris. Lavez la tache dans PBS-TritonX-100 (0,05%) et tWICE dans du PBS pendant 5 min, respectivement. Visualisez les anticorps primaires en utilisant ECL Plex chèvre anti-IgG de lapin-Cy5 ou ECL Plex chèvre anti-IgG de souris-Cy3-conjugué et le système d'imagerie Typhoon-Trio en combinaison avec l'image Quant TL 7.0 du logiciel. Dans le cas du gène SEC61A1, l'effet maximal taire est généralement considérée 96 h après la transfection d'abord. Une expérience représentative est montré dans la Fig. 2.
3. La complémentation des cellules HeLa
Afin de sauver le phénotype des SEC61A1 taire, l'ADNc a été inséré dans SEC61A1 le site de clonage multiple (MCS) d'un site interne d'entrée pCDNA3-ribosomiques (IRES)-GFP-vecteur qui contenait le cytomégalovirus (CMV), le MCS, l'IRES, plus la protéine fluoresecent verte (GFP) séquence codante.
- 48 h après la transfection de siRNA d'abord, l'échange de la moyenne (3,9 ml) pour une deuxième fois et transformer les cellules avec soit vecteur vide ou SEC61A1 plasmide d'expression en utilisant Fugene HD selon le protocole du fabricant (rapport final de vecteur à Fugene HD est de 4 mg vectoriel à 16 ul HD Fugene). En bref, préparer les plasmides fraîchement dans un microtube distincte avant la procédure de transformation: Ajouter 16 ul réactif Fugene transformation HD à 4 pg de chaque plasmide qui est dissous dans 80 ul de OptiMEM. Vortexer doucement ce mélange et laisser incuber à température ambiante pendant 10 min. Ajouter le mélange de plasmide (0,1 ml) goutte à goutte au ensemencé 5,2 x 10 5 cellules HeLa (3,9 ml).
- Après 48 h de plasmide d'expression, des boîtes de culture soumis à la microscopie par fluorescence avant l'imagerie calcique et la récolte. Si nécessaire, remplacer DMEM par PBS pour une meilleure signaux de fluorescence. Enregistrer des images de fluorescence sur un microscope à fluorescence équipé d'une caméra CCD refroidie. Efficacité de transformation peut être déterminée en divisant le nombre de cellules présentant fluorescence de la GFP par les cellules comptées dans le mode clair et devrait être supérieur à 80%. Un résultat typique est montré dans la Fig. 3.
4. Direct imagerie calcique cellulaire
- Avant la mesure, le transfert de la lamelle revêtement avec des cellules HeLa transfectées dans une boîte de culture séparée 3,5 cm. Chargez les cellules avec 4 pM FURA-deux heures dans 1 ml de DMEM pendant 45 min à 25 ° C dans l'11,12 sombre.
- Correction d'un bordereau de 25 mm de couverture dans la chambre de métal iMic et laver les cellules deux fois et les incuber dans un tampon sans calcium (à chaque fois 300 pl.)
- Commencer à recueillir des données sur un microscope iMic polychrome V par alternance passionnante à 340 nm et 380 nm et en mesurant la fluorescence émise à 510 nm (set de filtre: lame séparatrice, 565 nm; émetteur, nm 605/70). Exemples d'images contenant de 20 à 50 cellules / image toutes les 3 s. Enregistrement Fura-2 signaux que le ratio F340/F380, où F340 et F380 correspondent à l'arrière-plan soustrait l'intensité de fluorescence à 340 et 380 nm, respectivement.
- Après 1 min, traiter les cellules avec puromycine (500 uM) en calcium sans tampon ou avec le même tampon. Sinon, le traitement des cellules avec un inhibiteur de petite taille (par exemple 10 ou 100 uM trifluopérazine uM ophibolin A) ou avec le tampon sans calcium.
- Après les mesures ratiométrique sont effectuées pour 2 ou 10 min, ajouter thapsigargine (1 pM) et de continuer les mesures.
- Finalement, cytoslic [Ca 2 +] est estimée à partir de mesures du rapport par une méthode d'étalonnage établie 2. Analyser les données par Excel 2007 et d'origine 6.1.
5. Les résultats représentatifs:
Jusqu'ici, nous avons abordé la question de savoir si silençage du gène affecte SEC61A1 calcium (Ca 2 +) des fuites à partir du RE (figure 1). Le gène a été réduit au silence SEC61A1 par deux différents siRNA dans les cellules HeLa pendant 96 heures. Alors que faire taire la croissance cellulaire à peine touché et la viabilité, le transport des protéines dans le RE de cellules de semi-perméabilisées était presque complètement inhibée. En outre, les cellules SEC61A1 silence ont été gravement touchées à l'égard de Ca 2 + de fuite de l'ER. L'effet de l'inactivation des gènes a été infirmée par l'expression du gène SEC61A1. Ainsi, Sec61 complexes qui sont présents dans la membrane du RE de toutes les cellules nucléées forme Ca 2 + canaux de fuite qui peut être appelé à jouer un rôle crucial dans l'homéostasie du Ca 2 +. Toutefois, la présence de grandes, de l'eau des pores remplis avec la perméabilité aux ions incontrôlée, comme formé par Sec61 complexes dans la membrane du RE, pourrait nuire sérieusement à la libération régulée de Ca 2 + de la lumière du RE dans le cytosol, un mécanisme essentiel pour intracellulaire signalisation. Nous avons identifié une calmoduline (CaM) motif de liaison à la fraction N-terminale cytosolique de Sec61α mammifères que Cam liés mais pas de Ca 2 + libre apocalmodulin avec une affinité nanomolaire et une spécificité de séquence. Au niveau cellulaire, deux antagonistes CaM différents stimulé Ca 2 + communiqué de la ER dans la présence mais pas dans l'absence de Sec61 canaux (fig. 4 et 5). Ce dernier n'a pas été observée lorsque Sec61 canaux étaient présents qui contenait des mutations dans le motif de QI de Sec61α. Ainsi, le Ca 2 +-CaM est impliqué dans la limitation des fuites de Ca 2 + du RE (Fig. 6).
Figure 1. Organigramme. Voir le texte pour plus de détails.
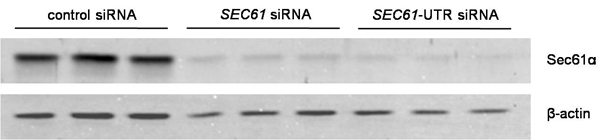
Figure 2. L'analyse des données pour faire taire l'efficacité. Taire a été évaluée par Western-blot utilisant des anticorps qui ont été dirigées contre Sec61α et β-actine (contrôle du chargement). Les anticorps primaires ont été visualisées en utilisant des anticorps ECL Plex secondaire et l'imagerie de fluorescence.
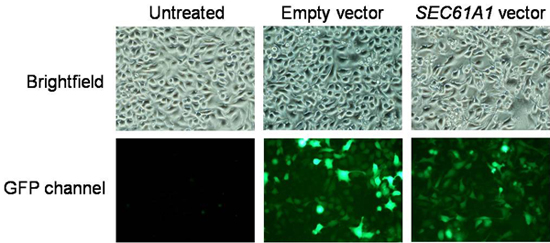
Figure 3. L'analyse des données d'efficacité de la transfection. Les images ont été enregistrées sur un microscope à fluorescence équipé d'une caméra CCD refroidie. Efficacité de transformation peut être déterminée en divisant le nombre de cellules présentant fluorescence de la GFP par les cellules comptées dans le mode fond clair.

Les captures d'écran la figure 4. Partir de l'imagerie cellulaire du calcium en direct de cellules HeLa en présence du contrôle ou des SEC61A1-siRNA et la présence ou l'absence des cellules CaM-antagoniste ophiobolin HeLa A. ont été traités avec siRNA dirigé contre SEC61A1 (B) ou une siRNA contrôle négatif (A) pour 96 h comme indiqué. Ces cellules ont été chargées avec l'indicateur de calcium fura-2 AM et incubés dans un tampon de Ca 2 + libre contenant 0,5 mM, EGTA, puis tampon ou ophiobolin A (Ophio A) dans le tampon a été ajouté et l'incubation a repris. Après 10 min, Ca 2 + communiqué a été initié par l'application thapsigargine (TG) en l'absence de Ca 2 + externe et l'incubation a été poursuivie. Les captures d'écran de l'imagerie calcique en continu ont été prises à l'heure indiquée.
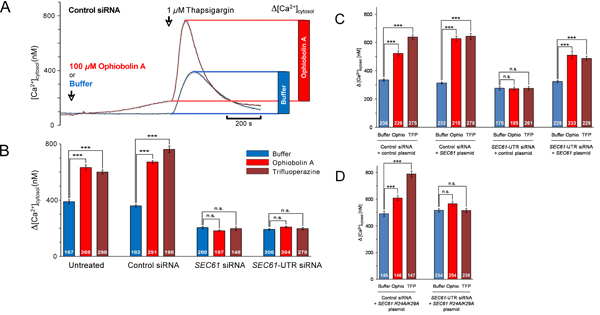
Figure 5. L'analyse des données pour des expériences d'imagerie de cellules vivantes de calcium. (A) L'analyse cinétique et quantitative d'une série d'expériences comme le montre la Fig. 4A. Cytoslic [Ca 2 +] a été estimée à partir de mesures du rapport par une méthode d'étalonnage établie 2. L'effet de thapsigargine est montré sous forme de diagramme à barres. (BD) Les cellules ont été traitées avec le siRNA contrôle ou le siRNA-indiquée SEC61A1 pendant 48 h puis transformé avec le vecteur de contrôle soit (C), ou SEC61A1 plasmide d'expression (C), ou mutant SEC61A1 plasmide d'expression (D) comme indiqué. Après 48 h, des expériences d'imagerie calcique ont été réalisées comme dans les figures 4 et 5A. L'analyse statistique des changements dans le Ca 2 + cytosolique de concentration après l'ajout de thapsigargine dans des expériences telles que présentées dans A sont représentés. Les valeurs de p <0,001 ont été définis comme significatifs par un test t non apparié et sont indiqués par trois astérisques (***), ns, non significatif. Le nombre de cellules qui ont été analysés sont indiqués. Les valeurs moyennes sont donnés, barres d'erreur représentent les erreurs standard des moyens (SEM). Nous notons que ces exemples ont été adaptés de réf. 13.
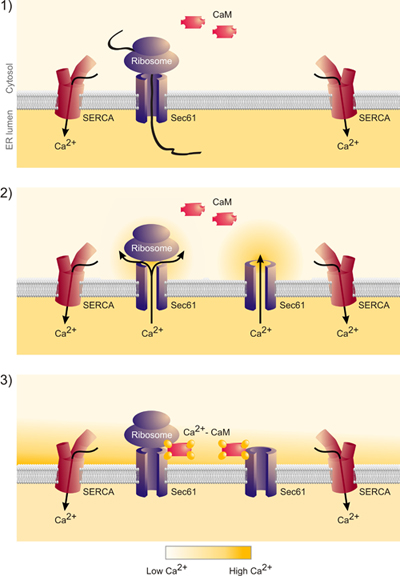
Figure 6. Ces données indiquent que la libération des chaînes naissantes du complexe Sec61 conduit en effet à la libération du calcium du RE et de la formation d'un nanodomain de calcium autour de la bouche cytosolique du complexe Sec61. Ce calcium est lié par la calmoduline et calcium-calmoduline ferme le complexe Sec61. "
Discussion
Dans les cellules de mammifères, le réticulum endoplasmique (RE) joue un rôle clé dans la biogenèse des protéines ainsi que dans la signalisation du calcium. Ici, nous avons décrit un système expérimental qui nous permet d'aborder directement le rôle d'un potentiel de Ca 2 + canal de fuite et de caractériser son putatifs des mécanismes de régulation 13. Ce système expérimental nous donne l'occasion unique de i) évaluer la contribution des différentes protéines de la membrane passive ER à l'efflux de Ca 2 + du RE dans divers types cellulaires, ii) de caractériser les protéines et les mécanismes qui limitent cette passive de Ca 2 + efflux, et iii) étudier les effets des mutations dans les maladies liées composantes pertinentes.
Nous notons que seules les cellules viables devraient être analysés et que la viabilité globale devrait être supérieure à 80%. Par conséquent, la viabilité cellulaire est évaluée régulièrement employant nucléaires ID réactif bleu / vert viabilité des cellules selon le protocole du fabricant. Par ailleurs, l'analyse statistique des changements dans le cytosol concentration de Ca2 + est obligatoire. Par conséquent, les expériences doivent être réalisées pour quatre lots différents de cellules et de deux lamelles avec au moins 20 cellules doivent être analysés pour chaque condition dans une expérience unique. Nous notons que les différentes expériences doivent être réalisées au même moment après l'ensemencement sur les feuillets de couverture.
Déclarations de divulgation
Remerciements
SL a été soutenu par une bourse de recherche de la DFG (Graduate School Research 845). Ce travail a été soutenu par des subventions de l'(530/C1 SFB & POUR 967) et par la DFG HOMFOR.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | |
|---|---|---|---|
| DMEM + glutamax | Invitrogen | 31966 | |
| OptiMEM + glutamax | Invitrogen | 51985 | |
| FBS | Biochrom | S0115 | |
| Pénicilline / streptomycine | AAP | P11-010 | |
| HiPerFect | Qiagen | 301707 | |
| Fugene HD | Roche Diagnostics | 04709713 | |
| Nucléaire-ID Bleu / Vert réactif viabilité cellulaire | Enzo Life Sciences | ENZ-53004 | |
| FURA-deux heures | Invitrogen | F-1221 | |
| Puromycine | Sigma | P 7255 | |
| Thapsigargine | Invitrogen | T-7459 | |
| Un Ophiobolin | Enzo Life Sciences | ALX-270-109 | |
| Trifluopérazine | Sigma | T 6062 | |
| Comtesse ® Compteur de cellules automatisé | Invitrogen | ||
| Typhon-Trio système d'imagerie | GE Healthcare | ||
| TE2000-S microscope avec caméra DS-5Mc | Nikon | ||
| Microscope iMic polychrome V | Jusqu'à la photonique |
Références
- Clapham, D. E. Calcium signalling. Cell. 131, 1047-1058 (2007).
- Lomax, R. B., Camello, C., Van Coppenolle, F., Petersen, O. H., Tepikin, A. V. Basal and physiological Ca2+ leak from the endoplasmic reticulum of pancreatic acinar cells. J. Biol. Chem. 277, 26479-26485 (2002).
- Van Coppenolle, F. Ribosome-translocon complex mediates calcium leakage from endoplasmic reticulum stores. J. Cell Sci. 117, 4135-4142 (2004).
- Flourakis, M. Passive calcium leak via translocon is a first step for iPLA2-pathway regulated store operated channel activation. FASEB J. 20, 1215-1217 (2006).
- Giunti, R., Gamberucci, A., Fulceri, R., Banhegyi, G. Both translocon and a cation channel are involved in the passive Ca2+ leak from the endoplasmic reticulum: a mechanistic study on rat liver microsomes. Arch. Biochem. Biophys. 462, 115-121 (2007).
- Ong, H. L., Liu, X., Sharma, A., Hegde, R. S., Ambudkar, I. S. Intracellular Ca2+ release via the ER translocon activates store operated calcium entry. Pflugers Arch. Eur. J. Physiol. 453, 797-808 (2007).
- Amer, M. S. Translocon closure to Ca2+ leak in proliferating vascular smooth muscle cells. Am. J. Physiol. Heart Circ. Physiol. 296, 910-916 (2009).
- Tu, H. Presenilins form ER Ca2+ leak channels, a function disrupted by familial Alzheimer's disease-linked mutations. Cell. 126, 981-993 (2006).
- Hamman, B. D., Hendershot, L. M., Johnson, A. E. BiP maintains the permeability barrier of the ER membrane by sealing the lumenal end of the translocon pore before and early in translocation. Cell. 92, 747-758 (1998).
- Alder, N. N., Shen, Y., Brodsky, J. L., Hendershot, L. M., Johnson, A. E. The molecular mechanism underlying BiP-mediated gating of the Sec61 translocon of the endoplasmic reticulum. J. Cell Biol. 168, 389-399 (2005).
- Aneiros, E., Philipp, S. E., Lis, A., Freichel, M., Cavalie, A. Modulation of Ca2+ signalling by Na+/Ca2+ exchangers in mast cells. J. Immunol. 174, 119-130 (2005).
- Gross, S. A. TRPC5 is a Ca2+-activated channel functionally coupled to Ca2+-selective ion channels. J. Biol. Chem. 284, 34423-34432 (2009).
- Erdmann, F. Interaction of calmodulin with Sec61a limit Ca2+ leakage from the endoplasmic reticulum. EMBO J. 30, 17-31 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon