Method Article
Erzeugung und Kennzeichnung von Murine Knochenmark gewonnenen dendritischen Zellen mit Qdot Nanokristalle für Tracking-Studien
In diesem Artikel
Zusammenfassung
Dendritische Zellen Aufnahme Antigene und wandern in Richtung Immunsystem Organe prozessierte Antigene, die auf T-Zellen präsentieren. Qdot Nanokristall Kennzeichnung stellt eine langfristige und stabile Fluoreszenz-Signal. Dies ermöglicht die Verfolgung von dendritischen Zellen in verschiedenen Organen durch Fluoreszenz-Mikroskopie.
Zusammenfassung
Dendritische Zellen (DCs) sind professionelle Antigen-präsentierende Zellen (APC) in peripheren Geweben und in der immunologischen Organe wie Thymus, Knochenmark, Milz, Lymphknoten und Peyer-Plaques 1-3 gefunden. DCs im peripheren Gewebe Probe des Organismus auf das Vorhandensein von Antigenen, die sie aufnehmen, verarbeiten und präsentieren in ihrer Oberfläche im Rahmen der Haupthistokompatibilitätskomplex-Moleküle (MHC). Dann Antigen-beladenen DCs zu immunologischen Organen, wo sie derzeit die verarbeiteten Antigen an T-Lymphozyten auslösen spezifische Immunantwort zu migrieren. Eine Möglichkeit, die wandernde Fähigkeiten von DCs zu bewerten ist, sie mit fluoreszierenden Farbstoffen 4 Label.
Hiermit zeigen wir die Verwendung von Qdot fluoreszierenden Nanokristallen zu murinen Knochenmark-abgeleitete DC-Label. Der Vorteil dieser Kennzeichnung ist, dass Qdot Nanokristalle stabile und langlebige Fluoreszenz, die sie ideal für die Erkennung markierter Zellen in Geweben wieder zu besitzen. Um dies zu erreichen, werden zunächst Zellen aus murinem Knochen Zucchini gewonnen und kultiviert für 8 Tage in Anwesenheit von Granulozyten-Makrophagen-Kolonie-stimulierender Faktor, um DC Differenzierung zu induzieren. Diese Zellen werden dann mit fluoreszierenden Quantenpunkte werden durch kurze In-vitro-Inkubation gekennzeichnet. Gefärbte Zellen mit einem Fluoreszenz-Mikroskopie sichtbar gemacht werden. Die Zellen können in Versuchstiere an dieser Stelle injiziert werden oder können zu reifen Zellen auf in-vitro-Inkubation mit entzündlichen Stimuli werden. In unseren Händen hat DC Reifung nicht bestimmen, Verlust der Fluoreszenz-Signal auch nicht Qdot Färbung beeinflussen die biologischen Eigenschaften des DCs. Nach der Injektion können diese Zellen im Immunsystem Organe durch Fluoreszenz-Mikroskopie werden folgende typische Präparation und Fixierung identifiziert.
Protokoll
1. Dissection der Maus Oberschenkel-und Schienbein und Kultur von Knochenmarkzellen
- Sacrifice 2 Mäuse durch CO 2-Erstickung und sorgfältig sezieren tibias und Oberschenkelknochen ohne Eingriff in die Knochen endet.
- Reinigen Sie die Knochen von allen angeschlossenen Gewebe durch Tissue-Papier. Achten Sie darauf, um die Knochen zu brechen.
- Sterilisieren der Knochen durch Eintauchen in 70% Ethanol für 10 min in einer 35 mm Petrischale. Von diesem Moment an, in einem Biosafety Haube arbeiten, um eine Kontamination der Zellkulturen zu vermeiden.
- Recover die Knochen aus dem Ethanol und lassen Sie sie an der Luft trocknen für 5 min in einer Petrischale im Biosicherheitswerkbank.
- Schneiden Sie die Oberschenkel zur Hälfte, und die Tibia von der dünnsten Spitze. Infuse der Innenseite des Knochens mit 1 ml RPMI-Medium (ohne Serum, sondern mit Antibiotika) mit einer sterilen Spritze auf eine sterile Petrischale.
- Die Zellsuspension wird gesammelt und gewaschen 2X in RPMI-Medium durch 10 min Zentrifugation in einem 15 ml Zentrifugenröhrchen bei 1.100 RPM in einer Kühlzentrifuge (4 ° C) mit einem Ausschwingrotor.
- Nach der letzten Waschung, die Zellen in 2 ml ACK-Lysepuffer und Inkubation für 5 min bei Raumtemperatur, um rote Blutkörperchen zu beseitigen.
- Fügen Sie 13 ml RPMI mit 10% FBS, resuspendieren und waschen in diesem Medium 2X mit den gleichen Einstellungen wie in 1.6 beschrieben.
- Zählen von Zellen, anpassen, um 2 x 10 5 Zellen / ml mit RPMI 10% FBS, und fügen Sie rm-GM-CSF (20 ng / ml Endkonzentration) 5.
- 10 ml dieser Suspension in eine sterile, mikrobiologische Qualität, 10 cm Petrischale und Kultur in einem CO 2-Inkubator (37 ° C, 5% CO 2).
- Drei Tage später kommen weitere 10 ml RPMI 10% FBS mit 20 ng / l rmGM-CSF zu jedem der vorbereiteten Platten.
- Drei Tage später 10 ml Zellsuspension aus jeder Petrischale erholt, zentrifugiert, wie in 1,6, resuspendiert in das gleiche Volumen RPMI 10% FBS mit rmGM-CSF und kehrte in die Petrischale. Die Zellen werden für 2 weitere Tage in der CO 2-Inkubator.
2. Sammlung und Kennzeichnung von DCs
- Nach 8 Tagen in Kultur lose anhaftenden Zellen werden durch Waschen der Petrischalen mit frischem Medium wieder. Dieses Protokoll macht etwa 2-4 x10 8 DCs in unseren Händen. Die Zellen können für DC-Phänotyp mittels Durchflusszytometrie analysiert werden.
- Gesammelten Zellen werden dann mit den Qtracker 655 Zellen Labeling Kit streng nach den Anweisungen des Herstellers gekennzeichnet.
- Wir haben hervorragende Ergebnisse Kennzeichnung murinen Knochenmark-abgeleitete DCs mit qdots bei 10 nM Konzentration. Um dies zu erreichen, Aliquots Qtracker Zelle Labeling Kit Komponenten A und B sind in gleichen Volumina gemischt, inkubiert für 5 min bei Raumtemperatur, und sofort verdünnt 1 / 100 in frischem Medium mit Vortexen für 30 s.
- Um Flecken 5 x 10 6 DCs, mix 5 ul der einzelnen Komponenten des Kits A und B in einem Eppendorf-Röhrchen und inkubieren für 5 min bei Raumtemp. Dann fügt man 1 ml RPMI 10% FBS inkubiert, und Vortex für 30 Sekunden.
- 0,5 ml Zellsuspension mit 5 x10 6 DCs, und bei 37 ° C für 60 min.
- Dann waschen Sie die Zellen 2X in RPMI 10% FBS (1.100 RPM). Die Zellen können in RPMI für weitere Kultur oder in PBS werden für die Injektion in Versuchsmäusen resuspendiert.
3. Evaluation von markierten DC
- Zellmarkierung können mittels Fluoreszenz-Mikroskopie ausgewertet werden. Um dies zu erreichen, ist ein Tropfen der Zellsuspension auf einen Objektträger gegeben, bedeckt mit einem Deckglas und ausgewertet mit einem Fluoreszenzmikroskop unter Berücksichtigung, dass diese qdots Emissions-und Anregungsspektren von 565nm und 405-525nm haben bzw. (Abb. 3 )
- An diesem Punkt können die markierten Zellen verwendet werden, um Tiere zu injizieren, oder Reifung kann durch Inkubation dieser Zellen für 48 h induziert werden (37 ° C, 5 CO 2) in Gegenwart von LPS (100 ng / ml) und TNF-( 20 ng / ml). Fluoreszenzmarkierung nicht durch DC-Reifung (Abb. 4) betroffen.
4. Repräsentative Ergebnisse:
Hiermit erklären wir beschrieben, wie man murine Knochenmark abgeleiteten DCs vorbereiten und wie beschriftet sie mit fluoreszierenden qdots. Abb.. 1 fasst die Verfahren, um die Zelle zu erhalten, während Abb.. 2 zeigt das Verfahren, um sie mit qdots Etikett. Wie in Abb.. 3, fast alle Zellen werden durch diesen Vorgang bezeichnet, und das ist nicht von DC-Reifung mit entzündlichen Faktoren (Abb. 4). Abb. betroffen. 5 zeigt, dass Qdot-gefärbten DCs (Abb. 5a), vergleichbar mit nicht-gefärbten Zellen verhalten, wenn mit einer entzündlichen Cocktail behandelt. Beide Zellpräparationen ähnlich hochregulieren Ausdruck kostimulatorischen Molekülen (Abb. 5b), und produzieren ähnliche Mengen an IL-6 (Abb. 5c) und Stickstoffmonoxid (Abb. 5d) bei der Reifung Reize. Dies stimmt mit VorjahrOrganisationseinheiten veröffentlichten Daten zeigt, dass Qdot Färbung hat keinen Einfluss auf die Fähigkeit von DC bis zu reifen Zellen hervorrufen können Immunreaktionen [6] ein. Diese Zellen können dann für die Injektion Versuchstiere verwendet werden. Wie in Abb.. 6, 2 Tage nach intravenöser Injektion von markierten DCs in Mäusen, konnten wir Qdot-gefärbten Zellen in der Milz zu erkennen. Dies ist auch in Übereinstimmung mit früheren veröffentlichten Daten über die Verwendung der Qdot Nanokristalle zur Migration von DC in vivo zu bewerten [6] durch nicht-invasive Bildgebung und Durchflusszytometrie.
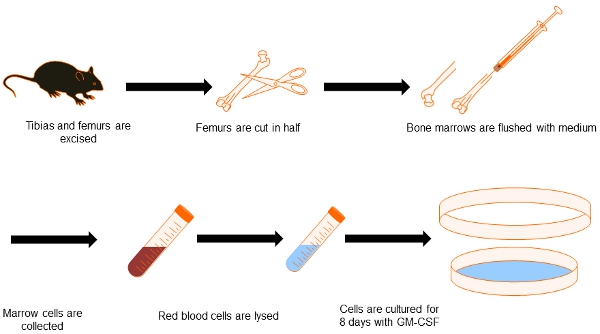
Abbildung 1. Flussdiagramm DC-Generation aus dem Knochenmark. Hiermit möchten wir zeigen den Prozess zu Knochenmark-abgeleitete DC zu erhalten. Beide Schienbeine und Oberschenkel sind seziert und sauber aus den umliegenden Gewebes. Knochen Tipps erhalten und das Innere der Knochen sind mit mittlerer gespült. Nach Beseitigung roten Blutkörperchen, sind Knochenmarkszellen für 8 Tage in Gegenwart von GM-CSF, um sie in DCs differenzieren kultiviert.
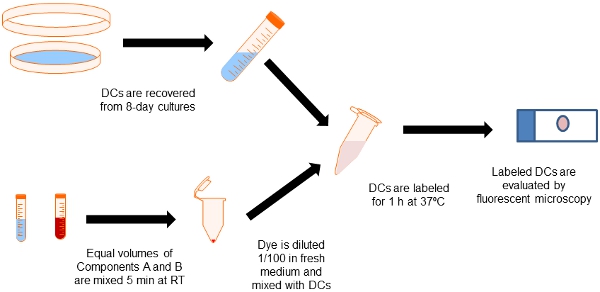
Abbildung 2. Flussdiagramm der Kennzeichnung Verfahren. Equal Aliquots Qtracker Zelle Labeling Kit Komponenten A und B sind in ein Eppendorf-Röhrchen gemischt. Dendritische Zellen sind aus 8-Tage-Knochenmark-Kulturen mit GM-CSF gesammelt und mit dem Etikett Farbstoff für 60 min bei 37C. Dann Zellen werden in Medium gewaschen, um überschüssige Markierung von Partikeln zu vermeiden.

Abbildung 3. Fluorescent Mikrofotografie von DCs sofort nach der Markierung. Ein Tropfen der markierten Zellen wurde auf einen Objektträger aufgebracht und bedeckt von einem Deckglas. Dann wurden die Proben in einem Fluoreszenz-Mikroskop ausgewertet und die Bilder wurden durch eine Micropublisher 5,0 Digitale CCD-Farbkamera (Qimaging, Surrey, BC Canada) erworben.
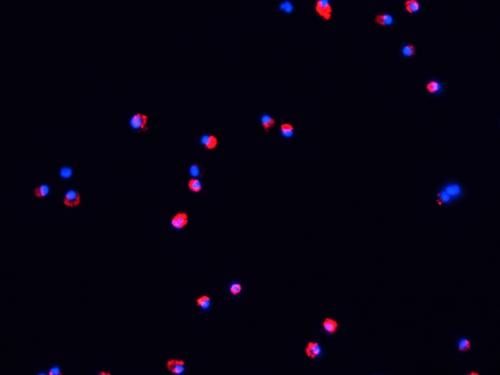
Abbildung 4. Fluorescent Mikrofotografie von DCs nach 48 h Reifung in vitro. Labeled DCs wurden für 48 h mit LPS (100 ng / ml) und TNF-α (20 ng / ml) auf Glasplättchen auf einer CO 2-Inkubator (37 ° C, 5% CO 2) kultiviert. Dann wurden die Proben mit PBS (5 min, 2X) gewaschen, mit Aceton (15 min, 4 ° C) und Gegenfärbung mit DAPI. Die Zellen wurden in einem Fluoreszenz-Mikroskop wie oben ausgewertet.
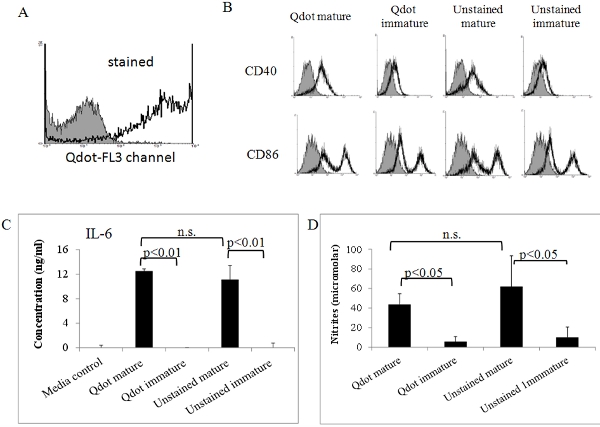
Abbildung 5. Biologische Aktivität von Qdot gefärbten reifen DCs. Labeled DCs in vitro wie oben gereift wurden mittels Durchflusszytometrie (A) analysiert und (B). (A) Qdot-gefärbten Zellen geben ein starkes Signal in der FL3 (PerCP) Kanal. Shaded Histogramm: ungefärbten Kontrolle. Und Isotypkontrollen; (B) Qdot-gefärbten und ungefärbten DCs wurden zusätzlich mit spezifischen Antikörpern gegen Reifung Marker CD86 und CD40 gefärbt. Die Zellen wurden dann in einem FACSort Durchflusszytometer (Becton Dickinson, San Jose, CA) analysiert. Zusätzlich wurden IL-6 (C) und Stickstoffmonoxid (NO) in Überständen von reifen Qdot-gefärbten DCs und Kontrollen bestimmt. Spiegel von IL-6 und Stickoxid wurden mittels ELISA-Analyse und Griess-Assay als wir bisher 7 beschrieben, 8 bestimmt. Alle Daten zeigten in dieser Abbildung ist repräsentativ für zwei oder drei unabhängigen Experimenten zeigen ähnliche Ergebnisse. Die Daten wurden mittels ANOVA mit dem GraphPad Software analysiert.
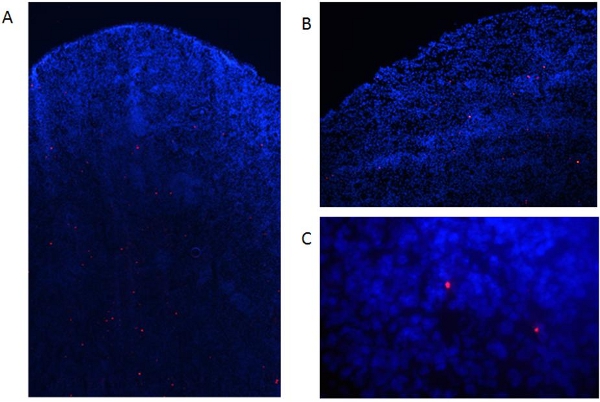
Abbildung 6. Erkennung von markierten DCs in seziert Gewebe. Labeled reife DCs (1x10 6 Zellen) wurden intravenös in C57BL / 6 Mäusen injiziert. (A) Zwei Tage später Mäuse getötet und Milz gesammelt, schockgefroren, eingebettet in OCT und 8 pM Abschnitte hergestellt unter Verwendung eines Kryostaten. Dann wurden die Proben mit Aceton (15 min, 4 ° C) fixiert und mit DAPI gegengefärbt. Die Zellen wurden in einem Fluoreszenz-Mikroskop wie oben ausgewertet Abb. 6a:. 40fache Vergrößerung, Abb. 6b: 100-facher Vergrößerung, Bild. 6C, 400-facher Vergrößerung.
Diskussion
Murine myeloische) DCs wurden ausgiebig genutzt, um die Wirksamkeit und Verbesserung der DC-basierte Impfstoffe zu bestimmen; untersuchen DC: T-Zell-Interaktionen oder DC Entwicklung und bestimmen ihre Rolle bei verschiedenen Erkrankungen 9-11. Hiermit zeigen wir, wie DCs aus Vorläufern aus den Knochen Zucchini der Schienbeine und Oberschenkel erholt zu generieren. Wir gewinnen die Knochen ohne Schneiden der Spitzen, so dass wir sie durch Eintauchen in 70% igem Ethanol sterilisiert, wodurch die Wahrscheinlichkeit einer Kontamination. Zur Unterscheidung DCs aus dem Knochenmark Zellen verwenden wir nur GM-CSF, wie oben beschrieben 5. Obwohl einige Protokolle auch IL-4, ist berichtet worden, dass dieses Zytokin nicht notwendig ist, bei der Arbeit mit einem hohen Grad von GM-CSF 12. In der Tat haben wir bereits gezeigt, dass diese DCs in der Lage, Immunreaktionen 13 induzieren. Auch ist darauf zu achten, um nur lose anhaftenden Zellen aus 8-Tage-Kulturen wieder durch Waschen der Petrischalen mit Medium, da anhaftenden Zellen eine Monozyten-ähnlichen Phänotyp zeigen. Hier zeigen wir die Kennzeichnung von DCs mit fluoreszierenden Qdot Partikel. Diese Kennzeichnung hat einige Vorteile gegenüber anderen Methoden. Zunächst werden die qdots Teilchen leicht in die Zellen aufgenommen. Zweitens ist die Fluoreszenz-Signal sehr hoch und wird nicht von DC Reifung verändert. Drittens wird die Fluoreszenz nicht verloren, wenn Zellen oder Gewebe mit Lösungsmitteln wie Aceton, entgegen dem, was passiert, wenn GFP wird verwendet, um DCs 14 Tag, was mehr Flexibilität im Moment zu Färbeprotokollen wählen fixiert sind. Schließlich erlaubt die hohe Fluoreszenz-Signal durch diese Partikel gegeben Visualisierung der Zellen trotz Gewebe Autofluoreszenz. Wie bereits 6 beschrieben, hat Qdot Färbung keinen Einfluss auf die Reifung Fähigkeit dieser Zellen. Hiermit zeigen wir, dass Qdot-gefärbten DCs in ähnlicher Weise als nicht-gefärbten DCs verhalten, heraufregulierende kostimulatorischen Molekülen und produzieren IL-6 und Stickstoffmonoxid in Reaktion auf entzündliche Reize. Obwohl DCs Zellen bei der Auslösung von Immunreaktionen spezialisiert sind, haben sie gezeigt, dass bei pathologischen Zuständen wie Krebs und Arteriosklerose 4, 15, 16 Jahren teilnehmen. Sie wurden auch behauptet, in angiogenen Prozess 17, 18, auch als strukturell an der Entwicklung von neuen Schiffen 19, 20 vorgeschlagen teilzunehmen. So Methoden, die für DC-Tracking in vivo, und die Bestimmung ihrer geografischen Lokalisation in verschiedenen Geweben 4, 21 zu ermöglichen, sind 22 sehr wertvoll.
Offenlegungen
Danksagungen
Diese Arbeit zum Teil durch die NIH unterstützt unter Grant R15 CA137499-01 (FB) und ein Startup-Fonds an der Ohio University (FB).
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
|---|---|---|---|
| C57BL / 6 Mäusen | Jackson Laboratorien | Weiblich, 6-8 Wochen alt | |
| RPMI | Invitrogen | 11875-119 | |
| Rinderfötenserum, qualifizierte | Invitrogen | 10437-028 | |
| Antibiotika-Antimykotikum | Invitrogen | 15240-096 | |
| PBS | Invitrogen | 10010-049 | |
| ACK Lysepuffer | Lonza Walkersville, Inc | 10-548E | |
| Rekombinantes murines GM-CSF | PeproTech Inc | 315-03 | |
| Qtracker 655 Zellen Labeling Kit | Invitrogen | Q25021MP | |
| Lipopolysaccharide | Invivogen | tlrl-eblps | |
| Rekombinantes murines TNF alpha | PeproTech | 315-01A | |
| CD86-Antikörper | BD Biosciences | 553691 | |
| CD40-Antikörper | BD Biosciences | 553791 | |
| Griess-Reagenz-System | Promega | G2930 | |
| IL-6 Fänger-Antikörper | eBioscience | 13-7061-81 | |
| IL-6 Nachweisantikörper | eBioscience | 13-7062-81 |
Referenzen
- Banchereau, J., Briere, F., Caux, C., Davoust, J., Lebecque, S., Liu, Y. J., Pulendran, B., Palucka, K. Immunobiology of dendritic cells. Annu Rev Immunol. 18, 767-811 (2000).
- Bonasio, R., von Andrian, U. H. Generation, migration and function of circulating dendritic cells. Curr Opin Immunol. 18, 503-511 (2006).
- Lanzavecchia, A., Sallusto, F. The instructive role of dendritic cells on T cell responses: lineages, plasticity and kinetics. Curr Opin Immunol. 13, 291-298 (2001).
- Conejo-Garcia, J. R., Benencia, F., Courreges, M. C., Kang, E., Mohamed-Hadley, A., Buckanovich, R. J., Holtz, D. O., Jenkins, A., Na, H., Zhang, L. Tumor-infiltrating dendritic cell precursors recruited by a beta-defensin contribute to vasculogenesis under the influence of Vegf-A. Nat Med. 10, 950-958 (2004).
- Lutz, M. B., Kukutsch, N., Ogilvie, A. L., Rossner, S., Koch, F., Romani, N., Schuler, G. An advanced culture method for generating large quantities of highly pure dendritic cells from mouse bone marrow. J Immunol Methods. 223, 77-92 (1999).
- Noh, Y. W., Lim, Y. T., Chung, B. H. Noninvasive imaging of dendritic cell migration into lymph nodes using near-infrared fluorescent semiconductor nanocrystals. Faseb J. 22, 3908-3918 (2008).
- Benencia, F., Courreges, M. C., Conejo-Garcia, J. R., Mohamed-Hadley, A., Zhang, L., Buckanovich, R. J., Carroll, R., Fraser, N., Coukos, G., Franco, L. G. HSV oncolytic therapy upregulates interferon-inducible chemokines and recruits immune effector cells in ovarian cancer. Mol Ther. 12, 789-802 (2005).
- Gilboa, E., Vieweg, J. Cancer immunotherapy with mRNA-transfected dendritic cells. Immunol Rev. 199, 251-263 (2004).
- Grolleau-Julius, A., Abernathy, L., Harning, E., Yung, R. L. Mechanisms of murine dendritic cell antitumor dysfunction in aging. Cancer Immunol Immunother. 58, 1935-1939 (2009).
- Yrlid, U., Svensson, M., Johansson, C., Wick, M. J. Salmonella infection of bone marrow-derived macrophages and dendritic cells: influence on antigen presentation and initiating an immune response. FEMS Immunol Med Microbiol. 27, 313-320 (2000).
- Lutz, M. B., Schnare, M., Menges, M., Rossner, S., Rollinghoff, M., Schuler, G., Gessner, A. Differential functions of IL-4 receptor types I and II for dendritic cell maturation and IL-12 production and their dependency on GM-CSF. J Immunol. 169, 3574-3580 (2002).
- Benencia, F., Courreges, M. C., Coukos, G. Whole tumor antigen vaccination using dendritic cells: comparison of RNA electroporation and pulsing with UV-irradiated tumor cells. J Transl Med. 6, 21-21 (2008).
- Probst, H. C., Tschannen, K., Odermatt, B., Schwendener, R., Zinkernagel, R. M., Van Den Broek, M. Histological analysis of CD11c-DTR/GFP mice after in vivo depletion of dendritic cells. Clin Exp Immunol. 141, 398-404 (2005).
- Fainaru, O., Adini, A., Benny, O., Adini, I., Short, S., Bazinet, L., Nakai, K., Pravda, E., Hornstein, M. D., D'Amato, R. J., Folkman, J. Dendritic cells support angiogenesis and promote lesion growth in a murine model of endometriosis. Faseb J. 22, 522-529 (2008).
- Bobryshev, Y. V., Lord, R. S., Rainer, S., Jamal, O. S., Munro, V. F. Vascular dendritic cells and atherosclerosis. Pathol Res Pract. 192, 462-467 (1996).
- Nakai, K., Fainaru, O., Bazinet, L., Pakneshan, P., Benny, O., Pravda, E., Folkman, J., D'Amato, R. J. Dendritic cells augment choroidal neovascularization. Invest Ophthalmol Vis Sci. 49, 3666-3670 (2008).
- Huarte, E., Cubillos-Ruiz, J. R., Nesbeth, Y. C., Scarlett, U. K., Martinez, D. G., Buckanovich, R. J., Benencia, F., Stan, R. V., Keler, T., Sarobe, P. Depletion of dendritic cells delays ovarian cancer progression by boosting antitumor immunity. Cancer Res. 68, 7684-7691 (2008).
- Fernandez Pujol, B., Lucibello, F. C., Zuzarte, M., Lutjens, P., Muller, R., Havemann, K. Dendritic cells derived from peripheral monocytes express endothelial markers and in the presence of angiogenic growth factors differentiate into endothelial-like cells. Eur J Cell Biol. 80, 99-110 (2001).
- Gottfried, E., Kreutz, M., Haffner, S., Holler, E., Iacobelli, M., Andreesen, R., Eissner, G. Differentiation of human tumour-associated dendritic cells into endothelial-like cells: an alternative pathway of tumour angiogenesis. Scand J Immunol. 65, 329-335 (2007).
- Bobryshev, Y. V., Lord, R. S. Mapping of vascular dendritic cells in atherosclerotic arteries suggests their involvement in local immune-inflammatory reactions. Cardiovasc Res. 37, 799-810 (1998).
- Bobryshev, Y. V., Lord, R. S. Co-accumulation of dendritic cells and natural killer T cells within rupture-prone regions in human atherosclerotic plaques. J Histochem Cytochem. 53, 781-785 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten