Method Article
Génération et d'étiquetage des murins de la moelle osseuse des cellules dendritiques dérivées des nanocristaux Qdot pour les études de suivi
Dans cet article
Résumé
Dendritiques antigènes des cellules d'absorption et de migrer vers les organes à l'abri de présenter les antigènes aux cellules T traitées. Qdot nanocristal étiquetage fournit un signal de longue durée et stable fluorescentes. Cela permet le suivi des cellules dendritiques à différents organes par microscopie fluorescente.
Résumé
Cellules dendritiques (CD) sont des cellules présentant l'antigène professionnelles (APC) a trouvé dans les tissus périphériques et dans les organes immunologiques comme le thymus, la moelle osseuse, la rate, les ganglions lymphatiques et les plaques de Peyer 1-3. PED présente dans l'échantillon des tissus périphériques de l'organisme à la présence d'antigènes, dont ils prennent, traiter et présenter dans leur surface dans le contexte des molécules de complexe majeur d'histocompatibilité (CMH). Ensuite, l'antigène CD chargés de migrer vers les organes immunologiques où ils présentent l'antigène aux lymphocytes T traitées déclenchement des réponses immunitaires spécifiques. Une façon d'évaluer les capacités migratoires des PED est de les étiqueter avec des colorants fluorescents 4.
Par la présente, nous démontrons l'utilisation de nanocristaux fluorescents Qdot à l'étiquette dérivées de moelle osseuse murine DC. L'avantage de cet étiquetage est que Qdot nanocristaux possèdent stable et à long fluorescence durables qui les rendent idéales pour la détection de cellules marquées dans les tissus récupérés. Pour ce faire, les premières cellules seront récupérés auprès des courges d'os murins et cultivés pendant 8 jours dans la présence de granulocytes macrophages facteur stimulant les colonies afin d'induire la différenciation DC. Ces cellules seront ensuite marqués avec Qdots fluorescents par de courtes incubation in vitro. Les cellules colorées peuvent être visualisées avec un microscope à fluorescence. Les cellules peuvent être injectées dans les animaux de laboratoire à ce point ou peut être en cellules matures après incubation in vitro avec des stimuli inflammatoires. Dans nos mains, la maturation des CD n'a pas de déterminer la perte de signal fluorescent ni coloration Qdot affecter les propriétés biologiques des PED. Lors de l'injection, ces cellules peuvent être identifiées dans les organes immunitaires par microscopie à fluorescence après la dissection typiques et des procédures de fixation.
Protocole
1. Dissection de fémurs et tibias de la souris et la culture de cellules de moelle osseuse
- Sacrifice 2 souris par le CO 2 asphyxie et soigneusement décortiquer les tibias et les fémurs sans couper les extrémités des os.
- Nettoyez les os de tous les tissus attachés en utilisant du papier de soie. Attention à ne pas briser les os.
- Stériliser les os par immersion dans de l'éthanol à 70% pendant 10 min dans un plat de Pétri de 35 mm. A partir de ce moment, le travail intérieur d'une hotte de biosécurité pour éviter la contamination des cultures cellulaires.
- Récupérer les os de l'éthanol et les laisser sécher à l'air pendant 5 min dans une boîte de Pétri dans l'armoire de biosécurité.
- Couper les fémurs de moitié, et le tibia par sa pointe plus fine. Faire infuser l'intérieur de l'os avec 1 ml de milieu RPMI (sans sérum mais avec des antibiotiques) à l'aide d'une seringue stérile sur une boîte de Pétri stérile.
- La suspension cellulaire est recueilli et lavé 2X dans le milieu RPMI par 10 centrifugation min dans un tube de 15 ml de centrifugeuses à 1100 RPM dans une centrifugeuse réfrigérée (4 ° C) avec un rotor swing.
- Après le dernier lavage, remettre en suspension les cellules dans 2 ml de tampon de lyse ACK et incuber pendant 5 min à température ambiante afin d'éliminer les globules rouges.
- Ajouter 13 ml de RPMI avec 10% de FBS, resuspendre et laver 2X dans ce milieu avec les mêmes paramètres que décrite au point 1.6.
- Compter les cellules, ajuster à 2 x 10 5 cellules / ml avec du RPMI 10% SVF, et ajoutez rm-GM-CSF (20 ng / ml final) 5.
- Ajouter 10 ml de cette suspension à une stérile, la qualité microbiologique, 10 cm boîte de Petri, et la culture dans un incubateur à CO 2 (37 ° C, 5% CO 2).
- Trois jours plus tard, ajouter un autre 10 ml de RPMI 10% SVF à 20 ng / l de rmGM-CSF à chacun des plats préparés.
- Trois jours plus tard, 10 ml de suspension cellulaire sont récupérés à partir de chaque boîte de Pétri, centrifugé comme dans 1.6, remis en suspension dans le même volume de RPMI 10% SVF avec rmGM-CSF et retourné à la boîte de Pétri. Les cellules sont cultivées pendant 2 jours supplémentaires dans l'incubateur CO 2.
2. Collecte et l'étiquetage des PED
- Après 8 jours de culture des cellules faiblement adhérentes sont récupérées par lavage de la boîte de Pétri avec un milieu frais. Ce protocole rend environ 2-4 x10 8 PED dans nos mains. Les cellules peuvent être analysés pour phénotype DC par cytométrie en flux.
- Cellules prélevées sont ensuite étiquetées avec le Qtracker 655 Kit marquage cellulaire suivant strictement les instructions du fabricant.
- Nous avons obtenu d'excellents résultats étiquetage dérivées de la moelle osseuse de souris avec les PED Qdots à une concentration de 10 nM. Pour ce faire, des aliquotes de composants cellulaires Kit Qtracker Etiquetage A et B sont mélangés dans des volumes égaux, incubé pendant 5 min à température ambiante, et immédiatement après dilution 1 / 100 en milieu frais avec vortex pendant 30 s.
- Pour tache 5 x 10 6 CD, mélanger 5 ul de chaque composants du kit A et B dans un tube Eppendorf et incuber pendant 5 min à température ambiante. Ensuite, ajoutez 1 ml de RPMI FBS incuber 10%, et le vortex pendant 30 secondes.
- Ajouter 0,5 ml de suspension cellulaire contenant 5 x10 6 CD, et incuber à 37 ° C pendant 60 min.
- Ensuite, laver les cellules 2X dans RPMI 10% SVF (1100 RPM). Les cellules peuvent être remises en suspension dans du RPMI pour la culture d'autres ou en PBS pour injection dans des souris expérimentales.
3. Evaluation de DC étiquetés
- Marquage cellulaire peut être évaluée au moyen de la microscopie à fluorescence. Pour ce faire, une goutte de suspension cellulaire sont ajoutés à une lame de microscope, recouvert d'une lamelle de verre, et évaluées avec un microscope à fluorescence en tenant compte que ces Qdots ont émission et d'excitation des spectres de 565nm et 525nm, respectivement de 405 (fig. 3 )
- À ce stade, les cellules marquées peuvent être utilisées pour injecter des animaux, ou de maturation peut être induite en incubant ces cellules pendant 48 h (37 ° C, 5 CO 2), en présence de LPS (100 ng / ml) et le TNF-( 20 ng / ml). Fluorescent étiquetage n'est pas affectée par la maturation des CD (fig. 4).
4. Les résultats représentatifs:
Par la présente, nous avons décrit comment préparer dérivées de la moelle osseuse de souris et comment les PED étiquetés avec Qdots fluorescentes. Fig. 1 résume la procédure pour obtenir la cellule, tandis que la Fig. 2 illustre la procédure à les étiqueter avec Qdots. Comme le montre la Fig. 3, presque toutes les cellules sont marquées par cette procédure, et ce n'est pas affectée par la maturation des CD avec des facteurs inflammatoires (Fig. 4). Fig. 5 montre que Qdot teinté PED (Fig.5a) se comportent similaires aux non-tachés cellules lorsqu'elles sont traitées avec un cocktail inflammatoires. Les deux préparations cellulaires de la même réguler positivement l'expression des molécules de costimulation (Fig. 5b), et de produire des quantités similaires de l'IL-6 (fig. 5c) et l'oxyde nitrique (fig. 5d) à des stimuli de maturation. Ceci concorde avec précédes unités d'organisation des données publiées indiquant que la coloration Qdot n'affecte pas la capacité de DC à se transformer en cellules matures capables de provoquer des réponses immunitaires [6]. Ces cellules peuvent ensuite être utilisées pour injecter des animaux de laboratoire. Comme le montre la Fig. 6, 2 jours après l'injection intraveineuse de PED étiquetés dans des souris, nous avons été capables de détecter Qdot cellules colorées dans la rate. Ceci est également en accord avec les précédents données publiées montrant l'utilisation des nanocristaux Qdot pour évaluer la migration des DC in vivo [6] par l'imagerie non invasive et cytométrie de flux.
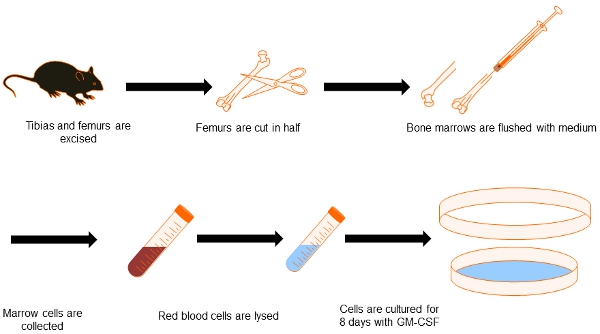
Organigramme Figure 1. Génération du CC de la moelle osseuse. Par la présente, nous dépeignent le processus pour obtenir la moelle osseuse DC dérivées. Les deux tibias et les fémurs sont disséqués et propre à partir de tissus environnants. Conseils osseuse sont préservées et l'intérieur de l'os sont rincées avec support. Après l'élimination des globules rouges, cellules de moelle osseuse sont cultivés pendant 8 jours en présence de GM-CSF pour les différencier en DC.
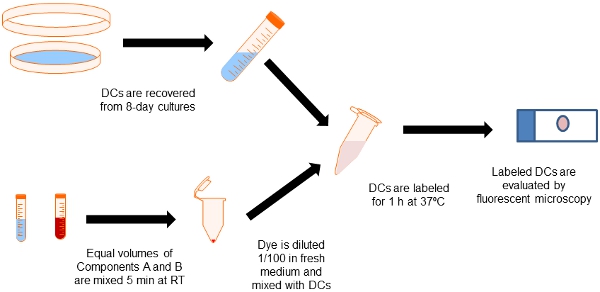
Organigramme Figure 2. De la procédure d'étiquetage. Aliquotes égales des composants de la cellule Kit Qtracker Etiquetage A et B sont mélangés dans un tube Eppendorf. Les cellules dendritiques sont collectées à partir de 8 jours cultures de moelle osseuse avec GM-CSF et mélangé avec le colorant d'étiquetage pour 60 min à 37C. Puis les cellules sont lavées dans les médias afin d'éliminer les particules d'étiquetage excès.

Figure 3. Microphotographie fluorescent des PED immédiatement après l'étiquetage. Une goutte de cellules marquées a été déposé sur une lame de verre et couverts par une lamelle. Ensuite, des échantillons ont été évalués dans un microscope à fluorescence et images ont été acquises par une caméra numérique 5.0 Micropublisher CCD couleur (QImaging, Surrey, BC Canada).
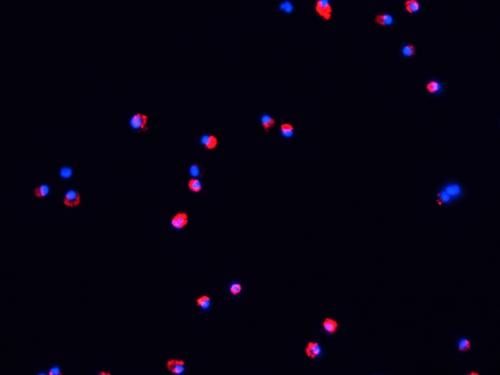
Figure 4. Microphotographie fluorescent des PED après 48 h de maturation in vitro. PED étiquetés ont été cultivés pendant 48 h avec le LPS (100 ng / ml) et le TNF-α (20 ng / ml) sur des lames de verre sur un incubateur à CO 2 (37 ° C, 5% CO 2). Ensuite, des échantillons ont été lavés avec du PBS (5 min, 2X), fixées à l'acétone (15 min, 4 ° C) et de contraste avec le DAPI. Les cellules ont été évaluées dans un microscope à fluorescence comme ci-dessus.
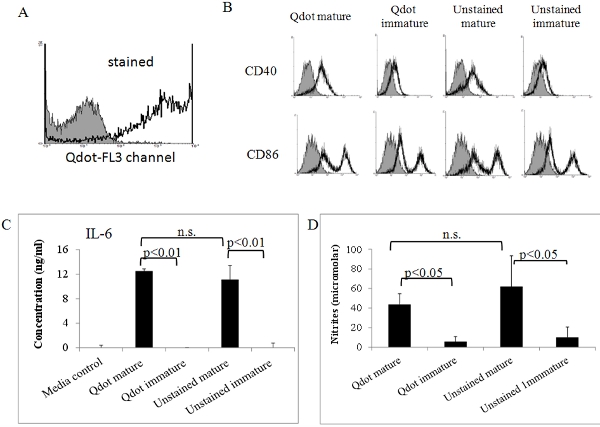
Figure 5. L'activité biologique des Qdot teinté CD matures. PED étiquetés mûri in vitro, comme ci-dessus ont été analysés par cytométrie en flux (A) et (B). (A) Qdot cellules colorées donner un signal fort dans le FL3 (PerCP) canal. Shaded histogramme: contrôle non colorées. (B) PED Qdot-colorées et non colorées ont en outre été colorés avec des anticorps spécifiques contre la maturation des marqueurs CD86 et CD40, et contrôle isotypique. Les cellules ont ensuite été analysées dans un cytomètre en flux FACSort (Becton Dickinson, San Jose, CA). De plus, l'IL-6 (C) et l'oxyde nitrique (NO) ont été déterminés dans les surnageants de maturité Qdot teinté PED et les contrôles. Les niveaux d'IL-6 et de l'oxyde nitrique ont été déterminés par analyse ELISA et test de Griess que nous avons décrit précédemment 7, 8. Toutes les données ont montré dans cette figure est représentative de deux ou trois expériences indépendantes montrant des résultats similaires. Les données ont été analysées par ANOVA en utilisant le logiciel GraphPad.
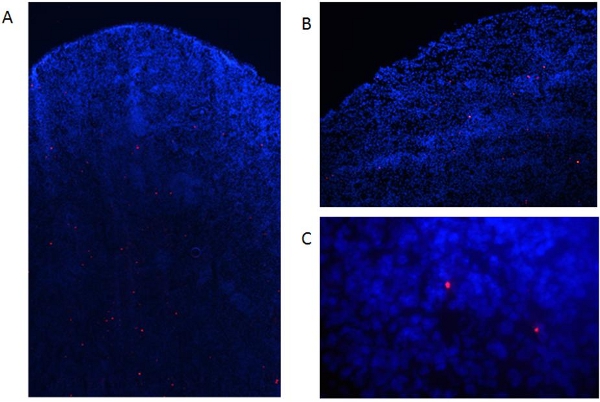
Figure 6. Détection des PED dans les tissus étiquetés disséqués. Étiquetés CD matures (1x10 6 cellules) ont été injectés par voie intraveineuse à des souris C57BL / 6. (A) Deux jours plus tard, les souris ont été sacrifiées et les rates recueillies, snap congelés, embarqué dans un PTOM, et 8 sections uM préparés en utilisant un cryostat. Ensuite, des échantillons ont été fixés avec de l'acétone (15 min, 4 ° C) et de contraste avec le DAPI. Les cellules ont été évaluées dans un microscope à fluorescence comme ci-dessus figure 6a:. Grossissement de 40X, fig 6b: grossissement 100X, fig. 6C, grossissement 400x.
Discussion
Murin myéloïde) PED ont été largement utilisées afin de déterminer l'efficacité et l'amélioration des vaccins à base de DC; enquêter sur DC: les interactions des cellules T ou de développement continu, et déterminer leur rôle dans diverses maladies 9-11. Par la présente, nous montrons comment générer les PED à partir de précurseurs récupéré de courges os de tibias et les fémurs. Nous récupérons les os sans couper les bouts, nous permettant de les stériliser par immersion dans l'éthanol à 70%, réduisant ainsi la probabilité de contamination. Pour différencier les PED à partir des cellules de moelle osseuse, nous n'utilisons que le GM-CSF que 5 décrit précédemment. Bien que certains protocoles utilisent aussi l'IL-4, il a été rapporté que cette cytokine n'est pas nécessaire lorsqu'on travaille avec des niveaux élevés de GM-CSF 12. En effet, nous l'avons déjà démontré que ces contrôleurs sont capables d'induire des réponses immunitaires 13. Aussi, les soins doivent être prises pour récupérer uniquement les cellules faiblement adhérentes à partir de 8 jours cultures par lavage de la boîte de Pétri avec un milieu de cellules attachées depuis montrent un phénotype plus monocyte. Ici, nous montrons l'étiquetage des PED avec des particules fluorescentes Qdot. Cet étiquetage a peu de respect avantages à d'autres méthodes. Premièrement, les particules Qdots sont facilement incorporés dans les cellules. Deuxièmement, le signal fluorescent est très élevé et n'est pas altérée par la maturation des CD. Troisièmement, la fluorescence n'est pas perdu lorsque les cellules ou les tissus sont fixés avec des solvants comme l'acétone, contrairement à ce qui se passe si la GFP est utilisé pour marquer les PED 14, donnant plus de flexibilité au moment de choisir les protocoles de coloration. Enfin, le signal haute fluorescente donnée par ces particules permet de visualiser les cellules des tissus, malgré l'auto-fluorescence. Comme décrit précédemment 6, coloration Qdot n'a pas affecté la capacité de maturation de ces cellules. Par la présente, nous montrons que Qdot teinté PED se comportent de façon similaire que les non-tachés PED, upregulating molécules de costimulation, et la production d'IL-6 et l'oxyde nitrique en réponse aux stimuli inflammatoires. Bien que les PED sont des cellules spécialisées dans le déclenchement des réponses immunitaires, elles ont été montrées à participer dans des conditions pathologiques comme le cancer et l'athérosclérose 4, 15, 16. Ils ont été également affirmé à participer au processus angiogénique 17, 18, a même suggéré que la structure participe à l'élaboration de nouveaux vaisseaux 19, 20. Ainsi, les méthodes qui permettent de DC suivi in vivo, et de déterminer leur localisation géographique dans les différents tissus 4, 21, 22 sont très précieux.
Déclarations de divulgation
Remerciements
Ce travail soutenu en partie par le NIH sous Grant R15 CA137499-01 (FB) et un fonds de démarrage de l'Ohio University (FB).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| Souris C57BL / 6 | Laboratoires Jackson | Les femelles, âgées de 6-8 semaines | |
| RPMI | Invitrogen | 11875-119 | |
| Sérum fœtal bovin, qualifié | Invitrogen | 10437-028 | |
| Antibiotiques antimycosiques | Invitrogen | 15240-096 | |
| PBS | Invitrogen | 10010-049 | |
| Tampon de lyse ACK | Lonza Walkersville, Inc | 10-548E | |
| Recombinant GM-CSF murin | PeproTech Inc | 315-03 | |
| Qtracker 655 kit de marquage cellulaire | Invitrogen | Q25021MP | |
| Lipopolysaccharide | Invivogen | tlrl-eblps | |
| Recombinant murin TNF alpha | Peprotech | 315-01A | |
| CD86 anticorps | BD Biosciences | 553691 | |
| CD40 anticorps | BD Biosciences | 553791 | |
| Système réactif de Griess | Promega | G2930 | |
| IL-6 anticorps de capture | eBioscience | 13-7061-81 | |
| D'anticorps de détection d'IL-6 | eBioscience | 13-7062-81 |
Références
- Banchereau, J., Briere, F., Caux, C., Davoust, J., Lebecque, S., Liu, Y. J., Pulendran, B., Palucka, K. Immunobiology of dendritic cells. Annu Rev Immunol. 18, 767-811 (2000).
- Bonasio, R., von Andrian, U. H. Generation, migration and function of circulating dendritic cells. Curr Opin Immunol. 18, 503-511 (2006).
- Lanzavecchia, A., Sallusto, F. The instructive role of dendritic cells on T cell responses: lineages, plasticity and kinetics. Curr Opin Immunol. 13, 291-298 (2001).
- Conejo-Garcia, J. R., Benencia, F., Courreges, M. C., Kang, E., Mohamed-Hadley, A., Buckanovich, R. J., Holtz, D. O., Jenkins, A., Na, H., Zhang, L. Tumor-infiltrating dendritic cell precursors recruited by a beta-defensin contribute to vasculogenesis under the influence of Vegf-A. Nat Med. 10, 950-958 (2004).
- Lutz, M. B., Kukutsch, N., Ogilvie, A. L., Rossner, S., Koch, F., Romani, N., Schuler, G. An advanced culture method for generating large quantities of highly pure dendritic cells from mouse bone marrow. J Immunol Methods. 223, 77-92 (1999).
- Noh, Y. W., Lim, Y. T., Chung, B. H. Noninvasive imaging of dendritic cell migration into lymph nodes using near-infrared fluorescent semiconductor nanocrystals. Faseb J. 22, 3908-3918 (2008).
- Benencia, F., Courreges, M. C., Conejo-Garcia, J. R., Mohamed-Hadley, A., Zhang, L., Buckanovich, R. J., Carroll, R., Fraser, N., Coukos, G., Franco, L. G. HSV oncolytic therapy upregulates interferon-inducible chemokines and recruits immune effector cells in ovarian cancer. Mol Ther. 12, 789-802 (2005).
- Gilboa, E., Vieweg, J. Cancer immunotherapy with mRNA-transfected dendritic cells. Immunol Rev. 199, 251-263 (2004).
- Grolleau-Julius, A., Abernathy, L., Harning, E., Yung, R. L. Mechanisms of murine dendritic cell antitumor dysfunction in aging. Cancer Immunol Immunother. 58, 1935-1939 (2009).
- Yrlid, U., Svensson, M., Johansson, C., Wick, M. J. Salmonella infection of bone marrow-derived macrophages and dendritic cells: influence on antigen presentation and initiating an immune response. FEMS Immunol Med Microbiol. 27, 313-320 (2000).
- Lutz, M. B., Schnare, M., Menges, M., Rossner, S., Rollinghoff, M., Schuler, G., Gessner, A. Differential functions of IL-4 receptor types I and II for dendritic cell maturation and IL-12 production and their dependency on GM-CSF. J Immunol. 169, 3574-3580 (2002).
- Benencia, F., Courreges, M. C., Coukos, G. Whole tumor antigen vaccination using dendritic cells: comparison of RNA electroporation and pulsing with UV-irradiated tumor cells. J Transl Med. 6, 21-21 (2008).
- Probst, H. C., Tschannen, K., Odermatt, B., Schwendener, R., Zinkernagel, R. M., Van Den Broek, M. Histological analysis of CD11c-DTR/GFP mice after in vivo depletion of dendritic cells. Clin Exp Immunol. 141, 398-404 (2005).
- Fainaru, O., Adini, A., Benny, O., Adini, I., Short, S., Bazinet, L., Nakai, K., Pravda, E., Hornstein, M. D., D'Amato, R. J., Folkman, J. Dendritic cells support angiogenesis and promote lesion growth in a murine model of endometriosis. Faseb J. 22, 522-529 (2008).
- Bobryshev, Y. V., Lord, R. S., Rainer, S., Jamal, O. S., Munro, V. F. Vascular dendritic cells and atherosclerosis. Pathol Res Pract. 192, 462-467 (1996).
- Nakai, K., Fainaru, O., Bazinet, L., Pakneshan, P., Benny, O., Pravda, E., Folkman, J., D'Amato, R. J. Dendritic cells augment choroidal neovascularization. Invest Ophthalmol Vis Sci. 49, 3666-3670 (2008).
- Huarte, E., Cubillos-Ruiz, J. R., Nesbeth, Y. C., Scarlett, U. K., Martinez, D. G., Buckanovich, R. J., Benencia, F., Stan, R. V., Keler, T., Sarobe, P. Depletion of dendritic cells delays ovarian cancer progression by boosting antitumor immunity. Cancer Res. 68, 7684-7691 (2008).
- Fernandez Pujol, B., Lucibello, F. C., Zuzarte, M., Lutjens, P., Muller, R., Havemann, K. Dendritic cells derived from peripheral monocytes express endothelial markers and in the presence of angiogenic growth factors differentiate into endothelial-like cells. Eur J Cell Biol. 80, 99-110 (2001).
- Gottfried, E., Kreutz, M., Haffner, S., Holler, E., Iacobelli, M., Andreesen, R., Eissner, G. Differentiation of human tumour-associated dendritic cells into endothelial-like cells: an alternative pathway of tumour angiogenesis. Scand J Immunol. 65, 329-335 (2007).
- Bobryshev, Y. V., Lord, R. S. Mapping of vascular dendritic cells in atherosclerotic arteries suggests their involvement in local immune-inflammatory reactions. Cardiovasc Res. 37, 799-810 (1998).
- Bobryshev, Y. V., Lord, R. S. Co-accumulation of dendritic cells and natural killer T cells within rupture-prone regions in human atherosclerotic plaques. J Histochem Cytochem. 53, 781-785 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon