Method Article
Transduktion humaner Zellen mit Polymer-Komplex ecotropen Lentivirus für Enhanced Biosafety
In diesem Artikel
Zusammenfassung
Lentiviren sind eine wertvolle Recherche-Tool für die Erkundung der Genfunktion, aber Forscher möge Produktion von pantropic Lentivirus Kodierung bekannten oder vermuteten Onkogene zu vermeiden. Als Alternative stellen wir ein sicheres Protokoll für die Verwendung von ecotropen Lentivirus auf menschliche Zellen geändert, um die ecotropen Rezeptor mSlc7a1 auszudrücken.
Zusammenfassung
Stamm-und Tumor-Zellbiologie Studien erfordern häufig virale Transduktion humaner Zellen mit bekannter oder vermuteter Onkogene, Erhöhung wichtigen Fragen der Sicherheit für das Laborpersonal. Pantropic Lentiviren, wie die häufig verwendeten VSV-G Pseudotyp, sind ein wertvolles Werkzeug zur Untersuchung der Genfunktion, weil sie vielen Zelltypen, einschließlich nicht-teilenden Zellen transduzieren. Allerdings können Forscher wollen Produktions-und Zentrifugation pantropic Viren kodieren Onkogene durch höhere Sicherheitsstufe Umgang mit Anforderungen und Fragen der Sicherheit zu vermeiden. Mehrere starke Onkogene, einschließlich c-Myc und SV40 large T-Antigen, sind bekannt, die Produktion von induzierten pluripotenten Stammzellen (IPSC) zu verbessern. Alle anderen bekannten iPSC-induzierenden genetischen Veränderungen (Oct4, Sox2, Klf4, NANOG, LIN28 und p53 Verlust der Funktion) auch Links zu Krebs, so dass sie relativ hoher Sicherheit betreffen, sowie.
Während diese im Zusammenhang mit Krebs Viren nützlich beim Studium der Reprogrammierung und Pluripotenz sind, müssen sie sicher verwendet werden. Um diese Fragen der biologischen Sicherheit, zeigen wir eine Methode zur Transduktion humaner Zellen mit ecotropen Lentivirus, mit zusätzlichem Schwerpunkt auf reduzierte Kosten und eine bequeme Handhabung. Wir haben ecotropen Lentivirus mit einer ausreichend hohen Titer produziert, um mehr als 90% der transduzieren-Rezeptor-exprimierenden menschlichen Zellen mit dem Virus, der Validierung der Wirksamkeit dieses Ansatzes.
Lentivirus ist oft durch Ultrazentrifugation konzentriert, allerdings dauert dieser Vorgang mehrere Stunden und kann Aerosole Infektionskrankheiten des Menschen biomedizinische Forscher produzieren. Als Alternative, virale Partikel können mehr sicher auf Zellen werden durch Komplexierung mit Chondroitinsulfat und Polybren (CS / PB) sedimentiert. Diese Technik erhöht die funktionelle virale Titer von bis zu 3-fach in den Zellen stabil exprimieren Mäuse-Retrovirus-Rezeptor, mit vernachlässigbaren zusätzlichen Zeit-und Kosten. Transduktion von humanen dermalen Fibroblasten (HDF) ist maximal erweitert mit CS / PB-Konzentrationen etwa 4-fach niedriger als der optimale Wert zuvor für Krebszelllinien gemeldet, was darauf hindeutet, dass Polymer-Konzentration für die Zielzelle Art der Verzinsung sollte titriert werden. Deshalb beschreiben die Verwendung von methylthiazolyldiphenyl-Tetrazolium Bromid (MTT) zum Testen auf Polymer-Toxizität in einem neuen Zelltyp. Wir beobachten, entspricht Lebensfähigkeit der HDF nach einer viralen Transduktion entweder mit Polymer-Komplexierung oder der Standard-Dosierung von Polybren (PB, 6 pg / ml), was darauf hinweist minimal akute Toxizität.
In diesem Protokoll, beschreiben wir die Verwendung von ecotropen Lentivirus für die Überexpression von Onkogenen in menschlichen Zellen, wodurch die biologische Sicherheit Risiken und die Erhöhung der Transduktion Rate. Wir zeigen auch die Verwendung von Polymer-Komplexierung Transduktion zu verbessern und gleichzeitig die Vermeidung aerosolbildende Zentrifugation von Viruspartikeln.
Protokoll
1. Lentivirus production, harvest, and freezing
- Consult your institutional safety official before beginning this protocol, and follow their recommended safety guidelines.
- Day 1. Start with healthy, rapidly growing 293T cells to produce virus. Plate the cells at 5 x 106 cells per 10 cm plate. Use antibiotic-free 293T medium (high-glucose DMEM with 10% FBS and 4 mM L-glutamine) for virus production.
- Day 2. In the late afternoon, transfect 293T cells as follows (numbers given are for one 10 cm plate). Let all reagents warm up to room temperature. Pipette 375 μl OptiMEM into a microcentrifuge tube, then add 25 μl Fugene HD. Do not allow undiluted Fugene to contact the surface of the tube.
- In a microcentrifuge tube, mix:
- 5 μg transfer plasmid (Slc7a1, target vector, or fluorescent control vector)
- 3.75 μg packaging plasmid (pCMV-dR8.91 or psPax2)
- 1.25 μg envelope plasmid (pMD2.G for pantropic, pHCMV-EcoEnv for ecotropic)
- serum-free OptiMEM to 100 μl
- Combine the two tubes and incubate the mixture 20-30 minutes at room temperature.
- Change the medium on the 293T cells to 10 ml fresh antibiotic-free 293T medium. Add the Fugene/plasmid mix drop-wise to the plate and incubate overnight at 37°C, 5% CO2.
- Day 3. Change medium on the 293T cells to 10 ml fresh antibiotic-free 293T medium. Be gentle, because 293T cells adhere only loosely and can slough off by media pipetted too forcefully onto the monolayer. Incubate for two days in a humidified incubator for virus production.
- Day 5. Harvest virus and filter with a 0.45 mm low protein binding filter. Use immediately or dispense into single-use aliquots and freeze at -80°C. Frozen pantropic and ecotropic virus should be re-titered after it has been stored for six months and one month, respectively.
- Titer the virus as follows, using cells that are relatively amenable to transduction. Transduce cells with fluorescent control virus overnight using serial dilutions (e.g. 1:10, 1:100, 1:1000) in fresh medium with 6 μg/ml PB. Change to fresh medium the next day. Allow the cells two days after transduction to begin expressing the fluorescent protein, then determine the fraction of transduced cells by FACS. Calculate the titer in transforming units (TU) per ml, based on dilutions that yield < 15% transduction to minimize multiple transduction events.

2. Transduction of human target cells with murine retrovirus receptor Slc7a1
- Select a multiplicity of infection (MOI) = 2 to ensure that most cells will be transduced. For target cells that are resistant to transduction such as HDFs, a higher MOI will be required; we dilute the viral supernatant only 1:2 to achieve transduction of a majority of the cells.
- Transduce target cells overnight with viral supernatant diluted in fresh culture medium with 6 μg/ml PB, which increases transduction by enhancing electrostatic interaction between the virus and target cell.1 Ideally one should use a minimal volume of virus, such as 1 ml for a 35 mm plate, because diffusion is a limiting factor in transduction efficiency.
- Culture cells for at least 48 hours after removing virus before transducing them with ecotropic virus, in order to ensure sufficient expression of the Slc7a1 receptor.
- (Optional) It is possible to use blasticidin to select for stably transduced cells expressing Slc7a1, if desired. A blasticidin kill curve should be generated in advance to determine the lowest effective concentration, generally between 2 – 10 μg/ml, that kills all untransduced target cells in 7 days. About 2 days after removing the Slc7a1 virus, switch the transduced cells to medium containing blasticidin. Culture the cells in blasticidin-containing medium for 7 days, at which point all remaining cells will stably express the retrovirus receptor at which point they can be transduced with ecotropic virus as well as banked for future use as a stable Slc7a1-expressing line.
3. Polymer complex titration to determine toxicity
- Day 1. Plate cells at 5000 cells/well in a 96-well plate, allowing at least triplicate wells for each experimental group. Include untransduced cells in complete medium to provide a baseline value for healthy cells, as well as samples consisting of cells in serum-free medium to induce growth arrest as a control. In parallel, plate cells in an appropriate format (such as a 24-well plate) for microscopic or FACS-based analysis of transduction efficiency in each experimental condition.
- Day 2. Transduce cells in plates set up for both the MTT and FACS analyses with virus encoding GFP, at an MOI of 0.5 to transduce ~40% of target cells. Test varied concentrations of CS/PB (e.g. 50, 100, 200, 400, 600, and 800 mg/ml of each component), as well as 6 μg/ml PB, to determine optimal amounts. Generate polymer complexes as described in Part 4, below.
- Day 3. Remove virus-containing medium and replace with fresh medium. Return the plates to a humidified incubator.
- Day 5. Analyze FACS plate to determine the transduction efficiency with each polymer concentration.
- Day 6. Remove the medium from all wells of the MTT plate and replace with 100 μl MTT solution (1 mg/ml MTT in complete medium). Culture for three hours in a humidified incubator to allow MTT to be reduced in the mitochondria of metabolically active cells.
- Remove MTT solution and replace with 200 ml MTT solvent (0.1 N HCl, 0.1% Igepal CA-630 in isopropanol).
- Incubate for two hours at room temperature or until all of the purple MTT formazan precipitate is dissolved. Read the absorbance on a microplate reader at 570 nm, subtracting the background reading at 690 nm.
- Select the optimal polymer concentration that produces maximum enhancement of transduction, as determined by FACS, with minimal effect on metabolic activity, as determined by MTT. For HDFs, we selected 100 μg/ml CS/PB based on the data shown in the Representative Results, below.
4. Ecotropic transduction with polymer complexation
- Prepare sterile-filtered stock solutions of PB and chondroitin sulfate at 20 mg/ml in water. Aliquot and store at -20°C.
- Pipette viral supernatant into a microcentrifuge tube and dilute to the desired final concentration (e.g. MOI of 2) with fresh culture medium. Add equal volumes of PB and chondroitin sulfate (concentrations determined in step 3 above) in succession, flicking the tube to mix after each addition. The viral mixture will immediately become cloudy as precipitates form. Incubate the viral mixture at room temperature for 5 minutes to allow complex formation.
- Remove media from the receptor-expressing target cells, replace with the viral mix, and incubate overnight at 37°C, 5% CO2. After removing the viral mix, wash the surface of the cells twice with PBS to aid in removing viral complexes. Complete removal is not necessary; we have observed no adverse effects on cell health from residual polymer complexes.
5. Verifying specificity of ecotropic transduction
- When producing ecotropic virus for the first time, it is prudent from a safety perspective to verify that the virus is unable to transduce unmodified human cells. Transduce human cells with ecotropic lentivirus at relatively high concentration (only a 1 to 2-fold dilution of viral supernatant in fresh medium) overnight with 6 μg/ml PB or optimized CS/PB concentration.
- Remove virus-containing medium and replace with fresh medium. After incubating cells for 2 days, validate transgene expression by FACS using fluorescent vectors and/or by RT-PCR with transgene-specific primers.
6. Representative results:
Fig. 1A shows the lentivirus production process, and Fig. 1B shows transduction of human cells with ecotropic lentivirus, including pre-transduction with murine retrovirus receptor Slc7a1. For titering virus, we use a human rhabdomyosarcoma cell line stably transduced with Slc7a1 (Slc-hRMS). When using fluorescent control vectors to monitor transduction efficiency, we routinely achieve > 90% transduction efficiency of Slc-hRMS with ecotropic virus, as shown in Fig. 2A and 2B. Transduction rates of HDFs are generally lower because the cells have not been blasticidin-selected for receptor expression (Fig. 2C). Titers of ecotropic lentivirus are generally 10-20% of VSV-pseudotyped virus when measured on Slc-hRMS (Fig. 2D).
One freeze-thaw cycle reduces titer of ecotropic virus by 16 - 3%, equal to titer loss during a single freeze-thaw cycle of VSV-pseudotyped virus (p > 0.05). Contrary to previous reports,2 we observe no positive effect on virus titer from flash freezing in dry ice. Rather, we achieve higher post-thaw titers of either pseudotype by simply placing tubes of virus into a -80°C freezer (data not shown).
The MTT viability assay allows sensitive detection of growth arrest in target cells. Transduction with virus plus concentrations of CS/PB up to 800 μg/ml has no effect on HDF metabolism (Fig. 3A). Exposure to CS/PB without virus also has no toxic effect on cells (data not shown). FACS analysis of HDFs transduced with virus plus various concentrations of CS/PB shows enhancement of transduction compared to PB alone (Fig. 3B). The maximum enhancement occurs at 100 μg/ml CS/PB (Fig. 3C), several-fold lower than previously reported values.3 Thus, it is important to optimize conditions for any given target cell type.
Complexation with CS/PB enhances the observed titer roughly 3-fold in Slc-hRMS (Fig. 4A, p < 0.01). In practice, this yields a greater effect on transduction efficiency at low virus concentrations than at higher concentrations (Fig. 4B), which is most likely due to multiply transduced cells and receptor saturation at higher virus concentrations.
Transduction with ecotropic virus is specific for cells expressing murine retrovirus receptor. When transducing unmodified human cells with ecotropic virus, we have not observed fluorescence greater than the untransduced background whether using PB or CS/PB, as shown in Fig. 5A. Microscopically, HDFs show no transduction in the absence of receptor (Fig. 5B) while pre-transduction with receptor results in fluorescent cells (Fig. 5C).
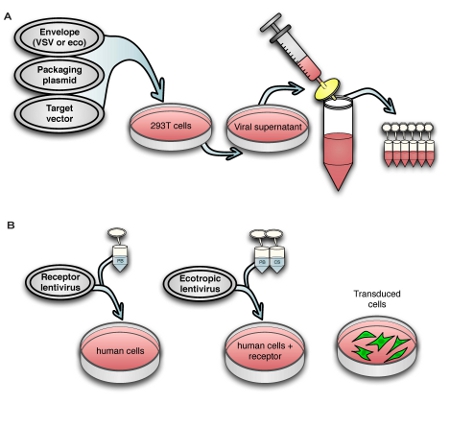
Figure 1. Schematic view of (A) the virus production process and (B) transduction of human cells with murine retrovirus receptor followed by ecotropic lentivirus.
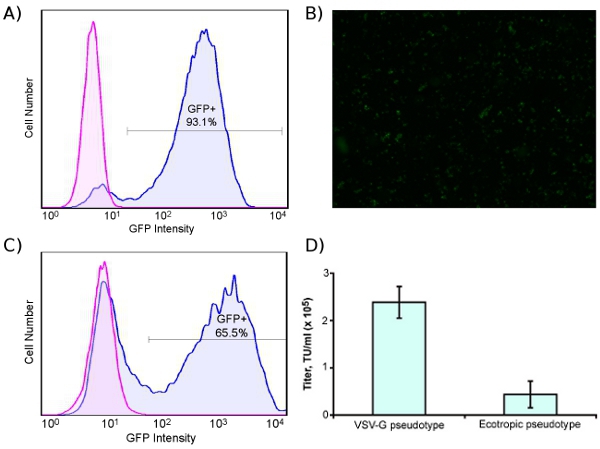
Figure 2. High-efficiency transduction of human cells with ecotropic lentivirus encoding GFP. Cells were pre-transduced with murine retrovirus receptor Slc7a1. (A) Human rhabdomyosarcoma cell line blasticidin-selected for Slc7a1 (Slc-hRMS), transduced (blue) or untransduced (pink) with GFP. (B) Fluorescent micrograph of ecotropic-transduced Slc-hRMS (4X). (C) HDFs transduced (blue) and untransduced (pink) with ecotropic GFP lentivirus; cells were transduced with Slc7a1 two days prior to ecotropic transduction. (D) Titer of VSV-G pseudotyped and ecotropic lentivirus, measured on Slc-hRMS.
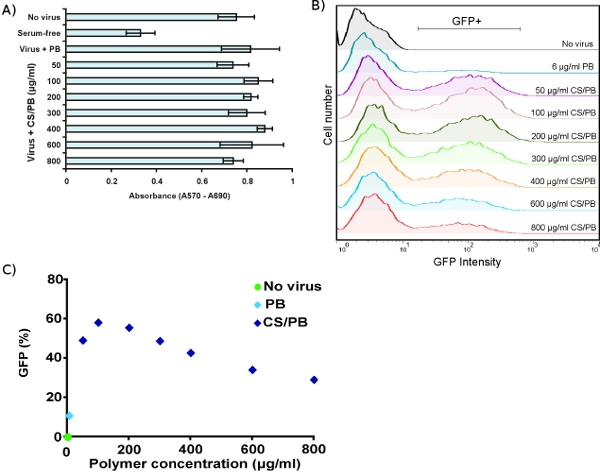
Figure 3. Optimizing chondroitin sulfate/polybrene (CS/PB) concentrations in human dermal fibroblasts. (A) Viability of HDFs measured by MTT assay after transduction in the presence of PB only or with varied concentrations of CS/PB. (B) Enhancement of transduction efficiency in HDFs by different concentrations of CS/PB, measured by FACS. (C) Quantification of transduction enhancement, showing that maximum transduction occurs at 100 μg/ml CS/PB.
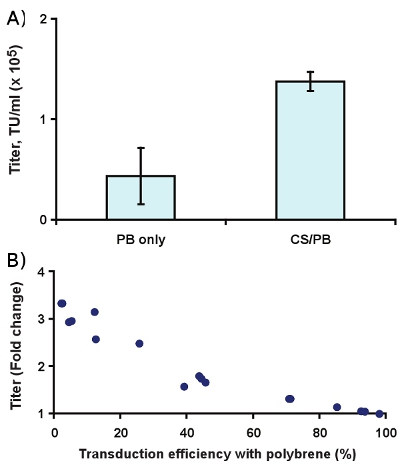
Figure 4. Effect of 400 μg/ml CS/PB on transduction of Slc-hRMS with ecotropic lentivirus. (A) Titer enhancement, and (B) fold change in transduction rate compared to 6 μg/ml polybrene alone.
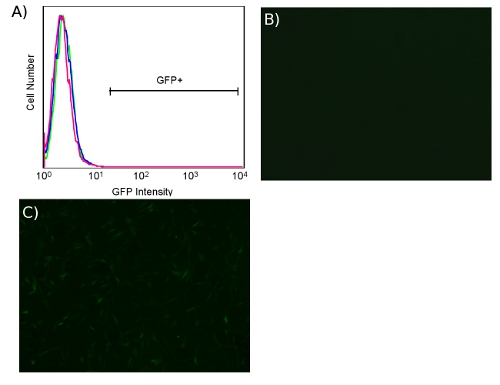
Figure 5. Lack of ecotropic transduction of HDFs in the absence of murine retrovirus receptor Slc7a1. (A) FACS plot of BJ human fibroblasts, untransduced (pink) or transduced (blue) with ecotropic GFP lentivirus in both cases in the absence of receptor Slc7a1. BJ human fibroblasts transduced with ecotropic GFP lentivirus, without (B) and with (C) pre-transduction with receptor Slc7a1 (4X).
Diskussion
Rekombinante ecotropen gammaretrovirus auf Moloney Maus-Leukämie-Virus (MLV) und sein Rezeptor mSlc7a1 Basis sind gut untersucht und überall erhältlich, mit mehr als 20 Jahren verwendet worden, um Transgenen auf murine Zellen liefern. Ecotropen gammaretrovirus wurde auch in jüngerer Zeit, um Onkogene, menschliche Zellen zu liefern verwendet;. Im Rahmen der Reprogrammierung, die Verwendung von mSlc7a1 zu Generation amphotropen Virus beherbergen menschlichen Onkogene zu vermeiden, ist gut etabliert 4,5 Allerdings sieht Lentivirus erhebliche Vorteile gegenüber gammaretrovirus in transduzierenden feuerfesten Zellpopulationen, 6 einschließlich Primärzellen, die oft wünschenswert, Ziele für die Neuprogrammierung, weil die lentiviralen Präintegrationskomplexes ermöglicht Transduktion von nicht-teilenden Zellen. 7
Lentiviren haben mit Dutzenden von verschiedenen Pseudotypen, einschließlich MLV, in dem Bemühen, Virus Tropismus, Toxizität und andere Eigenschaften. 8 MLV-pseudotypisiert ecotropen Lentivirus wurde verwendet, um Zellen der Maus, 9 transduzieren, hat aber nur selten auf menschliche Zellen verwendet worden verändern produziert . 10 Wir schlagen daher die Verwendung von MLV-pseudotypisiert ecotropen Lentivirus als eine sichere, kostengünstige und hocheffiziente Fahrzeug bekannter oder vermuteter Onkogene, einschließlich der Reprogrammierung Faktoren, die menschliche Zellen zu liefern.
Es ist wichtig zu beachten, dass dieses Protokoll nicht vollständig beseitigen die Notwendigkeit zu produzieren und zu nutzen pantropic Lentivirus, sondern trennt dieses Protokoll das Onkogen (s) aus dem pantropic Virus, isolierende Forscher vor möglichen Selbst-Impfung mit dem Krebs-verwandten Viren. Das Protein mSlc7a1 und seine menschliche Homolog hSlc7a1 sind ubiquitär Aminosäure-Transporter ohne bekannte Tumorigenität oder Fähigkeit, ein selektives Wachstum Vorteil Empfänger-Zellen übertragen, 11 machen mSlc7a1 von relativ geringem Risiko für den Einbau in amphotrope Virus exprimiert. Dieser zusätzliche Schritt kann besonders nützlich in Labors fehlen gewidmet Virus oder Gewebekultur Einrichtungen der erforderlichen Sicherheitsstufe.
In manchen Situationen kann es möglich sein, vollständig zu eliminieren die Verwendung von pantropic Virus durch Transfektion der Slc7a1 Plasmid direkt in Zielzellen, jedoch sind viele Zellen, die nützliche Ziele dieser Technik werden auch feuerfeste der Transfektion. Als Alternative, die Fähigkeit zu isolieren Slc7a1-transduzierten Zellen durch Blasticidin Auswahl bedeutet, dass VSV-G pseudotypisiert Lentivirus einmal verwendet werden kann, um einen Bestand von Rezeptor-exprimierenden Zellen, nach denen ecotropen Virus routinemäßig eingesetzt werden können, um diese Zellen für viele transduzieren generieren Experimente. Forscher sollten immer nach ihrer institutionellen Sicherheit Richtlinien für die Arbeit mit einem Lentivirus, unabhängig von ihrer Tropismus.
Titer ecotropen Virus mit diesem Protokoll erreicht werden moderat niedriger als VSV-pseudotypisiert Virus, in der Regel 10-20% des pantropic Virustiter, in Übereinstimmung mit früheren Studien. 9 Diese Titer in menschlichen Zellen wurden gemessen stabil transduzierten mit Slc7a1, so dass die unteren beobachtet Titer für ecotropen Virus kann teilweise durch vielseitige Ausdruck der Rezeptor-Gen in die Zielzellen. Dennoch sind die viralen Titer in unserem Protokoll erreicht mehr als ausreichend für die meisten Anwendungen und führen zu Transduktion der Mehrzahl der Zellen, in einigen Fällen> 90% der Zellen.
Centrifugation-basierte Techniken werden häufig verwendet, um virale Partikel zu konzentrieren. Allerdings erfordert Zentrifugation mehrere Stunden, erzeugt infektiöse Aerosole, und kann zu einem erheblichen Verlust der viralen Partikel führen. 12 Als Alternative Komplexierung mit CS / PB kann zur Transduktion ohne dass virale Tropismus zu verbessern. 3 Diese Methode ist schnell (5 Minuten ) und preisgünstig ($ 0,03 pro 10 ml-Virus), während etwa einer Verdreifachung der beobachteten Titer. Keine besondere Ausrüstung oder proprietären Reagenzien erforderlich sind, und wir beobachteten minimal akuten Toxizität nach der Exposition des HDF zu CS / PB, in Übereinstimmung mit früheren Arbeiten in anderen Zelllinien. 13 Ein potenzieller Nachteil dieses Protokolls ist, dass einige mikroskopisch sichtbare Polymer-Komplexe zu halten die Zellen für mehrere Tage in Kultur. Wir können nicht ausschließen, dass diese Komplexe, die zwar nicht offen toxisch auf die Zellen, können subtilere Effekte auf zellulärer Prozesse haben.
Hier haben wir eine Methodik zur sicheren und effizienten Transduktion humaner Zellen mit onkogenen Faktoren beschrieben. Dieser Ansatz sollte von großem Nutzen für Forscher studieren Onkogene und Stammzellbiologie einschließlich iPS-Zellen sein.
Offenlegungen
Danksagungen
Die Finanzierung für dieses Projekt wurde von der California Institute for Regenerative Medicine zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
|---|---|---|---|
| pLenti6/UbC/mSlc7a1 | Addgene | 17224 | Murine MLV-Rezeptor |
| pMD2.G | Addgene | 12259 | VSV-G Umschlag |
| pCMV-dR8.91 | D. Trono Labor 14 | Packaging-Plasmid (entspricht Plasmid psPax2 ist ab Addgene, Cat. Anzahl 12260) | |
| pHCMV-EcoEnv | Addgene | 15802 | Ecotropen Umschlag |
| FUGW | Addgene | 14883 | GFP Kontroll-Plasmid |
| OptiMEM | Invitrogen | 31985 | |
| Fugene HD | Roche | 04 709 705 001 | |
| Hexadimethrinbromid (Polybrene) | Sigma-Aldrich | H9268 | |
| Chondroitinsulfat Natriumsalz aus Haifischknorpel | Sigma-Aldrich | C4384 | |
| Blasticidin S | Fischer | BP 2647100 | |
| Methylthiazolyldiphenyl-Tetrazolium Bromid (MTT) | Sigma-Aldrich | M2128 | |
| Igepal CA-630 | Sigma-Aldrich | I3021 |
Referenzen
- Davis, H. E., Rosinski, M., Morgan, J. R., Yarmush, M. L. Charged polymers modulate retrovirus transduction via membrane charge neutralization and virus aggregation. Biophys J. 86, 1234-1242 (2004).
- Marino, M. P., Luce, M. J., Reiser, J. Small- to large-scale production of lentivirus vectors. Methods Mol Biol. 229, 43-55 (2003).
- Landazuri, N., LeDoux, J. M. Complexation of retroviruses with charged polymers enhances gene transfer by increasing the rate that viruses are delivered to cells. J Gene Med. 6, 1304-1319 (2004).
- Ohnuki, M., Takahashi, K., Yamanaka, S. Generation and characterization of human induced pluripotent stem cells. Curr Protoc Stem Cell Biol. 4, 4A.2-4A.2 (2009).
- Hotta, A. EOS lentiviral vector selection system for human induced pluripotent stem cells. Nat Protoc. 4, 1828-1844 (2009).
- Reiser, J. Transduction of nondividing cells using pseudotyped defective high-titer HIV type 1 particles. Proc Natl Acad Sci U S A. 93, 15266-15271 (1996).
- Cullen, B. R. Journey to the center of the cell. Cell. 105, 697-700 (2001).
- Cronin, J., Zhang, X. Y., Reiser, J. Altering the tropism of lentiviral vectors through pseudotyping. Curr Gene Ther. 5, 387-398 (2005).
- Schambach, A. Lentiviral vectors pseudotyped with murine ecotropic envelope: increased biosafety and convenience in preclinical research. Exp Hematol. 34, 588-592 (2006).
- Koch, P., Siemen, H., Biegler, A., Itskovitz-Eldor, J., Brustle, O. Transduction of human embryonic stem cells by ecotropic retroviral vectors. Nucleic Acids Res. 34, e120-e120 (2006).
- Yoshimoto, T., Yoshimoto, E., Meruelo, D. Molecular cloning and characterization of a novel human gene homologous to the murine ecotropic retroviral receptor. Virology. 185, 10-17 (1991).
- Cepko, C. Large-scale preparation and concentration of retrovirus stocks. Curr Protoc Mol Biol. Chapter 9, Unit 9.12-Unit 9.12 (2001).
- Doux, J. M. L. e., Landazuri, N., Yarmush, M. L., Morgan, J. R. Complexation of retrovirus with cationic and anionic polymers increases the efficiency of gene transfer. Hum Gene Ther. 12, 1611-1621 (2001).
- Zufferey, R. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J Virol. 72, 9873-9880 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten