Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung, Reinigung und Charakterisierung von Lanthanoidkomplexe für die Verwendung als Kontrastmittel für die Magnetresonanz-Tomographie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir zeigen die Metallierung, Reinigung und Charakterisierung von Lanthanoid-Komplexen. Die hier beschriebenen Komplexe können konjugiert werden, um Makromoleküle, damit diese Rückverfolgung Moleküle mittels Magnetresonanztomographie.
Zusammenfassung
Polyaminopolycarboxylate-Liganden werden häufig verwendet, um Lanthanidionen Chelat, und die resultierenden Komplexe eignen sich als Kontrastmittel für die Kernspintomographie (MRI). Viele im Handel erhältliche Liganden sind besonders nützlich, da sie funktionelle Gruppen, die für schnelle, hochreine ermöglichen, und mit hoher Ausbeute Konjugation an Makromolekülen und Biomolekülen über aminreaktiven aktivierten Estern und Isothiocyanat-Gruppen oder Thiol-reaktive Maleinimide enthalten. Während Metallierung dieser Liganden wird als allgemein bekannt, im Bereich der Biokonjugation Chemie, subtile Unterschiede in Metallierung Verfahren müssen berücksichtigt werden bei der Auswahl Metall Ausgangsstoffe. Darüber hinaus mehrere Optionen für die Reinigung und Charakterisierung existieren, und die Auswahl der effektivsten Verfahren teilweise abhängig von der Auswahl der Ausgangsstoffe. Diese feinen Unterschiede sind oft in veröffentlichten Protokollen vernachlässigt. Hier ist es unser Ziel, gemeinsame Methoden für die Metallierung, Reinigung und Charakterisierung von Lanthanoid-Komplexe, die als Kontrastmittel für die MRT (Abb. 1) verwendet werden können demonstrieren. Wir erwarten, dass diese Publikation ermöglicht biomedizinische Wissenschaftler Lanthanoid Komplexierung Reaktionen in ihr Repertoire von häufig verwendeten Reaktionen integrieren durch Lockerung der Auswahl der Ausgangsstoffe und Reinigungsverfahren.
Protokoll
1. Metallierung mit LnCl 3 Salze
- Lösen des Liganden in Wasser zu einer Lösung von 30-265 mm. Die Liganden 2 - (4-isothiocyanatobenzyl)-Diethylentriaminpentaessigsäure (p-SCN-Bn-DTPA) wurde in diesem Video bei einer Konzentration von 73 mM verwendet.
- Den pH-Wert der Lösung von Ligand zwischen 5,5 und 7,0 durch Zugabe von 1 M NH 4 OH. In diesem Video wurden 0,2 ml der 1 M NH 4 OH-Lösung verwendet.
- Lösen Sie 1-2 Äquivalente der LnCl 3 in Wasser zu einer Lösung mit einer Konzentration von 5-1000 mm herzustellen. In diesem Video wurden EuCl 3 und GdCl 3 in Konzentrationen von 111 mM verwendet. Ein Überschuss an Metall wird häufig verwendet, um die Metallierung zum Abschluss zu bringen und damit zu vereinfachen Reinigung.
- Fügen Sie die Lösung von LnCl 3 zur Lösung des Liganden unter Rühren.
- Nach der Zugabe von LnCl 3, den pH-Wert der resultierenden Reaktionsmischung auf zwischen 5,5 und 7,0 durch Zugabe von 0,2 M NH 4 OH. Insgesamt 0,5 ml der 0,2 M NH 4 OH-Lösung wurde in diesem Video verwendet. Wenn Ihr Liganden enthält säureempfindlichen funktionellen Gruppen, den pH-Wert mehrmals während dieses Schrittes. ACHTUNG - Wird die Lösung zu einfach, jede Basis sensitive funktionelle Gruppen, wie Isothiocyanat wird unbrauchbar für die Konjugation werden.
- Überwachen Sie die Reaktion über pH-Messungen. Die Reaktion ist beendet, wenn der pH-Wert konstant bleibt.
2. Raising pH Aufarbeitung (nicht in diesem Video enthalten, aber gut für Liganden ohne Sockel-sensitive funktionelle Gruppen)
- Fügen Sie konzentrierte NH 4 OH auf die Reaktionsmischung auf pH-Wert von ≥ 11 einzustellen. Dieser Schritt wird jeder Niederschlag unkomplexierten Metall als unlösliches Hydroxid.
- Den Überstand durch einen 0,2 um Filter. Wenn die Reaktionsmischung verstopft den Filter, Zentrifugieren und Dekantieren vor dem Filtern wird empfohlen.
- Wenn eine Dialyse nicht durchgeführt werden, entfernen Sie unter vermindertem Druck (Rotationsverdampfer oder Gefriertrocknung wird empfohlen) Lösungsmittel.
- Steps 2,1-2,3 kann wiederholt werden, wenn freie Lanthanoid bleibt.
3. Dialyse Aufarbeitung
- Schneiden Sie den Dialyseschlauch auf eine geeignete Länge (folgen Sie den Richtlinien des Herstellers), um das Probenvolumen zu halten, während verlassen Überlänge (ca. 10% des Probenvolumens). In diesem Video wurde eine 100-500 Dalton Molekulargewicht cut-off (MWCO) Membran verwendet, aber auch größere MWCO Schlauch kann nach Bedarf verwendet werden, wenn Konjugation ist vor Metallierung durchgeführt. Außerdem können Dialyse-Kassetten als Alternative zum Dialyseschlauch wenn gewünscht verwendet werden.
- Gegebenenfalls basierend auf den Richtlinien des Herstellers, genießen den Schnitt Dialyseschlauch in Wasser 15 min bei Raumtemperatur.
- Füllen Sie ein Dialyse-Reservoir (a 1 L Becherglas wurde in diesem Video verwendet wird) mit Wasser (Dialysat). Das Dialysat Volumen sollte ca. 100x, dass der Probe sein.
- Falten Sie das eine Ende des Schlauchs zweimal und sichern Sie den gefalteten Teil des Schlauches mit einer Dialyse Verschluss spannen. Wickeln Sie das Ende des Verschlusses mit einem Gummiband um sicherzustellen, dass es während der Dialyse bleibt geschlossen.
- Filter das Reaktionsgemisch durch einen 0,2 um Filter, und laden Sie das Filtrat in das offene Ende des Schlauches darauf achten, daß die Schläuche zerreißen. Achten Sie darauf, genügend Kopfraum zu verlassen, um den Schlauch zu schließen.
- Falten Sie die verbleibenden offenen Ende des Rohres zweimal mit einem Verschluss zu sichern, und wickeln Sie den Verschluss mit einem Gummiband wie in Schritt 3.4.
- Bringen Sie ein Glasfläschchen mit Luft, um die Klemme an einem Ende der Dialyseschlauch mit einem Gummiband. Bringen Sie ein Fläschchen mit Sand auf die andere Klemme. Diese Fläschchen sicher, dass der Schlauch in das Dialysat bleibt eingetaucht.
- Stellen Sie den vollen Rohren in der Dialyse-Reservoir, das Dialysat enthält.
- Stir das Dialysat mit einer magnetischen Rührplatte mit langsamer Geschwindigkeit (kein Vortex) bei Raumtemperatur.
- Ändern Sie den Dialysat 3x im Laufe eines Tages (in diesem Video, das Dialysat wurde mit 2,5, 6,5 und 11,5 h geändert), und dann lassen Dialyse weiterhin über Nacht (für insgesamt von 20-28 h Dialyse).
- Entfernen Sie den Dialyseschlauch aus dem Dialysat und vorsichtig öffnen Sie eine Schließung auf die Probe zu entfernen. Waschen Sie den Dialyseschlauch 3x mit Wasser und kombinieren das Waschwasser mit der Probe.
- Entfernen Sie das Wasser unter vermindertem Druck. Bei der Gefriertrocknung wird in diesem Video verwendet.
4. Bewertung der Anwesenheit von freiem Metall
- Lösen Sie die Metall-Komplex in Acetatpuffer (Puffer Zubereitung: Lösen Sie 1,4 ml Essigsäure in 400 ml Wasser, den pH-Wert auf 5,8 mit 1 M NH 4 OH, und Wasser bis zu einem Gesamtvolumen von 500 mL produzieren) und fügen Sie die Xylenol orange Anzeige (16 uM in pH 5,8-Puffer). In diesem Video, betrug 0,3 mg Komplex in 0,3 ml Puffer gelöst und 3 ml Indikator-Lösung versetzt.
- Das Vorhandensein von freiem Metall durch Beobachtung einer Farbänderung des Indikators von gelb bis violett.
- Falls gewünscht, kann die Menge des freien Metall durch die Schaffung einer Kalibrierkurve 1 quantifiziert werden. Alternativ kann der Farbstoff Arsenazo III statt Xylenolorange 2 verwendet werden. Wenn freies Metall bleibt, sollte die Probe weiter gereinigt werden mittels Dialyse, ein Entsalzungssäule oder High-Performance Liquid Chromatography (HPLC) vor Charakterisierung.
5. Bestimmung der Wasser-Koordinationszahl (q)
- Bereiten Sie eine Lösung der Eu III-haltigen Komplex (~ 1 mm) in H 2 O und eine andere Lösung der gleichen Konzentration in D 2 O. Vor der Analyse muss die D 2 O-Lösung verdampft und gelöst in D 2 O dreimal um das restliche H 2 O. entfernen
- Fügen Sie die Wasser-Lösung, um eine saubere Küvette, und setzen Sie die Küvette in einem Spektrofluorometer.
- Führen Anregungs-und Emissions-Scans, um die Maxima für jede (~ 395 nm und ~ 595 nm, jeweils) zu bestimmen.
- Führen Sie eine Phosphoreszenz Zeit-Zerfall Experiment mit folgenden Parametern: Anregungs-und Emissionswellenlänge von Schritt 5.3, Anregung und Emission Spaltbreiten (5 nm), Flash-count (100), anfängliche Verzögerung (0,01 ms), maximale Verzögerung (13 ms) bestimmt und Verzögerungsinkrement (0,1 ms). Diese Bedingungen sind für die meisten Komplexe, aber die maximale Verzögerung und den inkrementellen Werten kann erhöht oder verringert werden für Arten mit sehr langen oder sehr kurzen Abklingzeiten.
- Wiederholen Sie Schritt 5.4 mit der D 2 O-Lösung in Schritt 5.1 vorbereitet.
- Von der Lumineszenz-Zerfall Daten in 5,4 und 5,5 erhalten, Grundstück den natürlichen Logarithmus der Intensität als Funktion der Zeit. Die Steigung dieser Geraden sind die Abbauraten (τ -1) (Abbildung 2). In diesem Video wurde Microsoft Excel 2007 verwendet werden, um den natürlichen Logarithmus Plots aus den Rohdaten zu generieren. Verwenden Sie die Abbauraten in der Gleichung von Horrocks und Mitarbeiter (eq 1) 3 entwickelt. Wenn Ihr Liganden enthält OH-oder NH-Gruppen koordiniert, um das Metall, dann ist die Gleichung müssen vor Gebrauch 3 geändert werden.
eq 1: 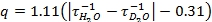
6. Relaxivität Messungen
- Wählen Sie die gewünschte Anwendung Modus auf die Relaxationszeit Analysator: T 1 (longitudinale Relaxationszeit) oder T 2 (transversale Relaxationszeit).
- Eine Reihe von Proben, die verschiedene Konzentrationen von Gd III-haltigen Komplex in einem wässrigen Lösungsmittel enthalten. In diesem Video wurde Wasser als Lösungsmittel und Lösungen von 10,0, 5,00, 2,50, 1,25, 0,625 verwendet, und 0 mM hergestellt wurden. Andere wässrigen Lösungsmitteln oder Puffer könnte verwendet werden, aber es ist wichtig, um das Lösungsmittel als Blindwert verwendet. Das endgültige Volumen der Probe ist spezifisch für das Instrument, das verwendet wird.
- Legen Sie eine Probe in das Instrument und lassen es 5 min stehen lassen, um die Temperatur des Gerätes (37 ° C in diesem Video) ausgleichen.
- Bestimmen Sie die Relaxationszeit (in Einheiten von s) durch Anpassung der Parameter der Software, um einen reibungslosen exponentiellen Kurve für T 1 oder T 2 (repräsentative Kurven für T 1 und T 2 sind in Abbildung 3 dargestellt) zu erhalten.
- Wiederholen Sie die Schritte 6.3 und 6.4 für alle Proben, einschließlich der leeren.
- Berechnen Sie die inverse der gemessenen T 1 oder T 2-Werte in Einheiten von s -1.
- Zeichnen Sie die T 1 -1 oder T 2 -1 Werte im Vergleich zu Gd III-Konzentration (in Einheiten von mM). Wegen der hygroskopischen Natur der Gd III-Komplexe, bestätigen die Konzentration von Gd III mit Atomabsorptionsspektrometrie oder induktiv gekoppelten Plasma-Massenspektrometrie. Fit das Grundstück mit einer geraden Linie. Ein Vertreter Grundstück ist in Abbildung 4 dargestellt.
- Die Steigung der angepassten Linie ist die Relaxivität (r 1 oder r 2 für T 1 und T 2), gegliedert und verfügt über Einheiten mM -1 s -1.
7. Repräsentative Ergebnisse
Repräsentative Daten für die Schritte in diesem Protokoll sind in den Tabellen und Abbildungen Abschnitt aufgenommen worden. Neben der Wasser-Koordinationszahl und Relaxivität Charakterisierung in das Protokoll beschrieben, ist es wichtig, Endprodukte mit Standard-chemischen Verfahren zu charakterisieren. Die Identität der Verbindung kann mithilfe der Massenspektrometrie und Vertreter Massenspektren zeigen die diagnostischen Isotopenmuster für Gd III - und Eu III-haltige Komplexe sind in Abbildung 5 dargestellt. Darüber hinaus, für Nicht-Gd III Lanthanoid-Komplexe können NMR-Spektroskopie zur Identifizierung des Produkts verwendet werden. Um die Reinheit des Komplexes, HPLC oder Elementaranalyse zu charakterisieren oder beides verwendet werden kann.
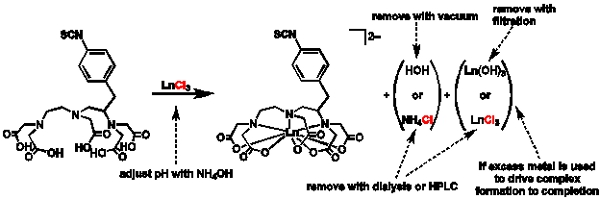
Abbildung 1 Allgemeine Regelung für die Metallierung und Reinigung:. Scheme Darstellung der allgemeinen Vorschrift zur Metallierung und Gründe für die Wahl verschiedener Reinigungsverfahren Routen.
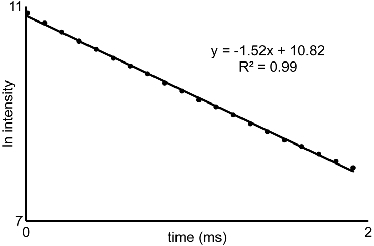
Abbildung 2 Lumineszenz-Intensität Grundstück:. Representative Auftragung des natürlichen Logarithmus der Intensität als Funktion der Zeit aus Abschnitt 5. Die Steigungen der Linien von ähnlichen Kurven für Wasser-und D 2 O-Lösungen erworben generiert werden mit eq 1 verwendet, um das Wasser-Koordination Reihe von EU-III-haltige Komplexe zu charakterisieren.

Abbildung 3 Entspannung Abklingzeit Kurven:. Repräsentative Daten für (links) T 1 und (rechts) T 2 Erwerb. Abweichungen von diesen Kurvenformen erzeugen würde unzuverlässige Daten.

Abbildung 4 Relaxivität Bestimmung:. Ein Vertreter Auftragung von 1 / T 1 gegen die Konzentration von Gd III. Die Steigung der angepassten Linie ist Relaxivität und hat Einheiten mM -1 s -1.

Abbildung 5 Massenspektren:. Representative Massenspektren zeigen die diagnostischen Isotopenmuster für (links) Gd III-haltige Komplexe und (rechts) Eu III-haltige Komplexe. Der schwarze Gaussian Spitzen geben die theoretischen Isotopenverteilung und die roten Linien sind die eigentlichen Daten.
Diskussion
Angesichts der zunehmenden Zahl von Publikationen, die Lanthanoid-basierte Kontrastmittel 4-14 zählen, ist es wichtig, dass Pflege in der Vorbereitung, Reinigung und Charakterisierung von Produkten, um reproduzierbare und vergleichbare Ergebnisse zu gewährleisten, wird übernommen. Diese Komplexe werden oft als schwierig zu reinigen und zu charakterisieren gegenüber organischen Molekülen aufgrund ihrer paramagnetischen Natur und die Empfindlichkeit eines funktionellen Gruppen, die für Biokonjugation verw...
Offenlegungen
Danksagungen
Wir danken Anschubfinanzierung von der Wayne State University (MJA), einen Zuschuss von der American Foundation for Aging Research (SMV) und ein Pathway to Independence Career Transition Award (R00EB007129) aus dem National Institute of Biomedical Imaging and Bioengineering der National Institutes of Health (MJA).
Materialien
| Name | Company | Catalog Number | Comments |
| Reagenzien und Geräte | Firma | Katalog-Nummer | |
|---|---|---|---|
| EuCl 3 • 6 H 2 O | Sigma-Aldrich | 203254-5G | |
| p-SCN-Bn-DTPA | Makrocyclen | B-305 | |
| Ammoniumhydroxid | EMD | AX1303-3 | |
| Spectra / Por Biotech Cellulose-Ester (CE) Dialysemembran - 500 D MWCO | Fisher Scientific | 68-671-24 | |
| Millipore IC Millex-LG Filter Units | Fisher Scientific | SLLG C13 NL | |
| Xylenolorange Tetranatriumsalz | Alfa Aesar | 41379 | |
| Essigsäure | Fluka | 49199 | |
| D 2 O | Cambridge Isotope Laboratories, Inc. | DLM-4-25 | |
| Wasserreiniger | ELGA | Purelab Ultra- | |
| Hochleistungs-Flüssigkeits-Chromatographie und Massenspektrometrie | Shimadzu | LCMS-2010EV | |
| Relaxationszeit Analysator | Bruker | mq60 minispec | |
| UV-VIS Spektralphotometer | Fisher Scientific | 20-624-00092 | |
| Gefriertrockner | Fisher Scientific | 10-030-133 | |
| pH-Meter | Hanna Instruments | HALLO 221 | |
| Spektrofluorometer | HORIBA Jobin Yvon | Fluoromax-4 | |
| Molecular Weight Calculator Version 6,46 von Matthew Monroe, 17. Oktober 2009 heruntergeladen | http://ncrr.pnl.gov/software/ | Molecular Weight Calculator |
Referenzen
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1, 184-188 (2006).
- Nagaraja, T. N., Croxen, R. L., Panda, S., Knight, R. A., Keenan, K. A., Brown, S. L., Fenstermacher, J. D., Ewing, J. R. Application of arsenazo III in the preparation and characterization of an albumin-linked, gadolinium-based macromolecular magnetic resonance contrast agent. J. Neurosci. Methods. 157, 238-245 (2006).
- Supkowski, R. M., Horrocks, W. D. On the determination of the number of water molecules, q, coordinated to europium(III) ions in solution from luminescence decay lifetimes. Inorg. Chim. Acta. 340, 44-48 (2002).
- Menjoge, A. R., Kannan, R. M., Tomalia, D. A. Dendrimer-based drug and imaging conjugates: design considerations for nanomedical applications. Drug Discovery Today. 15, 171-185 (2010).
- Que, E. L., Chang, C. J. Responsive magnetic resonance imaging contrast agents as chemical sensors for metals in biology and medicine. Chem. Soc. Rev. 39, 51-60 (2010).
- Uppal, R., Caravan, P. Targeted probes for cardiovascular MR imaging. Future Med. Chem. 2, 451-470 (2010).
- Major, J. L., Meade, T. J. Bioresponsive, cell-penetrating, and multimeric MR contrast agents. Acc. Chem. Res. 42, 893-903 (2009).
- Datta, A., Raymond, K. N. Gd-hydroxypyridinone (HOPO)-based high-relaxivity magnetic resonance imaging (MRI) contrast agents. Acc. Chem. Res. 42, 938-947 (2009).
- León-Rodríguez, L. M. D., Lubag, A. J. M., Malloy, C. R., Martinez, G. V., Gillies, R. J., Sherry, A. D. Responsive MRI agents for sensing metabolism in vivo. Acc. Chem. Res. 42, 948-957 (2009).
- Castelli, D. D., Gianolio, E., Crich, S. G., Terreno, E., Aime, S. Metal containing nanosized systems for MR-molecular imaging applications. Coord. Chem. Rev. 252, 2424-2443 (2008).
- Caravan, P., Ellison, J. J., McMurry, T. J., Lauffer, R. B. Gadolinium(III) chelates as MRI contrast agents: structure, dynamics, and applications. Chem. Rev. 99, 2293-2352 (1999).
- Lauffer, R. B. Paramagnetic metal complexes as water proton relaxation agents for NMR imaging: theory and design. Chem. Rev. 87, 901-927 (1987).
- Yoo, B., Pagel, An overview of responsive MRI contrast agents for molecular imaging. Front. Biosci. 13, 1733-1752 (2008).
- Pandya, S., Yu, J., Parker, D. Engineering emissive europium and terbium complexes for molecular imaging and sensing. Dalton Trans. 23, 2757-2766 (2006).
- Nwe, K., Xu, H., Regino, C. A. S., Bernardo, M., Ileva, L., Riffle, L., Wong, K. J., Brechbiel, M. W. A new approach in the preparation of dendrimer-based bifunctional diethylenetriaminepentaacetic acid MR contrast agent derivatives. Bioconjugate Chem. 20, 1412-1418 (2009).
- Nwe, K., Bernardo, M., Regino, C. A. S., Williams, M., Brechbiel, M. W. Comparison of MRI properties between derivatized DTPA and DOTA gadolinium-dendrimer conjugates. Bioorg. Med. Chem. 18, 5925-5931 (2010).
- Caravan, P., Das, B., Deng, Q., Dumas, S., Jacques, V., Koerner, S. K., Kolodziej, A., Looby, R. J., Sun, W. -. C., Zhang, Z. A lysine walk to high relaxivity collagen-targeted MRI contrast agents. Chem. Commun. , 430-432 (2009).
- León-Rodríguez, L. M. D., Kovacs, Z. The synthesis and chelation chemistry of DOTA-peptide conjugates. Bioconjugate Chem. 19, 391-402 (2008).
- Boswell, C. A., Eck, P. K., Regino, C. A. S., Bernardo, M., Wong, K. J., Milenic, D. E., Choyke, P. L., Brechbiel, M. W. Synthesis, characterization, and biological evaluation of integrin αVβ3-targeted PAMAM dendrimers. Mol. Pharm. 5, 527-539 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten