Method Article
High-und Low Throughput-Screens mit Wurzelknoten-Nematoden Meloidogyne spp.
In diesem Artikel
Zusammenfassung
Zwei verschiedene Methoden, um Bildschirm-Anlagen mit Wurzelknoten-Nematoden werden beschrieben. Die beschriebenen Ansätze sind in High-Throughput-Screens mit Nematoden in einer zerstörungsfreien Art und Weise zur Erleichterung der Nutzung dieser Pflanzen in Zuchtprogrammen.
Zusammenfassung
Wurzelknoten-Nematoden (Gattung Meloidogyne) sind obligat Pflanzenparasiten. Sie sind extrem polyphag und als eine der wirtschaftlich bedeutendsten Werk Nematoden. Die mikroskopische zweiten Stufe juvenile (J2), einmal im Ei gemausert, ist der infektiösen Stadium. Die J2S schlüpfen aus den Eiern, bewegen sich frei im Boden innerhalb von einem Wasserfilm, und suchen Sie Wurzelspitzen von geeigneten Pflanzenarten. Nach dem Durchdringen der Pflanzenwurzeln, sie gegenüber der vaskulären Zylinder migrieren, wo sie eine Futterstelle einzurichten und zu initiieren Fütterung mit ihrem Stilett. Die vielzelligen Futterstelle aus mehreren erweiterten mehrkernige Zellen, die sogenannten "Riesenzellen", die aus Zellen, die Karyokinese (wiederholte Mitose) ohne Zytokinese unterzog gebildet bestehen. Benachbarte Perizykel Zellen teilen und vergrößern in der Größe, die zu einer typischen Galle oder Root-Knoten, die charakteristische Symptom der Wurzel-Nematode Infektion. Nach Fütterung eingeleitet wird, werden J2S sesshaften und UNdergo drei weitere Häutungen, erwachsen zu werden. Die erwachsenen Weibchen legt 150-250 Eier in einer gallertartigen Matrix auf oder unterhalb der Oberfläche der Wurzel. Aus den Eiern schlüpfen neue infektiöse J2S und einen neuen Zyklus beginnen. Die Wurzel-Nematode Lebenszyklus wird in 4-6 Wochen bei 26-28 ° C abgeschlossen
Hier präsentieren wir die traditionellen Protokoll, um Pflanzen, in Töpfen gezogen, mit Wurzelknoten-Nematoden und zwei Methoden für die Hochdurchsatz-Assays zu infizieren. Die erste High-Throughput-Verfahren wird für Pflanzen mit kleinen Samen wie Tomaten verwendet, während der zweite ist für Pflanzen mit großen Samen wie Augenbohnen und gemeinsame Bohne. Große Samen unterstützen erweiterte Sämlingswachstum mit minimalem Nahrungsergänzungsmittel. Der erste Assay mit hohem Durchsatz verwendet Sämlinge in Sand in Böden gewachsen, während in der zweiten Assay Pflanzen in Beuteln in Abwesenheit des Bodens angebaut werden. Die Sämlingswachstum Beutel besteht aus einem 15,5 x 12,5 cm Papier Docht gemacht, gefaltet an der Spitze, eine 2-cm-tiefen Trog, in dem der Samen oder Sämling gelegt zu bilden. DiePapier Docht wird in einem durchsichtigen Kunststoffbeutel enthalten. Diese Wachstumsfaktoren Beutel ermöglichen die direkte Beobachtung der Nematodeninfektion Symptome, Fressen von Wurzeln und Eimasseproduktion unter der Oberfläche eines transparenten Beutel. Beide Methoden erlauben die Verwendung der abgeschirmten Pflanzen, nach Phänotypisierung, für die Überquerung oder Samenproduktion. Ein zusätzlicher Vorteil der Verwendung des Wachstums Beutel ist der geringe Platzbedarf, da Beutel aus Kunststoff Hängemappen in Racks angeordnet sind gespeichert.
Protokoll
1. Tomato Sämlingswachstum in Töpfe und Schalen
- Für Topf-Assays, Pflanzen Tomatensamen in einem Topf in einem organisch-reichen Boden wie Sunshine Mix. Pflegen Sie in einem Gewächshaus bei 22-28 ° C. Nach der Keimung, einmal in der Woche düngen mit Miracle-Gro.
- Etwa zwei Wochen nach der Keimung, bei der zwei wahre-Blatt-Stadium, die Sämlinge einzeln in Töpfe (10 cm Durchmesser und 17 cm tief) mit sterilem Sandboden mit 90% Sand und 10% Bio-Mischung gefüllt. Fügen Sie Osmocote Langzeitdünger und pflegen in einem Gewächshaus bei 22-28 ° C für zwei Wochen. Weiter zum Pflanzen einmal pro Woche mit Miracle-Gro befruchten.
- Für High-Throughput-Screens, Pflanzensamen direkt in Schalen auf sandigem Boden, bedecken Sie das Fach mit Klarsichtfolie bis zur Keimung und zu pflegen wie oben. Nach der Keimung, fügen Osmocote Langzeitdünger düngen und einmal pro Woche mit Miracle-Gro.
2. Cowpea Wachstum in Sämling Beutel
- Seeds werden entweder in einer Petrischale keimten, gefüttert mit mehreren Lagen Kimwipe Papier, übertragen und einzeln an Beuteln oder direkt in das Papier Nut der Beutel platziert und zum Keimen gebracht.
- Legen Sie die Beutel in einer Kunststoff-hängenden Aktenordner, zwei pro Ordner, und ordnen Sie die Ordner in einem Rack in einer senkrechten Position. Legen Sie die Ablage in einer Klimakammer oder bei einer Temperatur von 25-28 ° C und 16 h Licht / 8 h Dunkel-Zyklus gehalten. Racks können auch in einem Gewächshaus gehalten werden, sondern erfordern eine Folie oder steifem Papier Abdeckung über dem Regal auf beiden Seiten der Pflanzenstängel platziert, um Potenzial für Pilzbefall zu reduzieren.
- Wasser die Beutel ein-oder zweimal pro Tag mit Umkehrosmose-Wasser. Etwa 10 bis 14 Tage nach der Aussaat, wenn eine ausreichende Wurzelsystem mit tertiären Wurzelspitzen entwickelt hat (Abbildung 1), sind die Setzlinge bereit für die Impfung.
3. Extraktion von Nematodeneiern
Extraktion von EGGS aus infizierten Wurzeln wird aus einem Protokoll, das von Hussey und Barker (1973) entwickelt, modifiziert.
- Drei bis vier Tage vor Nematoden Inokulation extrahieren Wurzel-Nematode Eier aus infizierten Tomaten Wurzeln. Vor Beginn der Extraktion Ei, waschen Sie die Arbeitsfläche gründlich mit heißem Wasser, um eine Kontamination zu vermeiden. Auch in heißem Wasser waschen ein Mixer, zwei Eimer, ein Drahtgeflecht-Unterstützung, ein Gummihammer, drei Siebe von 425, 90 und 25 um Apertur, ein Messzylinder und eine Schere.
- Stapeln Sie die Siebe von oben nach unten in folgender Reihenfolge: 425, 90 und 25 um Apertur. Die Eier werden auf der 25 um Sieb am Boden gesammelt werden. Setze die Siebe auf einem Drahtnetz in einem Spülbecken unterstützt. Setzen Sie einen Eimer unter das Drahtgeflecht um die Durchlauf-Lösung sammeln.
- Schneiden Sie die Spitzen der infizierten Pflanze (n), als Quelle des Inokulum verwendet, und entsorgen. Entfernen Sie vorsichtig die Pflanze aus dem Topf. Waschen Sie die Wurzeln durch Eintauchen in eine Kunststoff-Eimer voll Wasser. Spülen Sie die Wurzeln weiter laufen unterNing Wasser, bis die Bodenteilchen von den Wurzeln gewaschen werden.
- Schneiden Sie die Wurzeln mit einer Schere in kleine Stücke. Entsorgen Sie die Pfahlwurzel.
- Legen Sie die gehackte Wurzeln, aus einer einzigen Pflanze in einem großen Kunststoffbehälter mit Deckel, gerade genug, fügen Sie 10% Bleichmittel, um die Wurzeln bedecken und den Deckel schließen.
- Schütteln Sie das Glas mit den Wurzeln für 2 min.
- Öffnen Sie das Glas gießen und die Wurzeln auf das obere Sieb waschen und mit einem Schlauch an einem Vernebelungsdüse. Gut waschen, bis das gesamte Bleichmittel Geruch ist verschwunden. Verwenden Sie einen Hammer, um die Seiten der Siebe tippen, um eine Verstopfung des Siebes Poren.
- Entfernen Sie die obere Sieb und spülen Sie die Trümmer auf dem zweiten Sieb.
- Entfernen Sie die zweite Sieb und sammeln die feinen Schmutz, der die Eier, aus dem letzten Sieb umfasst. Mit einem sanften Strahl aus einer Flasche Wasser, bewegen Sie den Schutt auf eine Seite des Siebes. Sammeln Sie die Trümmer und Eier in ein sauberes Becherglas mit möglichst wenig Wasser.
- Sieb wieder das Wasser in das gesammelteEimer über den 25 um-Sieb, um alle Eier, die freigesetzt wurden zu sammeln. Gründlich mit Wasser und sammeln im selben Becher.
- Entsorgen Sie die Pflanzenreste aus dem oberen Sieb und waschen Sie gründlich alle drei Siebe mit Druckwasser. Berühren Sie nicht die Mesh-Teil der Siebe, da es die Porengröße kann verzerren.
4. Hatching Nematodeneiern
- Linie eine saubere Metall-Korb mit ein paar Lagen Papier Kimwipe und passen auf eine Glas-Petrischale. Willkommen einer 1-cm Abstand zwischen dem Boden des Korbes und der Schüssel.
- Gießen Sie die extrahierten Nematoden Eier auf das Papier in den Drahtkorb. In genug Flüssigkeit, so daß der Boden der Drahtkorb die Wasseroberfläche berührt, jedoch nicht in Wasser eingetaucht. Decken Sie die Oberseite mit einem Plastikdeckel.
- Jeden Tag zur Wasserverdampfung zu überprüfen und etwas Wasser in der Petrischale, so dass der Boden des Korbes das Wasser berührt. Dadurch werden die Eier vor dem Austrocknen zu verhindern.
- Jeden zweiten Tag, sammeln das water, die die J2S aus den Petrischalen in einen Becher enthält. Wenn nicht sofort verwendet wird, belüften den gesammelten Inokulum bei Raumtemperatur mit Hilfe eines Labor Luftzufuhr oder Luft durch ein Aquarium Pumpe erzeugt. Verwenden Sie den belüfteten Inokulum innerhalb von 2 Tagen. J2S kann aus dem Schlüpfen bis über einen Zeitraum von 6-8 Tagen gesetzt gesammelt werden.
5. Tomato Wurzelinfektion in Töpfe oder Schalen und Auswertung der Infektion
- Verwenden drei Aliquots der gesammelten Nematoden, die Anzahl der in einem J2S Zählen Folie oder Schale zu zählen, der Mittelwert zu bestimmen, und das gewünschte Volumen zur Inokulation verwendet. Typischerweise 3000 J2S sind pro Pflanze in Töpfen und 500 J2S für Pflanzen in Sämling Tabletts gewöhnt.
- Rühren Sie das Inokulum auf einer Magnetrührplatte bei niedrigen Drehzahlen.
- Bevor Sie die Pflanzen impfen, stellen Sie sicher, dass der Boden feucht, aber nicht zu nass ist. Für Topf Impfung, machen drei Löcher von etwa einem halben Pot-Tiefe im Sand um jede Tomate Wurzelsystem mit einem Bleistift (Abbildung 2 ). Beimpfen jede Pflanze durch Auslieferung der J2S in die drei Löcher mit einer Pipette. Danach decken Sie die Löcher.
- Für die High-Throughput-Screens in Trays, verwenden eine modifizierte versiegelten Spitze Nadel mit Löchern an den Seiten geklebt, um eine 5-ml-Pipettenspitze entlang einer Pipette (Abbildung 3), um die J2S in den Boden zu liefern. Alternativ kann Nematoden nach Schritt 5.3 verschickt werden.
- Pflegen Sie die Pflanzen in einem Gewächshaus bei 24-27 ° C für 6-8 Wochen. Weiter zu befruchten zweimal im Monat mit Miracle-Gro.
- Für die Auswertung der Infektion, entfernen Sie vorsichtig die Pflanzen aus den Töpfen und waschen Sie die Wurzeln (wie in Schritt 3.3 beschrieben).
- Färben die Eier blau Massen durch Eintauchen der Wurzeln in der 1 mg / L Erioglaucin, für 15 min.
- Spülen Sie die Wurzeln in Wasser und evaluieren durch Zählen der gefärbten Eier Massen auf einzelne Wurzelsystem. Ein beleuchteter Schreibtisch Lupe kann zur besseren Visualisierung der Eigelege werden.
- Wenn die gerasterten Pflanzen werden für die weitere g nötigenetic Studien, nicht schneiden die Spitzen vor dem Waschen die Wurzeln für die Bewertung. Nach der Färbung und Zählung der Eigelege, die Sämlinge in organischen Böden, die Spitzen zu beschneiden, um die Transpiration stark zu reduzieren, und in einem Gewächshaus zu halten.
6. Cowpea Wurzelinfektion in Beutel und Auswertung der Infektion
- Zählen Sie die Nematoden Inokulum und rühren auf einer Magnetrührplatte wie oben beschrieben.
- Entfernen Sie die Beutel aus den Hängemappen und Ort auf einer horizontalen Fläche. Beimpfen jedem Beutel mit 1500 J2S in 5 ml. Heben Sie die Plastikabdeckung der Tasche und verteilen Sie die Nematoden gleichmäßig über die Oberfläche der Wurzeln.
- Halten Sie die Beutel in einer horizontalen Position für 24 h nach der Inokulation mit dunklem Papier überzogen, um Licht auszuschließen, dann zu den Hängemappen in der Klimakammer zurückzukehren.
- Wasser die Pflanzen je nach Bedarf einmal oder zweimal täglich, mit halber Stärke Hoagland-Lösung (Hoagland & Arnon, 1950; Tabelle 1 ), bis eine Reaktion auf den Dünger beobachtet wird, in der Regel erhöhte Laub Begrünung und kräftiger Sprosswachstum. Normalerweise werden die Pflanzen mit halber Stärke Hoagland 3 Tage in Folge abgeschwächt. Danach halten die Beutel mit Wasser feucht.
- Etwa 30 Tage (Spanne 28-35 Tage) nach der Impfung, ziehen jeden Beutel mit ca. 10-20 ml 75 mg / L Erioglaucin. Halten der Beutel mit dem Farbstoff in einer horizontalen Position über Nacht geflutet.
- Lassen Sie die Beutel und bewerten die Wurzelsysteme durch Zählung der Eigelege unter einem beleuchteten Schreibtisch Lupe.
- Wenn die Pflanzen abgeschirmt für weitere genetische Untersuchungen oder züchterische Arbeit benötigt werden, ziehen Sie vorsichtig die Wurzeln aus der Papier-, Transplantations in organischen Boden in Töpfen und in einem Gewächshaus zu halten.
7. Repräsentative Ergebnisse
Die entsprechenden Stufen der Tomate und Augenbohnen Pflanzen für Nematoden Impfungen für die beiden beschriebenen Systeme sind in den Abbildungen gezeigt1 und 2. Darüber hinaus sind Beispiele für gut infizierten Wurzeln von Tomaten und Kuherbsen in den 4 und 5 gezeigt. Wie in den meisten Krankheitsresistenz Bildschirmen, ist es ratsam, mindestens 6-10 Pflanzen pro Genotyp für Nematoden-Impfung verwenden, um den Durchschnitt der Infektionsrate zu berechnen. Variation in Nematodeninfektion zwischen Pflanzen, des gleichen Genotyps kann durch die Verwendung einheitlicher Größe der Anlage und genaue Menge und Lieferung von Inokulum reduziert werden.
Der Einsatz von Schalen und Beuteln Wachstum ermöglicht Screening von Hunderten bis Tausenden von Pflanzen in einem kleinen Raum Wachstum. Das Wachstum Beutel ermöglichen auch eine schnelle und effiziente nicht-destruktiven Bewertung von Wurzel-Nematode Infektionen, ohne dass zum Waschen Wurzeln (Abbildung 4).

Abbildung 1. Eine zwei Wochen alte cowpea Anlage in einem Beutel gewachsen und bereit für den Root-Knoten NEMATode Impfung.

Abbildung 2. Ein drei Wochen altes Tomatenpflanze bereit für Wurzel-Nematode Impfung.

Abbildung 3. Eine modifizierte Nadel und Pipettenspitze für High-Throughput-Impfung von Nematoden eingesetzt. Der Boden einer Nadel wurde verschlossen und drei Sätze von Löchern in der Nadel mit einem Laserstrahl gebohrt. Dann wurde das modifizierte Nadel mit einem 5-ml-Pipettenspitze geklebt.
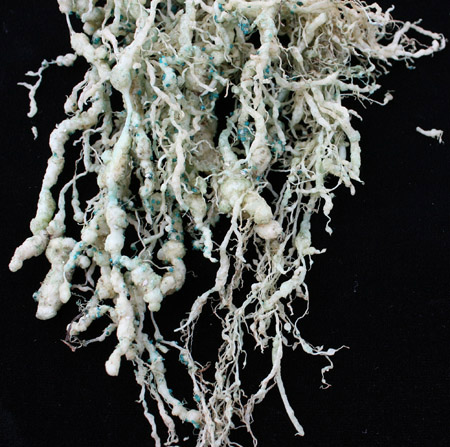
Abbildung 4. Eine Tomate Wurzelsystem mit Wurzelknoten-Nematoden infiziert.

Bild 5. Ein Kuherbsen Wurzelsystem mit Eiermassen mit Erioglaucin gefärbt 30 Tage nach der Inokulation bei gezüchtet28 ° C.
Diskussion
Es gibt zwei kritische Schritte für eine erfolgreiche Nematoden Bildschirm: Vorbereitung einer hoch infektiösen Inokulums und Verwendung von Pflanzen im richtigen Entwicklungsstadium. Schlupfrate der Wurzel-Nematode Eier ist sehr variabel und liegt zwischen 5 - 50%. Deshalb, um ein optimales Niveau von Luke und hoch infektiöse J2S zu erhalten, muss besonderes Augenmerk auf die Gewinnung und Ei Schlüpfen Verfahren bezahlt werden. Eier sollten zum Bleichen für einen minimalen Zeitraum ausgesetzt werden und Bleichmittel sollte gut werden, von der Wurzel Mischung gespült. Beim Schlüpfen der Eier sollte die Aufschlämmung, die die Eier nicht in Wasser getaucht werden. Darüber hinaus vermeiden verschütten die Eier in das darunter liegende Petrischale, wo die geschlüpften Jungtiere werden gesammelt. Eine Möglichkeit, damit kein die Eier während der Brut-Prozess ist nicht mit Wasser direkt in das Kimwipe als das Papier brechen könnte. Stattdessen fügen Sie das Wasser direkt in der Petrischale.
Für beste Ergebnisse verwenden frisch geschlüpften J2S. Wenn die hatch ist niedrig und mehr Inokulum benötigt wird, kann J2S bei 15 ° C über einen längeren Zeitraum gespeichert werden. Erwärmen Sie die gespeicherten Inokulum auf Raumtemperatur, um die Nematoden vor der Impfung wieder zu beleben. Jedoch nicht speichern die J2S über einen längeren Zeitraum sogar bei 15 ° C wie ausgehungerte J2S nicht effizient zu infizieren.
Junge Sämlinge sind die beste Entwicklungsstadium für Wurzel-Nematode Impfung. Dies muss jedoch ausgewogen sein mit der Bildung einer ausreichenden Wurzelsystem eine ausreichende Anzahl von Wurzelspitzen als Ansatzpunkte für den J2S. Sicherstellen der optimalen Pflanzenwachstum Bedingung ist auch entscheidend für die Bildschirme. Vermeiden Sie zu Bewässerung von Pflanzen speziell diejenigen in Beuteln gewachsen. Over-Bewässerung der Beutel, wie durch stehendes Wasser in der Unterseite der Tasche, kann das Pilzwachstum fördern und zu verringern Wurzel Gesundheit.
Sowohl Assays weitere Auswertung Nematodeninfektion und Berechnung der Anzahl von Eiern / Wurzelsystems und Eier / g Frequenzsh Root ausgeführt werden kann. Für die Tomaten-Assays, werden einzelne Wurzeln gewogen und Eier extrahiert, wie für Inokulumzubereitung (Abschnitt 3) beschrieben. Bei der Verarbeitung großer Anzahl von Pflanzenproben konnten einzelne Wurzel-Systeme mazeriert mit einem Mixer für Ei-Extraktion werden. Die Anzahl der Eier sollten in mindestens drei Aliquots gezählt werden und die Eier / Gramm der frischen Wurzel-System berechnet. Für den Beutel Assays wird das Wurzelsystem aus dem Papier-Einsatz gezogen, gewogen und Eier entnommen.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Research in Kaloshian Labor wird durch einen Zuschuss aus United States National Institute of Food and Agriculture (2007-35607-17765) gefördert. Forschung im Labor Roberts wird durch Zuschüsse aus United States Agency for International Development (GDG-G-00-02-00012-00 und EDH-A-00-07-00005) und der California Dry Bean Beirat finanziert.
Referenzen
- Bhattarai, K. K., Xie, Q. G., Mantelin, S., Bishnoi, U., Girke, T., Navarre, D. A., Kaloshian, I. Tomato susceptibility to root-knot nematodes requires an intact jasmonic acid signaling pathway. Mol. Plant Microbe Interact. 21, 1205-1214 (2008).
- Ehlers, J. D., Matthews, W. C., Hall, A. E., Roberts, P. A. Inheritance of a broad-based form of root-knot nematode resistance in cowpea. Crop Sci. 40, 611-618 (2000).
- Hoagland, D. R., Arnon, D. I. The water-culture method for growing plants without soil. Calif. Agric. Exp. Stn. Circ. 347, (1950).
- Hussey, R. S., Barker, K. R. A comparison of methods of collecting inocula of Meloidogyne spp., including a new technique. Plant Dis. Rep. 57, 1025-1028 (1973).
- Martinez de Ilarduya, O., Moore, A. E., Kaloshian, I. The tomato Rme1 locus is required for Mi-1-mediated resistance to root-knot nematodes and the potato aphid. Plant J. 27, 417-425 (2001).
- Matkin, O. A., Chandler, P. A., Baker, K. F. The U.C.-type soil mixes. In: The U.C. system for producing healthy container-grown plants. Calif. Agric. Exp. Stn. Manual. 23, 68-85 (1957).
- Omwega, C. O., Roberts, P. A. Inheritance of resistance to Meloidogyne spp. in common bean and the genetic basis of its sensitivity to temperature. Theor. Appl. Genet. 83, 720-726 (1992).
- Omwega, C. O., Thomason, I. J., Roberts, P. A. A nondestructive technique for screening bean germplasm for resistance to Meloidogyne incognita. Plant Dis. 72, 970-972 (1988).
- Perry, R. N., Moens, M., Starr, J. L. . Root-Knot Nematodes. , (2009).
- Starr, J. L., Cook, R., Bridge, J. . Resistance to Parasitic Nematodes. , (2002).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten