Method Article
Festphasensynthese eines funktionalisierten Bis-Peptids unter Verwendung von "Safety-Catch"-Methodik
In diesem Artikel
Zusammenfassung
Die effiziente Festphasen-Peptid-Synthese eines funktionalisierten Bis-Peptid Trimer Verwendung eines "Safety-catch" Spaltung Verfahren aus HMBA Harz beschrieben.
Zusammenfassung
Im Jahr 1962 veröffentlichte RB Merrifield die erste Verfahren unter Verwendung von Festphasen-Peptid-Synthese als ein neuer Weg, um effizient zu synthetisieren Peptide. Diese Technik erwies sich schnell als vorteilhaft gegenüber seinen Vorgänger-Phasen-Lösung sowohl in Zeit und Arbeit. Verbesserungen hinsichtlich der Art der festen Träger, beschäftigt die Schutzgruppen und die Kopplung Methoden in den letzten fünf Jahrzehnten beschäftigt haben nur die Nützlichkeit des ursprünglichen Systems Merrifield Jahre stark zugenommen. Heute Pionier Verwendung einer Boc-Schutz-und Base / Nucleophil spaltbare Harz Strategie oder Fmoc-Schutz-und sauren abspaltbare Harz Strategie, die von RC Sheppard, werden am häufigsten für die Synthese von Peptiden 1 verwendet.
Produkt von festen Träger Merrifield-Strategie, haben wir eine Boc / tert-Butyl-Festphasen-Synthese-Strategie für die Montage von funktionalisierten Bis-Peptide 2, die hierin beschrieben entwickelt. Der Einsatz von Festphasensynthese gegenüber tO-Lösung-Phasen-Methode ist nicht nur vorteilhaft sowohl in der Zeit und Arbeit, die von Merrifield 1 beschrieben, sondern erlaubt auch größere Leichtigkeit der Synthese von Bis-Peptid-Bibliotheken. Die Synthese, die wir hier zeigen, ist mit einem endgültigen Spaltung der Bühne, die ein zweistufiges "Safety-catch"-Mechanismus, um die funktionalisierten Bis-Peptid vom Harz durch Diketopiperazinbildung Release verwendet.
Bis-Peptide sind starr, Spiro-Leiter Oligomere von Bis-Aminosäuren, die in der Lage, Funktionen in einer vorhersagbaren und gestaltbar Weise durch die Art und Stereochemie der Monomer-Einheiten und die Konnektivität zwischen jedem Monomer gesteuert zu positionieren sind. Jede bis-Aminosäure eine stereochemisch reine, cyclische Gerüst, das zwei Aminosäuren (eine Carbonsäure mit einer α-Amin) 3,4 enthält. Unser Labor wird derzeit untersucht das Potenzial funktionellen Bis-Peptide in einer Vielzahl von Feldern einschließlich Katalyse, Protein-Protein-Wechselwirkungen und nanomaterials.
Protokoll
1. Setup-
- Die Reaktion Set-up für die Festphasen-Synthese ist ein Polypropylen Filterpatrone oder Glasreaktor, die über Polypropylen Schlauch zu einem geschlossenen Saugflasche wird unter Vakuum verbunden, wie in 1 gezeigt. Die Reaktion kann von einem magnetischen Rührstab oder durch Einblasen von Stickstoff durch den Reaktor gemischt werden.
- Ein Gasverteiler, der mit einem Argon-Zylinder mit einem Trockenrohr und Öl Absorptionsflasche ausgestattet ist auch zu empfehlen, da das Reaktionsgefäß unter einer inerten Atmosphäre enthalten sein können und ermöglicht die Entfernung von Reagenzien aus geschlossenen Behältern.
- Alle Operationen werden in einer Abzugshaube und richtige persönliche Schutzausrüstung (Schutzbrille, Laborkittel und Handschuhe aus Nitril) ist erforderlich, durchgeführt.
2. Lädt erste Bis-Peptid auf Harz
- Wiegen Sie 114 mg HMBA-AM-Harz (0,88 mmol / g Beladung, 100 mmol) in 8 ml Reaktionsgefäß und fügen Magnetrührer. Verschließen Sie den oberen Teil thE, das mit einem Gummiseptum und Spülung das Rohr mit Argon für mindestens 5 Minuten.
- In der Zwischenzeit, wiegen 117,3 mg der Verbindung 1 von 3 (586,63 g / mol, 2 Äq) und 59,2 mg 1 - (Mesitylen-2-sulfonyl)-3-nitro-1 ,2,4-triazol (MSNT, 296,0 g / mol, 2 Äq) in ein 15 ml Zentrifugenröhrchen Einweg und lösen sich in 2 ml wasserfreiem Dichlormethan (DCM). In 24 ul 1-Methylimidazol (NMI, 80,81 ml / mol, 3EQ) zu Lösung und mischen, bis vollständig gelöst ist.
- Übertragen der aktivierten Lösung in das Reaktionsgefäß über eine Spritze und zu erlauben, unter Argon über Nacht (~ 10 Stunden) gerührt.
- Entfernen Sie das Septum und lassen Sie das Reaktionsgemisch. Waschen des Harzes mit DCM (5x) und Dimethylformamid (DMF) (5x). Führen Sie die "Methylrot-Test" in Abschnitt 10.1 beschrieben, den Grad der Harzbeladung beurteilen. Wenn das Harz bleibt während der Methylrot-Test rot dann werden die Schritte 2.2 und 2.3 wiederholt werden soll. Eine gelbe Farbe, indikativ für ein negatives Methylrot Test, bevorzugt ist;jedoch kann, da alle verbleibenden Hydroxylgruppen im nächsten Schritt, ein leicht positives Ergebnis (hellorange Farbe Harz) verschlossen werden akzeptabel sein.
3. Entschützung der erste Bis-Peptid-und Simultan Resin Capping
- 1 mL DCM in das Reaktionsgefäß dann 1 ml 33% Bromwasserstoff in Essigsäure tropfenweise über 30 Sekunden (Blasenbildung auftritt) und lassen Sie ihn 15 Minuten lang rühren. Abgießen und wäscht das Harz mit DCM (5x) und wiederholen Sie noch einmal verarbeiten.
- Waschen des Harzes mit DCM (5x) dann DMF (5x). Neutralisieren des Harzes durch zweimaliges Waschen mit einer 5% v / v Lösung von N, N-Diisopropylethylamin (DIPEA) in DMF und dann mit DCM (5x) und DMF (5x) wieder zu waschen. Führen Sie die "Methylrot-Test" und "Chloranil-Test" in Abschnitt 10.1 und 10.2 diskutiert. Die Ergebnisse sollten für die Methylrot-Test und positiv für die Chloranil-Test negativ.
4. Coupling Boc / tBu-Protected funktionalisierte bis-Amikeine Säure
- Wiedereinführung einer inerten Atmosphäre zu dem Harz enthaltenden Reaktionsgefäß durch dreimaliges Waschen mit wasserfreiem DCM, dann schließen ein Septum und Argon Linie. Reinigen und waschen Sie den Behälter, indem 1-2 ml wasserfreiem DCM und Vermietung für Aufsehen für 30 Sekunden dann Ablassen des Schiffes bis zur Argon Linie Bubbler zu steigen beginnt. Tun Sie dies mindestens einmal mehr.
- Eine Lösung aus 0,15 M Bis-funktionalisierte Aminosäure (3EQ) und 245 mg 1-Hydroxy-7-azabenzotriazol (HOAt, 136,11 g / mol, 18eq) in 2 ml 2:1 DCM: DMF in einer Flamme getrockneten Test Rohr unter Argon-Atmosphäre. In 47 uL Diisopropylcarbodiimid (DIC, 156,6 mL / mol, 3EQ) und rühren für 90 Minuten.
- In 35 ul DIPEA (174,19 mL / mol, 2 Äq) in 666 ul wasserfreiem DMF auf Harz und lassen Sie es 5 Minuten rühren.
- Übertragen der voraktivierten bis-Aminosäure-Lösung in das Reaktionsgefäß über eine Spritze zu ermöglichen, und über Nacht gerührt.
- Lassen Sie das Reaktionsgemisch und waschen zweimal mit wasserfreiem DCM während unter Argon.
- Um die Schließung des Diketopiperazin fördern, fügen Sie eine 0,25 M Lösung von HOAt (136,11 g / mol, 10eq) und DIC (156,6 ml / mol, 10eq) in einem 4 ml 1:1 DCM: DMF und zu erlauben, unter Argon rühren für 1 Stunde.
- Entfernen Sie das Septum und lassen Sie das Reaktionsgemisch. Waschen des Harzes mit DCM (5x) und DMF (5x). Wenn gewünscht, führen Sie die "Chloranil-Test" in Abschnitt 10.2 besprochen.
5. Entschützung der Boc / tBu-geschützten funktionalisierten bis-Aminosäure
- 2 ml einer Lösung von 95:5 trifluororacetic (TFA): Triisopropylsilan (TIPS) in das Reaktionsgefäß und lassen Sie sie für 1 Stunde gerührt. Abgießen und wäscht das Harz etwa 30 Sekunden lang mit DCM (5x) und wiederholen Sie Vorgang noch einmal.
- Waschen des Harzes mit DCM (5x) dann DMF (5x). Neutralisieren des Harzes durch zweimaliges Waschen mit einer 5% v / v Lösung von DIPEA in DMF waschen DCM (5x) und DMF (5x) wieder. Wenn gewünscht, führen Sie die "Chloranil-Test" in Abschnitt 10.2 besprochen.
7. Funktionalisierung des Bis-Peptid Prolidine End
- Die prolidine Ende der wachsenden Bis-Peptid kann unabhängig oder gemeinsam durch ein Diketopiperazin acyliert werden. Außerdem kann dieses Ende links geschützt werden, was diese gespalten sein, weshalb die freie Aminosäure. Wenn gewünscht, führen Sie die "Chloranil-Test" in Abschnitt 10.2 diskutiert, um Kopplungseffizienz zu beurteilen.
8. Entschützung der Fmoc und Acylierung des Quartär Ende des Bis-Peptid
- Ein 2-ml-Lösung von 20% Piperidin in DMF zugegeben und die Reaktion wird für 20 Minuten gemischt. Abgießen und wäscht das Harz mit DMF (5x) und wiederholen Sie Vorgang noch einmal.
- Waschen des Harzes mit DCM (5x) dann DMF (5x).
- Planen einer 0,15 M Lösung von Aminosäure (3EQ) in 2 ml N-Methylpyrrolidon (NMP) mit 114 mg 2 - (7-aza-1H-Benzotriazol-1-yl) -1,1,3,3-tetramethyluroniumhexafluorphosphat (HATU, 380,2 g / mol, 3EQ) und 104,5 ul DIPEA (174,19 mL / mol, 6EQ) und umrühren. In den Reaktionsbehälter und lassen Sie sie für 6 Stunden rühren.
- Waschen des Harzes mit DCM (5x) dann DMF (5x).
9. Entfernen Sie die Boc-Gruppe vom Harz gebundenen Aminosäure und spalten aus Resin
- 2 ml eines 1:1 TFA: DCM-Lösung in das Reaktionsgefäß und zu ermöglichen, 30 Minuten rühren. Abgießen und wäscht das Harz mit DCM (5x) und wiederholen Sie noch einmal verarbeiten.
- Waschen und abtropfen lassen das Harz für 30 Sekunden mit DCM (5x), dann DMF (5x).
- 2 ml einer Lösung von 10% DIPEA in wasserfreiem DMF und zu ermöglichen, von 24-48 Stunden gerührt.
- Sammle Reaktionsmischung in vorgewogenen Rundkolben. Übertragen Sie 30 ul dieser Lösung in 450 ul THF in einem LC-MS-Fläschchen und legt für die Analyse. Das Harz wird mit zusätzlichen Aliquots DMF und sammeln in den Rundkolben entfernen Lösungsmittel im Vakuum.
10. Reinigung von Bis-Peptid
- Man löst rohe Bis-Peptid in einer minimalen Menge von Dimethylsulfoxid (100-250 mL) und Überführung in HPLC-Ampulle Einsatz. Ort-Einsatz in Autosampler von semi-prepitive HPLC-System (Hewlett Packard 1100 Serie) mit einer XTerra Prep MS C18 5 um 7.8x150 mm-Säule und einer 100 ul Injektionsschleife ausgestattet.
- Führen Sie mehrere Injektionen 50 ul der Probe unter Verwendung eines Gradienten-Programm von 5-95% Acetonitril in Wasser mit 0,1% Ameisensäure über 30 Minuten während der Überwachung bei 274 nm. Sammeln Sie die Produkt-Peak in einem vorher gewogenen Einweg-Zentrifugenröhrchen und einfrieren trocken mit einem Lyophilisators. Vorsicht ist mit dem ersten Lauf als eine leichte Verschiebung der Peak-Retentionszeit im Vergleich zu analytischen LCMS wird typischerweise beobachtet genommen werden.
11. Assessment Methods
- Methylrot TEST 7: Entfernen ~ 1 mg trockenes Harz über Einwegpipette und spülen in 4 ml Reaktionsgefäß. Fügen Sie eine Lösung von 20 mg Methylrot, 50 ul N, N'-Diisopropylcarbodiimid (DIC) und 5 mg 4-Dimethylaminopyridin (DMAP) in 500 ul wasserfreiem DCM und lassen Sie sie für 5-10 Minuten rühren. Abtropfen lassen und abwaschen Harz mit DCM, bis das Filtrat farblos wird. Positive Indikation ist die Harzperlen verbleibende orange oder rot.
- Chloranil-Test 12: Transfer ~ 1 mg trockenes Harz in einem kleinen Fläschchen über Einwegpipette. 3 Tropfen einer 0,8 mM sowohl Chloranil in DMF-Lösung und 2% Acetaldehyd in DMF-Lösung und lassen Sie sich bei Raumtemperatur für 5-10 Minuten. Positive Indikation ist die Harzperlen Drehen blau / lila.
- AKTIVIERUNG trap-Test: aktivierten Verbindungen während der Synthese kann durch die Übertragung eine kleine Menge (5-10 mL) der aktivierten Lösung für ein Flüssigchromatographie-Massenspektrometrie (LC-MS) Fläschchen mit 50 ul Pyrrolidin beurteilt werden. Mischen Sie mit der Hand ein paar Sekunden (Lösollten sich auf gelb), dann verdünnen mit 450 ul Tetrahydrofuran (THF) und legt für die LC-MS-Analyse.
- ANALYSE-LC-MS: Das Endprodukt und aktivierten Zwischenprodukte, kann unter Verwendung eines HP 1200-Serie LC-MS-System mit einem Waters Xterra MS C18 3,5 um versehen werden 4,6 mm x 150 mm-Säule und einem Gradienten-System von 5-95% Acetonitril in Wasser mit 0,1% Ameisensäure als 30 Minuten.
12. Repräsentative Ergebnisse
Ein Beispiel für sowohl rohe (4) und gereinigt (Abbildung 5) LCMS Spuren vorgesehen sind. Gereinigtes Ausbeuten von etwa 10% zu erwarten sind mit den oben beschriebenen Methoden.

Abbildung 1. Schematische Darstellung der Versuchsanordnung für die Festphasensynthese.

Abbildung 2.Einschlägige Nomenklaturen von Bis-Amino Acids / Bis-Peptide.
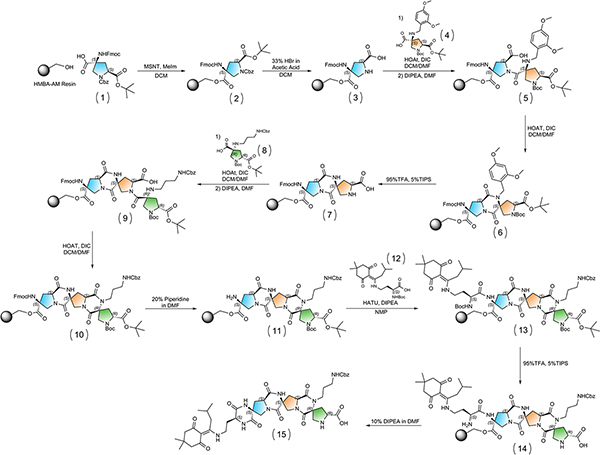
Abbildung 3. Insgesamt Syntheseschema. Klicken Sie hier für eine größere Abbildung anzuzeigen .

Abbildung 4a. HPLC-Spur des Rohprodukts bei 274 nm.
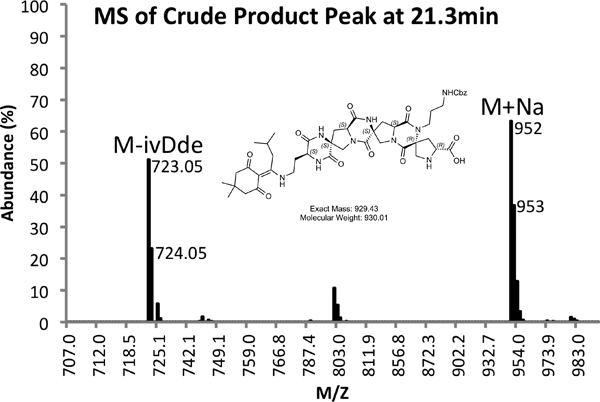
Abbildung 4b. MS-Spektrum des Rohprodukts Peak.
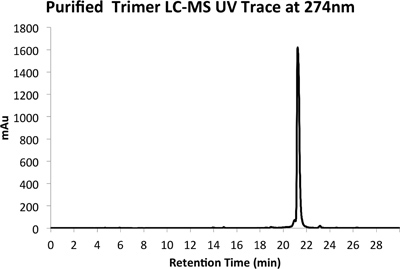
Abbildung 5a. HPLC-Spur des gereinigten Produkts bei 274 nm.
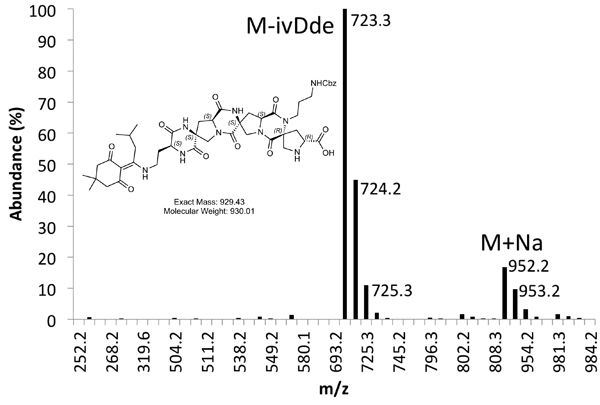
Abbildung 5b. MS Spektrum von gereinigtem Product Peak.
Diskussion
Die hierin präsentierten Syntheseansatz stellt ein Verfahren zur Synthese von funktionalisierten Bis-Peptide, die von Bis-Aminosäure-Bausteine mit gemeinsamen Festphasen-Peptidsynthesetechniken. Die Monomer-Synthese dieser "Pro4" Bausteine aus trans-4-Hydroxyprolin 3 ist hoch skalierbar und wurde erfolgreich auf die Bühne zu einem Hydantoin 600 mmol (234 g) Skala (unveröffentlicht) abgeschlossen. Wenn die Monomere in der Hand sind, stellt die Verwendung von Festphasenverfahren eine schnellere Verfahren nach Bis-Peptidsynthese, als die aktuelle Methode Lösungsphase 4 durch wodurch die Notwendigkeit für die Reaktion Aufarbeitungen und Zwischenprodukte Reinigungen.
Die primäre Herausforderung bei der Festphasensynthese wird die Diagnose synthetischen Fortschritt und Problemlösung, da keine Zwischenprodukte isoliert werden. Dies hat zu der Entwicklung vieler kolorimetrischen Tests einschließlich derer zu ermitteln, ob freie Amine (Kaiser-Test 10) oder frei Hydroxyle (Methyl-Rot-Test 7) an Harz ausgesetzt. Leider ist das häufig verwendete Kaiser Test 10 nicht allgemein anwendbar in unserem Festphasensynthese durch die fast ausschließliche Verwendung von sekundären Aminen oder Aminen an einem quartären Kohlenstoff. Andere Optionen für die Beurteilung auf HMBA Harz umfassen Test Spaltungen mit einem Nucleophil wie Hydrazin 11, quantitative Fmoc-Abspaltung durch UV / Vis 1,11 überwacht, und Einfangen und Analysieren von eingehenden Verbindungen aktiviert.
Ein weiteres Problem übersehen in der Festphasensynthese ist die Reproduzierbarkeit von synthetischen Schritten durch den Bediener erforderlich. Mit diesem Gedanken, die Autoren empfehlen dringend die Verwendung einer Tabellenkalkulation oder eine Checkliste bei der Durchführung keine manuelle Festphasen-Peptid-Synthese.
Die Schwierigkeit bei Verwendung von Bis-Peptide für die Festphasen-Synthese im Vergleich zu herkömmlichen α-Aminosäuren beinhaltet auch das Potenzial für schwierige Kopplung aufgrund von sterischendernis, die Notwendigkeit auf dem Harz Diketopiperazin Verschlüsse, und gleichzeitige Entschützen (Boc / tBu; Cbz / tBu). Ein weiterer schwer liegt bei der Erreichung quantitativer Freisetzung aus dem Harz mit dieser "Safety-catch"-Methode, wenn zu konventionelleren Mitteln verglichen. Mit diesen Faktoren zu berücksichtigen, ist es sehr möglich, dass eine weitere Optimierung dieser Methode erzielt werden kann und die derzeitigen Bemühungen sind in unserer Gruppe im Gange, um die hier vorgestellte Methode zu verbessern.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Die Autoren danken Herrn Dr. Zachary Z. Brown und Jennifer Alleva für die anfängliche Entwicklung dieses Festphasensynthese Technik und Matthew Parker FL für hilfreiche Diskussionen. Diese Arbeit wird durch die Defense Threat Reduction Agency (DOD-DTRA) (HDTRA1-09-1-0009) und dem Horst Witzel Fellowship Award von Cephalon, Inc. unterstützt unterstützt
Materialien
| Name | Firma | Katalog-Nummer | Kommentare |
| HMBA-Am Harz | NovaBiochem | 855018 | |
| MSNT | NovaBiochem | 851011 | |
| NMI | Sigma-Aldrich | 336092 | Giftig, Ätzend |
| DCM | Sigma-Aldrich | D65100 | Karzinogen |
| Wasserfreiem DCM | Acros | 34846 | Karzinogen |
| 33% Bromwasserstoff in Essigsäure | Sigma-Aldrich | 248630 | Giftig, Corrosive, Dämpfe, wenn sie geöffnet |
| DIPEA | Sigma-Aldrich | 387649 | Entzündlich, giftig, ätzend |
| DMF | Fisher Scientific | AC27960 | Entzündlich, Giftig |
| Wasserfreiem DMF | Acros | 34843 | Entzündlich, Giftig |
| HOAt | GenScript | C01568 | |
| DIC | Acros | BP590 | Entzündlich, giftig, ätzend |
| TFA | Sigma-Aldrich | T6508 | Giftig, Ätzend |
| TIPPS | Acros | 21492 | Entzündlich, Giftig |
| Piperidin | Sigma-Aldrich | 104094 | Entzündlich, giftig, ätzend |
| HATU | GenScript | C01566 | Toxic |
| NMP | Acros | 36438 | Giftig |
| DMAP | NovaBiochem | 851055 | Giftig |
| Methylrot | Sigma-Aldrich | 250198 | |
| THF | Sigma-Aldrich | 401757 | Entzündlich, giftig, Peroxid-Forming |
| Pyrrolidin | Sigma-Aldrich | P73803 | Entzündlich, giftig, ätzend |
| Dimethylsulfoxid | Fischer | D1281 | |
| SPPS Reaktionsgefäße | Gnade | 211108 | |
| LCMS | Agilent | 1200 Serie | |
| Semi-Prep LC | Hewlett Packard | 1100-Serie | |
| Lyophilisators | Labconco | 7934027 | |
| Rotovapor | Büchi | R-210-Serie | |
| Argon | Airgas | AR PP300CT |
Referenzen
- Atherton, E., Sheppard, R. C. . Solid Phase Peptide Synthesis: A Practical Approach. , (1989).
- Brown, Z. Z., Alleva, J., Schafmeister, C. E. Solid-Phase Synthesis of Functionalized Bis-Peptides. Biopolymers. 96, 578-585 (2010).
- Schafmeister, C. E., Brown, Z. Z., Gupta, S. Shape-Programmable Macromolecules. Acc. Chem. Res. 41, 1387-1398 (2008).
- Brown, Z. Z., Schafmeister, C. E. Synthesis of Hexa- and Pentasubstituted Diketopiperazines from Sterically Hindered Amino Acids. Org. Let. 12, 1436-1439 (2010).
- Nielson, J., Lyngso, L. O. Combinatorial Solid-Phase Synthesis of Balanol Analogues. Tet. Lett. 37, 8439-8442 (1996).
- Blankemeyer-Menge, B., Nimtz, M., Frank, R. An Efficient Method for Anchoring Fmoc-Amino Acids to Hydroxyl-Functionalized Solid Supports. Tet. Lett. 31, 1701-1704 (1990).
- Komba, S., Sasaki, S., Machida, S. A New Colorimetric Test for Detection of Hydroxyl Groups in Solid-Phase Synthesis. Tet. Lett. 48, 2075-2078 (2007).
- Demner, O., Dijkgraaf, I., Schottelius, M., Wester, H. J., Kessler, H. Introduction of Functional Groups into Peptides via N-Alkylation. Org. Lett. 10, 2015-2018 (2008).
- Plas, S. E. V. a. n. d. e. r., Van Hoeck, E., Lynen, F., Sandra, P., Madder, A. Toward a New SPE Material for EDCs: Fully Automated Synthesis of a Library of Tripodal Receptors Followed by Fast Screening by Affinity LC. Eur. J. Org. Chem. 11, 1796-1805 (2009).
- Kaiser, E., Colescot, R. L., Bossinger, C. D., Cook, P. I. Color Test for Detection of Free Terminal Amino Groups in Solid-Phase Synthesis of Peptides. Anal. Biochem. 34, 595-598 (1970).
- Chan, W. C., White, P. D. . Fmoc Solid Phase Peptide Synthesis: A Practical Approach. , (2000).
- Vojkovsky, T. Detection of Secondary Amines on Solid-Phase. Peptide Research. 71, 236-237 (1995).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten