Method Article
Synthèse en phase solide d'un bis-fonctionnalisé peptide en utilisant "Sécurité Catch" Méthodologie
Dans cet article
Résumé
La synthèse peptidique en phase solide efficace d'un peptide bis-fonctionnalisé trimère utilisant un "cran de sûreté" procédure de clivage de la résine HMBA est décrite.
Résumé
En 1962, RB Merrifield a publié la première procédure en utilisant la synthèse peptidique en phase solide comme une nouvelle voie pour synthétiser efficacement des peptides. Cette technique s'est rapidement avéré avantageux par rapport à sa solution en phase prédécesseur dans le temps et le travail. Améliorations concernant la nature du soutien solide, les groupes protecteurs employés et les méthodes de couplage utilisées au cours des cinq dernières décennies n'ont fait qu'accroître l'utilité du système d'origine Merrifield. Aujourd'hui, l'utilisation d'une protection Boc-base et base / nucléophile stratégie de résine Fmoc-clivable ou une protection basée sur la stratégie de résine et acides clivable, mis au point par RC Sheppard, sont le plus couramment utilisé pour la synthèse de peptides 1.
Inspiré par Merrifield stratégie soutenue solide, nous avons développé une stratégie Boc / tert-butyle synthèse en phase solide pour l'assemblage des fonctionnalisés bis-2 peptides, qui est décrite ici. L'utilisation de synthèse en phase solide par rapport to solution en phase méthode n'est pas seulement avantageuse dans le temps et active telle que décrite par une Merrifield, mais permet également une plus grande facilité dans la synthèse de bis-peptidiques bibliothèques. La synthèse que nous démontrons ici intègre un stade clivage final qui utilise un en deux étapes "cran de sûreté" mécanisme pour libérer le bis-fonctionnalisé peptide de la résine par la formation de dicétopipérazine.
Bis-peptides sont rigides, des spiro-échelle oligomères de bis-acides aminés qui sont aptes à placer la fonctionnalité d'une manière prévisible et désignable, commandé par le type et la stéréochimie des unités monomères et de la connectivité entre chaque monomère. Chaque acide aminé est le bis-une stéréochimiquement pur, cyclique échafaudage qui contient deux acides aminés d'un acide carboxylique avec une α-aminé) 3,4. Notre laboratoire étudie actuellement le potentiel de bis-fonctionnels des peptides à travers une grande variété de domaines, y compris la catalyse, interactions protéine-protéine et nanomaterials.
Protocole
1. Installation
- La réaction d'ouvertures pour la synthèse en phase solide est une cartouche de filtre ou de polypropylène réacteur en verre qui est connecté via un tube de polypropylène à une fiole fermée filtration sous vide conformément à la figure 1. La réaction peut être mélangé par un agitateur magnétique ou par barbotage d'azote dans le réacteur.
- Un collecteur de gaz relié à un cylindre d'Argon équipé d'un tube de séchage et de barboteur à huile est également recommandé car il permet la cuve de réaction à être contenue dans une atmosphère inerte et permet l'élimination des réactifs des conteneurs hermétiques.
- Toutes les opérations sont effectuées sous une hotte et un équipement de protection individuelle (lunettes de sécurité, blouse de laboratoire et des gants en nitrile) est nécessaire.
2. Chargement d'abord Bis-peptide sur résine
- Peser 114 mg de HMBA-AM Résine (0,88 mmol / g de chargement, 100 umol) dans 8 ml cuve de réaction et d'ajouter une barre d'agitation magnétique. Boucher le haut de ee navire avec un septum en caoutchouc et d'une purge du tube avec de l'argon pendant au moins 5 minutes.
- Dans l'intervalle, pèsent 117,3 mg du composé 1 de la figure 3 (586,63 g / mol, 2eq) et 59,2 mg de 1 - (mésitylène-2-sulfonyl)-3-nitro-1 ,2,4-triazole (MSNT, 296,0 g / mol, 2eq) dans un tube de 15 ml centrifugeuse jetable et dissoudre dans 2 ml de dichlorométhane anhydre (DCM). Ajouter 24 uL de 1-méthylimidazole (NMI, 80,81 ml / mol, 3EQ) à la solution et mélanger jusqu'à dissolution complète.
- Transférer la solution activée à l'aide d'une seringue récipient de réaction et laisser sous agitation sous argon nuit (~ 10 heures).
- Retirer le septum et vidanger le mélange réactionnel. Laver la résine avec du DCM (5x) et le diméthylformamide (DMF) (5x). Effectuez l'opération "rouge de méthyle test" décrit dans l'article 10.1 afin d'évaluer le degré de charge de résine. Si la résine reste rouge pendant le test au rouge de méthyle puis les étapes 2.2 et 2.3 doit être répété. Une couleur jaune, signe d'un test de rouge de méthyle négatif, est préféré;Cependant, étant donné que toute autres groupes hydroxyles seront plafonnés à l'étape suivante, un résultat légèrement positif (lumière de couleur en résine orange) peut être acceptable.
3. La déprotection de résine bis-peptide et simultanée d'abord Plafonnement
- Ajouter 1 ml de DCM à la cuve de réaction, puis ajouter 1 ml de bromure d'hydrogène de 33% en goutte à goutte d'acide acétique de plus de 30 secondes se produit un bullage) et laisser agiter pendant 15 minutes. Égoutter et laver la résine avec du DCM (5x), puis répétez le traitement une fois de plus.
- Laver la résine avec du DCM (5x), puis le DMF (5x). Neutraliser la résine par lavage deux fois avec un 5% v / v de N, N-diisopropyléthylamine (DIPEA) dans du DMF puis laver au DCM (5x) et de DMF (5x) à nouveau. Effectuer le "test du rouge de méthyle" et "test chloranile" discuté à la section 10.1 et 10.2. Les résultats devraient être négatifs pour le rouge de méthyle test et positif pour le test chloranile.
4. Couplage Boc / tBu-protégé fonctionnalisé Bis-Amipas d'acide
- Réintroduire une atmosphère inerte à la résine contenant du récipient de réaction par lavage trois fois avec DCM anhydre puis fixer une ligne de septum et l'argon. Purger et laver le récipient en ajoutant 1-2 ml de DCM anhydre et en laissant remuer pendant 30 secondes, puis vidange de la cuve jusqu'à ce que l'argon ligne barboteur commence à monter. Pour ce faire, au moins une fois de plus.
- Préparer une solution de 0,15 M fonctionnalisé bis-amino-acide (3EQ) et 245 mg de 1-hydroxy-7-azabenzotriazole (HOAt, 136,11 g / mol, 18eq) dans 2 mL de 2:1 DCM: DMF dans un test séché à la flamme tube sous atmosphère d'argon. Ajouter 47 ul de diisopropylcarbodiimide (DIC, 156,6 ml / mol, 3EQ) et agiter pendant 90 minutes.
- Ajouter 35 uL DIPEA (174,19 ml / mol, 2eq) dans 666 ul DMF anhydre à la résine et de permettre à remuer pendant 5 minutes.
- Transférer la solution pré-activé l'acide bis-amino à la cuve de réaction moyen d'une seringue et laisser agiter pendant une nuit.
- Égoutter le mélange réactionnel et laver deux fois avec du DCM anhydre tandis que sous l'argon.
- Pour favoriser la fermeture de la dicétopipérazine, ajouter une solution 0,25 M de HOAt (136,11 g / mol, 10eq) et DIC (156,6 ml / mol, 10eq) dans un 4 ml de 1:1 DCM: DMF et laisser sous agitation sous argon pendant 1 heure.
- Retirer le septum et vidanger le mélange réactionnel. Laver la résine avec du DCM (5x) et de DMF (5x). Si vous le souhaitez, effectuer le "test de chloranile" discuté à la section 10.2.
5. Déprotection de Boc / tBu-protégé fonctionnalisé Bis-amino-acide
- Ajouter 2 ml d'une solution de l'acide 95:5 trifluororacetic (TFA): triisopropylsilane (TIPS) à la cuve de réaction et de lui permettre de remuer pendant 1 heure. Égoutter et laver la résine pendant environ 30 secondes avec du DCM (5x), puis répéter le processus une fois de plus.
- Laver la résine avec du DCM (5x), puis le DMF (5x). Neutraliser la résine par lavage deux fois avec un 5% v / v de solution de DIPEA dans du DMF puis laver le DCM (5x) et de DMF (5x) à nouveau. Si vous le souhaitez, effectuer le "test de chloranile" discuté à la section 10.2.
7. La fonctionnalisation de la fin Prolidine Bis-Peptide
- L'extrémité prolidine du bis-peptidique en croissance peut être acylé indépendamment ou ensemble par une dicétopipérazine. De plus, cette extrémité peut être laissé protégés, qui sera coupé ci, donnant l'acide aminé libre. Si vous le souhaitez, effectuer le "test de chloranile" discuté à la section 10.2 pour évaluer l'efficacité du couplage.
8. La déprotection de Fmoc et acylation de la fin du Quaternaire de la Bis-Peptide
- Une solution de 2 ml de pipéridine 20% dans du DMF est ajouté et le mélange réactionnel est mélangé pendant 20 minutes. Égoutter et laver la résine avec du DMF (5x), puis répéter le processus une fois de plus.
- Laver la résine avec du DCM (5x), puis le DMF (5x).
- Préparer une solution à 0,15 M d'acide aminé (3EQ) dans 2 ml de N-méthylpyrrolidone (NMP) avec 114 mg de 2 - (7-aza-1H-benzotriazole-1-yl) -1,1,3,3-tétraméthyluronium (HATU, 380,2 g / mol, 3EQ) et de 104,5 ul DIPEA (174,19 ml / mol, 6EQ) et bien mélanger. Ajouter à la cuve de réaction et permettre de remuer pendant 6 heures.
- Laver la résine avec du DCM (5x), puis le DMF (5x).
9. Retirez le Groupe de Boc lié à la résine d'acides aminés et Cleave de résine
- Ajouter 2 mL d'une TFA 1:1: solution de DCM à la cuve de réaction et permettre de remuer pendant 30 minutes. Égoutter et laver la résine avec du DCM (5x), puis répétez le traitement une fois de plus.
- Lavez et égouttez la résine pendant 30 secondes avec du DCM (5x), puis du DMF (5x).
- Ajouter 2 ml d'une solution de DIPEA 10% dans le DMF anhydre et permettent de mélanger les 24-48 heures.
- Recueillir mélange réactionnel en pré-pesé ballon à fond rond. Transfert 30 uL de cette solution à 450 pl de THF dans un flacon LC-MS et de soumettre à l'analyse. Laver la résine avec des aliquotes supplémentaires de DMF et de recueillir dans le ballon à fond rond, puis éliminer le solvant sous vide.
10. Purification de Bis-Peptide
- Dissoudre brut bis-peptide dans une quantité minimale de diméthylsulfoxyde (100-250 pi) et le transfert dans l'insert flacon HPLC. Insérer le placer dans échantillonneur automatique de semi-prepitive système HPLC (HP 1100 série) équipé d'une XTerra MS Préparation C18 5 mm de colonne um 7.8x150 et une boucle d'injection 100 pi.
- Effectuer plusieurs injections de 50 ml de l'échantillon en utilisant un programme de gradient d'acétonitrile 5-95% dans de l'eau avec de l'acide formique 0,1% pendant 30 minutes tout en surveillant à 274 nm. Recueillir le pic du produit dans un tube à centrifuger pré-pesée jetable et lyophiliser l'aide d'un lyophilisateur. Il faut être prudent avec la première manche comme un léger décalage dans le temps de rétention maximale par rapport aux LCMS analyse est généralement observée.
11. Méthodes d'évaluation
- Rouge de méthyle ESSAI 7: Retirer ~ 1 mg de résine sèche par l'intermédiaire d'une pipette jetable et rincer en 4 ml cuve de réaction. Ajouter une solution de 20 mg rouge de méthyle, 50 N ul, N'-diisopropylcarbodiimide (DIC), et 5 mg de 4-diméthylaminopyridine (DMAP) dans 500 ul DCM anhydre et laisser agiter pendant 5-10 minutes. Égoutter et laver la résine avec du DCM jusqu'à ce que le filtrat devienne incolore. Indication positive est des perles de résine restants orange ou rouge.
- ESSAI CHLORANILE 12: Transfert ~ 1 mg de résine sèche dans un petit flacon par l'intermédiaire d'une pipette jetable. Ajouter 3 gouttes de deux de 0,8 mM dans chloranile solution dans le DMF et de l'acétaldéhyde à 2% en solution dans le DMF et laisser reposer à température ambiante pendant 5-10 minutes. Indication positive est les perles de résine de tournage bleu / violet.
- ESSAI TRAP ACTIVATION: composés activés au cours de la synthèse peut être évaluée par le transfert d'une petite quantité (ul 5-10) de la solution activée à une chromatographie en phase liquide-spectrométrie de masse (LC-MS) flacon contenant 50 ul de pyrrolidine. Mélanger à la main pendant quelques secondes (solutidevrait devenir le jaune), puis diluer avec 450 uL de tétrahydrofurane (THF) et de soumettre à analyse LC-MS.
- ANALYSE LC-MS: Le produit final et des intermédiaires activés peuvent être évalués en utilisant une HP série 1200 LC-MS équipé d'un système de Waters Xterra MS C18 3,5 um 4,6 mm x 150 mm colonne et un système de gradient de 5-95% d'acétonitrile dans l'eau avec de l'acide formique 0,1% en 30 minutes.
12. Les résultats représentatifs
Un exemple de tant brut (Figure 4) et purifiée (Figure 5) traces LCMS sont fournis. Rendements purifiés d'environ 10% sont attendus en utilisant les méthodes décrites ci-dessus.

Figure 1. Schéma de montage expérimental pour la synthèse en phase solide.

Figure 2.Nomenclature pertinente du Bis-amino-acides / bis-peptides.
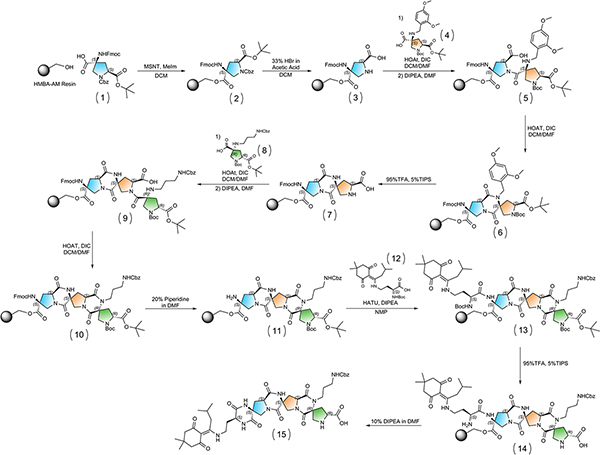
Figure 3. Globalement schéma de synthèse. Cliquez ici pour agrandir la figure .

Figure 4a. Trace HPLC du produit brut à 274 nm.
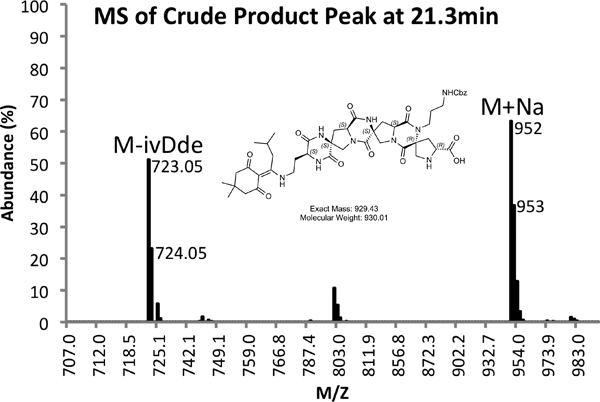
Figure 4b. Spectre MS de Peak produit brut.
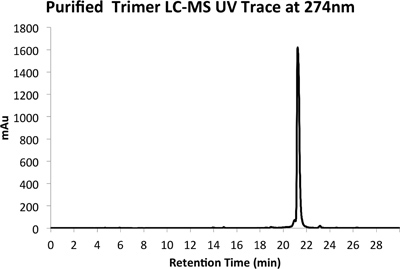
La figure 5a. HPLC Trace de produit purifié à 274 nm.
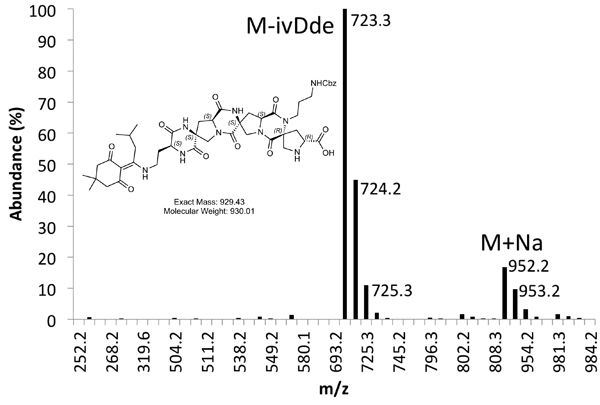
La figure 5b. Spectre MS de Produc purifiéet Peak.
Discussion
L'approche de synthèse présenté ci fournit un procédé pour la synthèse de peptides fonctionnalisés bis-bis-aminés à partir des blocs de construction d'acide à l'aide communs en phase solide des techniques de synthèse des peptides. La synthèse du monomère de ces «blocs de construction" Pro4 de trans-4-hydroxyproline 3 est hautement évolutive et a été complété avec succès à la scène lors d'une hydantoïne mmol 600 (234 g) échelle (non publié). Une fois que les monomères sont dans la main, l'utilisation de techniques en phase solide fournit une méthode plus rapide de bis-peptide de synthèse que notre actuelle phase solution la méthodologie 4 en éliminant la nécessité d'une réaction de travail-ups et les purifications intermédiaires.
Le principal défi de synthèse en phase solide est le diagnostic des progrès synthétique et la résolution de problèmes étant donné qu'aucun des intermédiaires sont isolés. Ceci a conduit à la mise au point de nombreux tests colorimétriques y compris ceux de déterminer si des amines libres (Kaiser essai 10) ou sans hydroxydeYLS (rouge de méthyle essai 7) sont exposés sur la résine. Malheureusement, le test couramment utilisé Kaiser 10 n'est pas généralement applicable dans notre synthèse en phase solide en raison de l'utilisation presque exclusive des amines secondaires ou des amines attachés à un atome de carbone quaternaire. D'autres options pour l'évaluation de résine HMBA comprennent clivages de test en utilisant un nucléophile tel que l'hydrazine 11, quantitative clivage Fmoc surveillé par UV / Vis 1,11, et le piégeage et l'analyse des composés entrants activés.
Une autre question négligée dans synthèse en phase solide est le caractère répétitif des étapes de synthèse requises par l'opérateur. Avec cela à l'esprit, les auteurs recommandons fortement l'utilisation d'un tableur ou une liste lorsqu'il exerce une synthèse peptidique en phase solide manuel.
La difficulté dans l'utilisation de bis-peptides pour synthèse en phase solide par rapport à α communs acides aminés comprend le potentiel de plus difficile en raison de couplages stérique hinDrance, la nécessité pour les fermetures dicétopipérazines sur résine, et déprotections simultanées (BOC / tBu; Cbz / tBu). Une autre réside dans la réalisation difficilement libération quantitative de la résine à l'aide de cette "cran de sûreté" méthode par rapport à des moyens plus conventionnels. Avec ces facteurs à l'esprit, il est très possible que l'optimisation de ce procédé peut être réalisé et les efforts actuels sont en cours dans notre groupe pour améliorer la méthode présentée ici.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs tiennent à remercier le Dr Zachary Z. Brown et Jennifer Alleva pour le développement initial de cette technique de synthèse en phase solide et Matthew Parker FL pour des discussions utiles. Ce travail est soutenu par la Defense Threat Reduction Agency (DOD-DTRA) (HDTRA1-09-1-0009) et le Horst Witzel Fellowship Award soutenu par Cephalon, Inc
matériels
| Nom | Entreprise | Numéro de catalogue | Commentaires |
| HMBA-Am Résine | Novabiochem | 855018 | |
| MSNT | Novabiochem | 851011 | |
| NMI | Sigma-Aldrich | 336092 | Toxique, Corrosif |
| DCM | Sigma-Aldrich | D65100 | Cancérigène |
| DCM anhydre | Acros | 34846 | Cancérigène |
| Bromure d'hydrogène 33% dans l'acide acétique | Sigma-Aldrich | 248630 | Toxique, Corrosive, fumées lorsqu'il est ouvert |
| DIPEA | Sigma-Aldrich | 387649 | Inflammable, toxique, corrosif |
| DMF | Fisher Scientific | AC27960 | Inflammable, toxique |
| DMF anhydre | Acros | 34843 | Inflammable, toxique |
| HOAt | GenScript | C01568 | |
| DIC | Acros | BP590 | Inflammable, toxique, corrosif |
| TFA | Sigma-Aldrich | T6508 | Toxique, Corrosif |
| CONSEILS | Acros | 21492 | Inflammable, toxique |
| Pipéridine | Sigma-Aldrich | 104094 | Inflammable, toxique, corrosif |
| HATU | GenScript | C01566 | Toxique |
| NMP | Acros | 36438 | Toxique |
| DMAP | Novabiochem | 851055 | Toxique |
| Rouge de méthyle | Sigma-Aldrich | 250198 | |
| THF | Sigma-Aldrich | 401757 | Inflammable, toxique, le peroxyde de formage |
| Pyrrolidine | Sigma-Aldrich | P73803 | Inflammable, toxique, corrosif |
| Diméthylsulfoxyde | Pêcheur | D1281 | |
| Réacteurs SPPS | Grâce | 211108 | |
| LCMS | Agilent | 1200 Series | |
| Semi-Prep LC | Hewlett Packard | Série 1100 | |
| Lyophiliseur | Labconco | 7934027 | |
| Rotovapor | Buchi | R-210 Series | |
| Argon | Airgas | AR PP300CT |
Références
- Atherton, E., Sheppard, R. C. . Solid Phase Peptide Synthesis: A Practical Approach. , (1989).
- Brown, Z. Z., Alleva, J., Schafmeister, C. E. Solid-Phase Synthesis of Functionalized Bis-Peptides. Biopolymers. 96, 578-585 (2010).
- Schafmeister, C. E., Brown, Z. Z., Gupta, S. Shape-Programmable Macromolecules. Acc. Chem. Res. 41, 1387-1398 (2008).
- Brown, Z. Z., Schafmeister, C. E. Synthesis of Hexa- and Pentasubstituted Diketopiperazines from Sterically Hindered Amino Acids. Org. Let. 12, 1436-1439 (2010).
- Nielson, J., Lyngso, L. O. Combinatorial Solid-Phase Synthesis of Balanol Analogues. Tet. Lett. 37, 8439-8442 (1996).
- Blankemeyer-Menge, B., Nimtz, M., Frank, R. An Efficient Method for Anchoring Fmoc-Amino Acids to Hydroxyl-Functionalized Solid Supports. Tet. Lett. 31, 1701-1704 (1990).
- Komba, S., Sasaki, S., Machida, S. A New Colorimetric Test for Detection of Hydroxyl Groups in Solid-Phase Synthesis. Tet. Lett. 48, 2075-2078 (2007).
- Demner, O., Dijkgraaf, I., Schottelius, M., Wester, H. J., Kessler, H. Introduction of Functional Groups into Peptides via N-Alkylation. Org. Lett. 10, 2015-2018 (2008).
- Plas, S. E. V. a. n. d. e. r., Van Hoeck, E., Lynen, F., Sandra, P., Madder, A. Toward a New SPE Material for EDCs: Fully Automated Synthesis of a Library of Tripodal Receptors Followed by Fast Screening by Affinity LC. Eur. J. Org. Chem. 11, 1796-1805 (2009).
- Kaiser, E., Colescot, R. L., Bossinger, C. D., Cook, P. I. Color Test for Detection of Free Terminal Amino Groups in Solid-Phase Synthesis of Peptides. Anal. Biochem. 34, 595-598 (1970).
- Chan, W. C., White, P. D. . Fmoc Solid Phase Peptide Synthesis: A Practical Approach. , (2000).
- Vojkovsky, T. Detection of Secondary Amines on Solid-Phase. Peptide Research. 71, 236-237 (1995).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon