Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Synthetische Spinnenseide Produktion im Labormaßstab
In diesem Artikel
Zusammenfassung
Trotz der hervorragenden mechanischen und biochemischen Eigenschaften von Spinnenseide, kann dieses Material nicht in großen Mengen mit konventionellen Mitteln gewonnen werden. Hier beschreiben wir eine wirksame Strategie, um künstliche Spinnenseide, die ein wichtiger Prozess für die Ermittler Studium Spinnenseide Herstellung und ihre Verwendung als Next-Generation-Biomaterialien ist zu spinnen.
Zusammenfassung
Wie die Gesellschaft fortschreitet und die Ressourcen werden knapper, wird es immer wichtiger, neue Technologien zu kultivieren, dass Ingenieur Biomaterialien nächsten Generation mit hoher Performance Eigenschaften. Die Entwicklung dieser neuen strukturellen Materialien muss schnell, kostengünstig und beinhalten Verarbeitungsverfahren und Produkte, die umweltfreundlich und nachhaltig sind. Spinnen spinnen eine Vielzahl von verschiedenen Fasertypen mit unterschiedlichen mechanischen Eigenschaften und bietet eine reiche Quelle der nächsten Generation technischen Werkstoffen für Bionik, dass Rivalen die besten künstlichen und natürlichen Materialien. Da die Aufnahme von großen Mengen der natürlichen Spinnenseide ist unpraktisch, hat Kunstseide Produktion die Möglichkeit, Wissenschaftler mit Zugang zu einem unbegrenzten Vorrat an Themen zu bieten. Deshalb, wenn das Spinnverfahren können gestrafft und perfektioniert haben künstliche Spinne Fasern die mögliche Verwendung für ein breites Spektrum von Anwendungen, die von Body Armor, chirurgisches Nahtmaterials, Kabel und Seile, Reifen, Saiten für Musikinstrumente, und Verbundwerkstoffe für Luft-und Raumfahrttechnik. Um die Kunstseide Produktion voranzubringen und zu Fasern, die geringe Varianz zeigen in ihren materiellen Eigenschaften von Spin zu drehen nachgeben, entwickelten wir eine Nassverspinnen Protokoll, das die Expression von rekombinanten Spinnenseide Proteine in Bakterien, Reinigung und Konzentration der Proteine integriert , gefolgt von Faserextrusion und mechanische Nachbearbeitung Spin Behandlung. Dies ist das erste visuelle Darstellung, die eine Schritt-für-Schritt-Prozess zeigt sich zu drehen und zu analysieren, Kunstseide Fasern im Labormaßstab. Es liefert auch Informationen, um die Einführung der Variabilität zwischen den Fasern aus dem gleichen Spinnlösung versponnen zu minimieren. Zusammen werden diese Methoden treiben den Prozess der Kunstseide Produktion, was zu höherer Qualität Fasern, die natürliche Spinnenseide zu übertreffen.
Einleitung
Spinnenseide verfügt über hervorragende mechanische Eigenschaften, die heraus führt mehrere künstlichen Materialien, einschließlich hochfestem Stahl, Kevlar und Nylon. 1 Spinnen spinnen mindestens 6-7 unterschiedliche Fasertypen, die unterschiedliche mechanische Eigenschaften zeigen, die jeweils mit unterschiedlichen Mengen an Zugfestigkeit und Erweiterbarkeit ausgelegt um spezifische biologische Aufgaben zu erfüllen. 2 Forschung Wissenschaftler werden schnell verfolgt die Verwendung von Spinnenseide als Biomaterial nächsten Generation aufgrund ihrer hervorragenden mechanischen Eigenschaften, ihrer Biokompatibilität und ihre nicht-toxisch und grün-materieller Natur. 3,4 Wegen des kannibalischen und giftigen Natur der Spinnentiere, Ernte Spinnenseide durch die Landwirtschaft ist keine praktische Strategie, um den Anforderungen, die für Herstellung im industriellen Maßstab gerecht zu werden. Daher haben Wissenschaftler in die Produktion von rekombinanten Seidenproteinen in transgenen Organismen in vitro gekoppelt Spinnen von synthetischen Fasern aus der eingeschaltetse gereinigte Proteine. 8.5 Expression von rekombinanten Volllängen-Spinnenseidenproteinen war technisch schwierig angesichts der Beschaffenheit ihrer Gensequenzen, die ihre stark repetitiven Natur und physikalischen Längen (> 15 kb) umfassen, GC-reiche Inhalt und voreingenommen Alanin und Glycin Codonverwendung. 11.09 Bis heute haben die meisten Labors auf auszudrücken verkürzten Formen der großen Ampullendrüse Seidenproteine MaSp1 oder MaSp2 mit partiellen cDNA-Sequenzen oder synthetische Gene konzentriert. 15.12 Spinning synthetischen Spinnenseide ist ein herausfordernder Prozess, der Beherrschung und Kenntnisse in verschiedenen wissenschaftlichen Disziplinen und den Feinheiten der Spinnverfahren sind noch nicht vollständig an die breite Öffentlichkeit von Video-Darstellung offenbart. In der Tat haben nur eine Handvoll Labors auf der ganzen Welt das Know-how, um die Spinnenseide cDNAs zum Ausdruck bringen, reinigen die Seidenproteine, synthetischen Fasern zu spinnen, und führen Sie nach dem Spin-Unentschieden, und dann schließlich testen ihre Eigenschaften Biomaterial. 8,16,17 Unterschiedliche Ansätze für die Spinnerei synthetischen Fasern haben umfasste nassen und trockenen Spinnerei sowie Elektrospinnen Methoden 16,18,19 Alle Verfahren haben ein gemeinsames Ziel -. Entwicklung eines Protokolls, das synthetische Spinnenseide produziert mit mechanischen Eigenschaften, die rivalisierenden natürlichen Fäden für groß angelegte kommerzielle Herstellungsverfahren.
Hier beschreiben wir den Vorgang, um künstliche Spinnenseide im Labormaßstab mit Hilfe eines Nassverspinnen Methodik zu generieren. Im Vergleich zu anderen Spinnverfahren hat Naßspinnen die konstantesten Ergebnisse für Faser-Analyse erzeugt. Wir stellen diese Vorgehensweise, beginnend mit der Expression der rekombinanten Proteine in Bakterien Seide, die durch ihre anschließende Reinigung und beschreiben anschließend die Schritte zur Vorbereitung Protein für die Spinnerei, einschließlich einer post-Spin-Methode wie für die Auslosung ", wie gesponnen" Fasern, Fäden ergibt sich mit Materialeigenschaften, die die Qualität der natürlichen Spinnenseide zu nähern. Unsere methodology wurde entwickelt, um genau imitieren den natürlichen Spinnprozess von Seidenfasern und es greift stark auf unser Know-how über die Architektur und Funktion der Seide-produzierende Drüsen von Orb-und COB-Weben Spinnen. 20-22 Darüber hinaus schließen wir mit der notwendigen Schritte, um die Materialeigenschaften der synthetischen Fasern mit einem Dehnungsmesser zu Spannungs-Dehnungs-Kurven, die Ermittler auf die Zugfestigkeit, Bruchdehnung und Zähigkeit der Fasern berechnen lassen plotten zu bestimmen. Schließlich aber von bedeutendem Wert, können die Spinnen, Spulen, Apparate und Zeichnung sein Zuhause gebaut mit handelsüblichen Teilen erwarben, anstatt aufwendige und teure kundenspezifische Geräte.
Access restricted. Please log in or start a trial to view this content.
Protokoll
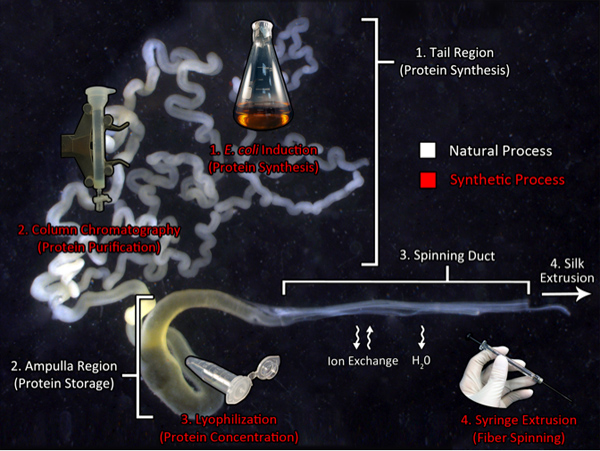
Grafische Übersicht: Biomimicry des Spinnprozesses
Biomimicry der natürlichen Spinnenseide Produktion Weg:. Eine Route zu Kunstseide herzustellen Dieses Bild zeigt den großen Ampullendrüse aus dem goldenen Radnetzspinne, Nephila clavipes, und die Komponenten für Naturseide Produktion (weiße Schrift) genutzt. Die Heckbereich großen Mengen synthetisiert aus Seidenproteinen, die zur Ampulle, ein Speicherbereich für die Spinnlösung transportiert werden. Diese konzentrierte dope extrudiert wird durch den Spinnschacht, wo die Lösung erfährt Ionenaustausch und Dehydratation vor Faserextrusion. Die biomimetische Prozesse in unserem Labor verwendet werden durch den roten Text angezeigt. Rekombinante Seidenproduktion wird unter Verwendung von transgenen Bakterien, durch Reinigung von Proteinen mittels Chromatographie. Als nächstes wird das gereinigte Protein SubProjekt zur Gefriertrocknung, um das Material zu konzentrieren. Schließlich wird das Protein in HFIP wieder gelöst und aus einer mittig Spritzennadel in einem Isopropanol-Bad.
1. Plasmidkonstruktion und Bakterienzellkultur Vorbereitung
- Führen Sie die PCR mit den gewünschten Spinnenseide und cDNA-spezifische Primer-Sets. Gel-Extrakt und Ligieren des amplifizierten cDNA in einen prokaryotischen Expressionsvektor zB pBAD / TOPO ThioFusion (1A). Dieser Vektor hat einen N-terminalen Thioredoxin-Tag Seidenprotein Solubilisierung und einen C-terminalen His-Tag 6x für die Proteinreinigung zu erleichtern. Verwandeln Sie die Ligationsprodukte in kompetente E. coli-Zellen.
- Wählen Kolonien, die den rekombinanten Klonierungsvektor enthalten und mit einer Kolonie in 200 ml sterilem LB mit Ampicillin (1B) ergänzt zu inokulieren. Wachsen diese Kultur über Nacht bis zur Sättigung durch Schütteln bei 200 rpm in einem Orbital Brutschrank bei 37 ° C.
- Kombinieren Sie die 200 ml saturatED-Kultur mit 800 ml frischem LB-Kultur. Induzieren Spinnenseidenprotein Expression für 4 Stunden durch Zugabe von 0,2% Arabinose (w / v). Vergewissern Sie sich, um die Kultur unter Antibiotika-Selektion zu halten.
- Pellet die Zellen bei 16.000 × g für 10 Minuten bei 4 ° C (1C). Der Einfachheit halber Pellet das gesamte Volumen in einem Behälter. Mehrere Zentrifugation Schritte erforderlich sein, abhängig vom Volumen Kapazität der Zentrifugenröhrchen. Falls erforderlich, das Volumen der Flüssigkeit dekantiert nach dem Spinnen und Re-Pellet zusätzliches Material, um die gesamte Zellpellet in einem Behälter zu gewährleisten. Zellpellets können bei -80 ° C gelagert werden, bis sie benötigt.
- Vor der Entsorgung der verbrauchten Kulturmedien, fügen Bleichmittel oder Autoklaven sterilisieren.
2. Cell Lysis
- 20 ml 1x Lysepuffer auf die 1 L Zellpellet (Abb. 2A). Achten Sie darauf, um das Zellpellet vollständig zu resuspendieren.
- In Lysozym auf eine Konzentration von 1 mg / ml weiter zu fördernZell-Lyse. DNase kann auch in diesem Schritt zugegeben werden, um chromosomale DNA zu verdauen zur Verringerung der Viskosität der Lösung. Legen Sie die Probe auf einem Schüttler und für 20 min sanft schaukeln.
- Beschallen der Lösung bei maximal 1 Minute.
- Um die Lösung, Zentrifuge bei 16.000 xg für 10 Minuten klären, bei 4 ° C (Abb. 2B).
3. Protein Purification: Ni-NTA-Affinitäts-Säulenchromatographie
- Entfernen Sie den Überstand und übertragen sie in einem sauberen 25 mL Chromatographiesäule. Stellen Sie sicher, der Überstand nicht-viskos und klar. Falls die Lösung trübe und viskose, fügen Sie mehr DNase oder Sonifikat und / oder Re-Pellet den Überstand (wiederholen Sie die Schritte von 2,3 bis 2,4).
- 1 ml Ni-NTA-Aufschlämmung (0,5 ml Kügelchen) in die Säule. Dicht sichern die Kappe und Hahn, und dann auf einer Wippe gesetzt zur Äquilibrierung 1 h, um die Bindung des 6x His-Tag an die Ni-NTA-Kügelchen (3A).
- Stellen Sie die Säule aufrecht auf einerstehen und damit die Ni-NTA-Beads für ca. 2 Minuten absitzen. Eine hellblaue Schicht kann an der Unterseite gesehen werden, wenn die Perlen vollständig beglichen sind.
- Entfernen Sie den Deckel und lassen Sie die Lösung durch den Hahn fließen. Sammeln diese Lösung für die weitere Analyse (3B).
- 20 ml 1x Waschpuffer und erlauben die Perlen zu begleichen. Öffnen Sie den Wasserhahn und lassen Sie die Lösung durch zu fließen. Sammeln diese Lösung in vier 5 ml-Aliquots zur weiteren Analyse Anmerkung: Zusätzliche Waschvolumina verwendet werden, um verunreinigende Proteine zu reduzieren, doch gibt es eine Möglichkeit einer Verringerung der endgültigen Ausbeute..
- 20 ml 1x Elutionspuffer und damit das Harz zu begleichen. Öffnen Sie den Wasserhahn und lassen Sie die Lösung durch zu fließen. Sammeln diese Lösung in vier 5 ml-Aliquots zur weiteren Analyse. Hinweis: Zusätzliche Elutionsvolumina kann von der Ni-NTA-Harz gesammelt werden, wenn die Elution nicht abgeschlossen ist.
- Proben können in 4 gespeichert werden° C oder -80 ° C für kurz-oder langfristige Lagerung bzw..
- Größe-fraktionieren die Proben mittels SDS-PAGE-Analyse. Visualisieren der Proteine mit Silber oder Coomassie Brilliant Blue R-250 (3C). Nur reinen Fraktionen sollte für die folgenden Schritte verwendet werden. Hinweis: Western-Blot-Analyse kann verwendet werden, um die Identität des gereinigten Proteins zu bestätigen.
4. Dialyse und Gefriertrocknung
- Dialysieren die Proben gegen mindestens 100x das Probenvolumen (VE-Wasser verwenden) für 2 Tage. Ändern des Wasser-Lösung alle 6 Stunden, um alle Salze zu entfernen. Hinweis: Das Molekulargewicht cut-off Größe des Dialyseschlauch hängt von der Größe des rekombinanten Seidenprotein.
- Wiegen Sie sechs 1,5 ml leer Mikrozentrifugenröhrchen und Aufzeichnung ihrer Massen. Es kann nützlich sein, um die Punktion kleinen Löchern oder Schlitzen an den Kappen der Rohre vor dem Wiegen für die Gefriertrocknung der Lyophilisierung zu erleichtern (4A).
- After Dialyse, je 1 ml der dialysierten Probe in jede der 6 vorgewogenen Mikrozentrifugenröhrchen (Abb. 4B). Flash-Hilfe von flüssigem Stickstoff einfrieren und trocknen Sie die Proben nach unten mit einem Gefriertrockner (Abb. 4C).
- Nach dem Trocknen einen anderen zu übertragen 1 mL der Dialyse Probe in jeder der sechs Röhren. Wiederholen, bis die gesamte Probe Dialyse wurde in den Mikrozentrifugenröhrchen getrocknet.
- Gefriergetrocknete Proben können bei -80 ° C zur Langzeitlagerung gelagert werden.
5. Spinnlösung Herstellung
- Wiegen Sie jedes der Mikrozentrifugenröhrchen mit den getrockneten Protein-Pulver. Subtrahieren Sie die anfängliche Masse der leeren Hülsen auf insgesamt trockenen Protein Masse zu erhalten. Hinweis: Je nach Ausbeute an Protein, müssen Sie zusätzliches Material für das Spinnverfahren zu reinigen.
- Berechnen des Volumens Hexafluorisopropanol (HFIP), um in jedes Röhrchen in 200 mg / ml bis 500 mg / ml oder 20% bis 50% Gewicht pro Volumen zu erhalten. Fügen Sie die entspreaß Menge an HFIP in jedes Röhrchen (Abb. 4D). Hinweis: HFIP ist leicht flüchtig und giftig, Pipette vorsichtig und Röhrchen verschließen so bald wie möglich. HFIP sollte unter einer Schutzhaube behandelt werden.
- Parafilm die Rohre und Ort auf einer Wippe, um das Protein löslich zu machen. Vortex-Zentrifuge und gelegentlich zu erleichtern Solubilisierung. Dies kann bis zu 2 Tage.
6. Spritzen-Zubereitung und Apparatebau-Setup
- Legen Sie mindestens 25 ul der solubilisierten Spinnlösung in die Spritze. Stellen Sie sicher, es gibt keine Aggregate präsentieren, wie es die Spritze verstopfen können. Hinweis: Dieses Beispiel ist unglaublich zähe, so kümmern sich beim Pipettieren.
- Schieben Sie das Dope auf der Vorderseite der Spritze senkrecht, Entfernen aller Luftblasen (Abb. 5A). Hinweis: Luftblasen zu Unstimmigkeiten in der Faser.
- Verriegeln Sie die Spritze mit der Pumpe. Heben Sie ein 400 ml Becherglas mit 95% Isopropanol aufgefüllt, so dass die Spitze der Spritzeist nur an der Wasseroberfläche des Alkohols (5B).
- Stellen Sie die Spritzenpumpe auf 15 ul / min und das Programm starten. Lassen Sie die so gesponnene Faser in der Isopropanol für 20 Minuten stehen vollständig ausgleichen lassen. Hinweis: Diese Fasern können weiterhin von MS / MS-Analyse verwendet werden, um die Identität der Proteine in den Fasern zu bestätigen.
7. Post-Spin-Draw und Probenentnahme
- Doppelseitigem Klebeband auf beiden Seiten der Kamm auf der Spulvorrichtung. Die Spulvorrichtung wurde aus Kleben Metallkämme einer digitalen Schieblehre (6A) erstellt. Bringen Sie die Spulvorrichtung mit einem Motor (6B). Wir empfehlen Aufspulen der Fäden bei 2 min. Hinweis: schneller Spooling Bewertung führt zu großen Mengen der Variation in der Faser Qualität und Reproduzierbarkeit.
- Mit einer Pinzette vorsichtig packe einen Ende der Faser und ziehen Sie es langsam aus dem Isopropanol, Befestigung an der Kante eines der Kamm Arme auf der Spule (Abb.. 6C). Die nächsten Schritte sollten ohne Unterbrechung, um die Fasern vor dem Austrocknen zu verhindern getan werden.
- Schalten Sie den Motor und sanft lenken die Faser auf die Spulvorrichtung. Hinweis: Während Spooling, erlauben nicht die Faser zu verdoppeln und zu stapeln oben auf einander.
- Sobald die gesamte Faser gespult wird, nehmen Sie die Spule aus dem Motor und leimen die Kante jeder Seidenfaden auf dem doppelseitigen Klebeband (6D). Dies befestigt die Spinnenseide auf die Vorrichtung. Hinweis: Durch Auftragen des Klebstoffs auf die doppelseitige Klebeband vor dem Schreiben-Spin-Zeichnung, verhindert, dass die gesamte Faser zu fixieren und erlaubt eine selektive Dehnung der inneren Segmente der Fasern innerhalb des Bremssattels Arme.
- Bringen Sie die Spule auf den Linearantrieb (Abb. 7A). Datensatz der anfänglichen Länge der Fasern mit den Bremssattel zu beachten, dass diese die innere Länge der Faser ist;. Nicht dazu gehören die Länge geklebt und gewickelt around die Spule.
- Senken Sie die Spule in einer 75% igen Isopropanol-Bad. Die Fasern müssen für 10 Minuten äquilibrieren Hinweis:. Andere Dehydratisieren Lösungen für die Spinnlösung verwendet werden, wie Methanol, Aceton und Ammoniumsulfat.
- Stellen Sie den Linearantrieb Geschwindigkeit bis 1,5 mm / sec. Auf der Grundlage der ursprünglichen Länge, berechnet die endgültige Länge des gewünschten nach Spinn-Streck-Verhältnis. Die Menge gedehnt werden kann, basierend auf der Geschwindigkeit oder der Länge gesteuert werden, je nach Aufbau. Zum Beispiel, mit einer ursprünglichen Länge von 15 mm und einer gewünschten nach Spinn-Streck-Verhältnis von 3x, sollte die endgültige Länge 45 mm betragen. Dies kann auch den Antrieb der Linearantrieb für 20 Sekunden bei einer Geschwindigkeit von 1,5 mm / s berechnet werden.
- Sobald der gewünschte Beitrag Spin Auslosung beendet ist, heben langsam die Spule aus dem Isopropanol. Lassen Sie die Tropfen von Isopropanol zu 1 Minute lang trocknen, und dann sammeln Proben (Abb. 7B). Die Proben sollten auf Karton oder Folie Frames für Testzwecke montiert werdenPosen.
- Wenn eine weitere Post-Spin Streckverhältnisse gewünscht werden, senken Sie die Spule wieder in die 75% Isopropanol-Bad. Die Fasern müssen für 10 Minuten ins Gleichgewicht, und dann gehen Sie zum nächsten Beitrag Spin Ziehverhältnis.
8. Zugprüfung
- Lassen Sie die gesammelten Proben, um zum Standard-Lab-Umgebung für mindestens 1 Stunde vor der mechanischen Prüfung Gleichgewicht zu bringen. Die Luftfeuchtigkeit und Temperatur sollten aufgenommen, wie sie der Faser mechanischen Eigenschaften beeinflussen können werden. Standard-Feuchtigkeits-und Temperaturbedingungen sollten ca. 40% und 25 ° C sein, beziehungsweise.
- Kleber die Ränder der Karton oder Folie zur Sicherung der Fasern auf dem Rahmen. Beachten Sie die Größe der Öffnung des Rahmens. Dies ist die anfängliche Länge der Faser getestet. Ein 1 Inch (25,4 mm) Öffnung Rahmen hier (8A) gezeigt.
- Mit einem Lichtmikroskop mit einer 100x oder mehr Vergrößerung, nehmen Messungen des Durchmessers entlang der Längs-Faserachse.Mindestens 3 Messungen aufgezeichnet werden sollen. Je höher die Vergrößerung verwendet und je mehr Messungen, desto höher die Genauigkeit.
- Befestigen Sie den Rahmen auf eine mechanische Belastung Tensometer Rahmen (8B). Schneiden Sie den Rahmen auf beiden Seiten, so dass die Spannung nur ausgeführt wird, durch die Faser. Tarieren Tensometer und sammeln die Daten. Ein Standard-Dehnung von 2% pro Sekunde zu verwenden.
- Mit Hilfe der gesammelten Daten und der mittlere Durchmesser kann ein Spannungs-Dehnungs-Kurve aufgetragen werden.
- Der gebrochene Faser kann nun auf einem Rasterelektronenmikroskop (REM) Stub für morphologische Analysen und Messungen Haltepunkt Durchmesser montiert werden. Die Faser-Segment weg von der Bruchstelle lässt sich abschätzen und prüfen Sie den anfänglichen Durchmesser von dem Lichtmikroskop gemessen werden.
9. Repräsentative Ergebnisse
Von Schritt 3, sollten die verschiedenen Fraktionen durch SDS-PAGE-Analyse analysiert werden und die Proteine sichtbar gemacht mit Silberoder Coomassie Brilliant Blue R-250. Von einem Standard-Ni-NTA-Säule Bedingungen kann Elutionsfraktionen mit> 90% Reinheit erhalten (Abb. 9) werden. Kleine verunreinigende Proteine kann durch ausgiebige Dialyse entfernt werden. Bei Verwendung von 25 ul der Spinnlösung bei 20% (w / v), kann um mindestens 30 Faserproben von der kontinuierlichen aufgewickelten Faser auf die Spule (geht von einer Länge von 13 mm verwendet wird) gesammelt werden. Die mechanischen Eigenschaften können durch Tensometer Tests (Abb. 10) analysiert werden. Abhängig von der rekombinanten Seidenprotein für die Spinnlösung verwendet, wird die maximal erreichbare Spinn-Streck-Verhältnis muss empirisch bestimmt werden. In der Regel veröffentlichen Spin Verstreckungsverhältnisse von 4.0x kann ohne LWL-Ausfall (Abb. 10) erreicht werden. Gesponnenen Fasern, vor oder nach dem Spin-Post zeichnen, können mit einem Rasterelektronenmikroskop, um die Ultrastruktur visualisieren (Abb. 11A, B) analysiert werden. Gesponnenen Fasern können auch für mechanische Tests verwendet werden und zeigt die Ergebnisse, die mit niedrigen Variation innerhalb einer post-Spin Ziehverhältnis Probe-Gruppe (Abb. 10).
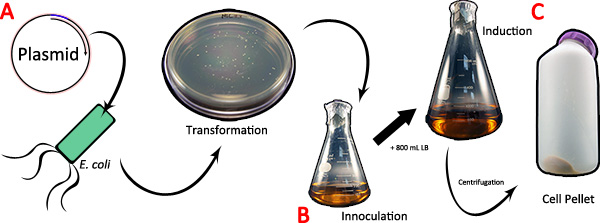
Abbildung 1. Die Expression der Spinnenseide cDNA in Bakterien. A) Die pBAD TOPO / Thio Vektor, der die Spinnenseide cDNA von Interesse wird in kompetente E. transformierten coli-Zellen. B) Eine einzelne Kolonie wird in 200 ml LB inokuliert und über Nacht bis zur Sättigung. Nach der Inokulation, 800 ml frisches LB zugegeben und die Kultur wird für die Expression unter Verwendung Arabinose induziert. C) Zum Abschluss der Induktion ist die Kultur durch Zentrifugation pelletiert. Klicken Sie hier für eine größere Abbildung anzuzeigen .
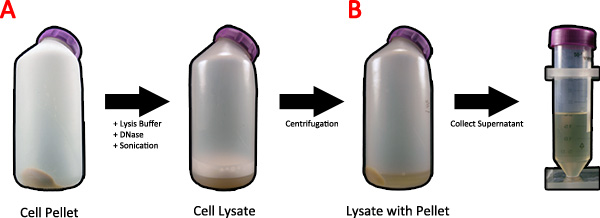
Abbildung 2. Lyse von Bakterienzellen nach Spinnenseidenprotein Induktion. A) Zwanzig milliliTER 1x Lysepuffer und DNase wird das Zellpellet gegeben und auf einem Schüttler und beschallt, um die Zellen zu lysieren. B) Das Zelllysat wird in einer Zentrifuge geschleudert, um den Überstand von Zelltrümmern zu löschen, und der Überstand wird gesammelt. Klicken Sie hier für eine größere Abbildung anzuzeigen .
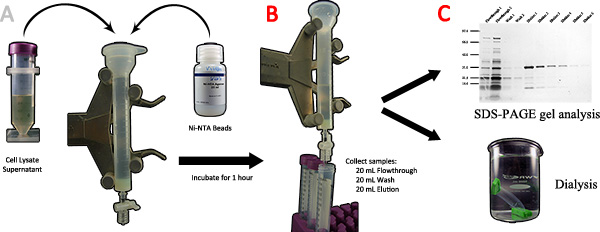
Abbildung 3. Reinigung von Spinnenseide rekombinanten Proteinen unter Verwendung der Affinitätschromatographie. A) Das Zelllysat Überstand und Ni-NTA-Kügelchen auf eine Chromatographiesäule gegeben und für 1 Stunde inkubiert. B) Nach dem Durchlauf gesammelt werden 20 ml Waschpuffer und 20 ml Elutionspuffer in der Sequenz verwendeten gesammelt und in 5 ml-Fraktionen. C) die verschiedenen Fraktionen werden durch SDS-PAGE analysiert, die reine Proben, die das Zielprotein in einen Dialyseschlauch überführt und gegen DI-WasserFertigstellung. Klicken Sie hier für eine größere Abbildung anzuzeigen .

Abbildung 4. Vorbereitung des gereinigten Spinnenseidenprotein für Nassverspinnen. A) Die dialysierte Produkt wird vorgewogenen Zentrifugenröhrchen in 1 ml-Aliquots übertragen. B) Die 1 ml Aliquots blinkt mit flüssigem Stickstoff eingefroren. C) Die gefrorenen Proben werden lyophilisiert und Dialyse Probe zugegeben wird. D) getrocknete Masse wird berechnet und HFIP wird auf das trockene Pulver zugesetzt, um eine 20% (w / v) Spinnlösung zu produzieren. Klicken Sie hier für eine größere Abbildung anzuzeigen .
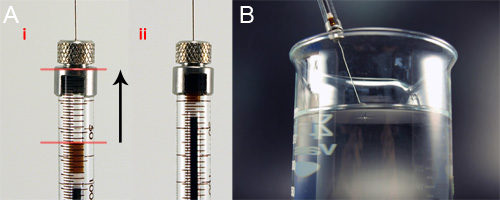
Abbildung 5. Einlegen der Spinnlösung in das Glas Spritze für Nassverspinnen. A) Halten Sie die syringe vertikal, wird die Spinnlösung Zum Anfang der Spritze Säule gedrückt, die Entfernung von Luftblasen. B) Das beladene Spritze ist mit der Spritzenpumpe befestigt und abgesenkt in das 95% Isopropanol-Bad so dass die Spitze nur bricht, ist die Oberfläche des Bades.

Abbildung 6. Spoolen im der synthetischen Spinnenseide Fasern auf ein benutzerdefinierte reeling-Gerät. A) Der Spooling-Gerät wird aus einer digitalen Schieblehre mit angehängten Metall Kämme konstruiert. Doppelseitiges Klebeband wird an beide Seiten des Kamms aufgebracht, um die Faserenden zu befestigen. B) Die Spule ist mit der langsamen Geschwindigkeit des Motors mit einer Krokodilklemme befestigt. C) Die Faser wird langsam aus dem Alkohol-Bad gezogen und gewickelt der Umgebung von der Spule ein. D) Kleber wird an den Rand einer jeden Faser-Segment angewendet, um sie an ihrem Platz halten. Angezeigten Uhrzeiten sind zwei verschiedenen Fasern aus verschiedenen Proteinen gesponnen sind.

Abbildung 7. Post-Spin der synthetischen Fasern mit einem hausgemachten Gerät zu ziehen. A) Die Spulvorrichtung ist an den linearen Stellantrieb Einrichtung mit Krokodilklemmen befestigt. B) Nach einem Schreiben Spinn-Streck-Schritt wird die Spule von dem Bad gehoben. Isopropanol Tröpfchen werden darf, bevor Fasersammelfläche verdampfen.

Abbildung 8. Montage der Kunstseide Fasern auf einem Karton für mechanische Untersuchungen. A) gesammelten Fasern werden auf Karton-Rahmen mit einem 1 "x 1" Aussparung montiert. Die Fasern werden zunächst an Ort und Stelle mit doppelseitigem Klebeband gehalten und dann mit Kleber fixiert. B) Der Karton Rahmen auf einen Dehnungsmesser befestigt. Die Seiten werden dann geschnitten, so dass die Spannung nur läuft, wenn die Faser.
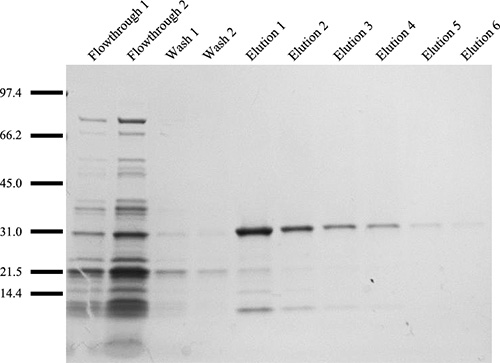
Abbildung 9. Größe Fraktionierung von gereinigter rekombinanter MaSp1 Protein Fraktionen mittels SDS-PAGE-Analyse durch Visualisierung mit Silberfärbung gefolgt. Protein Marker wird in kDa gezeigt. Die beiden Waschproben für unspezifische Bindung an die Beads, während die Elution Proben die Notwendigkeit für 6 Sammlungen zeigen zu Gesamtprotein Erholung zu gewährleisten.
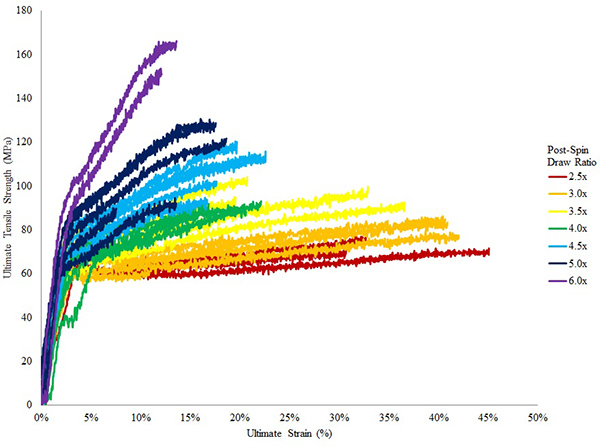
Abbildung 10. Spannungs-Dehnungs-Kurven von Fasern aus rekombinanten Proteinen TuSp1 gesponnen. 8 Farben zeigen Fasern, die unter anderen Post-Spin Streckverhältnisse und reicht von 2,5 x bis 6x waren. Fasern zeigen geringe Variation in ihrem Verhältnis steht; als Post Spinn-Streck-Verhältnis erhöht die Festigkeit der Faser erhöht wird, während Dehnbarkeit verringert wird.

Abbildung 11. Rasterelektronenmikroskopische Bilder von Fasern aus rekombinanten Proteinen TuSp1 gesponnen. A) bei 500-facher Vergrößerung, desto glatterOberflächen zu erkennen. B) An 5000x kann das Innere dichten Kern aus einem natürlichen Bruch der Faser beobachtet werden.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Synthetische Fasern, die aus dieser Methode versponnen werden mechanisch auf der gleichen Größenordnung im Vergleich zu den natürlichen Fasern. Durch die Verringerung der Menge an menschlichem Versagen durch Mechanisierung der Spooling-und Post-Spin Auslosung Prozesse, sind die experimentelle Variation zwischen den Proben kontrollierter und stark reduziert.
Unsere Methodik bietet die Möglichkeit, die mechanischen Eigenschaften der Fasern, die aus anderen rekombinanten Proteinen aus den c...
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wurde von der NSF RUI Grants MCB-0950372 und DMR-1105310 mit dem Titel "Molekulare Charakterisierung von Black Widow Spider Silks und mechanische Verhalten von Spider Silks Kleber", bzw. unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagenz / Ausrüstung | Firma | Katalog-Nummer | Kommentare |
| pBAD / TOPO Expression Kit ThioFusion | Invitrogen | K370-01 | |
| FastBreak Cell Lysis Reagent, 10x | Promega | V857C | |
| Ni-NTA-Agarose | Qiagen | 30210 | Inklusive Anleitung für Puffer |
| ProteoSilver Silver Stain Kit | Sigma-Aldrich | PROTSIL1-1KT | |
| FreeZone Lyophilisierer | Labconco | 7960041 | FreeZone 12plus |
| Hexafluorisopropanol (HFIP) | Sigma-Aldrich | 52512 | |
| Spritze | Hamilton | 7657-01 | 250 ul |
| Nadel | Hamilton | 7780-01 | 26s Gauge, Blunt Ende auswechselbarer Nadel |
| Spritzenpumpe | Harvard Apparatus | 702208 | 11Plus |
| Digitaler Messschieber | Carrera | CP5906 | 0-150 mm-Bereich |
| Edelstahlpinzette | World Precision Instruments | 501764 | Mini Dumont # M5S |
| Motor | Natur Mill | 7090529 | 12VDC, 2 min-Geschwindigkeit |
| Linear Actuator | Warner Electric | 01-D024-0050-A06-LP-IP65 | 24VDC, 6-Zoll-Bereich |
| Seziermikroskop | Leica Microsystems | Leica MZ16 | |
| Digitales MikroskopOPE-Kamera | Leica Microsystems | DFC320 | Software: Leica Application Suite v2.8.1 |
| Vannas Schere | World Precision Instruments | 500260 | |
| Microtensometer | Aurora Scientific | 310C | 5N Dual-Mode-System |
Referenzen
- Gosline, J. M., Guerette, P. A., Ortlepp, C. S., Savage, K. N. The mechanical design of spider silks: from fibroin sequence to mechanical function. J. Exp. Biol. 202, 3295-3303 (1999).
- Foelix, R. Biology of spiders. , Oxford University Press. New York. (1996).
- Vollrath, F., Knight, D. P. Liquid crystalline spinning of spider silk. Nature. 410, 541-548 (2001).
- Spiess, K., Lammel, A., Scheibel, T. Recombinant spider silk proteins for applications in biomaterials. Macromol. Biosci. 10, 998-1007 (2010).
- Stark, M., Grip, S., Rising, A., Hedhammar, M., Engstrom, W., Hjalm, G., Johansson, J. Macroscopic fibers self-assembled from recombinant miniature spider silk proteins. Biomacromolecules. 8, 1695-1701 (2007).
- Lazaris, A., Huang, Y., Zhou, J. F., Duguay, F., Chretien, N., Welsh, E. A., Soares, J. W., Karatzas, C. N. Spider Silk Fibers Spun from Soluble Recombinant Silk Produced in Mammalian Cells. Science. 295, 472-476 (2002).
- Teule, F., Cooper, A. R., Furin, W. A., Bittencourt, D., Rech, E. L., Brooks, A., Lewis, R. V. A protocol for the production of recombinant spider silk-like proteins for artificial fiber spinning. Nat. Protoc. 4, 341-355 (2009).
- Gnesa, E., Hsia, Y., Yarger, J. L., Weber, W., Lin-Cereghino, J., Lin-Cereghino, G., Tang, S., Agari, K., Vierra, C. Conserved C-Terminal Domain of Spider Tubuliform Spidroin 1 Contributes to Extensibility in Synthetic Fibers. Biomacromolecules. , (2011).
- Hayashi, C. Y., Shipley, N. H., Lewis, R. V. Hypotheses that correlate the sequence, structure, and mechanical properties of spider silk proteins. Int. J. Biol. Macromol. 24, 271-275 (1999).
- Xu, M., Lewis, R. V. Structure of a protein superfiber: Spider Dragline Silk. Proc. Natl. Acad. Sci. 87, 7120-7124 (1990).
- Hayashi, C. Y., Blackledge, T. A., Lewis, R. Molecular and mechanical characterization of aciniform silk: uniformity of iterated sequence modules in a novel member of the spider silk fibroin gene family. Mol. Biol. Evol. 21, 1950-1959 (2004).
- Lazaris, A., Arcidiacono, S., Huang, Y., Zhou, J. F., Duguay, F., Chretien, N., Welsh, E. A., Soares, J. W., Karatzas, C. N. Spider silk fibers spun from soluble recombinant silk produced in mammalian cells. Science. 295, 472-476 (2002).
- Arcidiacono, S., Mello, C., Kaplan, D., Cheley, S., Bayley, H. Purification and characterization of recombinant spider silk expressed in Escherichia coli. Appl. Microbiol. Biotechnol. 49, 31-38 (1998).
- Menassa, R., Zhu, H., Karatzas, C. N., Lazaris, A., Richman, A., Brandle, J. Spider dragline silk proteins in transgenic tobacco leaves: accumulation and field production. Plant Biotechnology Journal. 2, 431-438 (2004).
- Scheller, J., Guhrs, K. H., Grosse, F., Conrad, U. Production of spider silk proteins in tobacco and potato. Nat. Biotechnol. 19, 573-577 (2001).
- An, B., Hinman, M. B., Holland, G. P., Yarger, J. L., Lewis, R. V. Inducing beta-sheets formation in synthetic spider silk fibers by aqueous post-spin stretching. Biomacromolecules. 12, 2375-2381 (2011).
- Elices, M., Guinea, G. V., Plaza, G. R., Karatzas, C., Riekel, C., Agullo-Rueda, F., Daza, R., Perez-Rigueiro, J. Bioinspired Fibers Follow the Track of Natural Spider Silk. Macromolecules. 44, 1166-1176 (2011).
- Scheller, J., Guhrs, K. H., Grosse, F., Conrad, U. Production of spider silk proteins in tobacco and potato. Nature Biotechnology. 19, (2001).
- Kojic, N., Kojic, M., Gudlavalleti, S., McKinley, G. Solvent removal during synthetic and Nephila fiber spinning. Biomacromolecules. 5, 1698-1707 (2004).
- Jeffery, F., La Mattina, C., Tuton-Blasingame, T., Hsia, Y., Gnesa, E., Zhao, L. Microdissection of Black Widow Spider Silk-producing Glands. J. Vis. Exp. (47), e2382(2011).
- Blasingame, E., Tuton-Blasingame, T., Larkin, L., Falick, A. M., Zhao, L., Fong, J., Vaidyanathan, V., Visperas, A., Geurts, P., Hu, X., La Mattina, C., Vierra, C. Pyriform spidroin 1, a novel member of the silk gene family that anchors dragline silk fibers in attachment discs of the black widow spider, Latrodectus hesperus. J. Biol. Chem. 284, 29097-29108 (2009).
- La Mattina, C., Reza, R., Hu, X., Falick, A. M., Vasanthavada, K., McNary, S., Yee, R., Vierra, C. A. Spider minor ampullate silk proteins are constituents of prey wrapping silk in the cob weaver Latrodectus hesperus. Biochemistry. 47, 4692-4700 (2008).
- Hsia, Y., Gnesa, E., Jeffery, F., Tang, S., Vierra, C. Spider Silk Composites and Applications. Metal, Ceramic and Polymeric Composites for Various Uses. Cuppoletti, J. 2, InTech. 303-324 (2011).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten