È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Sintetico di produzione Spider Silk su scala di laboratorio
In questo articolo
Riepilogo
Nonostante le notevoli proprietà meccaniche e biochimiche di seta di ragno, questo materiale non può essere raccolto in grandi quantità con mezzi convenzionali. Qui descriviamo una strategia efficace per far girare fibre artificiali in seta di ragno, che è un processo importante per i ricercatori che studiano la produzione della seta di ragno e il loro uso come biomateriali di nuova generazione.
Abstract
Mentre la società progredisce e le risorse diventano più rari, sta diventando sempre più importante per coltivare nuove tecnologie che biomateriali ingegnere prossima generazione con caratteristiche ad alte prestazioni. Lo sviluppo di questi nuovi materiali strutturali deve essere rapido, conveniente e le metodologie di lavorazione e prodotti rispettosi dell'ambiente e sostenibili. Ragni tessono una moltitudine di diversi tipi di fibra con proprietà meccaniche diverse, offrendo una ricca fonte di materiale per la prossima generazione di ingegneria biomimicry che i rivali con i migliori materiali naturali o causati dall'uomo. Dato che la raccolta di grandi quantità di seta di ragno naturale è impraticabile, la produzione di seta sintetica ha la capacità di fornire agli scienziati l'accesso a una riserva illimitata di thread. Pertanto, se il processo di filatura può essere semplificato e perfezionato, ragno fibre artificiali hanno il potenziale utilizzo per una vasta gamma di applicazioni che vanno da giubbotti antiproiettile, sutura chirurgicas, corde e funi, pneumatici, corde per strumenti musicali, e compositi per l'aviazione e la tecnologia aerospaziale. Per far avanzare il processo di produzione della seta sintetica e per produrre fibre che visualizzano la varianza bassa nelle loro proprietà del materiale dallo spin a girare, abbiamo sviluppato una filatura a umido protocollo che integra l'espressione di proteine ricombinanti in batteri seta di ragno, la purificazione e la concentrazione delle proteine , seguita da estrusione fibra e uno meccanico post-rotazione trattamento. Questa è la prima rappresentazione visiva che rivela un passo-passo processo a girare e analizzare fibre di seta artificiali su scala di laboratorio. Fornisce inoltre i dettagli per ridurre al minimo l'introduzione della variabilità tra le fibre filate dalla droga stessa filatura. Collettivamente, questi metodi spingerà il processo di produzione della seta artificiale, che porta alle fibre di qualità superiore che superano sete ragno naturali.
Introduzione
Seta di ragno ha straordinarie proprietà meccaniche che esegue i materiali artificiali, tra cui acciaio ad alta resistenza, Kevlar e Nylon. 1 ragni tessono almeno 6-7 diversi tipi di fibra che consentono di visualizzare le proprietà meccaniche diverse, ognuna progettata con quantità variabili di resistenza alla trazione ed estensibilità per eseguire specifici compiti biologici. 2 Ricercatori stanno rapidamente perseguendo l'uso della seta di ragno, come biomateriali di nuova generazione a causa delle loro eccezionali proprietà meccaniche, la loro biocompatibilità, e la loro natura non-tossico e il verde-materiale. 3,4 A causa del cannibale e natura velenosa di aracnidi, raccolta sete di ragno attraverso l'agricoltura non è una strategia concreta per soddisfare le esigenze necessarie per la produzione su scala industriale. Pertanto, gli scienziati sono rivolti alla produzione di proteine ricombinanti in seta organismi transgenici in vitro accoppiata con la filatura di fibre sintetiche dalsé proteine purificate. 5-8 Espressione di full-length proteine ricombinanti della seta di ragno è stato tecnicamente difficile, viste le proprietà intrinseche delle sequenze di geni, tra cui la loro natura altamente ripetitiva e lunghezze fisiche (> 15 kb), GC ricco di contenuti e di parte alanina e glicina utilizzo codone. 9-11 Fino ad oggi, la maggior parte dei laboratori si sono concentrati sulla esprimere forme troncate delle principali proteine della seta ampullate MaSp1 o MaSp2 utilizzando sequenze di cDNA parziali o geni sintetici. 12-15 Spinning sintetica ragno sete è un processo impegnativo, che richiede padronanza e conoscenza in diverse discipline scientifiche, e la complessità del processo di filatura non sono state pienamente rivelato al grande pubblico dalla rappresentazione video. In realtà, solo una manciata di laboratori in tutto il mondo hanno la capacità di esprimere i cDNA di seta di ragno, purificare le proteine della seta, fibre sintetiche e girare ad un post-spin pareggio, e infine testare le loro proprietà biomateriale. 8,16,17 Approcci diversi per la filatura delle fibre sintetiche hanno circondato filatura ad umido e secco così come i metodi electrospinning 16,18,19 Tutte le procedure hanno un solo obiettivo in comune -. Sviluppo di un protocollo che produce seta sintetica ragno con proprietà meccaniche che rivali filati naturali per i grandi processi di produzione commerciale.
Qui viene descritta la procedura per generare sete ragno artificiali su scala di laboratorio utilizzando una metodologia di filatura a umido. Rispetto ad altri metodi di filatura, filatura ad umido ha prodotto i risultati più consistenti per l'analisi delle fibre. Si delineano questo inizio procedura con l'espressione delle proteine della seta ricombinanti in batteri, seguito dal loro purificazione, e quindi descrivere le fasi di preparazione di proteine per la filatura, tra cui una post-rotazione metodologia applicata al sorteggio "così come" le fibre filate che produce fili con proprietà dei materiali che si avvicinano la qualità delle sete ragno naturali. Il nostro metodologicoy è progettato per imitare da vicino il processo naturale di filatura di fibre di seta e richiama fortemente sulla nostra esperienza dell'architettura e la funzione delle ghiandole produttrici di seta di orb e COB-tessitura ragni. 20-22 Inoltre, concludiamo con la necessaria procedura per determinare le proprietà del materiale delle fibre sintetiche utilizzando un tensometer per tracciare curve sforzo-deformazione, che consentono investigatori calcolare il carico di rottura, deformazione ultima, e la tenacità delle fibre. Infine, ma di notevole valore, gli apparati di filatura, lo spooling, e il disegno può essere a casa, costruiti utilizzando parti disponibili in commercio, piuttosto che l'acquisto elaborate e costose attrezzature personalizzate.
Protocollo
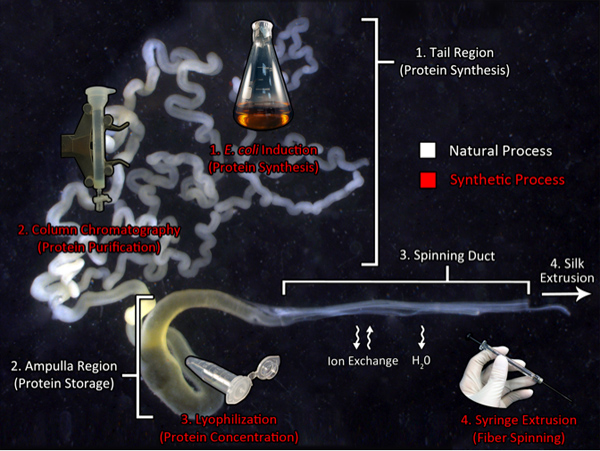
Grafica Panoramica: Biomimicry del processo di filatura
Biomimicry del naturale percorso di produzione della seta di ragno:. Un percorso per la produzione di seta sintetica Questa immagine mostra la ghiandola principale ampullate dal globo d'oro tessitore, Nephila clavipes, ed i componenti utilizzati per la produzione di seta naturale (testo bianco). La regione coda sintetizza grandi quantità di proteine della seta che vengono trasportati al ampolla, una regione di memorizzazione per la droga filatura. Questo concentrato droga viene estruso attraverso il condotto di filatura in cui la soluzione sperimenta scambi ionici e disidratazione prima dell'estrusione fibra. I processi biomimetici utilizzati nel nostro laboratorio sono indicati dal testo di colore rosso. Ricombinante produzione della seta è prodotta con batteri transgenici, seguita da purificazione di proteine mediante cromatografia. Successivamente, la proteina purificata è subgetto di liofilizzazione per concentrare il materiale. Infine, la proteina viene ridisciolto in HFIP e estrusa da una siringa in un bagno di isopropanolo.
1. Costruzione del plasmide e batteriche Preparazione coltura cellulare
- Eseguire PCR utilizzando le desiderate ragno serie di primer cDNA seta e specifici. Gel-estrarre e legare il cDNA amplificato in un vettore di espressione procariotico esempio pBAD / TOPO ThioFusion (Fig. 1A). Questo vettore ha un N-terminale per facilitare tag tioredossina solubilizzazione delle proteine della seta e C-terminale 6x-tag per la purificazione di proteine. Trasformare i prodotti legatura in competente E. coli cellule.
- Selezionare colonie che contengono il vettore ricombinante di clonazione ed utilizzare una colonia per inoculare 200 ml di LB sterile supplementato con ampicillina (Fig. 1B). Grow questa coltura durante la notte a saturazione agitando a 200 rpm in un incubatore orbitale a 37 ° C.
- Combina la 200 ml di saturated cultura con 800 ml di coltura LB fresco. Inducono l'espressione di proteine di seta ragno per 4 ore aggiungendo 0,2% arabinosio (w / v). Assicurarsi di mantenere la cultura in fase di selezione antibiotica.
- Pellet le cellule a 16.000 xg per 10 minuti a 4 ° C (Fig. 1C). Per semplicità, pellet l'intero volume in un contenitore. Le fasi di centrifugazione multipli può essere necessario a seconda della capacità volume dei tubi centrifugazione. Se necessario, decantare il volume del liquido dopo la filatura e ri-pellet materiale aggiuntivo per assicurare l'intera cella pellet è in un contenitore. I pellet cellulari possono essere conservati a -80 ° C fino al momento.
- Prima dello smaltimento dei terreni di coltura spesi, aggiungere candeggina o in autoclave per la sterilizzazione.
2. Lisi cellulare
- Aggiungere 20 mL di 1x tampone di lisi alla cella 1 pellet L (Fig. 2A). Assicurati di risospendere il pellet cellulare completamente.
- Aggiungere lisozima a una concentrazione di 1 mg / mL per promuovere ulteriormentelisi cellulare. DNasi può anche essere aggiunto in questa fase per digerire il DNA cromosomico per ridurre la viscosità della soluzione. Mettere il campione su un agitatore orbitale e agitare delicatamente per 20 min.
- Sonicare la soluzione al massimo per 1 minuto.
- Per chiarire la soluzione, centrifuga a 16.000 xg per 10 minuti a 4 ° C (Fig. 2B).
3. Purificazione delle proteine: Ni-NTA Affinity Chromatography Column
- Rimuovere il supernatante e trasferirlo in una colonna cromatografica pulita 25 mL. Assicurarsi che il surnatante non è viscoso e chiaro. Se la soluzione è viscoso e nuvoloso, aggiungere più DNase o Sottoporre ad ultrasuoni e / o ri-pellet il surnatante (ripetere i passi 2,3-2,4).
- Aggiungere 1 mL di Ni-NTA slurry (0,5 perle mL) nella colonna. Fissare saldamente il tappo e rubinetto, e quindi impostare su un rocker equilibrare per 1 ora per consentire il legame del suo 6x-tag alle Ni-NTA perle (Fig. 3A).
- Impostare la colonna verticale su unastare in piedi e permettere ai Ni-NTA perline riposare per circa 2 minuti. Uno strato di luce blu può essere visto in fondo quando le perle sono completamente risolta.
- Rimuovere il tappo e consentire alla soluzione di fluire attraverso il rubinetto. Raccogliere questa soluzione per ulteriore analisi (fig. 3B).
- Aggiungere 20 ml di tampone di lavaggio 1X e lasciare le sfere di stabilirsi. Aprire il rubinetto e consentire alla soluzione di fluire attraverso. Raccogliere questa soluzione in quattro aliquote di 5 mL per ulteriore analisi Nota: volumi lavaggio aggiuntivi possono essere utilizzati per ridurre proteine contaminanti, tuttavia, vi è la possibilità di una diminuzione della resa di proteine finale..
- Aggiungere 20 ml di 1x tampone di eluizione e consentire alla resina di depositarsi. Aprire il rubinetto e consentire alla soluzione di fluire attraverso. Raccogliere questa soluzione in quattro aliquote di 5 mL per ulteriore analisi. Nota: volumi di eluizione aggiuntivi possono essere raccolti dalla resina Ni-NTA se l'eluizione non è completata.
- I campioni possono essere conservati in 4° C o -80 ° C a breve o lunga conservazione a lungo termine, rispettivamente.
- Size-frazionare i campioni con SDS-PAGE analisi. Visualizzare le proteine con argento o Coomassie Brilliant Blue R-250 (Fig. 3C). Solo le frazioni pure deve essere utilizzato per le fasi seguenti. Nota: Analisi Western blot può essere utilizzata per confermare l'identità della proteina purificata.
4. Dialisi e liofilizzazione
- Dializzare i campioni contro almeno 100x il volume del campione (utilizzare acqua deionizzata) per 2 giorni. Cambiare la soluzione di acqua ogni 6 ore per rimuovere tutti i sali. Nota: Le dimensioni peso molecolare cut-off del tubo di dialisi dipende dalle dimensioni della proteina ricombinante seta.
- Pesare sei provette da 1,5 ml microcentrifuga vuoti e registrare le loro masse. Può essere utile per piccoli fori o fessure puntura sui tappi dei tubi prima di pesatura per liofilizzazione per facilitare la liofilizzazione (Fig. 4A).
- After dialisi, trasferimento 1 mL di campione dializzato in ciascuno dei 6 pre-pesato microcentrifuga tubi (Fig. 4B). Flash congelamento in azoto liquido e asciugare i campioni verso il basso con un liofilizzatore (Fig. 4C).
- Una volta asciutto, trasferire un'altra 1 mL di campione dialisi in ciascuna delle sei provette. Ripetere fino a quando il campione di dialisi intero è stato asciugato verso il basso nei tubi microcentrifuga.
- I campioni liofilizzati possono essere conservati a -80 ° C per una conservazione a lungo termine.
5. Spinning Preparazione Dope
- Pesare ciascuno dei tubi da microcentrifuga contenente la polvere essiccata proteina. Sottrarre la massa iniziale dei tubi vuoti per ottenere la massa totale a secco delle proteine. Nota: A seconda della resa di proteine, potrebbe essere necessario purificare materiale aggiuntivo per il processo di filatura.
- Calcolare il volume di esafluoroisopropanolo (HFIP) per aggiungere a ciascuna provetta per ottenere 200 mg / ml a 500 mg / ml, o 20% al 50% in peso per volume. Aggiungere il approprimangiato quantità di HFIP in ogni provetta (Fig. 4D) Nota:. HFIP è altamente volatile e tossico, pipetta accuratamente e tappare il tubo appena possibile. HFIP deve essere manipolato sotto una cappa di sicurezza.
- Parafilm i tubi e posto su una sedia a dondolo per solubilizzare la proteina. Vortex e centrifugare di tanto in tanto per facilitare la solubilizzazione. Questo può richiedere fino a 2 giorni.
6. Siringa Preparazione e installazione di apparecchi
- Caricare almeno 25 pl della soluzione per filatura solubilizzata filatura nella siringa. Assicurarsi che non vi siano aggregati presentano come potrebbe intasare la siringa. Nota: Questo esempio è incredibilmente viscoso, quindi attenzione quando si pipetta.
- Spingere la droga verso la parte anteriore della siringa verticalmente, rimuovendo tutte le bolle d'aria (Fig. 5A). Nota: Le bolle d'aria creare incongruenze nella fibra.
- Bloccare la siringa alla pompa. Sollevare un becher 400 ml riempito con il 95% fino isopropanolo modo che la punta della siringaè solo rompendo la superficie del alcol (Fig. 5B).
- Impostare la pompa a siringa a 15 microlitri / min e avviare il programma. Lasciare come filato di fibre a sedersi in isopropanolo per 20 minuti per equilibrare completamente Nota:. Queste fibre possono ancora essere utilizzato da MS / MS per confermare l'identità delle proteine nelle fibre.
7. Post-rotazione Draw e la raccolta del campione
- Applicare nastro biadesivo ad entrambi i lati del pettine sul dispositivo roccatura. Il dispositivo di roccatura è stato realizzato con incollaggio pettini metallici ad un calibro digitale (Fig. 6A). Collegare il dispositivo di spooling ad un motore (Fig. 6B). Si consiglia di bobinare i fili a 2 giri. Nota: i tassi più velocemente risultato spooling in grandi quantità di variazione della qualità delle fibre e riproducibilità.
- Uso pinza delicatamente afferrare un'estremità della fibra e estrarlo lentamente del isopropanolo, collegandolo al bordo di uno dei bracci pettine sul cursore (Fig. 6C). I prossimi passi dovrebbe essere fatto senza un arresto per evitare che le fibre si asciughi.
- Accendere il motore e guidare delicatamente la fibra sul Nota roccatura dispositivo:. Durante roccatura, non consentono la fibra di raddoppiare e impilare uno sopra l'altro.
- Una volta che la fibra intera è spooler, staccare il cassetto dal motore e applicare colla sul bordo di ciascuna fibra seta sul nastro biadesivo (Fig. 6D). Questo fissa il seta spider su dell'apparato. Nota: Applicando la colla al nastro biadesivo prima post-rotazione disegno, impedisce la fibra intera di scivolare e permette selettiva allungamento dei segmenti interni delle fibre all'interno della pinza armi.
- Fissare la bobina per l'attuatore lineare (Fig. 7A). Registrare la lunghezza iniziale delle fibre con la pinza Si noti che questa è la lunghezza interna della fibra;. Non comprende la lunghezza incollata e avvolto around la bobina.
- Abbassare la bobina in un bagno di 75% di isopropanolo. Lasciare le fibre equilibrare per 10 minuti Nota:. Altre soluzioni disidratanti possono essere utilizzati per il processo di filatura, come solfato di metanolo, acetone e ammonio.
- Impostare la velocità lineare dell'attuatore a 1,5 mm / sec. Sulla base della lunghezza iniziale, calcolare la lunghezza finale per il post-rotazione desiderato rapporto di stiramento. La quantità allungato può essere controllato sulla base della velocità o la lunghezza, a seconda del set up. Ad esempio, con una lunghezza iniziale di 15 mm e una desiderata post-rotazione rapporto di stiro di 3 volte, la lunghezza finale dovrebbe essere di 45 mm. Questo può anche essere calcolata come alimentare l'attuatore lineare per 20 secondi ad una velocità di 1,5 mm / sec.
- Una volta che il desiderato pareggio di spin post è completo, sollevare lentamente la bobina fuori dal isopropanolo. Lasciare le goccioline di isopropanolo asciugare per 1 minuto, e poi raccogliere campioni (Fig. 7B). I campioni devono essere montati su telai cartoncini o fogli per il test purpose.
- Se ulteriori rapporti post-pareggio di spin si desiderano, abbassare lo schienale spool nella vasca da bagno 75% di isopropanolo. Lasciare le fibre si stabilizzi per 10 minuti, e poi proseguire con il prossimo rapporto di stiro di spin post.
8. Prove di trazione
- Lasciare i campioni raccolti per equilibrare l'ambiente di laboratorio standard per almeno 1 ora prima della prova meccanica. L'umidità e la temperatura deve essere registrata in quanto possono influenzare le proprietà meccaniche della fibra. Umidità e condizioni standard di temperatura dovrebbe essere circa il 40% e 25 ° C, rispettivamente.
- Colla i bordi del cartoncino o foglio per fissare la fibra sul telaio. Prendere nota della dimensione dell'apertura del telaio. Questa è la lunghezza iniziale della fibra testati. Un telaio apertura 1 pollice (25,4 mm) è mostrato (Fig. 8A).
- Utilizzando un microscopio ottico con un ingrandimento 100x o maggiore, prendere misurazioni del diametro lungo l'asse longitudinale delle fibre.Almeno 3 misurazioni devono essere registrati. Maggiore è l'ingrandimento utilizzato e le misurazioni più prese, migliore è la precisione.
- Fissare il telaio ad un telaio meccanico di caricamento tensometer (Fig. 8B). Tagliare il telaio su entrambi i lati in modo che la tensione esegue solo attraverso la fibra. Tarare la tensometer e raccogliere i dati. Una aliquota ceppo standard del 2% per secondo.
- Utilizzando i dati raccolti e il diametro medio di una curva sforzo lo stress può essere tracciata.
- La fibra rotta può essere montato su un microscopio elettronico a scansione (SEM) stub per analisi morfologiche e le misurazioni del diametro del punto di rottura. Il segmento fibra lontano dal punto di rottura può essere utilizzato per stimare e controllare il diametro iniziale misurata dal microscopio ottico.
9. Risultati rappresentativi
Dalla fase 3, le diverse frazioni devono essere analizzati mediante analisi SDS-PAGE e le proteine visualizzati con argentoo Coomassie Brilliant Blue R-250. Da uno standard di Ni-NTA condizioni colonna, frazioni eluizione con purezza> 90% può essere ottenuta (Fig. 9). Piccole proteine contaminanti può essere ulteriormente rimosso mediante dialisi estensiva. Utilizzo di 25 pl di filatura droga al 20% (w / v), almeno 30 campioni di fibre separate possono essere raccolti dalla fibra ferita continua sulla bobina (assume una lunghezza iniziale di 13 mm viene utilizzato). Le proprietà meccaniche possono essere analizzati mediante prove tensometer (Fig. 10). A seconda della proteina di seta ricombinante utilizzato per il processo di filatura, i massimi postali rapporti di stiro di spin dovrà essere determinata empiricamente. In generale, post scissione disegnare rapporti di 4.0x possono essere raggiunti senza guasti di fibra (Fig. 10). Fibre filate, prima o dopo estrazione post scissione, possono essere analizzati con un microscopio elettronico a scansione per visualizzare la ultrastruttura (Fig. 11A, B). Fibre filate può anche essere utilizzato per prove meccaniche, visualizzare i risultatiche con la bassa variazione all'interno di un gruppo di spin post di esempio draw ratio (Fig. 10).
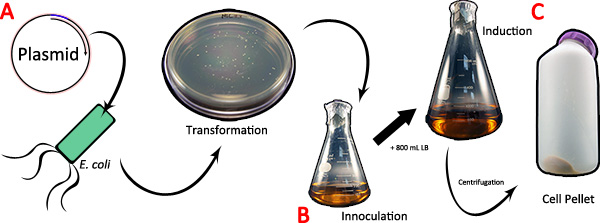
Figura 1. Espressione della ragnatela cDNA in batteri. A) Il TOPO / Thio pBAD vettore contenente la seta di ragno cDNA di interesse si trasforma in competente E. coli cellule. B) Una singola colonia è inoculata in 200 ml di LB e cresciuta a saturazione durante la notte. Dopo inoculazione, 800 ml di LB fresco è aggiunto e la coltura viene indotta per l'espressione mediante arabinosio. C) Al termine di induzione, la cultura è pellettato per centrifugazione. Clicca qui per ingrandire la figura .
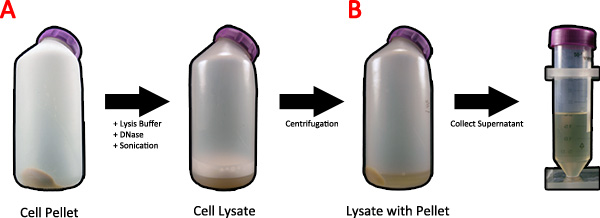
Figura 2. Lisi delle cellule batteriche dopo induzione della proteina di seta ragno. A) Twenty millilitri di lisi 1x tampone e DNasi è aggiunto al pellet e posto su un agitatore orbitale e sonicata per lisare le cellule. B) Il lisato cellulare è filata in una centrifuga per eliminare il surnatante di detriti cellulari, e il surnatante viene raccolto. Clicca qui per ingrandire la figura .
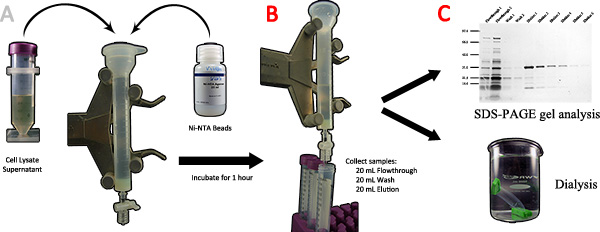
Figura 3. Purificazione di proteine della seta ragno ricombinanti utilizzando la cromatografia di affinità. A) Il lisato cellulare supernatante e Ni-NTA perline vengono aggiunti ad una colonna cromatografica e incubati per 1 ora. B) Dopo l'eluato è raccolto, 20 mL di tampone di lavaggio e 20 mL di tampone di eluizione vengono utilizzati in sequenza e raccolto in frazioni 5 mL. C) Le frazioni differenti sono analizzati mediante SDS-PAGE, i campioni puri contenenti la proteina bersaglio vengono trasferiti ad un sacchetto dialisi e dializzata contro acqua deionizzata acompletamento. Clicca qui per ingrandire la figura .

Figura 4. Preparazione della proteina purificata seta di ragno per la filatura a umido. A) Il prodotto dializzato è trasferito a provette pre-pesato in aliquote da 1 ml. B) Le aliquote da 1 ml sono flash congelato con azoto liquido. C) I campioni congelati sono liofilizzati e campione dialisi più viene aggiunto. D) la massa essiccata viene calcolato e HFIP viene aggiunto alla polvere secca per produrre un droga 20% (w / v) filatura. per vedere figura maggiore .
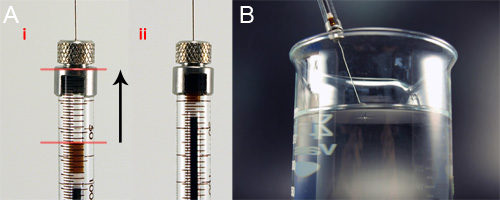
Figura 5. Caricamento della soluzione per filatura filatura nella siringa di vetro per filatura a umido. A) Tenendo premuto il syringe verticalmente, dope di filatura viene spinto alla sommità della colonna siringa, rimuovere bolle di aria. B) La siringa caricato viene attaccato alla pompa a siringa e abbassata nella vasca 95% isopropanolo modo che la punta è solo rompendo la superficie del bagno.

Figura 6. Spooling delle fibre sintetiche di seta di ragno su un dispositivo personalizzato trattura. A) Il dispositivo di roccatura è costruito da un calibro digitale con annesso pettini metallici. Il nastro biadesivo viene applicato a entrambi i lati del pettine per fissare le estremità delle fibre. B) Il rocchetto è collegato al motore a bassa velocità mediante un coccodrillo. C) La fibra viene tirata lentamente dal bagno di alcol e avvolto intorno il rocchetto. D) colla viene applicata al bordo di ciascun segmento fibra per trattenerli in posizione. Vengono mostrati due diverse fibre filate da diverse proteine.

Figura 7. Post-rotazione trarre delle fibre sintetiche utilizzando un apparecchio casalingo. A) Il dispositivo di spooling è collegato alla configurazione attuatore lineare con morsetti a coccodrillo. B) Dopo una fase di pareggio post scissione, la bobina viene sollevato dal bagno. Goccioline isopropanolo sono autorizzati a evaporare prima della raccolta delle fibre.

Figura 8. Montaggio delle fibre di seta sintetica su un cartoncino per gli studi meccanici. A) fibre Collected sono montati su telai cartoncini con un ritaglio 1 "x 1". Le fibre sono inizialmente fissato con nastro biadesivo, e quindi fissate con colla. B) Il telaio cartoncino è fissato su un tensometer. I lati vengono quindi tagliati in modo che la tensione esegue solo se la fibra.
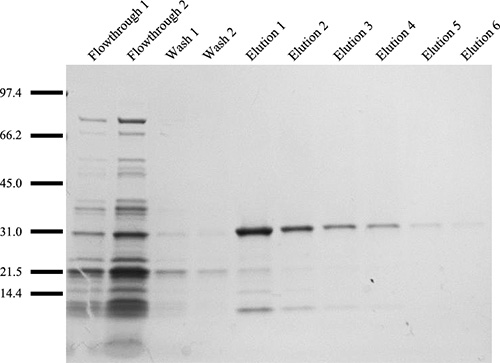
Figura 9. Size frazionamento di ricombinante purificata Protei MaSp1n frazioni utilizzando analisi SDS-PAGE seguita da visualizzazione con colorazione argentica. Scala delle proteine è raffigurato in kDa. I due campioni di lavaggio mostra il legame non specifico alle perline, mentre i campioni di eluizione rivelare la necessità di 6 raccolte per garantire il recupero di proteine totali.
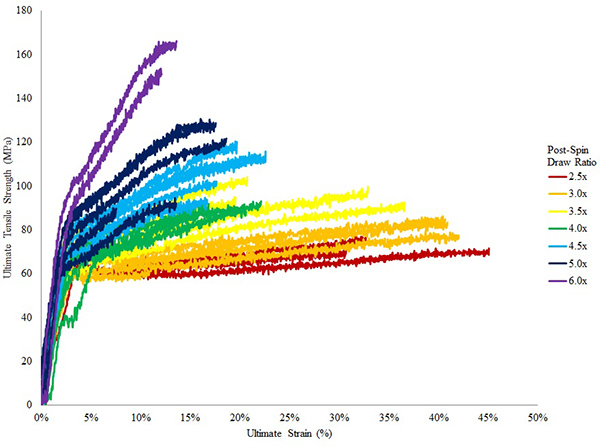
Figura 10. Curve stress di deformazione di fibre filate da TuSp1 proteine ricombinanti. 8 colori mostrano le fibre che sono state oggetto di diversi rapporti postali di spin pareggio, che vanno da 2,5 x a 6x. Fibre mostra bassa variazione nel loro gruppo rapporto; come spin messaggio draw aumento rapporti, la resistenza della fibra è aumentata mentre estensibilità è diminuita.

Figura 11. Acquisizione di immagini di microscopia elettronica di fibre filate da TuSp1 proteine ricombinanti. A) A ingrandimento 500x, esterno lisciosuperficie può essere visto. B) In 5000x, il nucleo interno denso può essere osservato da una rottura di fibra naturale.
Discussione
Fibre sintetiche filate da questa metodologia sono meccanicamente dello stesso ordine di grandezza rispetto alle fibre naturali. Diminuendo la quantità di errore umano meccanizzare la roccatura e post processi di tiraggio di spin, la variazione tra i campioni sperimentali sono più controllata e notevolmente ridotto.
La nostra metodologia offre la possibilità di studiare le proprietà meccaniche di altre fibre che sono filate dalle proteine ricombinanti codificate dai cDNA di altri m...
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Questo lavoro è stato supportato da NSF Grants RUI MCB-0950372 e DMR-1105310 dal titolo "Caratterizzazione molecolare di sete ragno vedova nera e comportamento meccanico di Spider Silks Colla", rispettivamente.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagente / Attrezzature | Azienda | Numero di catalogo | Comments |
| pBAD / TOPO ThioFusion Kit Expression | Invitrogen | K370-01 | |
| Contropiede Lysis Reagent Cell, 10x | Promega | V857C | |
| Ni-NTA agarosio | Qiagen | 30210 | Include le istruzioni per i buffer |
| ProteoSilver Argento Kit Stain | Sigma-Aldrich | PROTSIL1-1KT | |
| FreeZone Liofilizzatore | Labconco | 7960041 | FreeZone 12Plus |
| Esafluoroisopropanolo (HFIP) | Sigma-Aldrich | 52512 | |
| Siringa | Hamilton | 7657-01 | 250 pl |
| Ago | Hamilton | 7780-01 | Gauge 26s, Blunt rimovibile fine dell'ago |
| Pompa a siringa | Harvard Apparatus | 702208 | 11Plus |
| Digital Caliper | Carrera | CP5906 | 0-150 mm Campo |
| Pinza in acciaio inox | Mondo Strumenti di precisione | 501764 | Mini Dumont # M5S |
| Motore | Nature Mill | 7090529 | 12VDC, 2 rpm di velocità |
| Attuatore lineare | Warner Electric | 01-D024-0050-A06-LP-IP65 | 24VDC, range da 6 pollici |
| Dissezione microscopio | Leica Microsystems | Leica MZ16 | |
| Digital microscOpe fotocamera | Leica Microsystems | DFC320 | Software: Leica Application Suite v2.8.1 |
| Vännäs forbici | Mondo Strumenti di precisione | 500260 | |
| Microtensometer | Aurora Scientific | 310C | 5N Dual-Mode Sistema |
Riferimenti
- Gosline, J. M., Guerette, P. A., Ortlepp, C. S., Savage, K. N. The mechanical design of spider silks: from fibroin sequence to mechanical function. J. Exp. Biol. 202, 3295-3303 (1999).
- Foelix, R. . Biology of spiders. , (1996).
- Vollrath, F., Knight, D. P. Liquid crystalline spinning of spider silk. Nature. 410, 541-548 (2001).
- Spiess, K., Lammel, A., Scheibel, T. Recombinant spider silk proteins for applications in biomaterials. Macromol. Biosci. 10, 998-1007 (2010).
- Stark, M., Grip, S., Rising, A., Hedhammar, M., Engstrom, W., Hjalm, G., Johansson, J. Macroscopic fibers self-assembled from recombinant miniature spider silk proteins. Biomacromolecules. 8, 1695-1701 (2007).
- Lazaris, A., Huang, Y., Zhou, J. F., Duguay, F., Chretien, N., Welsh, E. A., Soares, J. W., Karatzas, C. N. Spider Silk Fibers Spun from Soluble Recombinant Silk Produced in Mammalian Cells. Science. 295, 472-476 (2002).
- Teule, F., Cooper, A. R., Furin, W. A., Bittencourt, D., Rech, E. L., Brooks, A., Lewis, R. V. A protocol for the production of recombinant spider silk-like proteins for artificial fiber spinning. Nat. Protoc. 4, 341-355 (2009).
- Gnesa, E., Hsia, Y., Yarger, J. L., Weber, W., Lin-Cereghino, J., Lin-Cereghino, G., Tang, S., Agari, K., Vierra, C. Conserved C-Terminal Domain of Spider Tubuliform Spidroin 1 Contributes to Extensibility in Synthetic Fibers. Biomacromolecules. , (2011).
- Hayashi, C. Y., Shipley, N. H., Lewis, R. V. Hypotheses that correlate the sequence, structure, and mechanical properties of spider silk proteins. Int. J. Biol. Macromol. 24, 271-275 (1999).
- Xu, M., Lewis, R. V. Structure of a protein superfiber: Spider Dragline Silk. Proc. Natl. Acad. Sci. 87, 7120-7124 (1990).
- Hayashi, C. Y., Blackledge, T. A., Lewis, R. Molecular and mechanical characterization of aciniform silk: uniformity of iterated sequence modules in a novel member of the spider silk fibroin gene family. Mol. Biol. Evol. 21, 1950-1959 (2004).
- Lazaris, A., Arcidiacono, S., Huang, Y., Zhou, J. F., Duguay, F., Chretien, N., Welsh, E. A., Soares, J. W., Karatzas, C. N. Spider silk fibers spun from soluble recombinant silk produced in mammalian cells. Science. 295, 472-476 (2002).
- Arcidiacono, S., Mello, C., Kaplan, D., Cheley, S., Bayley, H. Purification and characterization of recombinant spider silk expressed in Escherichia coli. Appl. Microbiol. Biotechnol. 49, 31-38 (1998).
- Menassa, R., Zhu, H., Karatzas, C. N., Lazaris, A., Richman, A., Brandle, J. Spider dragline silk proteins in transgenic tobacco leaves: accumulation and field production. Plant Biotechnology Journal. 2, 431-438 (2004).
- Scheller, J., Guhrs, K. H., Grosse, F., Conrad, U. Production of spider silk proteins in tobacco and potato. Nat. Biotechnol. 19, 573-577 (2001).
- An, B., Hinman, M. B., Holland, G. P., Yarger, J. L., Lewis, R. V. Inducing beta-sheets formation in synthetic spider silk fibers by aqueous post-spin stretching. Biomacromolecules. 12, 2375-2381 (2011).
- Elices, M., Guinea, G. V., Plaza, G. R., Karatzas, C., Riekel, C., Agullo-Rueda, F., Daza, R., Perez-Rigueiro, J. . Bioinspired Fibers Follow the Track of Natural Spider Silk. Macromolecules. 44, 1166-1176 (2011).
- Scheller, J., Guhrs, K. H., Grosse, F., Conrad, U. Production of spider silk proteins in tobacco and potato. Nature Biotechnology. 19, (2001).
- Kojic, N., Kojic, M., Gudlavalleti, S., McKinley, G. Solvent removal during synthetic and Nephila fiber spinning. Biomacromolecules. 5, 1698-1707 (2004).
- Jeffery, F., La Mattina, C., Tuton-Blasingame, T., Hsia, Y., Gnesa, E., Zhao, L. Microdissection of Black Widow Spider Silk-producing Glands. J. Vis. Exp. (47), e2382 (2011).
- Blasingame, E., Tuton-Blasingame, T., Larkin, L., Falick, A. M., Zhao, L., Fong, J., Vaidyanathan, V., Visperas, A., Geurts, P., Hu, X., La Mattina, C., Vierra, C. Pyriform spidroin 1, a novel member of the silk gene family that anchors dragline silk fibers in attachment discs of the black widow spider, Latrodectus hesperus. J. Biol. Chem. 284, 29097-29108 (2009).
- La Mattina, C., Reza, R., Hu, X., Falick, A. M., Vasanthavada, K., McNary, S., Yee, R., Vierra, C. A. Spider minor ampullate silk proteins are constituents of prey wrapping silk in the cob weaver Latrodectus hesperus. Biochemistry. 47, 4692-4700 (2008).
- Hsia, Y., Gnesa, E., Jeffery, F., Tang, S., Vierra, C., Cuppoletti, J. Spider Silk Composites and Applications. Metal, Ceramic and Polymeric Composites for Various Uses. 2, 303-324 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon