Method Article
Strom-Free, Sequential Nukleinsäure-und Protein Isolation
In diesem Artikel
Zusammenfassung
Ein Gerät mit Chemikalien werden beschrieben, um sequentiell Isolierung von Nukleinsäuren durch Proteine aus einer Probe ohne Einsatz von Elektrizität an. Das Werkzeug besteht aus einem Sorptionsmittel innerhalb einer Transferpipette gehalten, während die Isolation Chemie auf Festphasenextraktion Prinzipien beruhen. Die isolierten Makromoleküle durch Immun-basierten und PCR-basierten Assays analysiert werden.
Zusammenfassung
Traditionelle und entstehende Krankheitserreger wie Enterohämorrhagische Escherichia coli (EHEC), Yersinia pestis, oder Prion-basierten Krankheiten sind von großem Interesse für Regierungen, Industrie und medizinische Fachkräfte weltweit. Zum Beispiel sind EHECs, mit Shigella kombiniert, verantwortlich für den Tod von etwa 325.000 Kinder pro Jahr und sind besonders häufig in den Entwicklungsländern, wo Labor-basierte Identifikation, gemeinsam in den Vereinigten Staaten, nicht verfügbar ist 1. Die Entwicklung und den Vertrieb von Low-Cost, konnte Feld-basierte Point-of-Care-Tools, um bei der schnellen Identifizierung und / oder Diagnose von Krankheitserregern oder Krankheitsmarker helfen dramatisch verändern Krankheitsverlauf und die Prognose der Patienten. Wir haben ein Werkzeug, um Nukleinsäuren und Proteinen aus einer Probe durch Festphasenextraktion (SPE) zu isolieren, ohne Elektrizität oder assoziierten Laborgeräte 2 entwickelt. Die isolierten Makromoleküle können für die Diagnose verwendet werdensis entweder in einem Labor oder nach vorne über das Feld-basierte Punkt-of-Care-Plattformen. Wichtig ist, bietet diese Methode für den direkten Vergleich von Nukleinsäuren und Proteinen Daten aus einer ungespalteten Probe und bietet ein Vertrauen durch Bestätigung der Genom-und Proteomanalyse.
Unsere Isolation Werkzeug verwendet den Industriestandard für die Festphasen-Isolierung von Nukleinsäuren, die BOOM-Technologie, die von Nukleinsäuren aus einer chaotropen Salzlösung, in der Regel Guanidinisothiocyanat, durch Bindung an Siliciumdioxid basierende Teilchen oder Filter 3 isoliert. CUBRC proprietären Festphasenextraktion Chemie wird verwendet, um Protein aus chaotropen Salzlösungen zu reinigen, in diesem Fall aus dem Abfall oder Durchflussgefäße nach Nukleinsäure-Isolierung 4.
Durch die Verpackung Chemikalien in eine kleine, kostengünstige und einfache Plattform gut charakterisierten, haben wir ein tragbares System zur Nukleinsäure-und Protein-Extraktion, die unter einer var durchgeführt werden können, erzeugtiety von Bedingungen. Die isolierten Nukleinsäuren sind stabil und können zu einer Position, zur Verfügung steht für die PCR-Amplifikation transportiert werden, während der Proteingehalt kann sofort der Hand gehalten oder anderen immunologischen-basierten Assays analysiert werden. Die rasche Identifizierung von Krankheiten Marker im Bereich erheblich verändern könnte der Patient Ergebnis, indem er den richtigen Verlauf der Behandlung in einem früheren Stadium des Fortschreitens der Krankheit. Das Werkzeug und ein Verfahren beschrieben, eignen sich zur Verwendung mit nahezu jeder Erreger und bieten dem Anwender die Redundanz der Multi-Makromolekül-Typ-Analysen bei gleichzeitiger Reduzierung der logistischen Aufwand.
Protokoll
1. Probenlyse
- Die Proben sollten in flüssiger Form vorliegen. Wenn Probe ist solide, zum Beispiel Lebensmittel oder Stuhl, sollte die Probe in einem flüssigen Medium wie Wasser oder Phosphat ausgesetzt werden Kochsalzlösung (PBS).
- Mischen Sie 500 ul der Probe mit 500 ul 6M Guanidinthiocyanat (pH 6,5) in einer 1,5-ml-Tube.
- Drücken Sie den Kolben der Pipette ein Extraktionsverfahren, die Vertreibung der Umgebungsluft.
- Ziehen Sie den ganzen 1 mL Probe in die Pipette Extraktion, über dem Sorptionsmaterial, indem sie die Glühbirne langsam zu erweitern.
- Kehren Sie die Extraktions-Werkzeug, so dass die Perlen Sorbens und Probe Drain in der Birne.
- Schleifen Sie die Sorbens-Kügelchen, die mit der Probe in der Glühbirne darauf achten, daß die Probe aus der Extraktion zu vertreiben Pipette.
2. Nukleinsäure-Extraktion (Abbildung 1, Teil A)
- Kehren Sie die Extraktion Pipette (Öffnung nach unten) und zu vertreiben, die Probe in der ursprünglichen 1,5 ml Tube.
- Ziehen Sie den ganzen 1 mL Probe in die Extraktion Pipette, die über das Sorbens, mit mäßiger Geschwindigkeit, dabei darauf achten, das Sorbens in den Hals der Pipette Extraktion zu halten.
- Vertreibt die gesamte Probe in das 1,5 ml Tube durch Drücken der Glühbirne.
- Wiederholen Sie die Schritte 2.2 und 2.3, vorbei an der Probe über den Sorptionsmittel vier weitere Male für insgesamt 5 Durchgängen.
- Nach dem fünften Durchlauf über das Sorbens, vertreiben die gesamte 1 mL Probe in 4 ml der Protein-Extraktions-Puffer (in einem 15 ml konischen Röhrchen), schließen Sie das Rohr, und beiseite stellen für die spätere Verwendung.
- Waschen der isolierten Nukleinsäuren, indem 1 ml 95% Ethanol in den Sorbens dreimal Rücksendung der Ethanol in seine ursprüngliche Röhre auf letzte Passage.
- Wiederholen Sie Schritt 2,6 unter Verwendung einer zweiten 1 mL, 95% Ethanol waschen.
- Drücken Sie kurz die Lampe für 5 Minuten, vorbei an der Luft in die Pipette, um die Extraktion von Nukleinsäuren / Sorbensbett trocknen. Wischen restliche Ethanol von der Spitze der Pipette Extraktion usingen ein Kimwipe.
- Wiederherstellen der Nukleinsäuren, indem 250 ul 10 mM Tris (pH 6,8) über die Sorbens fünfmal. Die Tris-Puffer kann durch jede andere geeignete wässrige Lösung, wie PBS ersetzt werden. Die resultierende Lösung enthält die extrahierten Nukleinsäuren.
3. Protein-Extraktion (Abbildung 1, Teil B)
- Mischen Sie die Probe-und Protein-Extraktionspuffer Rohr von 2,5 Schritt durch Umdrehen und gehen etwa zwei bis drei Milliliter dieser 5 ml Probe über dem Sorbens Extraktion eines neuen Pipette.
- Austreiben des gesamten Probe in der gleichen 15 ml konischen Röhrchen darauf achten, das Sorptionsmittel in den Hals der Extraktion Pipette zu halten.
- Wiederholen Sie die Schritte 3.1 und 3.2, vorbei an der Probe über den Sorptionsmittel 15-mal.
- Waschen des Sorbens und das gebundene Protein, indem 1 ml 95% Ethanol über das Sorptionsmittelbett dreimal Ausstoßen der Ethanol in seiner ursprünglichen Rohres.
- Wiederholen Sie Schritt 3,4 unter Verwendung einer zweiten 1 mL, 95% Ethanol waschen.
- Drücken Sie kurz die Lampe für 5 Minuten, vorbei an der Luft in der Gewinnung Pipette, um das Protein / Sorbensbett trocknen. Wischen restliche Ethanol von der Spitze der Pipette unter Verwendung der Extraktion einem Kimwipe.
- Recover, die das Protein, indem man 250 ul PBS über die Sorbens fünfmal. Der PBS-Puffer kann durch jede andere geeignete wässrige Lösung, wie 10 mM Tris (pH 6,8) ersetzt werden. Die resultierende Lösung enthält, die das Protein der Probe.
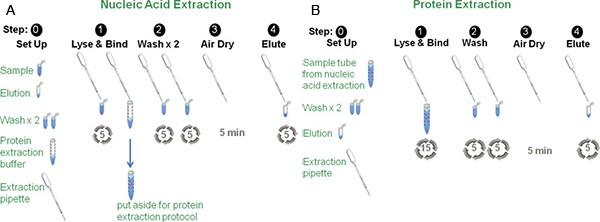
Abbildung 1.

Abbildung 2.

Abbildung 3.

Abbildung 4.

Abbildung 5.
Ergebnisse
Nukleinsäure-Isolierung: Isolierte Nukleinsäuren sind PCR-amplifizierbare und frei von Protein Verunreinigungen.
Beispiel 1: Die gewonnenen Nukleinsäuren sind für die Verwendung in PCR-basierte Anwendungen. Zum Beispiel zeigt 2 die Verstärkung des Shiga-Toxin-Gene mit enterohämorrhagischen E. zugeordnet coli O157: H7-Stamm EDL-933 (ATCC # 35.150) von einer Nukleinsäure / Protein-Extraktionsverfahren unter Verwendung der Extraktion Pipette. Die Shiga-Toxin-Gene stx 1 und stx 2 sind auf gemäßigten Bakteriophagen Lambda-like und defekten Bakteriophagen in diesem und anderen enterohämorrhagische E. gefunden coli-Stämme unter der Kontrolle des P R Promotors 5 6 7 8. Die Aktivierung des SOS-Reaktion in E. coli führt zur Induktion und / oder Toxinproduktion 9 Prophagen. Wir haben eine modifizierte Version des Multiplex-PCR-Assay von Feng et al genutzt werden. 11 zur Identifizierung des stx 1 und stx 2 Gene sowohl in Kultur und Spike Abwasserproben. Die Spuren A und B in 2 zeigen die Ergebnisse einer PCR-Amplifikation eines unverarbeiteten Kulturprobe (Spur A) und einer verarbeiteten Kulturprobe (Spur B). Diese Ergebnisse sind praktisch identisch Sinn gibt es keinen Verlust der Treue in der verarbeiteten oder isolierten Nukleinsäuren. Wir nächste Stachelwalze Rohabwasser (Spur D) oder isolierten Nukleinsäuren aus dotierten Abwasser (Spuren E & F) verstärkt. Diese Daten zeigen, dass die isolierten Nucleinsäuren in größere Verstärkung im Vergleich zu den nicht isolierten Nukleinsäuren aus dotierten Abwasserproben geführt. Wir schließen daraus, dass entweder PCR-Inhibitoren natürlich im Abwasser nach der Isolierung vor der Aufhebung oder dass die Nukleinsäuren wurden nach der Isolierung eingeengt. Eine Kombination dieser beiden Hypothesen ist ebenfalls möglich.
UV-Spektroskopie wurde als nächstes verwendet werden, um zu zeigen, dass die isolierten Nukleinsäuren relativ frei waren of Mengen an Protein. Abbildung 3 zeigt die UV-Spektren von zwei E. coli O157: H7-Nukleinsäure-Extraktionen markierten Isolierung ein und Isolierung b, im Vergleich zu der normalisierten Spektrums der Bakterienkultur, markierten prä-Isolation. Die UV-Spektren der isolierten Nukleinsäuren ähnelt der Spektren reiner Nukleinsäuren, mit einem berechneten Verhältnis der Extinktion zwischen 260 nm und 280 nm 1.8 10 nähert. Diese Daten zeigen, dass es eine sehr kleine Mengen an Protein in der Nukleinsäure-Fraktion gewonnen unter Verwendung der Technik beschrieben.
Proteinisolierung: gewonnene Protein aus der Nukleinsäure / Protein Isolationsexperiment immunreaktiv ist und elektrophoretisch identisch reines Protein.
Beispiel 2: Das isolierte Protein-Fraktion wurde in der RapidChek E. angewendet coli O157 Lateral-Flow-Assay-Streifen (SDIX, Inc.). Kontrollen zeigen eine positive Identifikation in allen Proben beherbergt, E. coli O157, mit oder ohne STX Induktion (Abbildung 4, Spuren B bzw. C). Die Daten in Abbildung 4 zeigen auch positive Ergebnisse für die Proben, beherbergen E. coli O157, die für Nukleinsäuren und Proteine dann mit der Pipette Extraktion verarbeitet wurden. Diese Daten zeigen, dass das isolierte Protein von jeder Probe immunreaktiv ist damit das Auslösen einer positiven Resonanz.
PCR-Amplifikation (wie in Beispiel 1 beschrieben) wurde auf die Protein-Proben durchgeführt, um zu zeigen, dass das isolierte Protein-Fraktion frei von kontaminierenden Nukleinsäuren war. Die Ergebnisse für diese Experimente waren alle durch Gelelektrophorese negativ. Daraus schließen wir, dass der Proteingehalt der Probe von kontaminierenden Nukleinsäuren wurde abgetrennt. Diese Ergebnisse, im Ganzen mit denen für die Nukleinsäure-Isolierung Schritt zeigen, dass die Nukleinsäuren-und Protein-Gehalt in separaten Fraktionierung Schritte werden beschrieben isoliert genommen.
t "> Beispiel 3:. Das isolierte Protein geeignet ist für die Elektrophorese 10 Abbildung 5 zeigt eine Coomassie gefärbt 8% Acrylamid-Gel mit BSA (5, Spuren A und C) und BSA geladen aus 6 M Guanidin-Isothiocyanat-Extraktion unter Verwendung der Pipette und zugehörigen isoliert Protokoll. Die elektrophoretische Mobilität des isolierten Proteins ist identisch mit der Kontrollproben. Wir schließen daraus, dass das Extraktionsverfahren ändert nichts an der kovalenten Struktur des isolierten Proteins.
Abbildung 1, Teil A: Darstellung eines typischen Nukleinsäure Extraktionsverfahren Die Probe wird mit 6 M Guanidin-Thiocyanat in das Probenröhrchen vermischt und in den Sorbens fünfmal.. Nach dem letzten Durchgang, wird die Probe auf der Protein-Puffer zugegeben. Die Sorptionsmittel und gebundenen Nukleinsäuren werden zweimal mit Ethanol gewaschen. Die Probe wird dann Luft dRied und eluiert aus dem Sorbens.

Abbildung 1, Teil B: Darstellung eines typischen Protein-Extraktions-Verfahren wird die Probe mit Proteinisolierung Puffer aus Schritt 1, Abbildung 1, Abbildung A über das Sorbens von einer zweiten Extraktion Pipette 15 Mal übergeben wird gemischt.. Der Rest des Verfahrens ist identisch mit der Nukleinsäure-Extraktion-Protokoll.

2:. Negatives Bild eines mit Ethidiumbromid gefärbten Agarosegel Multiplexsignal Shiga-Toxin 1 und 2-Gen-Amplifikation wurde unter Verwendung Kulturproben (Bahnen A und B) oder Rohabwasser Proben mit E. versetzt coli O157: H7 (Spuren D, E und F). Die Proben wurden entweder direkt an ein PCR-Gefäß (Bahnen A und D) oder den Proben zugegeben wurden unter Verwendung der Isolation-Verarbeis und die extrahierten Nukleinsäuren wurden zur PCR-Reaktionsgefäß (Proben B, E und F) zugegeben. Das PCR-Protokoll ist eine Modifikation des einen von Feng et al 11 beschrieben. Unsere Modifikation nur die von der STX-1 (unteres Band) und stx 2 (oberes Band) Primerpaare amplifiziert gezielten Ausstieg aus alle anderen Primerpaare. Lane C ist die 1 Kb Leiter von BioRad.

Abbildung 3: UV-Spektroskopie Ergebnisse von E. coli O157: H7 Nukleinsäuren isoliert mit der Extraktion berichtet Pipette Die isolierten Nukleinsäuren markiert sind, eine Trennung und Isolation. b. Das UV-Spektrum der Probe wurde auch vor Nukleinsäureextraktion getestet und markierten prä-Isolation. Die Spektren wurden unter Verwendung eines Hitachi U3010 Spektrophotometer und der zugehörigen Software-Paket.
 />. Abbildung 4: Farbfoto von RapidChek Teststreifen Der Proteingehalt der Proben in Abbildung 2 verwendet wurde unter Verwendung des Pipetten-Extraktion und getestet für Immun-Reaktivität von Lateral-Flow-Assay. AC Lanes sind unverarbeitete Kontrollen, das heißt, Zellkultur wird auf den Teststreifen wurde ohne Nukleinsäure oder ein Protein Extraktion zugegeben. Ein Lane ist E. coli BL21 DE3 pLysS als negative Kontrolle, Spuren B und C zeigen, E. coli O157: H7, die unbehandelt (B) oder mit Mitomycin C für 4 Stunden (C) behandelt worden war. Lanes D bis H zeigen die Ergebnisse der Addition der extrahierten Proteins auf die Lateral-Flow-Teststreifen. Lanes D und E wurden sondiert mit Proteinextrakt aus E. coli BL21 DE3 pLysS entweder ohne (D) oder mit Mitomycin C behandelt (E) als negative Kontrollen. Lanes FH zeigen die Ergebnisse, wenn das extrahierte Protein aus E. coli O157: H7 verwendet. Das Protein wurde von unbehandelten (F), oder 2 Stunde (G) oder 4 Stunden (H) Mitomycin C behandelten Kulturen extrahiert.Positive Ergebnisse produzieren eine doppelte rote Linie.
/>. Abbildung 4: Farbfoto von RapidChek Teststreifen Der Proteingehalt der Proben in Abbildung 2 verwendet wurde unter Verwendung des Pipetten-Extraktion und getestet für Immun-Reaktivität von Lateral-Flow-Assay. AC Lanes sind unverarbeitete Kontrollen, das heißt, Zellkultur wird auf den Teststreifen wurde ohne Nukleinsäure oder ein Protein Extraktion zugegeben. Ein Lane ist E. coli BL21 DE3 pLysS als negative Kontrolle, Spuren B und C zeigen, E. coli O157: H7, die unbehandelt (B) oder mit Mitomycin C für 4 Stunden (C) behandelt worden war. Lanes D bis H zeigen die Ergebnisse der Addition der extrahierten Proteins auf die Lateral-Flow-Teststreifen. Lanes D und E wurden sondiert mit Proteinextrakt aus E. coli BL21 DE3 pLysS entweder ohne (D) oder mit Mitomycin C behandelt (E) als negative Kontrollen. Lanes FH zeigen die Ergebnisse, wenn das extrahierte Protein aus E. coli O157: H7 verwendet. Das Protein wurde von unbehandelten (F), oder 2 Stunde (G) oder 4 Stunden (H) Mitomycin C behandelten Kulturen extrahiert.Positive Ergebnisse produzieren eine doppelte rote Linie.

Bild 5:. Fotografie eines mit Coomassie gefärbten SDS-PAGE BSA wurde von der Lösung unter Verwendung der Extraktion Pipette und beschriebenen Protokollen isoliert. Lanes A und C sind Kontrollbahnen von 250 ug / ml und 500 pg / ml. Spuren B und D zeigen gewonnen BSA aus Lösungen, die die gleichen Konzentrationen wie ihre jeweiligen Steuerelemente.
Diskussion
Die Werkzeug-, Chemie-und Protokoll in diesem Bericht beschriebenen repräsentieren die erste bekannte Beispiel eines Strom-frei, Multi-Extraktion Makromolekül, das in Feld-basierte Point-of-Care-Anwendungen genutzt werden können. Beide Typen können Makromolekül eine Reihe von nachgeordneten diagnostische oder analytische Vorrichtungen angewendet werden. Zum Beispiel sind die isolierten Nukleinsäuren PCR Qualität (2 und 3), während die Protein-Komponente der Probe immunreaktiv ist (Abbildung 4). Die Verwendung dieser Absauganlage in herber oder Ressource begrenzte Bereiche der Welt könnte drastisch reduzieren die Belastung durch Krankheiten auf die dort lebenden Bevölkerungen. Diese Extraktion System könnte auch in Krankheitsüberwachung Programme in der ganzen Welt zu helfen, indem sie eine robuste und dennoch schnelle und kostengünstige Methode zur Probenaufbereitung in herber oder entfernten Standorten.
Ein wichtiger Aspekt der oben beschriebenen Extraktionsverfahren ist, dasses kann vom Benutzer geändert werden. Zum Beispiel in Fällen, wo die Probe eine Größe größer oder kleiner als die ersten 500 μLs (Schritt 1.2), kann der Benutzer das Volumen der Reagenzien entsprechend. Das heißt, das volumetrische Verhältnis der Reagenzien zu der Probe Größe sollte konstant bleiben, während die absoluten Mengen geändert werden kann. Außerdem können Anpassungen in der Anzahl der Durchgänge über die Sorbens auch nach Ermessen des Benutzers erfolgen. Zum Beispiel, wenn ein größeres Probenvolumen verwendet wird, wobei das Gas in den Sorbens öfter als aufgeführt (Schritte 2.4 und 3.3) erhöht die Wahrscheinlichkeit des Makromoleküls Typ (Nucleinsäure oder Protein) Kontaktieren des Sorbens. Der Anstieg der Passagen sollten erhöhen die Effizienz zu erfassen, bis Sorbens Sättigung erreicht ist.
Wir haben festgestellt, dass der Extraktions-Werkzeug und die damit verbundenen chemischen einige Einschränkungen, die bedeutendste davon, dass die Protein-Extraktions-Chemie ineffizient für die Verwertung von hochglykosylierte ist habenProteine. Für den Fall, dass der stromabwärtige Diagnose eines glykosylierten Proteins abzielt, kann dieses System nicht ideal für die Identifizierung. Darüber hinaus werden die oberen und unteren Grenzen für die Gewinnung für entweder Nukleinsäuren oder Proteine noch bestimmt wird, und die Optimierung im Gange, um Rückgewinnung zu maximieren. Die weitere Entwicklung des Werkzeugs wird der Überwindung dieser aktuellen Wissenslücken.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Mittel für die Entwicklung der Extraktion Pipette wurde zum Teil von einer internen Forschung und Entwicklung Zuschuss für DRP zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| Guanidinthiocyanat | Teknova | G4000 | |
| Ethanol | Pharmco-Aaper | 11ACS200 | |
| 2-Propanol | Sigma-Aldrich | 109.827-1L | |
| BSA | Sigma | A-4503 |
Referenzen
- Gupta, S. K., Keck, J., Ram, P. K., Crump, J. A., Miller, M. A., Mintz, E. D. Analysis of data gaps pertaining to enterotoxigenic Escherichia coli infections in low and medium human development index countries, 1984-2005. Epidemiology and Infection. 136, 721-738 (2007).
- Pawlowski, D. R. Extraction Pipette. United States Patent and Trademark Office. , Patent Pending (2010).
- Boom, R., Sol, C. J., Salimans, M. M., Jansen, C. L., Wertheim-van Dillen, P. M., van der Noordaa, J. Rapid and simple method for purification of nucleic acids. J. Clin. Microbiol. 28, 495-503 (1990).
- Karalus, R. J., Pawlowski, D. R. Method and Device for Isolating a Protein Sample. United States Patent and Trademark Office. , Patent Pending (2010).
- Huang, A., Friesen, J., Brunton, J. L. Characterization of a bacteriophage that carries the genes for production of Shiga-like toxin 1 in Escherichia coli. Journal of Bacteriology. 169, 4308-4312 (1987).
- O'Brien, A. D., Newland, J. W., Miller, S. F., Holmes, R. K., Smith, H. W., Formal, S. B. Shiga-like toxin-converting phages from Escherichia coli strains that cause hemorrhagic colitis or infantile diarrhea. Science. 226, 694-696 (1984).
- Wagner, P. L., Neely, M. N., Zhang, X., Acheson, D. W. K., Waldor, M. K., Friedman, D. I. Role for a Phage Promoter in Shiga Toxin 2 Expression from a Pathogenic Escherichia coli Strain. Journal of Bacteriology. 183, 2081-2085 (2001).
- Mizutani, S., Nakazono, N., Sugino, Y. The So-called Chromosomal Verotoxin Genes are Actually Carried by Defective Prophages. DNA Research. 6, 141-143 (1999).
- Ptashne, M. A Genetic Switch: Phage Lambda Revisited. , Third Edition ed, Cold Spring Harbor Press. (2004).
- Sambrook, J., Russell, D. W. Molecular cloning : a laboratory manual. , 3rd ed, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, N.Y. (2001).
- Feng, P., Monday, S. R. Multiplex PCR for detection of trait and virulence factors in enterohemorrhagic Escherichia coli serotypes. Mol. Cell. Probes. 14, 333-337 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten