Method Article
Elettricità-Free, Nucleic Acid sequenziale e isolamento delle proteine
In questo articolo
Riepilogo
Uno strumento e chimici sono descritti per isolare sequenzialmente acidi nucleici seguite da proteine da un campione senza la necessità di energia elettrica. Lo strumento consiste in un assorbente tenersi entro una pipetta di trasferimento, mentre le caratteristiche chimiche di isolamento si basano su una solida fase di estrazione dei principi. Le macromolecole isolati possono essere analizzati mediante saggi immuno-based e basato su PCR.
Abstract
Patogeni tradizionali ed emergenti quali l'enteroemorragica Escherichia coli (EHEC), Yersinia pestis, o prioni a base di malattie sono di notevole preoccupazione per i governi, le industrie e gli operatori sanitari in tutto il mondo. Ad esempio, EHECs, combinati con Shigella, sono responsabili della morte di circa 325.000 bambini ogni anno e sono particolarmente diffusa nel mondo in via di sviluppo in cui l'identificazione di laboratorio-based, comune negli Stati Uniti, non è disponibile 1. Lo sviluppo e la distribuzione di basso costo, sul campo, point-of-care alcuni strumenti per facilitare la rapida identificazione e / o la diagnosi di agenti patogeni o marker di malattia potrebbe alterare profondamente la progressione della malattia e la prognosi del paziente. Abbiamo sviluppato uno strumento per isolare gli acidi nucleici e proteine da un campione di estrazione in fase solida (SPE) senza elettricità o associati attrezzature di laboratorio 2. Le macromolecole isolato può essere usato per diagnosisis sia in un laboratorio o in avanti utilizzando campo-basati point-of-care piattaforme. È importante sottolineare che questo metodo prevede il confronto diretto di acidi nucleici e proteine di dati provenienti da un non-split del campione, offre una conferma di fiducia mediante analisi genomica e proteomica.
Lo strumento di isolamento utilizza lo standard industriale per fase solida isolamento degli acidi nucleici, la tecnologia BOOM, che isola gli acidi nucleici da una soluzione salina caotropico, solitamente guanidina isotiocianato, attraverso il legame al particelle a base di silice o filtri 3. CUBRC proprietaria chimica in fase solida di estrazione viene usato per purificare proteine da soluzioni saline caotropici, in questo caso, da rifiuti o flusso attraverso successivo isolamento di acido nucleico 4.
Con imballaggio ben caratterizzato chimiche in una piccola piattaforma, poco costoso e semplice, abbiamo generato un sistema portatile per l'estrazione dell'acido nucleico e proteina che può essere eseguito in uno variety di condizioni. Gli acidi nucleici isolati sono stabili e possono essere trasportati in una posizione in cui l'alimentazione è disponibile per l'amplificazione PCR, mentre il contenuto proteico può essere immediatamente analizzati mediante mano o altri saggi basati immunologica. La rapida identificazione di marcatori di malattia nel settore potrebbe alterare sensibilmente i risultati del paziente dirigendo il corretto svolgimento del trattamento in una fase iniziale della progressione della malattia. Lo strumento e il metodo descritto sono adatti per l'uso con qualsiasi agente infettivo e offrire all'utente la ridondanza di multi-macromolecola analisi di tipo contemporaneamente riducendo l'onere logistico.
Protocollo
1. Esempio di Lysis
- I campioni dovrebbero essere in forma liquida. Se il campione è solido, ad esempio per il cibo o su uno sgabello, il campione dovrebbe essere sospeso in un mezzo liquido come l'acqua o tampone fosfato (PBS).
- Miscelare 500 microlitri del campione con 500 microlitri di 6M guanidina tiocianato (pH 6,5) in una provetta da 1,5 ml.
- Premere il bulbo di una pipetta di estrazione, espellendo l'aria ambiente.
- Tirare l'intero 1 mL di campione nella pipetta di estrazione, il materiale assorbente, consentendo la lampadina di espandersi lentamente.
- Capovolgere lo strumento di estrazione in modo tale che le perline assorbenti e scarico del campione nel bulbo.
- Macinare le perline sorbente con il campione nel bulbo facendo attenzione a non espellere il campione dalla pipetta estrazione.
2. Acido nucleico di estrazione (figura 1, pannello A)
- Invertire la pipetta di estrazione (apertura verso il basso) ed espellere il campione nel tubo originale 1,5 mL.
- l'intera Tirare 1 mL di campione nella pipetta di estrazione, passando sopra il sorbente, ad una velocità moderata, prestando attenzione a mantenere l'assorbente nel collo della pipetta estrazione.
- Espellere l'intero campione nella provetta 1,5 ml premendo il bulbo.
- Ripetere i punti 2.2 e 2.3, passando per il campione nel corso degli assorbenti quattro volte per un totale di 5 passaggi.
- Dopo il quinto passaggio sopra l'assorbente, espellere l'intera 1 ml di campione in 4 ml di tampone di estrazione delle proteine (in una provetta da 15 ml), chiudere il tubo, e mettere da parte per un uso successivo.
- Lavare gli acidi nucleici isolati passando 1 mL di etanolo al 95% negli assorbenti tre volte, restituendo il etanolo al tubo originale sopra il passaggio finale.
- Ripetere il passaggio 2,6 utilizzando un secondo 1 mL, lavaggio con etanolo al 95%.
- Premere e rilasciare la lampadina per 5 minuti, passare aria ambiente per tutta la pipetta di estrazione per asciugare gli acidi nucleici / letto assorbente. Pulire l'etanolo residuo dalla punta della pipetta di estrazione ucantare una Kimwipe.
- Recuperare gli acidi nucleici passando 250 pl di 10 mM Tris (pH 6,8) negli assorbenti cinque volte. Il tampone Tris può essere sostituita da qualsiasi altra soluzione appropriata acquoso come PBS. La soluzione risultante contiene gli acidi nucleici estratti.
3. Protein Extraction (Figura 1, Panel B)
- Mescolare il campione e l'estrazione del tubo tampone proteica a partire dal punto 2,5 per inversione e passare circa due o tre millilitri di questo campione 5 mL oltre l'assorbente di una pipetta nuova estrazione.
- Espellere l'intero campione nello stesso tubo conico 15mL prestando attenzione a mantenere l'assorbente nel collo della pipetta estrazione.
- Ripetere i punti 3.1 e 3.2, passando per il campione nel corso degli assorbenti 15 volte.
- Lavare il sorbente e la proteina legata passando 1 mL di etanolo al 95% sopra il letto sorbente tre volte, espellendo l'etanolo in esso il tubo originale.
- Ripetere il passaggio 3,4 utilizzando un secondo 1 mL, lavaggio con etanolo al 95%.
- Premere e rilasciare la lampadina per 5 minuti, passare aria ambiente per tutta la pipetta di estrazione per asciugare la proteina / letto sorbente. Pulire etanolo residuo dalla punta della pipetta estrazione utilizzando un Kimwipe.
- Recuperare la proteina passando 250 microlitri di PBS nel corso degli assorbenti cinque volte. Il tampone PBS può essere sostituita da qualsiasi altra soluzione appropriata acquoso come 10 mM Tris (pH 6,8). La soluzione risultante contiene il contenuto proteico del campione.
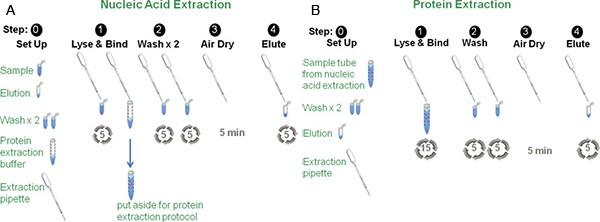
Figura 1.

Figura 2.

Figura 3.

Figura 4.

Figura 5.
Risultati
Isolamento degli acidi nucleici: isolati acidi nucleici sono PCR amplificabile ed esenti da contaminazione proteine.
Esempio 1: Gli acidi nucleici recuperati sono adatti per l'uso in applicazioni basate su PCR. Ad esempio, la Figura 2 mostra l'amplificazione di geni di tossina Shiga associati enteroemorragica E. coli O157: H7 ceppo EDL-933 (ATCC # 35150) da un acido nucleico / proteina procedimento di estrazione con la pipetta di estrazione. I geni della tossina Shiga STX stx 1 e 2 sono disponibili sul temperato lambda-like batteriofago e difettoso batteriofago in questo e altri enteroemorragica E. coli sotto il controllo del promotore P R 5 6 7 8. L'attivazione della risposta SOS in E. coli porta a profago induzione e / o produzione di tossina 9. Abbiamo utilizzato una versione modificata del saggio PCR multiplato da Feng et al. 11 per identificare l'stx 1 e STX 2 geni in cultura e campioni delle acque reflue a spillo. Corsie A e B nella figura 2 mostrano i risultati di una amplificazione PCR di un campione di coltura non trasformato (corsia A) e un campione cultura elaborato (corsia B). Questi risultati sono praticamente identici significato vi è alcuna perdita di fedeltà negli acidi nucleici isolati o trasformati. Abbiamo poi amplificato a spillo acque reflue non trattate (corsia D) o isolati gli acidi nucleici da liquami a spillo corsie (E & F). Questi dati indicano che gli acidi nucleici isolati comportato maggiore rispetto amplificazione degli acidi nucleici non-isolato da campioni spiked liquami. Abbiamo quindi concludere che sia inibitori della PCR naturalmente presenti nelle acque di scarico sono stati rimossi dopo isolamento o che gli acidi nucleici sono stati concentrati su di isolamento. Una combinazione di queste due ipotesi è anche possibile.
Spettroscopia ultravioletta è stato accanto usato per dimostrare che gli acidi nucleici isolati erano relativamente liberi of proteina contaminante. Figura 3 mostra gli spettri UV di due E. coli O157: H7 estrazioni acido nucleico, isolamento con A e B isolamento, rispetto allo spettro normalizzato della coltura batterica, etichettato pre-isolamento. Gli spettri UV degli acidi nucleici isolati assomiglia spettri di pure acidi nucleici, avente un rapporto calcolato di assorbanza tra 260 nm e 280 nm avvicinano 1,8 10. Questi dati mostrano che vi è molto poco proteine contaminanti nella frazione di acido nucleico recuperato usando la tecnica descritta.
Isolamento delle proteine: proteine recuperato dal acidi nucleici / proteine esperimento di isolamento è immunoreattiva e elettroforeticamente identica alla proteina pura.
Esempio 2: La frazione di proteina isolata è stata applicata alla E. RapidChek coli O157 strisce laterali di flusso saggio (SDIX, Inc.). I controlli mostrano una identificazione positiva in tutti i campioni ospitano E. coli O157, con o senza induzione STX (figura 4, corsie B e C, rispettivamente). I dati in figura 4 mostrano anche risultati positivi per i campioni ospitano E. coli O157 che sono stati elaborati per acidi nucleici e proteine poi con la pipetta di estrazione. Questi dati dimostrano che la proteina isolata da ogni campione è immunoreattiva innescando così una risposta positiva.
Amplificazione PCR (come descritto nell'Esempio 1) è stata effettuata sui campioni di proteine per dimostrare che la frazione di proteina isolata era privo di contaminanti acidi nucleici. I risultati di questi esperimenti erano tutti negativi mediante elettroforesi su gel. Quindi, concludiamo che il contenuto proteico del campione è stata separata dalla contaminazione acidi nucleici. Questi risultati, preso in complesso con quelli descritti per la fase di isolamento nucleico mostra acido che gli acidi nucleici e proteine contenuti sono isolati in fasi distinte di frazionamento.
t "> Esempio 3:. La proteina isolata è adatto per elettroforesi 10 La Figura 5 illustra un coomassie macchiata gel di acrilammide 8% caricato con BSA (Figura 5, corsie A e C) e BSA isolato da 6M guanidina isotiocianato utilizzando l'estrazione pipetta e associato protocollo. La mobilità elettroforetica della proteina isolata è identica a quella dei campioni di controllo. Abbiamo quindi concludere che il processo di estrazione non altera la struttura covalente della proteina isolata.
Figura 1, Panel A: Rappresentazione di una tipica procedura di estrazione degli acidi nucleici Il campione viene mescolato con 6M guanidina tiocianato nella provetta campione e passato sopra l'assorbente cinque volte.. Dopo l'ultimo passaggio, il campione viene aggiunto al tampone di estrazione delle proteine. Gli acidi nucleici adsorbimento e legato vengono lavate due volte con etanolo. Il campione è poi libero in aria dRied e eluite dalla sorbente.

Figura 1, pannello B: Rappresentazione di un tipico procedimento di estrazione delle proteine Il campione miscelato con tampone isolamento delle proteine dal passaggio 1, Figura 1, pannello A è passato sopra la sorbente di una pipetta seconda estrazione 15 volte.. Il resto della procedura è identico a quello del protocollo di estrazione degli acidi nucleici.

Figura 2:. Immagine negativa di un macchiato etidio bromuro di gel di agarosio Un multiplex gene della tossina Shiga 1 e 2 esperimento di amplificazione è stata eseguita utilizzando campioni di cultura (corsie A e B) o dei campioni di liquami non trattati addizionati con E. coli O157: H7 (corsie D, E e F). I campioni sono stati aggiunti direttamente a un tubo di reazione di PCR (corsie A e D), oppure i campioni sono stati elaborati usando il proces isolamentos e gli acidi nucleici estratti sono stati aggiunti al tubo di reazione di PCR (campioni B, E e F). Il protocollo PCR è una modifica di quella descritta da Feng et al 11. La nostra modifica mirata solo quelli amplificata dalla stx 1 (fascia inferiore) e stx 2 (fascia superiore) coppie di primer, abbandono tutte le altre coppie di primer. Corsia C è la scala da BioRad 1Kb.

Figura 3: risultati della spettroscopia UV E. coli O157: H7 acidi nucleici isolato con la pipetta di estrazione riportato isolati Gli acidi nucleici sono etichettati isolamento a e b isolamento.. Lo spettro UV del campione è stato anche testato prima dell'estrazione dell'acido nucleico ed è etichettato pre-isolamento. Gli spettri sono stati ottenuti utilizzando uno spettrofotometro Hitachi U3010 e pacchetto software associato.
 />. Figura 4: Foto a colori di strisce reattive RapidChek Il contenuto proteico dei campioni utilizzati in figura 2 è stato isolato con la pipetta di estrazione e testati per immuno-reattività con test a flusso laterale. Lanes AC sono i controlli non trasformati, che è, è stato aggiunto coltura cellulare per la striscia di test senza estrazione di acidi nucleici o di proteine. Corsia A è E. coli BL21 DE3 pLysS come controllo negativo, corsie B e C mostrano E. coli O157: H7 che era non trattata (B), o trattate con mitomicina C per 4 ore (C). Lanes D attraverso H mostrano i risultati di aggiunta della proteina estratta per le strisce di prova di flusso laterali. Lanes D ed E sono stati sondati utilizzando estratti proteici da E. coli BL21 DE3 pLysS o senza (D) o trattamento con mitomicina C (E) come controlli negativi. Lanes FH mostrano i risultati quando le proteine estratte da E. coli O157: H7 è stato utilizzato. La proteina è stata estratta da non trattata (F), o da 2 ore (G) o 4 ore (H) mitomicina C colture trattate.Risultati positivi producono una doppia linea rossa.
/>. Figura 4: Foto a colori di strisce reattive RapidChek Il contenuto proteico dei campioni utilizzati in figura 2 è stato isolato con la pipetta di estrazione e testati per immuno-reattività con test a flusso laterale. Lanes AC sono i controlli non trasformati, che è, è stato aggiunto coltura cellulare per la striscia di test senza estrazione di acidi nucleici o di proteine. Corsia A è E. coli BL21 DE3 pLysS come controllo negativo, corsie B e C mostrano E. coli O157: H7 che era non trattata (B), o trattate con mitomicina C per 4 ore (C). Lanes D attraverso H mostrano i risultati di aggiunta della proteina estratta per le strisce di prova di flusso laterali. Lanes D ed E sono stati sondati utilizzando estratti proteici da E. coli BL21 DE3 pLysS o senza (D) o trattamento con mitomicina C (E) come controlli negativi. Lanes FH mostrano i risultati quando le proteine estratte da E. coli O157: H7 è stato utilizzato. La proteina è stata estratta da non trattata (F), o da 2 ore (G) o 4 ore (H) mitomicina C colture trattate.Risultati positivi producono una doppia linea rossa.

Figura 5:. Fotografia di uno colorato con Coomassie SDS-PAGE BSA è stato isolato dalla soluzione mediante la pipetta estrazione e protocolli descritti. Corsie A e C sono corsie di controllo di 250 ug / ml e 500 pg / ml, rispettivamente. Corsie B e D rappresentano BSA recuperato da soluzioni contenenti le stesse concentrazioni rispettivi controlli.
Discussione
Gli utensili e chimiche, i protocolli descritti in questa relazione rappresentano il primo esempio noto di un senza elettricità, multi-macromolecola sistema di estrazione che può essere utilizzato in campo-based, point-of-care applicazioni. Entrambi i tipi macromolecola può essere applicato a un numero di valle dispositivi diagnostici o analitica. Ad esempio, gli acidi nucleici isolati sono di qualità PCR (Figura 2 e 3), mentre la componente proteica del campione è immunoreattiva (Figura 4). L'utilizzo di questo sistema di estrazione in aree limitate austere o una risorsa del mondo, potrebbe ridurre drasticamente il peso delle malattie sulle popolazioni che vi abitano. Questo sistema di estrazione potrebbe anche aiutare a programmi di sorveglianza delle malattie in tutto il mondo, fornendo un metodo efficace ma rapido e conveniente per l'elaborazione del campione in luoghi austeri o remoto.
Un aspetto importante del metodo di estrazione di cui sopra è chepuò essere modificato dall'utente. Ad esempio, nei casi in cui la dimensione del campione è superiore o inferiore rispetto a quello iniziale (passo 500 μLs 1,2), l'utente può regolare il volume dei reagenti conseguenza. Cioè, il rapporto volumetrico dei reagenti al campione deve rimanere costante mentre i volumi assoluti può essere alterato. Inoltre, le regolazioni del numero di passaggi sulla assorbente può anche essere effettuata a discrezione dell'utente. Ad esempio, se un volume di campione più grande è, passare il campione sui tempi sorbente più di passi elencati (2,4 e 3,3) aumenterà la probabilità del tipo macromolecola (acido nucleico o proteina) contattare il sorbente. L'aumento passaggi dovrebbero aumentare l'efficienza acquisire fino a saturazione sorbente è raggiunto.
Abbiamo trovato che l'utensile di estrazione e chimici associati hanno alcune limitazioni, la più importante delle quali è che la chimica di estrazione delle proteine è inefficiente per il recupero di altamente glicosilataproteine. Nel caso in cui la diagnostica valle bersaglio una proteina glicosilata, questo sistema non può essere ideale per l'identificazione. Inoltre, i limiti superiore e inferiore di efficienza di estrazione sia per acidi nucleici o proteine sono ancora determinate, e ottimizzazione è in corso per massimizzare l'efficienza di recupero. L'ulteriore sviluppo dello strumento sarà superare queste lacune nelle conoscenze attuali.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Finanziamenti per lo sviluppo della pipetta di estrazione è stata fornita in parte da una ricerca interna e Grant lo sviluppo assegnato a DRP.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | |
| Tiocianato di guanidina | Teknova | G4000 | |
| etanolo | Pharmco-Aaper | 11ACS200 | |
| 2-propanolo | Sigma-Aldrich | 109.827-1L | |
| BSA | Sigma | A-4503 |
Riferimenti
- Gupta, S. K., Keck, J., Ram, P. K., Crump, J. A., Miller, M. A., Mintz, E. D. Analysis of data gaps pertaining to enterotoxigenic Escherichia coli infections in low and medium human development index countries, 1984-2005. Epidemiology and Infection. 136, 721-738 (2007).
- Pawlowski, D. R. Extraction Pipette. United States Patent and Trademark Office. , Patent Pending (2010).
- Boom, R., Sol, C. J., Salimans, M. M., Jansen, C. L., Wertheim-van Dillen, P. M., van der Noordaa, J. Rapid and simple method for purification of nucleic acids. J. Clin. Microbiol. 28, 495-503 (1990).
- Karalus, R. J., Pawlowski, D. R. Method and Device for Isolating a Protein Sample. United States Patent and Trademark Office. , Patent Pending (2010).
- Huang, A., Friesen, J., Brunton, J. L. Characterization of a bacteriophage that carries the genes for production of Shiga-like toxin 1 in Escherichia coli. Journal of Bacteriology. 169, 4308-4312 (1987).
- O'Brien, A. D., Newland, J. W., Miller, S. F., Holmes, R. K., Smith, H. W., Formal, S. B. Shiga-like toxin-converting phages from Escherichia coli strains that cause hemorrhagic colitis or infantile diarrhea. Science. 226, 694-696 (1984).
- Wagner, P. L., Neely, M. N., Zhang, X., Acheson, D. W. K., Waldor, M. K., Friedman, D. I. Role for a Phage Promoter in Shiga Toxin 2 Expression from a Pathogenic Escherichia coli Strain. Journal of Bacteriology. 183, 2081-2085 (2001).
- Mizutani, S., Nakazono, N., Sugino, Y. The So-called Chromosomal Verotoxin Genes are Actually Carried by Defective Prophages. DNA Research. 6, 141-143 (1999).
- Ptashne, M. A Genetic Switch: Phage Lambda Revisited. , Third Edition ed, Cold Spring Harbor Press. (2004).
- Sambrook, J., Russell, D. W. Molecular cloning : a laboratory manual. , 3rd ed, Cold Spring Harbor Laboratory Press. Cold Spring Harbor, N.Y. (2001).
- Feng, P., Monday, S. R. Multiplex PCR for detection of trait and virulence factors in enterohemorrhagic Escherichia coli serotypes. Mol. Cell. Probes. 14, 333-337 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon