Method Article
Ein Mausmodell der Stentimplantation in der Arteria carotis für das Studium der Restenose
In diesem Artikel
Zusammenfassung
Ein Modell der Stent-Implantation in Maus Halsschlagader beschrieben. Im Vergleich zu anderen ähnlichen Methoden ist dieses Verfahren sehr schnell, einfach und zugänglich, bietet die Möglichkeit, auf bequeme Weise die Gefäßwand Reaktion auf verschiedene Medikamente-freisetzende Stents und die molekularen Mechanismen der Restenose zu studieren.
Zusammenfassung
Trotz der erheblichen Fortschritte in der Stent-Entwicklung in den letzten Jahrzehnten gemacht, bleiben Herz-Kreislauferkrankungen die häufigste Todesursache in den westlichen Ländern. Neben den Vorteilen durch die Entwicklung der verschiedenen Medikamente-freisetzende Stents angeboten, trägt der koronaren Revaskularisation auch lebensbedrohliche Risiken der In-Stent-Restenose und Thrombose. Forschung an neuen therapeutischen Strategien wird durch den Mangel an geeigneten Methoden zur Stent-Implantation und Restenose Prozesse studieren beeinträchtigt. Hier beschreiben wir eine schnelle und leicht zugängliche Verfahren der Stent-Implantation in Maus Halsschlagader, die die Möglichkeit, auf bequeme Weise die molekularen Mechanismen der Gefäß Umbau und die Auswirkungen der verschiedenen Drogen Beschichtungen studieren bietet.
Einleitung
Herz-Kreislauf-Erkrankungen, die durch das Fortschreiten der Arteriosklerose sind die häufigste Todesursache in den Industrienationen. Atherosklerose ist ein zentraler, entzündliche Fibro-proliferative Reaktion der Gefäßwand Endothelverletzung 1, was zur Bildung einer erweiterten Plaque in das Lumen des Gefäßes, die die Blutströmung durch Koronararterien. Über 75% der Herzinfarkte ergeben sich aus dem Bruch der dünnen fibrösen Kappe des entzündeten Plaque 2. Da diese Komplikation kann tödlich sein, wurde eine perkutane transluminale (koronare) Angioplastie (PTCA) mit Stent-Implantation die Therapie der ersten Wahl in der aktuellen medizinischen Praxis. Das Verfahren ermöglicht die Dilatation des verengten Koronararterien und damit die Wiederherstellung des Blutflusses. Gleichzeitig bewirkt es eine Ausdehnung Schädigung des Endothels und Gefäßwand 3. Jedoch ist die Langzeitwirkung dieser Therapie durch eine übermäßige arteriellen ReMode begrenztling und Restenose 4.
Durch Einsatz von Stents, wurde der PTCA mehr wirksam bei der Behandlung von schweren Verletzungen, so Revaskularisation nach akutem Gefäßverschluss 5. Dieses Verfahren verringert die Häufigkeit von In-Stent-Restenose, um weniger als 10% 6. Neben diesen Vorteilen, trägt diese Therapie der ersten Wahl für die koronare Revaskularisation auch lebensbedrohliche Risiken der In-Stent-Restenose und Thrombose.
In-Stent-Thrombose durch eine de-Endothelialisierung des Gefäßes, durch eine massive Adhäsion von Blutplättchen und Fibrin auf die verletzte Stelle gefolgt verursacht. 26% der Patienten leiden an In-Stent-Thrombosen und 63% sterben an Herzinfarkt 7. Restenose bezieht sich auf den Prozess der Wundheilung nach einer mechanischen Verletzung der Gefäßwand mit Neointimalhyperplasie (Migration und Proliferation von glatten Gefäßmuskelzellen (VSMC), Ablagerung von extrazellulärer Matrix (ECM) und Umgestaltungdes Schiffes. Oft wird eine invasive erneuten Eingriff notwendig, stark verengte atherosklerotische Gefäße durch In-Stent-Restenose und Thrombose dilatate.
Um in-Stent-Thrombose zu verhindern, ist eine langfristige Behandlung mit anti-thrombotischen Medikamente erforderlich 8. Um Restenose zu verhindern, eluieren neue Generation von Medikamenten-freisetzende Stents antiproliferativen Mittel wie Immunsuppressiva (zB Sirolimus, Everolimus, Zotarolimus) und Anti-Krebs-Medikamente (zB Paclitaxel) aus einer Polymer-Beschichtung für mehrere Monate 9,10. Obwohl diese Arzneimittel verringern die Neointima-Bildung und Restenose, halten sie ein hohes Risiko von In-Stent-Thrombose durch Hemmung der Reendothelisierung.
Nach einer arteriellen Verletzung, ist die Aufrechterhaltung der endothelialen Fach wesentlich thrombotischen Komplikationen zu verhindern. Unter physiologischen Bedingungen zeigt das menschliche Endothel eine kleine Fluktuation 11. Unter patholgroßartiges Puzzle Bedingungen, jedoch wird die endothelialen Integrität beeinträchtigt wird, so dass eine schnelle Erholung von umgebenden reifen Endothelzellen und zirkulierender endothelialer Vorläuferzellen (EPC) 12,13 erforderlich.
Die Untersuchung dieser komplexen molekularen Mechanismen in größeren Tieren 14-16 oder in der Maus Aorta ist ein sehr schwieriges Verfahren, mit begrenzten Daten 17-19. Um die Effizienz des neuartigen Stent-Beschichtungen zu testen, um In-Stent-Restenose und Thrombose neue Modelle zu reduzieren sind unerlässlich.
Nitinol ist die ideale Plattform für Stents wegen seiner 'hohe Elastizität, Form-Gedächtnis-Effekt und gute Verträglichkeit bei Patienten, erfolgreich als Bare-Metal Stents im klinischen Einsatz verwendet. Diese Legierung kann eine miniaturisierte Stent mit einem äußeren Durchmesser von 500 um, die 20 beschichtet werden und implantiert in die Halsschlagader von Mäusen zu erstellen. Die Entwicklung eines miniaturisierten Nitinol-Stent für Maus carotid Arterie ermöglicht die Untersuchung der genauen molekularen Mechanismen Stentimplantation induziert und bietet die Möglichkeit, schnell und effizient zu testen, die Effekte von verschiedenen Medikamenten-Beschichtungen, um eine Restenose zu verhindern. Darüber hinaus stellt die Existenz von verschiedenen Knock-out-Mäuse Stämme einen großen Vorteil bei der Klärung der Rolle der verschiedenen Moleküle in Neointima Wachstum und In-Stent-Thrombosen beteiligt.
Protokoll
1. Stent Vorbereitung und Implantation
- Das Stent-Streben (Fort Wayne Metals, Castlebar, Irland) waren geflochten und dann auf die gewünschte Größe am Institut für Textil-und Maschinenbau, RWTH Aachen in Deutschland (Abbildung 1A) geschnitten.
- Vor der Implantation muss die Stents in eine 2 cm Silikonschlauch übertragen werden, mit einer Pinzette und legte 2 mm an einem terminalen Ende, bezeichnet vorderen Ende (1A).
- Das vordere Ende sollte schräg geschnitten werden, um eine scharfe Spitze für die Implantation zu gewährleisten.
- Vor der Implantation sollte der Stent reichlich bewässert, um ein Verrutschen zu sichern.
2. Stent Implantation
- 10-12 Wochen alten männlichen C57BL / 6 Wildtyp-Mäusen, sind 25-27 g betäubt mit intraperitoneale Injektion von 100 mg / kg Ketamin und 10 mg / kg Xylazin. Proper Betäubung wird vor der Operation durch das Fehlen von Reflexen und bestätigtBart Bewegung. Bis zur Trockene zu verhindern, während der Narkose, die Mäuseaugen durch einen Film aus bepanthene Creme bedeckt sind.
- Nach der Rasur und der Desinfektion der ventralen Halsbereich wird ein kleiner mittlerer Einschnitt von 1 cm unter einem Stereomikroskop durchgeführt wird, mit einer Schere. Nach Trennung der 2 Fettkörper mit sterilem gebogenen Pinzette kann die linke gemeinsame Halsschlagader gesehen Pulsen mit der Luftröhre.
- 1 cm von der linken Arteria carotis communis und die Bifurkation sollte frei hergestellt. 1 Knoten mit einem 5/0 Seidenfaden um die linke Arteria carotis communis gebunden werden, werden 2 Knoten mit 7/0 Seidenfäden um die linke äußere Halsschlagader gebunden sein, und 1 Knoten mit einem 7/0 Seidenfaden gebunden werden um die innere Halsschlagader (Abbildung 1B).
- Der Blutfluss wird dann durch Bindung der Knoten auf der Arteria carotis interna und Arteria carotis externa proximalen fest, sowie durch Ziehen den Knoten Surround unterbrochenING die Arteria carotis communis. Der Behälter sollte in einer Weise, dass der gemeinsame und Arteria carotis externa in einer geraden Linie festgelegt.
- Ein kleiner Schnitt an der äußeren Halsschlagader durchgeführt wird, in der Nähe des proximalen Knoten mit einem Vannas Schere. Der Silikonschlauch mit dem Stent in die äußere Halsschlagader eingeführt, mit dem spitzen Ende voran, mit einem Führungsdraht. Nachdem der Stent die gewünschte Position erreicht, wird der Silikonschlauch wieder über den Führungsdraht herausgezogen und ermöglicht die Formgedächtnis-Expansion des Stents (1B).
- Das distale Knoten auf der externen Halsschlagader ist fest zu binden, um die Website der Schnittführung und den Knoten an der internen und Arteria carotis communis schließen werden entfernt, wodurch die Wiederherstellung des Blutflusses.
- Der Hautschnitt wird geschlossen mit 3-4 Michel Wundklammern und Michel forcep. Die Maus wird unter der roten Ampel bis zur vollständigen Erholung gelegt. Eine analgetische Behandlung ist nicht erforderlich.
- DiePlaque kann nach 1-3 Wochen analysiert. Um die Reendothelisierung studieren, ist eine frühere Ende-Zeitpunkt notwendig (3-4 Tage). Wir haben beobachtet, in unserem Modell der Stentimplantation als 4 Wochen nach der chirurgischen Eingriff, insbesondere durch die Verwendung von speziellen Beschichtungen, die miniaturisierte Stents biofunctionalize, Gefäßneubildung in etwa 30% der Probe auftritt. Dies ist eine Hirschkuh für Umbau und regenerative Prozesse mit unterschiedlichen Mechanismen und Vertretung eines anderen pathologischen Problem. Um Neointimabildung, In-Stent-Stenose und / oder Analyse der Mechanismen dieser Nebenwirkungen nach der Stent-Implantation eine Ende-Zeitpunkt 3 Wochen von Vorteil wäre nicht zu verwechseln mit den regenerativen Effekte durch den Beginn der Gefäßneubildung induziert konzentrieren.
3. Analyse der Plaquebildung
- Am Ende-Zeitpunkt werden die Tiere narkotisiert mit intraperitoneale Injektion von 100 mg / kg Ketamin und 10 mg / kg Xylazin.Proper Betäubung wird vor der Operation durch das Fehlen von Reflexen und Bart Bewegung bestätigt.
- Die Tiere werden durch intrakardiale Ausbluten getötet. Das Serum Blut wird zur weiteren Analyse gesammelt.
- Nach dem Öffnen der Brusthöhle und PBS Waschen via intrakardiale Punktion, ein Körper-Perfusion mit 4% Paraformaldehyd (PFA)-Lösung wird für 5 min durchgeführt. Die linke Arteria carotis mit dem Stent wird seziert, direkt in einer 4% PFA-Lösung gegeben und mindestens 16 Stunden später in Kunststoff embbeded.
- 50 um dicke Schnitte sind aus Kunststoff eingebettete Proben unter Verwendung eines Diamant-Bandsäge durchgeführt.
- Um die Plaque Größe zu messen, wird Giemsa-Färbung durchgeführt.
- Um die Rate der Reendothelisierung im Stent-Bereich des Schiffes zu analysieren, ist für Immunhistochemie von Willebrand-Faktor (vWF) durchgeführt.
Ergebnisse
- Die Implantation eines miniaturisierten Nitinol-Stent in die linke Halsschlagader von Mäusen dauert 25-30 min und zeigt eine Mortalitätsrate von 10% vor allem aufgrund der Beschädigung des Schiffes während der Intervention. Eine bessere Überlebensrate ist bei Mäusen mit einem Gewicht von mehr als 25 g zum Zeitpunkt der Stentimplantation (Mortalitätsrate von 5%) beobachtet. Daher entschieden wir uns für die Implantation Mäuse mit einem Gewicht zwischen 25-27 g. Nach der Operation erholen die Mäuse aus der Narkose innerhalb von 2-5 min und ohne körperliche Beeinträchtigungen, wie zB Lähmungen, beobachtet werden. Micro-Computer-Tomographie (Mikro-CT)-Bildgebung durchgeführt eine Woche nach Stentimplantation zeigte, dass die Stents sind nicht durch den Blutfluss (1C) ausgerenkt. Leider ist die Analyse der Neointimabildung in diesen Bildern nicht möglich, da die Metall-derived Artefakte (1D, 1E).
- Konnten wir nicht beobachten jedes Schiff oder endothelialen Schäden unstented Bereich des Schiffes, unmittelbar unterhalb des Stents, Als detektierbare durch histologische (2A) und durch spezifische Färbung für Endothel (2B, anti-Maus-CD31-Antikörper). Zur besseren Übersicht wurde die Sektion gescannt mit einem Zwei-Photonen-Laser-Scanning-Mikroskopie (2B, 2C).
- In der Stent Schiffes wird eine permanente Dilatation von 15% nachgewiesen werden (Verhältnis Stent: Arterie, 1,15:1) von Mäusen mit einem Gewicht zwischen 25-27 g. Neointima-Bildung und Thrombus-Bildung kann durch klassische histologische Färbungen (zB Hämatoxilin-Eosin, Giemsa, Movat, Toluidinblau, Masson-Trichrom-Goldner, 3A, 3B) analysiert werden. Da die Lamina externa und interna nicht mehr sichtbar sind, wurde Plaquegröße als Differenz der externen und der luminalen Bereiche (: 234566 ± 3315 um 2, bedeuten luminalen Fläche: 12036 ± 2662 um 2 bedeuten Plaquefläche) berechnet. Externe Umfang wurde auch gemessen (Mittelwert: 1799 ± 14 um). Für die Auswertung derZellzusammensetzung, müssen die Abschnitte deplastified und mit spezifischen Markern gefärbt werden. Für die Reendothelisierung, verwendeten wir eine Cy3-konjugierten anti-CD31-Antikörper und für die Proliferation glatter Muskelzellen ein FITC-konjugierten anti-SMA-Antikörper (3C). Eine Woche nach Stentimplantation: Re-Endothelialisierung wurde als Prozentsatz der CD-31 positive gebeizt auf die gesamte luminale Oberfläche (23,07 ± 3,14% Mittelwert) berechnet.
Natürlich ist eine unbegrenzte Anzahl von spezifischen Färbung möglich, abhängig von einzelnen Laboratorien Erfahrung. Analyse von Myosin schwere Kette, für eine bessere Charakterisierung von SMC, aber auch die Analyse von infiltrierten Zellen (Monozyten, Lymphozyten) oder Färbungen für verschiedene inflammatorische Zytokine können auch durchgeführt werden, je nach Ziel der Studie.
c = "/ files/ftp_upload/50233/50233fig1.jpg" />
Abbildung 1. Schematische Darstellung des chirurgischen Eingriffs (A). Der Blutfluss durch Bindung der Knoten auf der Arteria carotis interna und Arteria carotis externa proximalen fest, sowie durch Ziehen den Knoten um die Arteria carotis communis unterbrochen. Der Silikonschlauch mit dem Stent wird in der A. carotis externa durch einen kleinen Einschnitt in der externen Karotis-Arterie eingeführt. Nachdem der Stent die gewünschte Position erreicht, wird der Silikonschlauch wieder über den Führungsdraht herausgezogen und ermöglicht die Formgedächtnis-Expansion des Stents. Micro-CT-Bildern, die die Position des Stents eine Woche nach der chirurgischen Implantation (B). Aufgrund der Material-derived Artefakte, ist eine Analyse der Neointima Wachstum nicht möglich ist (C, D).
3fig2highres.jpg "src =" / files/ftp_upload/50233/50233fig2.jpg "/>
2. Unstented Bereich des Behälters nicht von der Operation betroffen, von Toluidin Blau (A) und Endothelzellen-spezifische CD31-Färbung (B, C) gezeigt.
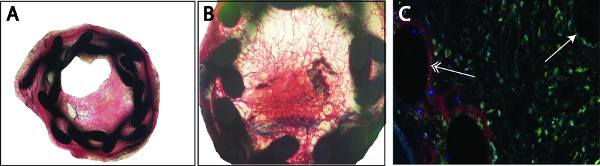
Abbildung 3. Analyse der Plaque kann durch klassische histologische Färbungen (zB Masson-Goldner-Trichrom) (A) durchgeführt werden. Die organisierten Thrombus durch schwarz gefärbte Fibrinablagerungen in der Neointima nachgewiesen werden, in einigen Fällen ein vollständiger Verschluss des Gefäßes zu beobachten (B). Reendothelisierung (Cy3, rot) oder Proliferation von glatten Muskelzellen (FITC, grün) durch doppelte Immunfluoreszenz mit spezifischen Markern detektiert.Gegenfärbung mit 4 ',6-Diamidino-2-phenylindol (DAPI, blau) (C) durchgeführt wird. Uns ist aufgefallen, ein ausgefülltes Reendothelisierung der Stentstreben (links, Doppelpfeil) im Vergleich zu einem unvollendeten luminalen Reendothelisierung (rechts, einzelne Pfeil).
Diskussion
Um das Risiko von In-Stent-Restenose und Thrombose zu verringern und die Entwicklung von neuen Beschichtungen für Medikamente-freisetzende Stents, eine einfache, einfache und zugängliche Methode der Stent-Implantation im Tiermodell Sustain benötigt wird. Mäuse liefern das ideale System, um die komplexen Mechanismen der arteriellen Umbau nach der Stent-Implantation und die Effizienz solcher Arzneimittel zu studieren. Bestehende Modelle für In-Stent-Restenose in der Maus sind schwierig, erfordern hohe chirurgische Fähigkeiten und implizieren hohe Risiken von Komplikationen wie Blutungen oder Lähmung 17-19. Zum Beispiel wird in dem Modell der Stent-Implantation in Aorta eines Spenders Maus nach einer Ballon-Dilatation des Gefäßes und der Transplantation des Stent-Segment in Halsschlagader eines Empfängers Maus 17 ist die Untersuchung der pathogenen Mechanismen nicht beeinflusst nur durch Empfänger Reaktion auf Spender Material, sondern auch durch die massive Schädigung der Vasa vasorum und Adventitia. Implantation eines Stahlarmbandl Stent direkt in Bauchaorta nach Ballon-Dilatation 19 ist durch eine hohe Sterblichkeit (35%) wegen Hinterbein Lähmung nach Thrombosen oder Blutungen aus Bauchaorta vor Ort von Arteriotomie gefolgt. Implantation einer spiralförmigen selbst-expandierenden Nitinol-Stents in Bauchaorta über Oberschenkelarterie 18 muss hoch chirurgischen Fähigkeiten, vor allem aufgrund blind Leiten des Stents entlang der Verzweigung von Oberschenkelarterie zur Aorta, um den Stent an der richtigen Stelle zu platzieren. Dieser Vorgang wird durch eine hohe Gefahr der Beschädigung des femoralis daher Lähmung des Hinterbein gefolgt. Im Vergleich mit diesen Verfahren, unser Modell der Stent-Implantation in der Maus nicht brauchen hohe chirurgische Fähigkeiten.
Unser Modell bietet eine einfache, einfache und effiziente Methode, um die Auswirkungen der verschiedenen Drogen-Beschichtungen auf die arterielle Remodeling zu analysieren, wird die Platzierung des Stents unter den Augen gemacht, und es gibt keine Risiken von schädlichen Nerven oder anderen Strukturen. Die comkomplexen molekularen Mechanismen untersucht leichter in unser Modell der Maus Halsschlagader Stenting werden, nicht nur durch direkte Zugänglichkeit des Schiffes, sondern auch aufgrund der Existenz von verschiedenen Knock-out-Mäuse Stämme.
Als einer Einschränkung, verglichen mit dem klinischen Verfahren, nutzt unser Modell gesunden Mäusen / Arterien und führt keine Stenting auf bereits bestehende Plaques (nicht in-Stent-Restenose, aber in-Stent-Stenose). Wir wissen auch nicht durchführen Ballon-Dilatation vor Stent-Implantation. Aufgrund der massiven Schädigung der Gefäßwand in beiden Modellen die reparatory ähnlichen Verfahren. Leider wegen der Metall-abgeleiteten Artefakten ist eine in vivo Beobachtung der Neointima-Wachstum nicht von bestehenden bildgebenden Verfahren wie Ultraschall oder Computertomographie möglich. Ein weiterer limitierender Faktor ist die dünne Schnitte von Metall-basierte Stents, die einige Erfahrung in der Metallverarbeitung erfordert.
Mit dieser Methode konnten wirder Lage zu zeigen, dass Neutrophile anweist Nitinol-Stents mit LL-37 in-Stent-Restenose zu verringern, dass ein neues Konzept zu Gefäßheilung interventionelle Therapie nach 21 fördern beschichtet biofunktionalisiert miniaturisiert.
Trotz dieser Einschränkungen scheint dieses Modell zu sein, bis jetzt, das am besten geeignete System, damit Geld-und zeitsparend, neue Wirkstoff-Beschichtungen für Stents und deren Auswirkungen auf die molekularen Vorgänge während der arteriellen Remodeling zu untersuchen. Darüber hinaus kann dieses Modell einfach zur Hamster, die ähnlich wie die menschliche angepasst wird, so dass jedes therapeutische Hypothese vor dem Auftragen auf größere Tiere oder Menschen, unangenehme und unerwartete Effekte zu vermeiden verifiziert werden kann.
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Wir danken Frau Angela Freund für die hervorragende technische Unterstützung in Kunststoff eingebettet Zerteilen der Stents. Wir danken auch Frau Roya Soltan und Frau Angela Freund für die professionelle Hilfe bei der Immunhistochemie-Färbung.
Materialien
| Name | Company | Catalog Number | Comments |
| nitinol-stents (self-made from nitinol-struts) | Fort Wayne Metals, Castlebar, Ireland NiTi#1, superelastic, straight annealed, light oxide, diameter 500 μm | custom-made product | Institute for Textile Technology and Mechanical Engineering |
| silicon tube | IFK Isofluor, Germany | custom-made product | diameter 500 μm, section thickness 100 μm, polytetrafluorethylene catheter |
| stereomicroscope | Olympus | SZ/X9 | |
| forceps | FST, Germany | 91197-00 | standard tip curved 0.17 mm |
| Ketamine 10% | CEVA, Germany | ||
| Xylazine 2% | Medistar, Germany | ||
| Bepanthene | Bayer, Germany | ||
| Scissors | FST, Germany | 91460-11 | Straight |
| Vannas scissor | Aesculap, Germany | OC 498 R | |
| 5/0 Silk | Seraflex | IC 108000 | |
| 7/0 Silk | Seraflex | IC 1005171Z | |
| guide-wire | Abbott Vascular | 1001782-HC | 0.014-inch angioplastie guide-wire |
| Michel suture clips | Aesculap, Germany | BN507R | 7.5 x 1.75 mm |
| Michel Forcep | Aesculap, Germany | BN730R |
Referenzen
- Ross, R., et al. Response to injury and atherogenesis. Am. J. Pathol. 86, 675-684 (1977).
- Virmani, R., et al. Pathology of the vulnerable plaque. J. Am. Coll. Cardiol. 47, 13-18 (2006).
- Farb, A., et al. Pathology of acute and chronic coronary stenting in humans. Circulation. 99, 44-52 (1999).
- Weber, C., Noels, H. Atherosclerosis: current pathogenesis and therapeutic options. Nat. Med. 17, 1410-1422 (2011).
- Lenzen, M. J., et al. Management and outcome of patients with established coronary artery disease: the Euro Heart Survey on coronary revascularization. Eur. Heart J. 26, 1169-1179 (2005).
- Babapulle, M. N., et al. A hierarchical Bayesian meta-analysis of randomised clinical trials of drug-eluting stents. Lancet. 364, 583-591 (2004).
- Wiviott, S. D., et al. Intensive oral antiplatelet therapy for reduction of ischaemic events including stent thrombosis in patients with acute coronary syndromes treated with percutaneous coronary intervention and stenting in the TRITON-TIMI 38 trial: a subanalysis of a randomised trial. Lancet. 371, 1353-1363 (2008).
- van Werkum, J. W., et al. Predictors of coronary stent thrombosis: the Dutch Stent Thrombosis Registry. J. Am. Coll. Cardiol. 53, 1399-1409 (2009).
- Finn, A. V., et al. Vascular responses to drug eluting stents: importance of delayed healing. Arterioscler. Thromb Vasc. Biol. 27, 1500-1510 (2007).
- Joner, M., et al. Pathology of drug-eluting stents in humans: delayed healing and late thrombotic risk. J. Am. Coll. Cardiol. 48, 193-202 (2006).
- Cines, D. B., et al. Endothelial cells in physiology and in the pathophysiology of vascular disorders. Blood. 91, 3527-3561 (1998).
- Hristov, M., Weber, C. Endothelial progenitor cells: characterization, pathophysiology, and possible clinical relevance. J. Cell Mol. Med. 8, 498-508 (2004).
- Rabelink, T. J., et al. Endothelial progenitor cells: more than an inflammatory response?. Arterioscler. Thromb. Vasc. Biol. 24, 834-838 (2004).
- Schwartz, R. S., et al. Preclinical evaluation of drug-eluting stents for peripheral applications: recommendations from an expert consensus group. Circulation. 110, 2498-2505 (2004).
- Schwartz, R. S., et al. Differential neointimal response to coronary artery injury in pigs and dogs. Implications for restenosis models. Arterioscler. Thromb. 14, 395-400 (1994).
- Schwartz, R. S., et al. Restenosis and the proportional neointimal response to coronary artery injury: results in a porcine model. J. Am. Coll. Cardiol. 19, 267-274 (1992).
- Ali, Z. A., et al. Increased in-stent stenosis in ApoE knockout mice: insights from a novel mouse model of balloon angioplasty and stenting. Arterioscler. Thromb. Vasc. Biol. 27, 833-840 (2007).
- Chamberlain, J., et al. A novel mouse model of in situ stenting. Cardiovasc. Res. 85, 38-44 (2010).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209, 359-366 (2010).
- Costa, F., et al. Covalent immobilization of antimicrobial peptides (AMPs) onto biomaterial surfaces. Acta Biomaterialia. 7, 1431-1440 (2011).
- Soehnlein, O., et al. Neutrophil-derived cathelicidin protects from neointimal hyperplasia. Science Translational Medicine. 3, 103ra198 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten