Method Article
Un modelo murino de la implantación de un stent en la arteria carótida para el Estudio de la reestenosis
En este artículo
Resumen
Se describe un modelo de implantación de un stent en la arteria carótida del ratón. En comparación con otros métodos similares, este procedimiento es muy rápido, simple y accesible, que ofrece la posibilidad de estudiar de una manera conveniente la reacción de la pared vascular a diferentes stents liberadores de fármacos y los mecanismos moleculares de la restenosis.
Resumen
A pesar de los considerables progresos realizados en el desarrollo del stent en las últimas décadas, las enfermedades cardiovasculares siguen siendo la principal causa de muerte en los países occidentales. Además de los beneficios que ofrece el desarrollo de los diferentes stents liberadores de fármacos, la revascularización coronaria lleva también los riesgos que amenazan la vida de la trombosis en el stent y la reestenosis. La investigación sobre nuevas estrategias terapéuticas se ve afectada por la falta de métodos adecuados para el estudio de la implantación del stent y los procesos de reestenosis. Aquí se describe un procedimiento rápido y accesible de la implantación de un stent en la arteria carótida del ratón, que ofrece la posibilidad de estudiar de una forma sencilla los mecanismos moleculares de remodelado vascular y los efectos de las diferentes capas de la droga.
Introducción
Las enfermedades cardiovasculares causadas por la progresión de la aterosclerosis son la principal causa de muerte en los países industrializados. La aterosclerosis es un centro de coordinación de respuesta inflamatoria, fibro-proliferativa de la pared vascular a la lesión endotelial 1, dando como resultado la formación de una placa extendida en el lumen del vaso, que afecta el flujo sanguíneo a través de las arterias coronarias. Más del 75% de los infartos de miocardio resultado de la ruptura de la capa fibrosa fina de la placa inflamada 2. Dado que esta complicación puede ser fatal, un transluminal percutánea (coronaria) percutánea (ACTP) con stent se convirtió en el tratamiento de primera elección en la práctica médica actual. El método permite la dilatación de la arteria coronaria estrechada y por lo tanto la restauración del flujo sanguíneo. Al mismo tiempo, se produce una lesión medida en el endotelio y la pared del vaso 3. Sin embargo, el efecto a largo plazo de esta terapia está limitada por un remodelado arterial excesivaling y restenosis 4.
Por el empleo de stents, la ACTP se hizo más eficaz en el tratamiento de lesiones complicadas, lo que permite la revascularización después de una oclusión aguda de vasos 5. Este método disminuye la incidencia de reestenosis intra-stent a menos del 10% 6. Además de estos beneficios, esta terapia de primera elección para la revascularización coronaria lleva también los riesgos que amenazan la vida de la trombosis en el stent y la reestenosis.
En la trombosis del stent es causada por un de-endotelización del recipiente, seguido por una adhesión masiva de plaquetas y fibrina en el sitio lesionado. 26% de los pacientes sufren de trombosis en el stent y el 63% muere de infarto de miocardio 7. La restenosis se refiere al proceso de cicatrización de la herida después de la lesión mecánica a la pared del vaso, que implica la hiperplasia neointimal (migración y proliferación de células del músculo liso vascular (CMLV), deposición de la matriz extracelular (ECM), y la remodelacióndel buque. A menudo, una re-intervención invasiva hace necesario dilatate vasos ateroscleróticos severamente estrechadas debido a una trombosis en el stent y la reestenosis.
Para prevenir la trombosis en el stent, un tratamiento a largo plazo con fármacos anti-trombóticos es necesario 8. Para evitar la restenosis, la nueva generación de stents liberadores de fármacos eluir agentes antiproliferativos tales como medicamentos inmunosupresores (por ejemplo, sirolimus, everolimus, zotarolimus) y medicamentos contra el cáncer (por ejemplo, paclitaxel) de un recubrimiento de polímero durante varios meses 9,10. A pesar de que estos fármacos disminuyen la formación de la neoíntima y la reestenosis, que mantienen un alto riesgo de trombosis en el stent mediante la inhibición de la re-endotelización.
Después de una lesión arterial, el mantenimiento de el compartimiento endotelial es esencial para prevenir las complicaciones trombóticas. En condiciones fisiológicas, el endotelio humano tiene un índice de rotación de 11. En patologíaogical condiciones, sin embargo, la integridad endotelial se deteriora, por lo que se requiere una rápida recuperación por rodea a las células endoteliales maduras y células progenitoras endoteliales (CPE) que circulan 12,13.
El estudio de estos complejos mecanismos moleculares en los animales más grandes 14-16 o en la arteria aorta del ratón es un procedimiento muy difícil, que ofrece datos limitados 17-19. Para probar la eficacia del stent recubrimientos novedosos para reducir la trombosis en el stent y la reestenosis nuevos modelos son imprescindibles.
Nitinol representa la plataforma ideal para stents debido a su "alta elasticidad, efecto de memoria de forma y buena tolerancia en los pacientes, que se utiliza con éxito como los stents convencionales en uso clínico. Esta aleación hizo posible la creación de un stent en miniatura con un diámetro exterior de 500 micras, que se pueden revestir 20 y se implantan en la arteria carótida de los ratones. El desarrollo de un stent de nitinol en miniatura para el ratón carteria arotid, permite el estudio de los mecanismos moleculares precisos inducida por la implantación del stent y ofrece la posibilidad de comprobar de forma rápida y eficiente los efectos de los diferentes recubrimientos de medicamentos para prevenir la reestenosis. Por otra parte, la existencia de diferentes cepas de ratones knock-out representa una gran ventaja para aclarar el papel de las diferentes moléculas involucradas en el crecimiento de la neoíntima y trombosis en el stent.
Protocolo
1. Preparación de stent y de implantación
- El stent struts (Fort Wayne Metals, Castlebar, Irlanda) fueron trenzados y luego se corta a la medida deseada en el Instituto de Tecnología Textil e Ingeniería Mecánica, Universidad RWTH Aachen en Alemania (fig. 1A).
- Antes de la implantación, los stents deben ser transferidos a un tubo de 2 cm de silicio, usando fórceps, y se colocaron 2 mm en un extremo terminal, denominado extremo delantero (Figura 1A).
- La parte delantera debe ser cortada oblicuamente, para garantizar una punta afilada para la implantación.
- Antes de la implantación, el stent debe ser abundantemente regado, para asegurar el deslizamiento.
2. Implantación de stent
- 10-12 semanas de edad ratones de tipo salvaje C57BL / 6 macho, 25-27 g se anestesian mediante inyección intraperitoneal de 100 mg / kg de ketamina y 10 mg / kg de xilazina. Anestesia adecuada se confirmó antes de la cirugía por la falta de reflejos ymovimiento barba. Para evitar la sequedad, mientras que bajo anestesia, los ojos del ratón están cubiertos por una película de crema de Bepanthene.
- Después del afeitado y desinfección de la zona ventral del cuello, una pequeña incisión mediana de 1 cm se realiza bajo un microscopio estereoscópico, con unas tijeras. Después de separar los cuerpos grasos con 2 pinzas curvas estériles, la arteria carótida común izquierda se puede ver pulsante, junto con la tráquea.
- 1 cm de la arteria carótida común izquierda y la bifurcación deben estar libres preparados. 1 nudo con una rosca de 5/0 seda será atado alrededor de la arteria carótida común izquierda, 2 nudos con 7/0 hilos de seda se unirán alrededor de la arteria carótida externa izquierda y 1 nudo con un hilo 7/0 seda estarán obligados alrededor de la arteria carótida interna (Figura 1B).
- El flujo de sangre se interrumpe a continuación, mediante la unión de los nudos en la arteria carótida interna y la arteria carótida externa proximal con firmeza, así como tirando de la envolvente nudoción de la arteria carótida común. El recipiente debe fijarse de manera que la arteria carótida común y externos están en una línea recta.
- Se realiza una pequeña incisión en la arteria carótida externa, cerca del nudo proximal, utilizando una tijera Vannas. El tubo de silicona que contiene el stent se introduce en la arteria carótida externa, con el extremo afilado en frente, usando una guía-alambre. Después de que el stent alcanza la posición deseada, el tubo de silicona se tira hacia atrás sobre la guía-alambre y permite la expansión de memoria de forma del stent (Figura 1B).
- El nudo distal de la arteria carótida externa se une fuertemente a cerrar el sitio de la incisión y los nudos en la arteria carótida interna y comunes se eliminan, restableciendo así el flujo sanguíneo.
- La incisión se cierra con suturas 3-4 clips Michel y Michel fórceps. El ratón se coloca bajo la luz roja hasta la recuperación completa. Un tratamiento analgésico no es necesario.
- Lala placa puede ser analizado después de 1-3 semanas. Estudiar la reendotelización, un punto de los últimos tiempos antes es necesario (3-4 días). Hemos observado en nuestro modelo de implante de stent que 4 semanas después de esta intervención quirúrgica, especialmente por el uso de revestimientos específicos para biofunctionalize los stents miniaturizados, neoangiogénesis se produce en aproximadamente el 30% de la muestra. Esta es una cierva en los procesos de remodelación y regeneración, con diferentes mecanismos y que representan otro problema patológico. Para concentrarse en la formación de neoíntima, estenosis en el stent y / o análisis de los mecanismos subyacentes a estos efectos secundarios después de la implantación del stent de un punto de 3 semanas de tiempo final sería beneficioso no mezclar con los efectos regeneradores inducidos por la aparición de la neoangiogénesis.
3. Análisis de la formación de placa
- En el punto de tiempo final, los animales se anestesian usando inyección intraperitoneal de 100 mg / kg de ketamina y 10 mg / kg de xilazina.Anestesia adecuada se confirmó antes de la cirugía por la falta de los reflejos y el movimiento barba.
- Los animales son sacrificados por desangrado intracardiaca. La sangre se recoge el suero para el análisis adicional.
- Después de abrir la cavidad torácica y PBS de lavado a través de punción intracardiaca, un cuerpo-perfusión con solución de paraformaldehído al 4% (PFA) se lleva a cabo durante 5 min. La arteria carótida izquierda que contiene el stent se disecciona, se coloca directamente en una solución de PFA 4% y al menos 16 horas más tarde embbeded en plástico.
- 50 micras de espesor secciones se realizan a partir de plástico incrustados muestras usando una banda de sierra de diamante.
- Para medir el tamaño de la placa, se realizó una tinción de Giemsa.
- Para analizar la tasa de re-endotelización del stent dentro de la zona de la embarcación, se lleva a cabo la inmunohistoquímica para el factor de von Willebrand (vWF).
Resultados
- La implantación de un stent de nitinol en miniatura en la arteria carótida izquierda del ratón toma 25-30 minutos y muestra una tasa de mortalidad del 10% principalmente debido a los daños del buque durante la intervención. Una mejor tasa de supervivencia se observó en ratones que tienen un peso de más de 25 g en el momento de la implantación del stent (tasa de mortalidad de 5%). Por lo tanto, se optó por la implantación de los ratones con un peso de entre 25 a 27 g. Después de la cirugía, los ratones se recuperan de la anestesia en 2-5 minutos y sin impedimentos físicos, como por ejemplo, la parálisis, se observan. Micro-Computer Tomography (micro-TC) realizó una semana después de la implantación del stent mostró que los stents no están dislocados por el flujo sanguíneo (Figura 1C). Desafortunadamente, el análisis de la formación de neoíntima en estas imágenes no es posible debido a los artefactos de metal-derivados (Figura 1D, 1E).
- No se observó ningún buque o daños endoteliales de superficie sin endoprótesis de la nave, inmediatamente debajo del stent, Como detectable por histológico (Figura 2A) y por tinción específica de endotelio (Figura 2B, anti-ratón CD31 de anticuerpos). Para una mejor visión de conjunto, la sección fue escaneada utilizando un microscopio de escaneo láser de dos fotones (Figura 2B, 2C).
- En el recipiente de stent, se detecta una dilatación permanente de 15% (relación de stent: arteria, 1,15:1) por los ratones con un peso entre 25-27 g. Formación de la neoíntima y la formación de trombo-pueden ser analizados por tinciones histológicas clásicas (por ejemplo, hematoxilina-eosina, Giemsa, Movat, Azul Toluidina, Masson Trichrom-Goldner, la Figura 3A, 3B). Dado que la lámina externa e interna no son visibles más, tamaño de la placa se calculó como la diferencia entre el exterior y las áreas luminales (media área de la placa: 234.566 ± 3.315 m 2, la media de área luminal: 12.036 ± 2.662 m 2). También se midió la circunferencia externa (media: 1.799 ± 14 micras). Para el análisis de lacomposición celular, las secciones deben ser deplastified y se tiñeron con marcadores específicos. Para la re-endotelización, se utilizó un anticuerpo anti-CD31 conjugado con Cy3 y para la proliferación celular del músculo liso un anticuerpo anti-SMA conjugado con FITC (Figura 3C). Reendotelización se calculó como porcentaje del CD-31 positivas teñidas a la superficie luminal total (media: 23,07 ± 3,14%), una semana después de la implantación del stent.
Por supuesto, un número ilimitado de tinción específica es posible, dependiendo de la experiencia de cada uno de los laboratorios. Análisis de la cadena pesada de la miosina, para una mejor caracterización de las SMC, sino también el análisis de las células infiltradas (monocitos, linfocitos), o tinciones para diferentes citoquinas inflamatorias también se puede realizar, dependiendo del objetivo del estudio.
c = "/ files/ftp_upload/50233/50233fig1.jpg" />
Figura 1. Esquema general del procedimiento quirúrgico (A). El flujo de sangre se interrumpe por la unión de los nudos en la arteria carótida interna y la arteria carótida externa proximal con firmeza, así como tirando del nudo que rodea la arteria carótida común. El tubo de silicona que contiene el stent se introduce en la arteria carótida externa a través de una pequeña incisión en la arteria carótida externa. Después de que el stent alcanza la posición deseada, el tubo de silicona se tira hacia atrás sobre la guía-alambre y permite la expansión de memoria de forma del stent. Imágenes micro-CT, que indican la posición del stent una semana después de la implantación quirúrgica (B). Debido a los artefactos materiales derivados, un análisis de crecimiento de la neoíntima no es posible (C, D).
3fig2highres.jpg "src =" / files/ftp_upload/50233/50233fig2.jpg "/>
Figura 2. Área sin endoprótesis de la embarcación no se ve afectado por el procedimiento quirúrgico, tal como se muestra por Toluidina azul (A) y tinción con CD31 endotelial específico (B, C).
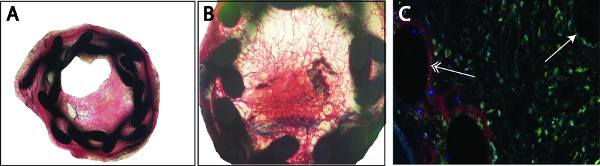
Figura 3. Análisis de la placa puede ser realizada por tinciones histológicas clásicas (por ejemplo, Masson Trichrom-Goldner) (A). Los trombo organizado pueden ser detectados por deposiciones de fibrina teñido de negro dentro de la neoíntima, en algunos casos se observa una oclusión completa del vaso (B). Re-endotelización (Cy3, rojo) o la proliferación de células del músculo liso (FITC, verde) se detectó por tinción de inmunofluorescencia doble utilizando marcadores específicos.Contratinción se realizó con 4 ',6-diamino-2-fenilindol (DAPI, azul) (C). Notamos un reendotelización completa de los puntales del stent (izquierda, flecha doble) en comparación con un reendotelización incompleted luminal (derecha, flecha simple).
Discusión
Para reducir el riesgo de trombosis en el stent y la reestenosis y sostener el desarrollo de nuevos recubrimientos para stents liberadores de fármacos, un método fácil, sencillo y accesible de la implantación del stent en un modelo animal es necesario. Ratones ofrecer el sistema ideal para estudiar los complejos mecanismos de la remodelación arterial después de la implantación del stent y la eficacia de estos fármacos. Los modelos existentes de la reestenosis intra-stent en el ratón son difíciles, requieren habilidades quirúrgicas altos e implican un alto riesgo de complicaciones como sangrado o parálisis 17-19. Por ejemplo, en el modelo de la endoprótesis de la implantación en la aorta torácica de un ratón donante después de globo de dilatación del vaso y después del trasplante del segmento con stent en la arteria carótida de un ratón receptor 17, el estudio de los mecanismos pato-no es influido sólo por reacción destinatario para material donante, sino también por la masiva perjudicial de vasa vasorum y adventicia. Implantación de un acero steel stent directamente en la aorta abdominal después de globo de dilatación 19 es seguida por una alta tasa de mortalidad (35%) a causa de patas parálisis después de una trombosis o sangrado de la aorta abdominal en el sitio de la arteriotomía. Implantación de una espiral en forma de autoexpandible de nitinol-stent en la aorta abdominal a través de la arteria femoral 18 necesita las habilidades quirúrgicas de alta, debido principalmente a ciegas dirigir el stent a lo largo de la ramificación de la arteria femoral a la aorta para colocar el stent en la posición correcta. Este procedimiento es seguido por un alto riesgo de dañar el nervio femoral, por lo tanto, la parálisis de la pata trasera. En comparación con estos procedimientos, el modelo de implantación de stent en el ratón no necesita habilidades quirúrgicas de alto.
Nuestro modelo ofrece un método simple, fácil y eficaz para analizar los efectos de las diferentes drogas revestimientos en remodelación arterial, la colocación del stent se realiza bajo la vista, y no hay riesgo de dañar los nervios u otras estructuras. La commecanismos moleculares complejas pueden ser investigados más fácil en nuestro modelo de ratón stent de la arteria carótida, no sólo por la accesibilidad directa de la embarcación, sino también debido a la existencia de diferentes cepas de ratones knock-out.
Como una limitación, en comparación con el procedimiento clínico, el modelo utiliza ratones / arterias sanas y no lleva a cabo la colocación de stents en placas pre-existentes (no reestenosis intra-stent, pero estenosis intra-stent). Tampoco realizamos con balón de dilatación antes de la implantación del stent. Sin embargo, debido al daño masivo de la pared del vaso en ambos modelos, los procesos reparadores son similares. Desafortunadamente, debido a los artefactos de metal-derivados, una monitorización in vivo del crecimiento de la neoíntima no es posible por métodos de imagen existentes como ultrasonido o tomografía por ordenador. Otro factor limitante es el seccionamiento fino de stents basados en metal, lo que requiere un poco de experiencia en el procesamiento de metales.
Usando este método, hemos sidocapaz de demostrar, que los neutrófilos instruir biofuncionalizadas nitinol stents recubiertos con LL-37 reducir reestenosis intra-stent, proporcionando un nuevo concepto para promover la cicatrización vascular después de la terapia intervencionista 21 miniaturizados.
A pesar de estas limitaciones, este modelo parece ser, hasta ahora, el sistema más adecuado, con lo que el dinero y el ahorro de tiempo, para investigar nuevos recubrimientos para stents de drogas y sus efectos sobre los eventos moleculares durante la remodelación arterial. Por otra parte, este modelo se puede adaptar fácilmente para el hámster, que es más similar a la humana, por lo que cada hipótesis terapéutica puede ser verificada antes de aplicar a animales más grandes o humanos para evitar efectos desagradables e inesperados.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Damos las gracias a la Sra. Angela Freund por la excelente asistencia técnica en seccionar los stents plásticos incrustados. Agradecemos también la señora Roya Soltan y la Sra. Angela Freund para la ayuda profesional con la tinción inmunohistoquímica.
Materiales
| Name | Company | Catalog Number | Comments |
| nitinol-stents (self-made from nitinol-struts) | Fort Wayne Metals, Castlebar, Ireland NiTi#1, superelastic, straight annealed, light oxide, diameter 500 μm | custom-made product | Institute for Textile Technology and Mechanical Engineering |
| silicon tube | IFK Isofluor, Germany | custom-made product | diameter 500 μm, section thickness 100 μm, polytetrafluorethylene catheter |
| stereomicroscope | Olympus | SZ/X9 | |
| forceps | FST, Germany | 91197-00 | standard tip curved 0.17 mm |
| Ketamine 10% | CEVA, Germany | ||
| Xylazine 2% | Medistar, Germany | ||
| Bepanthene | Bayer, Germany | ||
| Scissors | FST, Germany | 91460-11 | Straight |
| Vannas scissor | Aesculap, Germany | OC 498 R | |
| 5/0 Silk | Seraflex | IC 108000 | |
| 7/0 Silk | Seraflex | IC 1005171Z | |
| guide-wire | Abbott Vascular | 1001782-HC | 0.014-inch angioplastie guide-wire |
| Michel suture clips | Aesculap, Germany | BN507R | 7.5 x 1.75 mm |
| Michel Forcep | Aesculap, Germany | BN730R |
Referencias
- Ross, R., et al. Response to injury and atherogenesis. Am. J. Pathol. 86, 675-684 (1977).
- Virmani, R., et al. Pathology of the vulnerable plaque. J. Am. Coll. Cardiol. 47, 13-18 (2006).
- Farb, A., et al. Pathology of acute and chronic coronary stenting in humans. Circulation. 99, 44-52 (1999).
- Weber, C., Noels, H. Atherosclerosis: current pathogenesis and therapeutic options. Nat. Med. 17, 1410-1422 (2011).
- Lenzen, M. J., et al. Management and outcome of patients with established coronary artery disease: the Euro Heart Survey on coronary revascularization. Eur. Heart J. 26, 1169-1179 (2005).
- Babapulle, M. N., et al. A hierarchical Bayesian meta-analysis of randomised clinical trials of drug-eluting stents. Lancet. 364, 583-591 (2004).
- Wiviott, S. D., et al. Intensive oral antiplatelet therapy for reduction of ischaemic events including stent thrombosis in patients with acute coronary syndromes treated with percutaneous coronary intervention and stenting in the TRITON-TIMI 38 trial: a subanalysis of a randomised trial. Lancet. 371, 1353-1363 (2008).
- van Werkum, J. W., et al. Predictors of coronary stent thrombosis: the Dutch Stent Thrombosis Registry. J. Am. Coll. Cardiol. 53, 1399-1409 (2009).
- Finn, A. V., et al. Vascular responses to drug eluting stents: importance of delayed healing. Arterioscler. Thromb Vasc. Biol. 27, 1500-1510 (2007).
- Joner, M., et al. Pathology of drug-eluting stents in humans: delayed healing and late thrombotic risk. J. Am. Coll. Cardiol. 48, 193-202 (2006).
- Cines, D. B., et al. Endothelial cells in physiology and in the pathophysiology of vascular disorders. Blood. 91, 3527-3561 (1998).
- Hristov, M., Weber, C. Endothelial progenitor cells: characterization, pathophysiology, and possible clinical relevance. J. Cell Mol. Med. 8, 498-508 (2004).
- Rabelink, T. J., et al. Endothelial progenitor cells: more than an inflammatory response?. Arterioscler. Thromb. Vasc. Biol. 24, 834-838 (2004).
- Schwartz, R. S., et al. Preclinical evaluation of drug-eluting stents for peripheral applications: recommendations from an expert consensus group. Circulation. 110, 2498-2505 (2004).
- Schwartz, R. S., et al. Differential neointimal response to coronary artery injury in pigs and dogs. Implications for restenosis models. Arterioscler. Thromb. 14, 395-400 (1994).
- Schwartz, R. S., et al. Restenosis and the proportional neointimal response to coronary artery injury: results in a porcine model. J. Am. Coll. Cardiol. 19, 267-274 (1992).
- Ali, Z. A., et al. Increased in-stent stenosis in ApoE knockout mice: insights from a novel mouse model of balloon angioplasty and stenting. Arterioscler. Thromb. Vasc. Biol. 27, 833-840 (2007).
- Chamberlain, J., et al. A novel mouse model of in situ stenting. Cardiovasc. Res. 85, 38-44 (2010).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209, 359-366 (2010).
- Costa, F., et al. Covalent immobilization of antimicrobial peptides (AMPs) onto biomaterial surfaces. Acta Biomaterialia. 7, 1431-1440 (2011).
- Soehnlein, O., et al. Neutrophil-derived cathelicidin protects from neointimal hyperplasia. Science Translational Medicine. 3, 103ra198 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados