Method Article
Produktion von
In diesem Artikel
Zusammenfassung
Wir beschreiben die Sammlung von unbefruchteten Xenopus tropicalis Eier und Produktion einer Meiose II verhaftet Ei-Extrakt. Dieses Ei-Extrakt kann verwendet werden, um Mikrotubuli und Mikrotubuli-assoziierten RNAs zu reinigen.
Zusammenfassung
Viele Organismen lokalisieren mRNAs auf spezifische subzelluläre Destinationen räumlich und zeitlich Genexpression steuern. Neuere Studien haben gezeigt, dass die Mehrheit der transcriptome einer zufälligen Position in Zellen und Embryonen lokalisiert ist. Ein Ansatz, um lokalisierte mRNAs zu identifizieren, ist biochemisch Reinigung einer zellulären Struktur von Interesse und alle assoziierten Transkripte identifizieren. Mit neu entwickelten Hochdurchsatz-Sequenzierung Technologien ist es jetzt einfach, um alle RNAs mit einer subzellulären Struktur zu identifizieren. Um die Identifizierung zu erleichtern Transkript ist es notwendig, mit einem Organismus mit einem vollständig sequenzierten Genom arbeiten. Ein attraktives System für die biochemische Reinigung von subzellulären Strukturen sind Auszüge aus dem Ei Frosch Xenopus laevis produziert. Allerdings X. laevis derzeit nicht über eine vollständig sequenzierten Genom, das Transkript Identifizierung erschwert. In diesem Artikel beschreiben wir eine MethodeEi Auszüge aus einem verwandten Frosch, X. produzieren tropicalis, die eine vollständig sequenzierten Genom hat. Wir bieten Informationen zu Mikrotubuli Polymerisation, Reinigung und Isolierung Transkript. Während dieser Artikel beschreibt eine spezifische Methode zur Identifizierung von Mikrotubuli-assoziierten Transkripte, glauben wir, dass es leicht auf andere subzellulären Strukturen angewendet werden und eine leistungsfähige Methode zur Identifizierung von lokalisierten RNAs liefern.
Einleitung
Räumliche und zeitliche Kontrolle der Genexpression ist für alle Zellen wichtig, und ist besonders wichtig für die Kontrolle der frühen Embryonalentwicklung prasselt 1. Räumliche Kontrolle der Genexpression ist durch das aktive Lokalisierung von mRNAs zu bestimmten Zielen innerhalb der Zellen oder Embryonen erreicht. In vielen sehr großen Zelltypen (zB Oozyten, Embryonen und Neuronen) Lokalisation mRNA wird verwendet, um Protein-Expression an den Ort der Wirkung des codierten Proteins zu beschränken. Da eine lokalisierte mRNA viele Runden der Proteinproduktion katalysieren kann, ist es effizienter zu lokalisieren eine mRNA als zu lokalisieren einzelne Proteinmoleküle. Lokalisierte mRNAs werden typischerweise translational reprimiert, bis sie ihr Ziel, die zu einer weiteren Begrenzung der Lokalisation des kodierten Proteins 2 dient erreichen. Zusätzlich zu den vielen gut dokumentierten Fällen von RNA Lokalisation zu embryonalen Musterbildung steuern, haben mehrere Studien, die mRNAs lokalisiert sind dokumentiertan den Ort der Wirkung des codierten Proteins. Prominente Beispiele sind Lokalisation des β-Aktin 3 und Arp2 / 3 4 mRNAs an der Vorderkante der beweglichen Fibroblasten und Lokalisation der mRNAs für viele mitotischen Regulatoren meiotischen und mitotischen Spindeln 5-7.
Viele der klassischen Beispiele für lokalisierte mRNAs wurden durch genetische Screens für mütterliche Wirkung Mutationen identifiziert und wurden später ermittelt, um lokalisierte RNAs kodieren. Allerdings haben die jüngsten genomweite Studien begonnen, breiteren Einblick in den Umfang der lokalisierten RNAs liefern. Eine kürzlich in situ Hybridisierung Bildschirm in Drosophila Embryonen gezeigt, dass ~ 70% aller mRNAs eine bestimmte Lokalisation, darunter viele neuartige Destinationen 8 haben. Reinigung von Pseudopodien von Maus-Fibroblasten identifiziert eine vielfältige Gruppe von lokalisierte mRNAs 9. Arbeiten aus unserer Gruppe mit biochemischen Aufreinigung von Mikrotubuli aus meiotic XenoEiter Ei extrahiert identifiziert Hunderte von mRNAs, die mit der Spindel 5,7 copurify. Unsere Arbeit zeigt, dass die Mehrheit der Mikrotubuli-lokalisierten mRNAs Proteine, die die Kontrolle der Mitose kodieren, unterstützen die Idee, dass mRNAs an den Ort der Wirkung des codierten Proteins lokalisiert sind. Darüber hinaus unterstreicht die Fähigkeit, mRNA Anreicherung in einer subzellulären Fraktion durch biochemische Reinigung erkennen die Macht dieser Ansatz für die Identifizierung von lokalisierten mRNAs.
Die meisten lokalisierten RNAs verwenden aktiven Transport auf das Zytoskelett, entweder Aktin oder Mikrotubuli, um den Transport zu ihrem endgültigen Bestimmungsort 10 zu erreichen. Um ein besseres Verständnis für das Ausmaß und die Art der RNAs, die zu bestimmten Zielen mit einem biochemischen Ansatz ist es notwendig, ein in vitro-System, kann Zytoskelett Prozesse rekapitulieren müssen lokalisiert sind zu gewinnen. Einer der führenden Systeme für die Untersuchung des Zytoskeletts Biologie Ei Extrakte hergestelltaus unbefruchteten Eiern aus der Frosch Xenopus laevis. X. laevis Ei Extrakte sind seit Jahrzehnten eine breite Palette von Zytoskelett-Prozesse zu untersuchen benutzt worden und haben viel zu unserem Verständnis der Mechanismen und Moleküle, die Montage und Zytoskelett Dynamik 11 zu steuern beigetragen. Außerdem X. laevis Ei Extrakte zugänglich sind groß angelegte Reinigungen von Mikrotubuli und assoziierte Proteine 12,13 und es gibt gut entwickelten Methoden für die Herstellung von verschiedenen Arten von Ei-Extrakten 14-16. Für genomische Untersuchungen gibt es einige Nachteile bei der Verwendung von X. laevis als Modellsystem.
Seit Jahrzehnten Xenopus laevis Frösche sind ein leistungsfähiges System für die Untersuchung der Entwicklungs-und Zellbiologie, aufgrund der großen Eizelle Größe und robuste externe Entwicklung 17. Außerdem ist die Entwicklung von Systemen, die Eiextrakt viele zelluläre processe zusammenzufassen kanns in einem Reagenzglas hat dieser Frosch eine leistungsstarke experimentellen Modell. Allerdings Xenopus laevis durch das Fehlen einer vollständigen Genomsequenz, die von der Natur des allotetraploid genome.In Kontrast wurde verlangsamt behindert wurde, hat eine eng verwandte Spezies, Xenopus tropicalis, einen diploiden Genoms, die im Jahr 2010 18 sequenziert wurde. Während X. tropicalis ist nicht so experimentell wie gefügig X. laevis 17 die Verfügbarkeit eines sequenzierten Genoms ist es ein attraktives Modellsystem zur genomweiten Analysen durchzuführen.
In diesem Bericht beschreiben wir eine Methode, um die Meiose II-, Zytostatika-Faktor verhaftet Extrakte (CSF) von X. machen tropicalis 19. Anschließend beschreiben wir eine einfache Methode, um Mikrotubuli und assoziierte RNAs aus diesem Extrakt zu reinigen. Die RNAs können dann in Bibliotheken zugänglich Sequenzierung unter Verwendung neu entwickelten Hochdurchsatz-Technologien umgesetzt werden. Sobald die Bibliothekensequenziert werden sie zum Genom des Frosches spezifische mRNAs, die in der Mikrotubuli Probe im Vergleich zur gesamten Extrakt angereichert identifizieren ausgerichtet werden können. Dies stellt eine leistungsfähige Methode, um Mikrotubuli-bezogenen mRNA Lokalisierung in einem genomweiten Maßstab zu erkennen. Zusätzlich zu der Möglichkeit, lokalisierte mRNAs erkennen, bieten der Einsatz von Hochdurchsatz-Sequenzierung und sequenzierte Genom die Möglichkeit der Entdeckung neuer Transkripte, die derzeit nicht in der öffentlichen Datenbank Anmerkungen.
Protokoll
1. Generation X. tropicalis Eggs
Alle Xenopus tropicalis Frösche werden von NASCO bestellt. Unsere Frösche werden in einem aquatischen Lebensräume Wasserkreislaufsystem bei 27 ° C gehalten untergebracht Es gibt viele Möglichkeiten für Wasser-Systeme für die Pflege von X. tropicalis. Einige gute allgemeine Informationen über diese Froscharten finden Sie auf den Webseiten der Harland and Grainger Labors gefunden werden ( http://tropicalis.berkeley.edu/home/ , http://www.faculty.virginia.edu/xtropicalis / ). Unsere Frösche werden in tankwater bestehend aus (0,4 g Ciclid See Salze, 0,6 g Meersalz, 0,625 g NaHCO 3 pro Liter Wasser, pH 7,0) 20 gehalten. Dieses Rezept ergibt eine Leitfähigkeit von ~ 1.800 uS, die einen hohen Salzgehalt ist für X. tropicalis. Allerdings haben wir festgestellt, dass unsere Frösche in thi gedeihens Umwelt und Qualität der Oozyten wird verbessert. Alternative tankwater Rezepte können über die Ressourcen für allgemeine X. aufgeführt gefunden werden tropicalis Pflege.
- Frösche mit humanem Choriongonadotropin (hCG) werden an drei aufeinanderfolgenden Tagen injiziert, um Eier zu stimulieren Verlegung: Zuerst bereiten zwei Konzentrationen von hCG Lösung. Resuspendieren 10.000 U lyophilisierter hCG-Pulver in 10 ml sterilem, deionisiertem H 2 O für eine endgültige Konzentration von 1,000 U / ml. Dann verdünnt 1 ml 1,000 U / ml hCG Lösung in 9 ml H 2 O bei einer Endkonzentration von 100 U / ml. Bewahren Sie beide Lösungen bei 4 ° C.
- Am Tag 1, bereiten 4-6 Frösche zur Eiablage durch die Injektion mit hCG zwischen 2.00 bis 3.00. Spritzen Sie sich Frosch in der dorsalen Lymphsack in der Nähe der Kloake mit 0,2 ml 100 U / ml hCG Lösung. Nachdem die Frösche schnell während der folgenden zwei Injektionen wird die Menge der Abfälle, die während Frosch Eiablage zu minimieren, ist aber optional.
- Am 2. Tag injizieren die gleichen Fröschemit 0,2 ml 100 U / ml hCG Lösung zwischen 2.00 bis 3.00 Uhr.
- Am 3. Tag, injizieren die gleichen Frösche mit 0,2 ml 1.000 U / ml hCG-Lösung, zwischen 7.00 bis 10.00 Uhr. Richten Sie Frösche, Eier zu legen: füllen ein 6-Liter-Kunststoff-Eimer mit frischem tankwater, fügen Frösche und im Dunkeln bei 25 ° C. Nach dieser Injektion wird Eiablage nach 4 Stunden beginnen und wird von 7 Stunden abgeschlossen. Frösche legen ihre Eier sollten in einem Umfeld, das bei einem Minimum von 25 ° C gehalten wird
- Machen Sie extrahieren Lösungen und haben Ausrüstung bereit unmittelbar vor Eier sammeln.
20X MMR: 100 mM HEPES, pH 7,8; 2 mM EDTA pH 7,8; 2 M NaCl; 40 mM KCl; 20 mM MgCl 2; 40 mM CaCl 2. Autoklav und bei Raumtemperatur lagern. Bereiten 1 L 1X MMR kurz vor der Zubereitung zu extrahieren.
10X XB: 100 mM HEPES, pH7.7; 10 mM MgCl 2; 1 mM CaCl 2, 1 M KCl; 500 mM Saccharose. Autoklaven und lagern bei 4 ° C. Bereiten 1 L 1X j XBust vor der Herstellung zu extrahieren. Dejelly Lösung: Bereiten Sie 250 ml 3% Cystein-Lösung in entionisiertem H 2 O und pH-Wert auf 7,8-8,0 mit 10 N NaOH. Bereiten Sie kurz vor der Zubereitung zu extrahieren.
CSF-XB: Nehmen Sie 200 ml 1X XB und 2 ml 0,5 M EGTA pH 7,7 und 200 ul 1 M MgCl 2. Bereiten Sie kurz vor der Zubereitung zu extrahieren.
CSF-XB +: Nehmen Sie 50 ml CSF-XB und 50 ul LPC (10 mg / ml jedes Lager von Leupeptin, Pepstatin und Chymostatin in DMSO). In 50 ul Cytochalasin D (10 mg / ml in DMSO). Bereiten Sie kurz vor der Zubereitung zu extrahieren.
Vorbereiten einer 0,2% Gelatine Lösung in entionisiertem H 2 O, Mikrowelle zu lösen und zu filtern, zu sterilisieren. Lagerung bei Raumtemperatur.
Reserve 2 Beckman 2 x ½ Zoll Ultrazentrifugenröhrchen.
Bereiten Sie zwei 15 ml Glas-Rundkolben Zentrifugenröhrchen mit 0,5 ml H 2 O in jeder zur Abfederung derUltrazentrifugenröhrchen.
Machen feuerpolierten Glas Pasteur Pipetten. Rasten Sie das Ende weg von 5 ¾ Zoll Glaspipetten eine breite Öffnung freizulegen und offenen Flammen ausgesetzt, um die neue Pipettenspitze zu glätten.
- Vorbereiten einer 500 ml-Becherglas zur Speicherung von Eiern durch Schwenken einer 0,2% Gelatine Lösung zu beschichten, um die Wände des Bechers. Verwerfen Gelatine-Lösung aus Becherglas nach dem Gebrauch.
- Sammeln Sie Eier aus dem Plastikeimer für die Verlegung von 6-7 Stunden nach der dritten Injektion am Tag 3 verwendet. Falls gewünscht, drücken Sie leicht jedes Frosch einmal, um alle verbleibenden Eier zu bekommen. Waschen Sie Eier einmal mit frischen tankwater und in den 500 ml Becherglas mit 0,2% Gelatine beschichtet.
2. Herstellung eines Extrakts aus X. tropicalis Eggs
Alle Schritte Extraktzubereitung kann bei Raumtemperatur durchgeführt werden, etwa 25 ° C. Während der Waschungen, ist es wichtig, um das Ei zu haltens unter Flüssigkeit eingetaucht, so dass sie nass bleiben. Die Exposition gegenüber Luft kann die Eier Zellzyklus Verhaftung zu entgehen oder Lyse.
- Dekantieren so viel wie möglich tankwater unter Vorbehalt genügend Flüssigkeit zu halten die Eier nass. Kippen Sie das Becherglas mit Eiern auf die Seite und fügen Sie ~ 300 ml 1X MMR langsam an der Wand des Bechers, so dass körperliche Bewegung der Eier minimiert. Lassen Sie Eier absetzen, dann dekantiert enthaltende Überstand Schutt. X. tropicalis Eier sind bei diesem Schritt strähnig, so Entfernen von aktivierten Eier nach dejellying getan. Wiederholen für insgesamt drei Waschungen 1X MMR.
- Dejelly die Eier. Dekantieren Sie so viel wie möglich und MMR Add Hälfte des dejelly Lösung. Swirl kontinuierlich für ca. 5 min. Auflösen Gelee Mäntel werden im Überstand sichtbar nach ein paar Minuten. Dekantiert und fügen Sie die restlichen dejelly Lösung. Weiter zu wirbeln kontinuierlich, bis Eier sehr dicht packen und alle orientieren mit ihrem vegetativen Pol (der Polmit Weißpigment) zu dem Boden der Schale. Schnell abdekantieren so viel wie möglich dejelly Lösung. Sobald die Eier dejellied sind sie sehr empfindlich gegen mechanische Manipulationen.
- Vorsichtig XB auf die Eier. In der ersten XB waschen, entfernen Eier, die CSF Verhaftung entgangen, indem lysierten, geschwollen, weiß und pseudocleavage Eier. Activated X. tropicalis Eier neigen dazu, in der Mitte oben zu regeln, so verwenden Sie ein Kunststoff Transferpipette diese heraus zu ziehen. Entfernen Sie auch Stücke von Haut und Frosch Abfall. Waschen Sie Eier insgesamt dreimal mit ~ 300 ml 1X XB Lösung, sanft wirbelnde Eier zwischen Waschungen und damit sie sich auf dem Boden des Bechers zu begleichen. Wie zuvor dekantieren wie viel von jeder Waschlösung wie möglich, während Eier nass.
- Waschen Sie Eier zweimal mit CSF-XB und dekantiert.
- In CSF-XB + Eier. Mit einer Gelatine-behandelten feuerpolierten Pasteurpipette Transfer Eier Ultra-Zentrifugen-Röhrchen mit CSF-XB +, kümmert sich nicht um die E aussetzenGGS an der Luft. Platz innerhalb der 15 ml Glas Zentrifugenröhrchen mit dem Wasser Kissen.
- Spin Eier in einer klinischen Zentrifuge bei 200 xg für 1 min, erhöhen Sie die Geschwindigkeit auf 800 xg und Spin für 30 Sekunden.
- Verwenden Sie einen Sauger, um so viel wie möglich zu entfernen Puffer aus Eiern. Sie sollten fast trocken an der Spitze. Schnelles Verschieben Eier zu einer Sorvall RC-6 Zentrifuge mit einem Rotor HB-6 (oder gleichwertig) ausgestattet und Spin 17.000 × g für 15 min bei 20 ° C.
- Entfernen Sie die gelbe zytoplasmatischen zwischen dem Pigment und Lipid-Schichten unter Verwendung einer 18-Gauge-Nadel in eine 1 ml Spritze. Punktion der Seite der Röhre, und ziehen Sie die Spritze langsam auf der cytoplasmatischen Extrakt Schicht zu erhalten. Vermeiden Pigmentgranulate so viel wie möglich.
- Übertragen Zytoplasma neue Ultrazentrifugation Rohr. Es ist normal, dass der Extrakt zu erscheinen leicht bewölkt bei diesem Schritt. Platz innerhalb der 15 ml Glaszentrifugenröhrchen mit Wasser Kissen. Spin wieder 17.000 xg für 10 min bei 20 ° C. Wiederholen extraction mit 18-Gauge-Nadel.
- Übertragen Zytoplasma in ein 1,5 ml Mikrozentrifugenröhrchen. Schätzen Sie die Lautstärke und verdünnter Extrakt Cytochalasin D und LPC 1:1000 in den Extrakt. Mischen Sie gut mit einer 1 ml Pipettenspitze und Abpipettieren viele Male ohne Einführung von Luftblasen. Eine typische Ausbeute von einem gesunden Frosch Kolonie ist etwa 300-500 ul Extrakt / frog. Um eine maximale Aktivität zu erhalten, ist es notwendig, den Extrakt speichern und die experimentelle Manipulationen bei Raumtemperatur (20-25 ° C).
3. Reinigung Taxol-stabilisierten Mikrotubuli von X. tropicalis Extract
- In Taxol zu einem 100-200 ul Aliquot des Extraktes in einer Endkonzentration von 10 uM und Inkubation bei Raumtemperatur für 30 min. Zur Steuerung Reaktionen behandeln sie eine gleichwertige Menge des Extrakts mit dem Mikrotubuli-destablilzing Medikament Nocodazole (10 uM). Reserve 100 ul unbehandelten Extrakt für die Analyse.
- Verdünnen Sie das Medikament behandeltenAuszug mit 10 Volumen BRB-80 (80 mM PIPES pH 6,8, 1 mM MgCl 2, 1 mM EGTA) + 30% Glycerin. Montieren 14 ml Rundkolben Polypropylen Röhrchen mit 10 ml von BRB-80 + 60% Glycerin Kissen. Mit einem breiten Bohrung Pipettenspitze Schicht die Droge-Extrakt behandelten Reaktion sanft auf der Oberseite des BRB-80 + 60% Glycerin Kissen. Zentrifuge für 10 min bei 17.000 xg bei 20 ° C in einer Sorvall RC-6 Zentrifuge mit einem HB-6 Rotor (oder gleichwertig) und Rohr-Adapter ausgestattet.
- Saugen Sie den Überstand mit unsedimented Extrakt Material und waschen Sie die Schnittstelle zweimal mit deionisiertem H 2 O. Saugen Sie die restlichen Kissen Lautstärke langsam, kümmert sich nicht um die gelartige Pellet Mikrotubuli Mikrotubuli-assoziierten Proteinen und Mikrotubuli-assoziierten RNAs in der Taxol-behandelten Probe zu stören. Die Nocodazole behandelten Probe keine sichtbaren Material. Das Pellet in 1 ml TRIzol und fahren Sie mit den Anweisungen des Herstellers zur Isolierung von RNA. Untr.eated Extrakt (bis zu 100 ul) können direkt in 1 ml TRIzol resuspendiert werden.
- Inzwischen gibt es im Handel erhältlichen Kits zur Herstellung von Transkriptom-Bibliotheken für RNA-seq. Diese können durch erworben werden http://www.illumina.com/ und http://www.454.com/ .
Ergebnisse
Um X. identifizieren tropicalis Transkripte mit Mikrotubuli verbunden sind, bereiten wir eine cytosolische Extrakt aus unbefruchteten Eiern in der Metaphase der Meiose II (CSF) verhaftet. Behandlung dieses Extrakts mit Taxol ermöglicht die Bildung von stabilen Mikrotubuli, die durch Sedimentation durch ein Glycerin Kissen (1A) gereinigt werden kann. Coomassie-Gel-Analyse bestätigt, dass α / β-Tubulin-Sedimente in einem Taxol-abhängigen Weise und stellt die wichtigsten Protein-Spezies in diesen Zubereitungen (Abbildung 1B) gewonnen. Geringere Mengen von anderen Proteinen sind auch in der Taxol-Pellet, aber nicht in Zubereitungen mit Mikrotubuli depolymerisiert Medikament Nocodazol behandelt, was anzeigt, dass Proteine in der Fraktion Taxol speziell assoziieren mit Mikrotubuli (MAPs).
Ein Agilent Bioanalyzer wird verwendet, um allgemeine RNA-Zusammensetzung in allen X. prüfen tropicalis Extraktfraktionen (1C ). Sowohl rRNA und tRNA-Spezies sind in CSF-Extrakt und der Mikrotubuli-haltige Pellet Taxol, im Einklang mit früheren Befunden, dass Übersetzung auf Mikrotubuli und Spindeln in X. tritt laevis Ei extrahieren 5,21. Eine Linie Spur des Gels Projektion zeigt die mRNA-Signal ist deutlich niedriger in der Mikrotubuli-Pellet enthält Taxol, vor allem in der Region über die Migration 28S rRNA, was darauf hinweist, dass eine Untergruppe von mRNAs cosediment mit Mikrotubuli in X. tropicalis. RNA in dieser Weise isoliert ist geeignet für RNA-seq Experimente mit kommerziell erhältlichen Reagenzien.
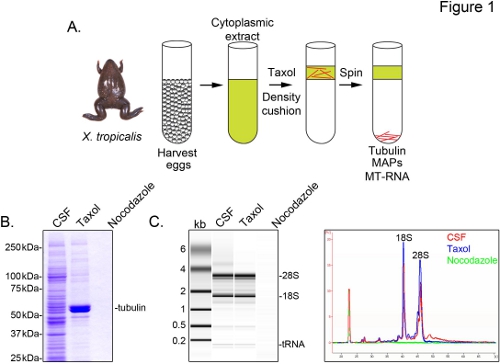
Abbildung 1. Reinigung von MT-RNA zur RNA-seq. (A) Reinigung Regelung zur MT-RNA zu isolieren. Die Eier werden von den weiblichen X. geerntet tropicalis Frösche. Nach Herstellung einer zytoplasmatischen Extraktes wird Taxol hinzugefügt Mikrotubuluspolymerisation induzieren. Mikrotubuli und MT-RNA durch Sedimentation durch ein Glycerin Kissen gereinigt. (B) Coomassie-Gel-Analyse von Proteinen isoliert unter Verwendung des Schemas in (A) beschrieben. Insgesamt CSF an Proteine in Gegenwart von Taxol oder Nocodazol sedimentiert Vergleich zu extrahieren. (C) Bioanalyzer Gel-Analyse von RNA unter Verwendung des Schemas in (A) beschrieben, isoliert. RNA isoliert von CSF Extrakt im Vergleich zu RNA sedimentiert in Anwesenheit von Taxol oder Nocodazol. Sowohl das Gel Vorsprung und die Linie Spuren angezeigt. Nachdruck mit freundlicher Genehmigung von Sharp, et al., (2011). Klicken Sie hier für eine größere Ansicht .
Diskussion
In diesem Bericht haben wir eine einfache Methode beschrieben, um CSF-Ei verhaftet Auszüge aus X. produzieren tropicalis 19 und verwenden diesen Extrakt zu studieren Mikrotubuli-assoziierten RNAs 7. Das grundlegende Verfahren zur Herstellung von CSF-Ei verhaftet Auszüge aus X. tropicalis ist die gleiche wie für X verwendet laevis mit ein paar wichtige Unterschiede. Einer der schwierigsten Aspekte der Arbeit mit X. tropicalis Frösche ist der Erhalt genug qualitativ hochwertige Eier, um einen Extrakt mit Mikrotubuli-Nukleation oder Spindelbaugruppe vergleichbare Aktivität X. machen laevis Ei extrahiert. Um optimale Bedingungen zu erreichen Eiablage und verhindert ein Verrutschen von Meiose II Zellzyklus, das Intervall zwischen Hormonspritzen für X. tropicalis ist kürzer als die für X verwendet laevis, und das Timing von dem dritten hCG-Injektion an den Anfang der Eiablage auch viel kürzer. Mit X. laevis das Timing von der hCG-Injektion zu ter Anfang der Eiablage ist so, dass es bequem und effizient für die Eier über Nacht in den Puffer gelegt werden soll. Jedoch aufgrund der kürzeren Zeit zwischen hCG-Injektion und Eiablage mit X. tropicalis ist es häufig notwendig, manuell drücken die Eier von Fröschen. Ein weiterer wesentlicher Unterschied zwischen Ei machen Extrakt aus den zwei verschiedenen Fröschen ist die dejellying Schritt. Mit X. laevis die Eier sind so groß, dass es einfach zu bestimmen, wann die Gallerthüllen wurde durch die Beobachtung, wie eng die Eier in dem Becherglas beabstandet sind gelöst. Da die Reaktion dejellying beginnt, fangen die Eier dichter packen. Allerdings X. tropicalis Eier sind viel kleiner und es kann ziemlich schwierig sein, zu bestimmen, wann das Gelee Mantel wurde von Ei Packungsdichte allein gelöst. Wir haben festgestellt, dass die zuverlässigste Methode, um zu bestimmen, wenn der Mantel Gelee aufgelöst hat, um die Orientierung des Tieres (schwarz) und pflanzliche (weiß) Pole überwachen. Wenn alle pflanzlichen Pole orient in Richtung des Bodens des Bechers das Gelee Mantel entfernt wurde genug, um mit dem Extrakt gehen. Schließlich, während X. laevis Ei-Extrakt kann bei kühlen Temperaturen gelagert werden (4-12 ° C) haben wir beobachtet, dass es entscheidend auf X. zu halten ist tropicalis Eiextrakt bei Raumtemperatur (20-25 ° C) während der Herstellung und experimentelle Manipulationen zu erhalten biochemische Aktivität. Aufgrund der Unterschiede in der Benutzerfreundlichkeit bevorzugen wir verwenden X. laevis Frösche für die Produktion von Ei-Extrakt. Doch für Experimente, oder erfordern, werden von einem Organismus mit einem sequenzierten Genom, X. erleichtert tropicalis ist eine hervorragende Alternative System.
Die Methode, die wir in diesem Bericht beschrieben wird, verwendet als Mikrotubuli-stabilisierende Mittel Taxol Mikrotubuli Polymerisation zu induzieren. Wir haben uns für diese Methode, weil Taxol ist eine robuste Mikrotubuli-stabilisierende Mittel, das die großen Trennung von gereinigtem Mikrotubuli erleichtert. Das Verfahren thbei uns bezeichnen könnte wahrscheinlich durch den Vergleich der Proteine und RNAs mit Mikrotubuli mit alternativen Methoden verbunden Mikrotubuli Polymerisation verbessert werden. Alternativen könnten Polymerisation mit GTP-induzierte Polymerisation (a klassische Technik), 22 oder mit Ran-GTP als Mikrotubuli Polymerisator die Mikrotubuli durch Chromatin-driven Spindelbaugruppe 23 induziert imitieren. Schließlich gereinigtes Spermakerne zu induzieren Mikrotubuli Polymerisation wäre in der Nähe von der Art der Mikrotubuli, die während der Mitose (Zentrosoms, Chromatin und Kinetochor vermittelte) nukleiert werden imitieren verwenden. Nachteile dieser alternativen Quellen der Mikrotubuli Keimbildung sind, dass die Nukleierungsmitteln nicht so leicht verfügbar wie Taxol und sie nicht nukleieren oder stabilisieren Mikrotubuli so effizient wie Taxol. Daher würde jede dieser Methoden schwieriger sein für eine groß angelegte Reinigungen nutzen. Der Vorteil der Vergleich mehrerer unterschiedlicher Arten von Mikrotubuli Nukleatorenist, dass es möglich sein könnte, Proteine und / oder RNAs, die spezifisch für jeden Weg der Mikrotubuli Keimbildung zu identifizieren.
Die Methode, die wir hier beschrieben haben, nutzt Zytoplasmaextrakte von Amphibien. Allerdings könnte dieser Ansatz die Verwendung von Extrakt System aus anderen Organismen verlängert werden. Mitotic Extrakte aus synchronisiert menschlichen Gewebekulturzellen 24 wurde beschrieben, dass getreu rekapitulieren viele Aspekte der Mikrotubuli. Wir haben erfolgreich diese Extrakte verwendet werden, um Mikrotubuli-assoziierten RNAs aus HeLa-Zellen 5 identifizieren. Ähnliche Mikrotubuli Reinigungsschemata haben für viele verschiedene Organismen 25,26 beschrieben worden ist, obwohl die Mikrotubuli assoziiert RNAs nicht untersucht worden sind. Der hier beschriebene Ansatz könnte mit einem Organismus, der ein konzentriertes Extrakt zytoplasmatische Lage Nukleierungsmittel Mikrotubuli produzieren kann verwendet werden.
Schließlich, auch wenn der Ansatz, dass wir deSchreiber hier diskutiert die Reinigung von Mikrotubuli und assoziierte Proteine und RNAs könnte dieser Ansatz verallgemeinert werden, um anderen subzellulären Strukturen. Während die meisten lokalisierte mRNAs nicht identifiziert wurden mit biochemischen Methoden die jüngsten Fortschritte in der DNA-und RNA-Sequenzierung Technologien machen diesen Ansatz eine attraktive Methode, um lokalisierte RNAs zu identifizieren. Bei diesem Ansatz eine subzelluläre oder Sub-Embryo Struktur von Interesse könnten getrennt oder gereinigt werden. Dann werden die assoziierten Proteinen und RNAs können auf einem genomweiten Maßstab identifiziert werden. RNAs können dann auf die RNA-Gehalt der gesamten Zelle oder Embryo angereichert lokalisierte RNAs zu identifizieren verglichen werden. Dieser Ansatz könnte mit ganzen Eiern (tierischen und pflanzlichen Trennung, ähnlich dem Ansatz, der die ersten lokalisierten RNAs in Xenopus 27 identifiziert), Aktin assoziierten RNAs, ER-assoziierten RNAs, Mitochondrien-assoziierten RNAs oder zu jeder subzelluläre Struktur, die verwendet werden können mit assoziierten RNAs intakt gereinigt werden. Basierend aufunsere Arbeit auf Mikrotubuli-assoziierten RNA prognostizieren wir, dass dies eine hervorragende Methode, um neue Proteine, die an einem bestimmten Ort zu entdecken. Darüber hinaus wird die Identifizierung des Ort und Ausmaß der alle lokalisierten RNAs Einblick in die Zellen und Embryonen mRNA Lokalisation, die Genexpression steuern.
Offenlegungen
Keine Interessenskonflikte erklärt.
Materialien
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Xenopus tropicalis | NASCO | LM00823MX | |
| human Chorionic Gonadotropin | Sigma-Aldrich | CG10 | |
| HEPES | Sigma-Aldrich | H4034 | |
| EDTA | Sigma-Aldrich | E5134 | |
| NaCl | Sigma-Aldrich | S3014 | |
| KCl | Sigma-Aldrich | P9541 | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| CaCl2 | Sigma-Aldrich | C8106 | |
| sucrose | Sigma-Aldrich | S0389 | |
| NaOH | Sigma-Aldrich | S5881 | |
| EGTA | Sigma-Aldrich | E3889 | |
| Leupeptin | Sigma-Aldrich | L9783 | |
| Pepstatin | Sigma-Aldrich | P5318 | |
| Chymostatin | Sigma-Aldrich | C7268 | |
| Cytochalasin D | Sigma-Aldrich | C8273 | |
| Gelatin, porcine skin | Sigma-Aldrich | G1890 | |
| PIPES | Sigma-Aldrich | P6757 | |
| Taxol | Sigma-Aldrich | T7191 | |
| Nocodazole | Sigma-Aldrich | M1404 | |
| Trizol | Invitrogen | 15596-026 | |
| L-Cysteine, free base | USB Corporation | 14030 | |
| Cichlid Lake Salt | Seachem | 47894 | |
| Marine salt | Seachem | SC7111 | |
| NaHCO3 | Sigma-Aldrich | S6014 | |
| EQUIPMENT | |||
| 1 ml syringes | BD Biosciences | 309659 | |
| 18 gauge needles | BD Biosciences | 305195 | |
| 30 gauge needles | BD Biosciences | 305106 | |
| Rubbermaid Plastic bucket | Amazon | 6306 | |
| Beckman Polyallomer 2 x ½ inch Ultracentrifuge tubes | Beckman | 326819 | |
| 15 ml round-bottomed glass centrifuge tubes | Fisher Scientific | 45500-15 | |
| Rubber adapter sleeves for 15 ml tubes | Kimble-Chase | 45550-15 | |
| 5 ¾ inch glass Pasteur pipettes | Fisher Scientific | 13-678-20A | |
| 14 ml polypropylene round-bottom tube | BD Biosciences | 352059 | |
| Sorvall HB-6 rotor | Thermo Scientific | 11860 | |
| Sorvall RC-6 centrifuge | Thermo Scientific | 46910 | |
Referenzen
- Martin, K. C., Ephrussi, A. mRNA localization: gene expression in the spatial dimension. Cell. 136, 719-730 (2009).
- Besse, F., Ephrussi, A. Translational control of localized mRNAs: restricting protein synthesis in space and time. Nat. Rev. Mol. Cell Biol. 9, 971-980 (2008).
- Lawrence, J. B., Singer, R. H. Intracellular localization of messenger RNAs for cytoskeletal proteins. Cell. 45, 407-415 (1986).
- Mingle, L. A., et al. Localization of all seven messenger RNAs for the actin-polymerization nucleator Arp2/3 complex in the protrusions of fibroblasts. J. Cell Sci. 118, 2425-2433 (2005).
- Blower, M. D., Feric, E., Weis, K., Heald, R. Genome-wide analysis demonstrates conserved localization of messenger RNAs to mitotic microtubules. J. Cell Biol. 179, 1365-1373 (2007).
- Eliscovich, C., Peset, I., Vernos, I., Mendez, R. Spindle-localized CPE-mediated translation controls meiotic chromosome segregation. Nat. Cell Biol. 10, 858-865 (2008).
- Sharp, J. A., Plant, J. J., Ohsumi, T. K., Borowsky, M., Blower, M. D. Functional analysis of the microtubule-interacting transcriptome. Mol. Biol Cell. 22, 4312-4323 (2011).
- Lecuyer, E., et al. Global analysis of mRNA localization reveals a prominent role in organizing cellular architecture and function. Cell. 131, 174-187 (2007).
- Mili, S., Moissoglu, K., Macara, I. G. Genome-wide screen reveals APC-associated RNAs enriched in cell protrusions. Nature. 453, 115-119 (2008).
- Holt, C. E., Bullock, S. L. Subcellular mRNA localization in animal cells and why it matters. Science. 326, 1212-1216 (2009).
- Desai, A., Murray, A., Mitchison, T. J., Walczak, C. E. The use of Xenopus egg extracts to study mitotic spindle assembly and function in vitro. Methods Cell Biol. 61, 385-412 (1999).
- Gache, V., Waridel, P., Luche, S., Shevchenko, A., Popov, A. V. Purification and mass spectrometry identification of microtubule-binding proteins from Xenopus egg extracts. Methods Mol. Med. 137, 29-43 (2007).
- Gache, V., et al. Xenopus meiotic microtubule-associated interactome. PLoS One. 5, e9248 (2010).
- Cross, M. K., Powers, M. Obtaining eggs from Xenopus laevis females. J. Vis. Exp. (18), e890 (2008).
- Cross, M. K., Powers, M. Preparation and fractionation of Xenopus laevis egg extracts. J. Vis. Exp. (18), e891 (2008).
- Cross, M., Powers, M. In vitro nuclear assembly using fractionated Xenopus egg extracts. J. Vis. Exp. (19), e908 (2008).
- Harland, R. M., Grainger, R. M. Xenopus research: metamorphosed by genetics and genomics. Trends Genet. 27, 507-515 (2011).
- Hellsten, U. The genome of the Western clawed frog Xenopus tropicalis. Science. 328, 633-636 (2010).
- Brown, K. S. Xenopus tropicalis egg extracts provide insight into scaling of the mitotic spindle. J. Cell Biol. 176, 765-770 (2007).
- Godfrey, E. W., Sanders, G. E. Effect of water hardness on oocyte quality and embryo development in the African clawed frog (Xenopus laevis). Comp. Med. 54, 170-175 (2004).
- Groisman, I., et al. CPEB, maskin, and cyclin B1 mRNA at the mitotic apparatus: implications for local translational control of cell division. Cell. 103, 435-447 (2000).
- Budde, P. P., Desai, A., Heald, R. Analysis of microtubule polymerization in vitro and during the cell cycle in Xenopus egg extracts. Methods. 38, 29-34 (2006).
- Kalab, P., Pu, R. T., Dasso, M. The ran GTPase regulates mitotic spindle assembly. Curr. Biol. 9, 481-484 (1999).
- Gaglio, T., Saredi, A., Compton, D. A. NuMA is required for the organization of microtubules into aster-like mitotic arrays. J. Cell Biol. 131, 693-708 (1995).
- Hughes, J. R., et al. A microtubule interactome: complexes with roles in cell cycle and mitosis. PLoS Biol. 6, e98 (2008).
- Suprenant, K. A., Tempero, L. B., Hammer, L. E. Association of ribosomes with in vitro assembled microtubules. Cell Motil. Cytoskeleton. 14, 401-415 (1002).
- Rebagliati, M. R., Weeks, D. L., Harvey, R. P., Melton, D. A. Identification and cloning of localized maternal RNAs from Xenopus eggs. Cell. 42, 769-777 (1985).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten