Method Article
Vorbereitung, Imaging und Quantifizierung der Bakterienoberfläche Motilität Tests
In diesem Artikel
Zusammenfassung
Swarming motility is influenced by physical and environmental factors. We describe a two-phase protocol and guidelines to circumvent the challenges commonly associated with swarm assay preparation and data collection. A macroscopic imaging technique is employed to obtain detailed information on swarm behavior that is not provided by current analysis techniques.
Zusammenfassung
Bakterielle Oberflächenbeweglichkeit, wie das Schwärmen, wird üblicherweise im Labor mit Plattentests, die spezifische Konzentrationen von Agar und manchmal Aufnahme spezifischer Nährstoffe in dem Nährmedium notwendig sucht. Die Herstellung von solchen expliziten Medien und Wachstumsbedingungen Fläche dient, die günstige Bedingungen, die nicht nur das Wachstum von Bakterien, aber koordinierte Motilität der Bakterien gegenüber diesen Oberflächen innerhalb dünnen Flüssigkeitsfilmen ermöglichen. Die Reproduzierbarkeit der Schwarm Platte und andere Oberflächenbeweglichkeit Plattentests kann eine große Herausforderung sein. Speziell für mehr "gemäßigten Schwärmer", die Beweglichkeit nur innerhalb Agar Bereiche von 0,4% -0,8% (G / V), kleine Änderungen in Protokoll oder Laborumgebung können Schwarm Untersuchungsergebnisse stark beeinflussen aufweisen. "Wettability", oder des Wassergehalts in der Flüssigkeits-Feststoff-Luft-Grenzfläche dieser Plattentests, ist oft eine wichtige Variable kontrolliert werden. Eine weitere Herausforderung bei der Beurteilung Schwärmen ist, wie man o quantifizierenbserved Unterschiede zwischen zwei (oder mehr) Experimenten. Hier werden wir ausführlich ein vielseitiges Zweiphasen-Protokoll zu erstellen und Bild Schwarm Assays. Wir sind Leitlinien für die Herausforderungen häufig mit Schwarm Assay Medienvorbereitung und Quantifizierung von Daten aus diesen Tests verbundenen umgehen. Wir haben uns speziell zeigen unsere Methode mit Bakterien, die fluoreszierende oder Biolumineszenz genetische Reporter wie das grün fluoreszierende Protein (GFP), Luciferase (lux-Operon) zum Ausdruck bringen oder Mobil Flecken auf Zeitraffer-optische Bildgebung ermöglichen. Wir zeigen weiter die Fähigkeit unseres Verfahrens zu verfolgen konkurrierenden Schwärmen Spezies in dem gleichen Experiment.
Einleitung
Viele Bakterien bewegen auf Oberflächen mit verschiedenen Mitteln der Selbstantrieb. Einige Motilität Phänotypen kann im Labor mit Plattentests, die von der flüssigen Umgebung mit dem halbfesten Platten-Assay Zusammensetzung assoziiert betroffen sind recherchierbar. Eine Untergruppe der Nutzfläche Motilität Plattentests weiter beinhalten eine Gasphase-typischerweise Raumluft. Dementsprechend wird der Ausgang eines bestimmten Oberflächen Motilität Assay erfordert eine sorgfältige Steuerung der Schnittstelle aus drei Phasen: die örtlichen Umwelt festen Oberfläche, flüssigen Umgebung und Gasumgebung Eigenschaften.
Die am häufigsten untersuchten Motilität Modus derart dreiphasigen Assay wird wie Schwärmen bekannt. Schwärmen Beweglichkeit ist die koordinierte Gruppe Bewegung von Bakterienzellen, die durch ihre Geißeln durch dünne Flüssigkeitsfilme auf Oberflächen 1 angetrieben werden. Es wird üblicherweise in Laboratorien mit halbfesten Plattentests, die 0,4% -0,8% (w / v) Agar 1 studiert. Eine Anordnung vonHumanpathogene nutzen diese Motilität Verhalten zu erforschen und zu besiedeln den menschlichen Wirt. Zum Beispiel nutzt Proteus mirabilis wimmelt Motilität zu bewegen auf der Harnröhre und erreichte und Kolonisierung der Blase und Nieren 2. Schwärmendes Motilität wird allgemein als Vorläuferschritt zu Biofilmbildung, die primäre Ursache der Pathogenese bei vielen menschlichen Pathogenen 3.
Das Schwärmen Phänotyp ist sehr unterschiedlich zwischen den Bakterienarten; experimentelle Erfolg und Reproduzierbarkeit stark verlassen sich auf Faktoren wie Nährstoffzusammensetzung, Agar Art und Zusammensetzung, Sterilisation Protokoll (zB Autoklavieren), halbfeste Medien Aushärtung und Umgebungsfeuchtigkeit (zB Wechsel der Jahreszeiten), unter anderem 3-5. Die Variabilität der Motilität Antworten Oberfläche betont die Herausforderungen in diesen Studien und den maßgeblichen Einfluss Medien und Umwelt ausüben kann auftreten. Für einige schwärmen Arten, wie Pseudomonas, wimmelt motility kann auf einer Vielzahl von Medien-Zusammensetzungen auftreten, obwohl der beobachtete Phänotyp und Begleit Schwarm Ausdehnungsrate wird erheblich 3 variieren. In Kombination können diese Faktoren machen Oberfläche Motilität Studien extrem schwierig. Saisonale Schwankungen in einem Labor können diese Dreiphasen-Assays beeinflussen: Tests können besser in der feuchten Luft des Sommers und noch schlimmer in der trockenen Luft des Winters funktionieren. Hier präsentieren wir die allgemeinen Leitlinien zu einigen der wichtigsten Herausforderungen bei der Durchführung von Oberflächenbeweglichkeit Platte Studien zu umgehen.
Für einige Oberflächen Motilität Studien, ist von großem Interesse die Entwicklung von spezifischen Phänotypen. Die meisten, aber nicht alle veröffentlichten Studien zu Schwärmen von P. prüfen aeruginosa zeigen die Bildung von Ranken oder Fraktale strahlenförmig von einer Impfung Center 9.3. Die Unterschiede zwischen P. aeruginosa-Stämme wurden dokumentiert 5,8, aber viel von der Gegenwart oder Abwesenheit von Ranken können zur spezifi zurückzuführenc Medium und das Protokoll für diesen Schwarm Motilität Platte Assays verwendet. Hier sind Informationen, wie man Ranke bildenden Schwärmen für P. fördern aeruginosa. Da P. aeruginosa ist nur eine von vielen schwärmenden Bakterien, auch wir Informationen für unsere Verfahren zu Schwärmen von Bacillus subtilis und Gleiten von Myxococcus xanthus zu untersuchen. Wie P. aeruginosa, der aktuellen Forschung auf B. subtilis und M. xanthus umfasst eine Reihe von Themen, wie Forscher arbeiten, um Aspekte der Sporenbildung, Motilität, Stressantwort und Übergangsverhalten 1,10 zu erkennen. Es besteht ein Bedarf, die Muster und die Dynamik des spezifischen Verhaltens (s) für diese Zellen in Schwärmen Gruppen zu quantifizieren.
Oberflächenbeweglichkeit Datenerfassung, können Analyse und Interpretation umständlich und qualitativ sein. Wir haben ein Verfahren für die detaillierte makroskopische Analyse der bakteriellen Schwärmen, die zusätzlich zur Verfügung stellt Zone Morphologie und s Schwarm entwickeltenize (zB Durchmesser), quantitative dynamische Informationen zum Schwarm Expansionsrate und bakterielle oder Bioprodukt Dichteverteilung 7. Darüber hinaus kann dieses Verfahren die Vorteile der verfügbaren fluoreszierenden Proteinen, Lumineszenz, und Farbstoffe, um einen umfassenden Überblick der bakteriellen Interaktionen 8 zu erhalten, sowie um die Synthese von Bioprodukten (zB Rhamnolipid P. aeruginosa 7,8) innerhalb eines Schwarms zu verfolgen.
Protokoll
1. Swarm Assay Medien Vorbereitung und Inokulation 4,5,7,8,11
- Medienvorbereitung
HINWEIS: Die nachfolgend beschriebene Zusammensetzung des Mediums ist auf P. aeruginosa Rankenbildung Studien. Bitte lesen Sie den Medienanforderungen in Tabelle 1 für P. aeruginosa, B. subtilis und M. xanthus Oberfläche Motilität Tests.- Mischungs 200 ml FAB-minus (NH 4) 2 SO 4 Schwarm Medium (Werkstoff-Tabelle), 0,9 g Noble-Agar und 0,2 g Casaminosäuren (Tabelle 1) unter Rühren mit einem magnetischen Rührstab. Verwenden Sie kleine Mengen (100-300 ml), um die Kohärenz zwischen den Experimenten zu verbessern.
- Autoklavieren die 200 ml Agar / Mediengemisch mit einer Belichtungszeit von 22 min, Einsatztemperatur von 121,1 ° C, und einem schnellen Vent-Stellung. Die Autoklaven Einstellungen richtige Sterilisation und Agar Schmelzen zu ermöglichen, aber zu verhindern Agar Karamelisierung.
HINWEIS: Edel-Agar ist anfällig für Karamellsierung; bakterielle Motilität auf karamellisierten Agar verändert. - Unmittelbar nach der Sterilisationszyklus abgeschlossen ist, schließen Sie den Deckel des Medienflasche um den Wasserverlust durch Verdunstung zu verhindern. Beachten Sie jedoch, dass die enge Begrenzung kann eine "Vakuumversiegelung" -ähnliche Wirkung auf die Flasche führen.
- Man kühlt das Medium auf 50 ° C unter Rühren bei Raumtemperatur (RT) und mit 2 ml sterilem 1,2 M Glucose. Sie können auch den Medien in einem 60 ° C Inkubator oder Wasserbad bis zur Verwendung (bis zu 15 Stunden später), und gehen Sie wie angegeben. Um die Bildung von Blasen in den Medien zu verhindern, gründlich gemischt unter Verwendung der magnetischen Rührstab; Blasen auf der Oberfläche des Agars werden zu verhindern, selbst Schwärmen.
HINWEIS: Bei anderen Assays, fügen in diesem Schritt wärmeempfindliche Komponenten, die nicht wie beispielsweise zusätzliche Nährstoffe oder Farbstoffe autoklaviert werden kann, je nach Bedarf (beispielsweise Zugabe von 8 & mgr; Invitrogen Syto 63 Farbstoff pro 100 ml geschmolzene Agar Bild M. xanthus wie gezeigt in Vertreve Ergebnisse, unten). Zusatz einiger Farbstoffe können Basisschwarmverhalten, das gegenüber einer nicht-Farbstoff Steuerung überprüft werden sollte beeinflussen. - In einem Laborabzug, aliquoten 7,5 ml sterilem Medium pro 60 mm Durchmesser Petrischale aus Polystyrol und zu warten, die Platten in einer einzigen Schicht (nicht gestapelt). Bei größeren Schwärmen Oberfläche, aliquote 25 ml Medium pro 100 mm Petrischale. Es ist wichtig, um das Geschirr auf einer ebenen horizontalen Fläche zu füllen. Verwenden Sie Augenhöhe eines Stiers zu überprüfen, ob die Oberfläche eingeebnet.
HINWEIS: Für P. aeruginosa-Assays, mit einem spezifischen Mediavolumen pro Platte wird die Konsistenz und Reproduzierbarkeit zu verbessern. Für B. subtilis und M. xanthus Assays Hand Gießen führt zu Ergebnissen vergleichbar spezifisches Volumen Aliquots.
- Platte Aushärtung
- Für kleine Platten (60 mm), damit das geschmolzene Agar-Medium zu heilen (beide bis halbfeste und trockene überschüssige Flüssigkeit gesetzt) in der Haube aufgedeckt (dh ohne Deckel) für 30 Minuten. GrößerePlatten (100 mm) erfordern eine längere Aushärtezeit (siehe Diskussion).
HINWEIS: Alternativ können einige Tests erfordern Platten auf der Tischplatte über Nacht (20-24 h) abgedeckt (dh Deckel auf) in einer einzigen Schicht (Tabelle 1) zu heilen. Das Schwärmen ist empfindlich gegenüber sowohl überschüssige und unzureichende Feuchtigkeit. Die Feuchtigkeit, Luftströmung und Temperatur eines jeden Labors kann Schwankungen erfordern zur Platte, um eine optimale Heilung Schwärmen Sie Bakterium zu fördern. - Impfen Platten unmittelbar nach der Trocknungszeit ist vorbei. Die Platten für die weitere Verwendung aufbewahren.
- Führen Sie die "Tintenausbreitungstest" durch Spotting eine Testplatte mit 10 ul Gemisch von 0,50% (v / v) Higgins Wasserdicht Schwarz Tusche und Bakterieninokulum 11. Wenn die Tinte / Inokulum Gemisch ausbreitet leicht (dh nicht Tröpfchenform zu halten) auf der Oberfläche des Mediums, werden die Medien zusätzliche Zeit zum Trocknen brauchen.
HINWEIS: Für die Arten, die besonders empfindlich gegenüber Feuchtigkeit sind ( zB P. aeruginosa), werden Sie schnell ein "Tintenausbreitungstest" 11 zu bestimmen, ob die Platten trocken genug.
- Führen Sie die "Tintenausbreitungstest" durch Spotting eine Testplatte mit 10 ul Gemisch von 0,50% (v / v) Higgins Wasserdicht Schwarz Tusche und Bakterieninokulum 11. Wenn die Tinte / Inokulum Gemisch ausbreitet leicht (dh nicht Tröpfchenform zu halten) auf der Oberfläche des Mediums, werden die Medien zusätzliche Zeit zum Trocknen brauchen.
- Für kleine Platten (60 mm), damit das geschmolzene Agar-Medium zu heilen (beide bis halbfeste und trockene überschüssige Flüssigkeit gesetzt) in der Haube aufgedeckt (dh ohne Deckel) für 30 Minuten. GrößerePlatten (100 mm) erfordern eine längere Aushärtezeit (siehe Diskussion).
- Swarm Assay Impfung
- Impfen Sie 6 ml Brühe Kulturmedien (siehe Tabelle 1 für Details) mit einer Einzelkolonie von einer frischen (<5 Tage alt, wenn bei Raumtemperatur belassen) LB-Medium (LB) Plattenkultur. Bouillonkulturen über Nacht (≤18 h) Inkubieren bei 30 ° C oder 37 ° C mit horizontalen Schütteln (240 rpm).
- Impfen Schwarm Platten durch Spotting mit 1-5 ul der Übernbouillonkultur oder durch "Stossen" der Agar mit einer sterilen Zahnstocher oder Draht Impfnadel.
HINWEIS: Wir bevorzugen die letztere Methode, weil es verringert die Wahrscheinlichkeit des Spritzens des Inokulums und verhindert, dass das Hinzufügen zusätzlicher Feuchtigkeit auf der Schwarm Fläche.
- Swarm Assay Incubation
- Für allgemeine Assay inkubiert Schwarm Testplatten bei 30 °C oder 37 ° C (oder 42 ° C für B. subtilis; Tabelle 1) -Dies ist Bakterium spezifisch. Kehren Sie die Platten während der Inkubation, so dass überschüssige Feuchtigkeit kondensiert am Deckel, nicht der Agar.
HINWEIS: Die Temperatur kann Phänotyp als auch die Kinetik beeinflussen. Für P. aeruginosa Schwärmen, Inkubation bei 37 ° C führt zu einem schnelleren Wachstum und Schwarmausdehnung als eine Inkubation bei 30 ° C; aber die Morphologie dieser Schwärme unterscheidet sich oft mit dieser Temperaturänderung. - Für Zeitraffer-Bildgebung, Inkubation Schwarm Platten bei der entsprechenden Temperatur, bevor sie in der Bilderzeugungsstation (siehe Tabelle 1 für weitere Details) übertragen.
ANMERKUNG: Diese Vorabbildungs Inkubation ermöglicht Schwärme, um ihre Entwicklung zu beginnen und bevor sie an eine neue Umgebung, die möglicherweise nicht optimal für Schwärmen Motilität können bewegt etabliert.
- Für allgemeine Assay inkubiert Schwarm Testplatten bei 30 °C oder 37 ° C (oder 42 ° C für B. subtilis; Tabelle 1) -Dies ist Bakterium spezifisch. Kehren Sie die Platten während der Inkubation, so dass überschüssige Feuchtigkeit kondensiert am Deckel, nicht der Agar.
2. makroskopischen Abbildung von Oberflächen Motilität Tests 7,8
- Für Zeitraffer-Bildgebung nach den Vorabbildungs Inkubationszeit Ort Schwarm Testplatten auf einer klaren Bildplatte in einem kommerziellen In-vivo-Imaging-Station. Bild bis zu sechs, Durchmesser 60 oder vier mm, Durchmesser 100 mm Platten auf einmal. Da die Kamera Bilder von unterhalb der Bildebene, kehren die Platten, so daß der optische Weg nicht behindert 8. Alternativ Inkubieren bei 30 ° C oder 37 ° C (Tabelle 1) für die Dauer des Experiments, und entfernen sich die Platten aus dem Inkubator zu festgesetzten Zeitintervallen abgebildet werden.
- Legen Sie die Deckel der Petrischalen aufrecht auf der Oberseite der Platte, die das Gegenstück impften Medien hält. Füllen Sie die Deckel der Petrischalen mit Wasser zu übermäßiger Austrocknung während der Bilderzeugung zu verhindern, und die gesamte Einrichtung mit einem anderen klaren Tray Feuchtigkeit während des Experiments zu erhalten.
- Mit Molecular Imaging (MI) Software 12, führen Assay (n) bei Raumtemperatur mit Hilfe der imAltern in der Tabelle 2 beschriebenen Einstellungen. Für Zeitraffer-Bildgebung, die Einrichtung eines Protokolls mit den notwendigen Schritten und Spezifikationen.
3. Datenverarbeitung und Interpretation 7,8
- Bildverarbeitung
- Verwenden MI Software Batch-Export Bilder als 16-Bit-TIFF-Dateien: Datei> Exportieren oder Export Multiple> Datei (en) auswählen, um den Export und Exportstandort.
- Verwenden ImageJ, um ein einzelnes Bild zu öffnen oder importieren Sie eine Zeitraffer-Serie:
- Öffnen Sie ein einzelnes Bild: Datei> Öffnen
- Import Zeitraffer-Bildfolge: Datei> Importieren Sequenz, und wählen Sie "Namen numerisch sortieren".
- Für größere Zeitraffer-Dateien, wählen Sie "virtuellen Stack" im Fenster "Import Sequence", um die exportierten Bilder in entsprechenden Kategorien (dh GFP, RFP, etc.) zu stapeln.
- Falls erforderlich, Bilder von 16-Bit-Dateien in 8-Bit-Dateien ändern: Bild> Typ> 8-Bit-
HINWEIS: Einige ImageJ Werkzeuge erfordern 8-Bit-Bilder. - Ermitteln, ob der Intensitätssignals für ein Bild oder einer Zeitablaufsequenz muss invertiert werden. Setzen Sie den Cursor auf einem hellen Fleck auf dem Bild (zB fluoreszenzmarkierten Wachstum) und beachten Sie die Signalintensität "Wert" aus dem ImageJ Symbolleiste. Dann setzen Sie den Cursor in einem dunklen Ort außerhalb der Plattenfläche und beachten Sie die Signalstärke. Wenn die Signalintensität für den dunklen Fleck größer als die Intensität des hellen Flecks, muss die Bildsignalstärke zu invertieren (Folgeschritte 1-2 unten).
- Kehren Sie die Intensitätssignale: Bearbeiten> Umkehren
- Kehren Sie die Lookup-Tabelle: Bild> Suchtabellen> Umkehren LUT
- Ziehen Sie den Hintergrund: Prozess> Ziehen Sie den Hintergrund, und verwenden Sie ein "Rollkugelradius" mit einem Pixel-Radius, der die Hälfte einer Bilddimension (ist zB 1000 Pixel für eine 2000 x 2000 pIxel Bild).
- Künstlich Farbe ein Bild oder Zeitraffer-Reihenfolge: Bild> Suchtabellen, und wählen Sie die gewünschte Farbe aus der Liste Optionen.
- Bei Filmen mit zwei oder mehr Kanäle, zusammenführen und vor dem Speichern als Film (Bildverarbeitung, Schritt 8) das Gleichgewicht der Farben. Um Bilder miteinander verschmelzen, öffnen alle Bildstapel in ImageJ, und wählen Sie Bild> Farbe> Kanäle zusammenfügen, und weisen Sie jedem Stapel zu einem Farbkanal.
- Sparen Sie Zeitraffersequenz als AVI oder Quicktime-Film: Datei> Speichern unter, und wählen Sie gewünschte Format und Spezifikationen.
- Datenanalyse
- Der Erwerb Bakterielle Oberflächenwachstumsfeld zu quantifizieren Expansion Rate
- Offene Bild (er) in ImageJ
- Für die Berechnung der Durchmesser der Platte in Pixel, ziehen Sie eine Linie über die Mitte einer Testplatte mit dem "Straight" Werkzeug aus der und messen die Länge: Analysieren> Messen
- Die Standard-Maßeinheit in ImageJ ist die pixel. Besorgen eines Umwandlungsfaktors durch Dividieren des Durchmessers der Testplatte (zB 60 für eine 60 mm-Platte), die durch die Pixellänge in dem vorhergehenden Schritt erhalten.
- Ändern Sie die Maßeinheit von Pixel zu mm: Bild> Eigenschaften
- Ändern Sie den "Längeneinheit" auf "mm", und die "Pixel Breite", "Pixel Height" und "Depth Voxel" auf den Umrechnungsfaktor im vorherigen Schritt berechnet. Wählen Sie das "Global" Kästchen, um diese Umrechnungsfaktor über mehrere Bilder zu erhalten.
HINWEIS: Wenn ImageJ geschlossen und wieder geöffnet, oder das Sichtfeld eines Bildes geändert wird (das heißt, ein Bild wird in mehr als eine andere herausgezoomt), ist der Umwandlungsfaktor neu berechnet werden. Alternativ führen Sie alle Analysen in Pixel und dann in mm.
- Ändern Sie den "Längeneinheit" auf "mm", und die "Pixel Breite", "Pixel Height" und "Depth Voxel" auf den Umrechnungsfaktor im vorherigen Schritt berechnet. Wählen Sie das "Global" Kästchen, um diese Umrechnungsfaktor über mehrere Bilder zu erhalten.
- Für jeden Rahmen zu verfolgen und messen Sie die Schwarm-Bereich mittels "Freihand-Auswahl" in der Werkzeugleiste, um den ou verfolgentline des Schwarms und messen Sie den Bereich mit: Analysieren> Messen. Dies erzeugt eine Messung protokolliert, die können zur weiteren Analyse in Microsoft Excel oder ähnlichen Programmen gespeichert werden: Datei> Speichern unter
- Der Erwerb Bakterielle Oberflächenwachstumsintensität zu quantifizieren Oberflächen Growth Rate
- Sobald der Hintergrund subtrahiert (Bildverarbeitung, Schritt 5), verwenden Sie das letzte Bild der Sequenz, die maximale Fläche von Schwarm (Datenanalyse, Schritt 1) zu bestimmen.
- Verwenden Sie das "Oval" Auswahl-Werkzeug in der Werkzeugleiste, um einen Rahmen um das bakterielle Oberflächenwachstum zu ziehen.
- Stellen Sie den mittleren Intensitätsmessung der Pixel in der Box mit: Analysieren> Set Messungen, und wählen Sie "Mittlerer Grauwert".
- Um Intensität Signalmessungen für jedes Bild in der Zeitraffer-Sequenz zu erhalten, während auf dem ersten Bild der Sequenz gehen Sie zu: Analysieren> Messen. Dies erzeugt eine Messung protokolliert, die können zur weiteren Analyse in Mi gespeichert werdencrosoft Excel oder ähnlichen Programmen: Datei> Speichern unter
- Alternative zum vorhergehenden Abschnitt (Datenanalyse, Schritt 2). Verwenden Sie die Makros ImageJ Plugin zu installieren und führen Sie einen Makro Oberflächenwachstum Intensitätsmessung Skript.
- Einrichtung eines automatisierten Mess Skript, um mehrere Bilder gleichzeitig zu analysieren: Plugin> Neu> Makro, und fügen Sie den bereitgestellten Skript (unten) in das Feld und speichern Sie als ImageJ Makro Textdatei: Datei> Speichern unter, und speichern Sie mit dem ImageJ Anwendungsordner unter " Makros ".
numberOfFrames = N
for (i = 0; i laufen ('Measure');
laufen ('Next Scheibe [>]');
}
Anmerkung: Hier wird die Variable "N" ist für eine unbestimmte Anzahl von Rahmen. - Bearbeiten Sie die "numberOfFrames" in der Macros-Plugin für jedes Experiment, um die Anzahl der Bilder in der Bildsequenz vor der Ausführung des Skripts zu reflektieren. Verwendung: Plugin> Makros>Bearbeiten, und geben Sie die richtige Anzahl von Rahmen in der Sequenz und speichern (Datei> Speichern).
- Folgen Sie Schritte 1-3 in Datenanalyse-Schritt 2, und während auf dem ersten Bild der Sequenz führen Sie das Makro-Plugin: Plugin> Makros> Ausführen. Dies erzeugt eine Messung protokolliert, die können zur weiteren Analyse in Microsoft Excel oder ähnlichen Programmen gespeichert werden: Datei> Speichern unter
- Einrichtung eines automatisierten Mess Skript, um mehrere Bilder gleichzeitig zu analysieren: Plugin> Neu> Makro, und fügen Sie den bereitgestellten Skript (unten) in das Feld und speichern Sie als ImageJ Makro Textdatei: Datei> Speichern unter, und speichern Sie mit dem ImageJ Anwendungsordner unter " Makros ".
- Der Erwerb Bakterielle Oberflächenwachstumsfeld zu quantifizieren Expansion Rate
Ergebnisse
Variation der Plattenherstellung kann einen großen Einfluss auf die Motilität Schwärmen. Die Härtung bzw. Trocknung nach dem Gießen von geschmolzenem Agar-Medium wirkt sich auf die Oberflächenbeweglichkeit Assays und der bakteriellen Motilität im Laufe der Zeit die dünne Flüssigkeit Film. Veränderungen in der Nährstoffzusammensetzung beeinflussen auch Schwärmen mehrere Bakterien. 1A zeigt eine kurzfristige Wirkung Trocknungszeit beim Verteilen von Tusche und Ausbreitung eines anfänglichen Inokulum von Bacillus subtilis 11. 1B zeigt die Wirkung der Trocknungsdauer und 1C zeigt die Wirkungen von Ammoniumsulfat [(NH 4) 2 SO 4] bei der nachfolgenden Entwicklung mit Ranken Schwärmen P. aeruginosa 5.
Zeigt quantifizierbare Daten von Endpunkt-Bilder der Oberfläche Motilität unter Verwendung mehrerer Imaging-Strategien erreicht werden. Abbildung 2 repräsentative Oberflächenwachstum Ergebnisse für P. aeruginosa wimmelt und der zugehörigen Bild GFP-Fluoreszenz, B. subtilis Schwärmen und die zugehörige Bild Biolumineszenz; und xanthus Oberflächenwachstum und die damit verbundene roten Fluoreszenzbild SYTO 64-gefärbten Zellen.
Expansion der Datenerfassung über die reine Untersuchung und Bilddarstellung von Endpunktergebnisse können zur Untersuchung des dynamischen Verhaltens (n) für die Oberflächen wachsenden Bakterien, Fig. 3 7 zeigt ein Beispiel von P. aeruginosa Schwärmen (abgebildet auf GFP-exprimierenden Zellen) und die damit verbundenen Rhamnolipid Produktion (aufgenommen mit Nile Red Lipid-Färbung) -die Quantifizierung von Daten aus diesen Bildern wird ebenfalls angezeigt, um die Expansionsrate des P. zeigen aeruginosa Schwärmen. Video 1 zeigt eine Zeitraffer von B. subtilis Schwärmen aufgenommen mit Lumineszenz einer lux exprimierenden Stammes. Video 2 8 zeigt eine Zeitraffer-P. aeruginosa (grün-GFP) und Salmonella enterica Serovar Typhimurium (rot-exprimierenden Lux) in einem kompetitiven Assay-Schwarm.
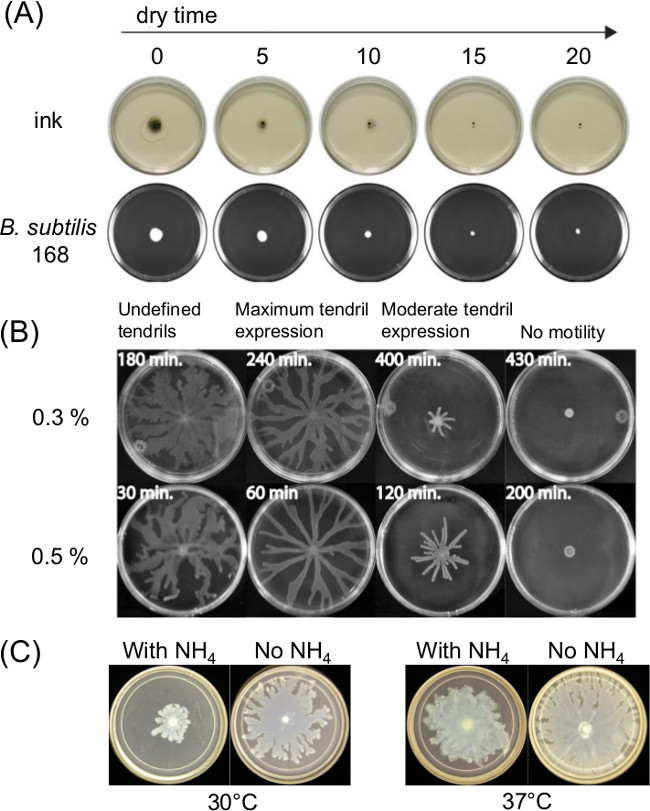
Abbildung 1: Beispiele für die Faktoren in der Oberflächenbeweglichkeit Assay Zubereitung, Assay Ergebnisse Wirkung von (A) Agar Trocknungszeit auf Agar Oberflächenfeuchte beeinflussen und Ausbreitung von Inokulum für B.. subtilis (Ref 8), (B) Agar Trocknungszeit auf P. aeruginosa Schwärmen, und (C) Anwesenheit oder Abwesenheit von Ammoniumsulfat auf P. (aus Lit. 5 Nachdruck mit freundlicher Genehmigung) aeruginosa Schwärmen und Rankenbildung.
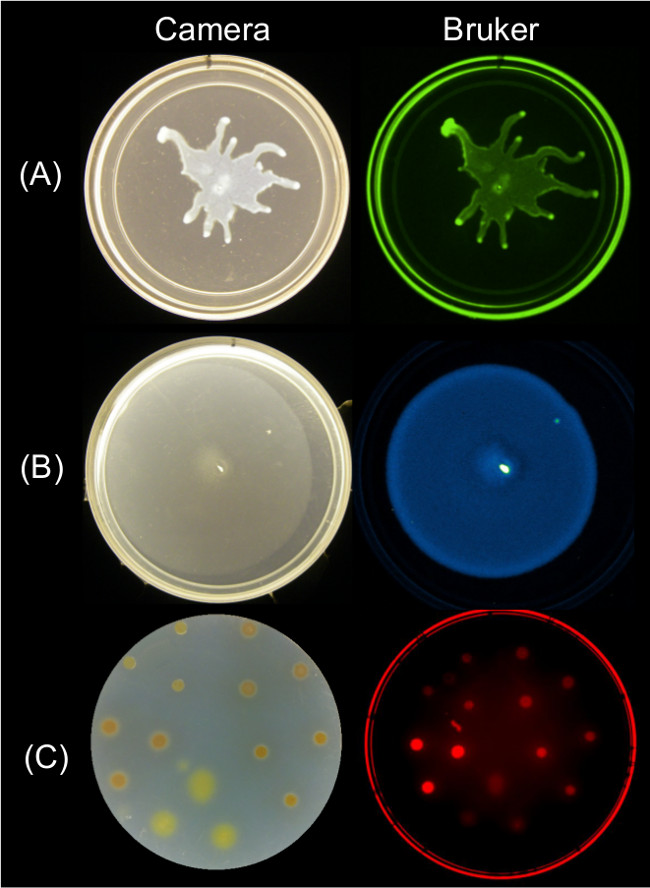
Abbildung 2: Alternative Ansätze zur Abbildungsoberfläche Wachstum und Motilität der Bakterien unter Verwendung eines Bruker Abbildungsstation. seitigen Seiten Bild einer Kamera (links) und Bruker Bildes (rechts) zeigt, (A) P. aeruginosa, die GFP-bebilderten Verwendung der grünen Fluoreszenz Einstellungen, (B) B. subtilis lux Ausdruck Biolumineszenz Reporter bebilderten mit Lumineszenz-Einstellungen, und (C) M. xanthus mit SYTO gebeizt 64 aufgenommen mit roter Fluoreszenz II-Einstellungen. Siehe Tabelle 2 für die Einstellung Details.
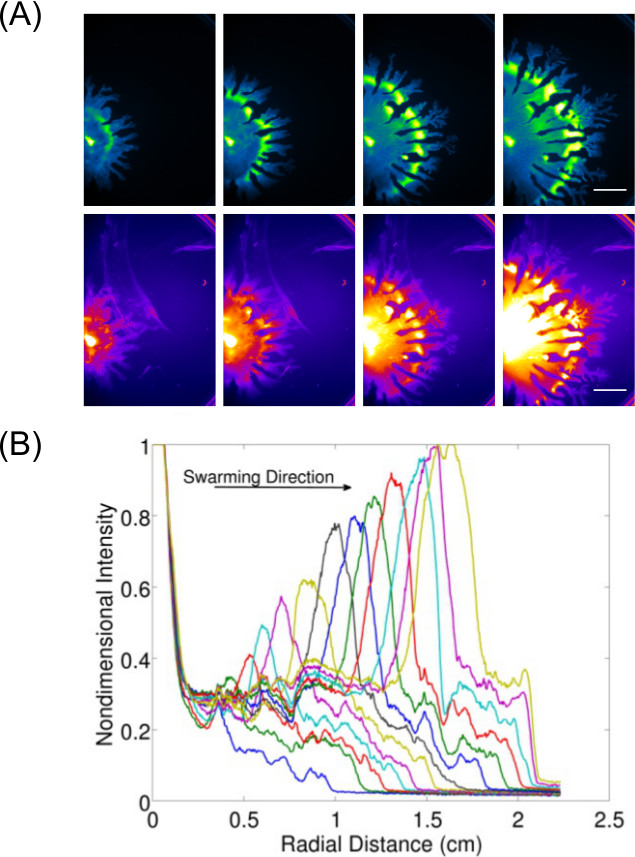
Abb. 3: Qualitative und quantitative Analyse einer Oberfläche Motilität Assay (A) Zeitraffer-Analyse von Zelldichteverteilung, mit Hilfe des Red-Fluoreszenz abgebildet Rhamnolipid Produktion (Nilrot LipidfleckIch Einstellungen; Balken = 15 mm), und (B) Quantifizierung der Expansionsrate von Zelldichteverteilung Bilder eines P. aeruginosa Schwarm. (Nachdruck aus Lit. 6 mit Genehmigung.)
Video 1. Zeitraffer-Bildgebung eines B. subtilis Schwarm. B. subtilis Ausdruck Lux und aufgezeichnet mit den Lumineszenz-Einstellungen. Siehe Tabelle 2 für die Einstellung Details.
Video 2. Interspezies Wettbewerb Zeitraffer-Bildgebung sichtbar gemacht. Schwärme von P. aeruginosa (grün; GFP-exprimierenden und aufgezeichnet mit den Grün-Fluoreszenz-Einstellungen) und S. Ella enterica Serovar Typhimurium (rot; expressingen Lux und aufgezeichnet mit den Lumineszenz-Einstellungen). Siehe Tabelle 2 für die Einstellung Details. (Nachdruck mit Genehmigung aus Lit. 7).
| P. aeruginosa | P. aeruginosa Rankenbildung Studien | B. subtilis | M. xanthus | |
| Übernachtung Brühe Kulturmedien | FAB plus 30 mM Glucose | FAB plus 30 mM Glucose | PFUND | CTT |
| Übernachtung Bouillonkultur Inkubationstemperatur | 37 ° C | 37 ° C | 37 ° C | 30 h bei 30 ° C |
| Swarm Medien | FAB | FAB minus (NH 4) 2 SO 4 | 2% (wt / vol) LB | CTT |
| Swarm Medien: Zusatzkomponenten | 12 mM Glucose ein | 10% (wt / vol) CAA, 12 mM Glucose a | n / a | SYTO® 64 a |
| Agar-Typ | Agar, Edle | Agar, Edle | Granulierte Agar | Agar, Edle Affymetrix |
| Agar-Konzentration (G / V) | 0,45% | 0,45% | 0,60% | 1,50% |
| Swarm Plattengröße | 60 mm | 60 mm | 100 mm | 150 mm |
| Medienlautstärke pro Platte | 7,5 ml | 7,5 ml | Hand gegossen | Hand gegossen |
| Swarm Medieneinstellung / Trocknungsverfahren | Hood; Platten aufgedeckt | Hood; Platten aufgedeckt | Benchtop; Platten abgedeckt | Benchtop; Platten abgedeckt |
| Swarm Medieneinstellung / Trockenzeit | 30 Minuten | 30 Minuten | Übernachtung (20 -24 h) | Übernachtung (20 -24 h) |
| Swarm Assay Inkubationstemperatur | 30 oder 37 ° C | 30 ° C | 37 ° C | 30 ° C |
| Inkubation für Zeitraffer-Bildgebung | 30 ° C für mindestens 4 Stunden | 30 ° C für mindestens 4 Stunden | 37 ° C 2 h | RT für 12 h |
| Zeitraffer-Aufzeichnungslänge | 24-Stunden- | 24-Stunden- | 10 Stunden | 66 Stunden |
| Zeitraffer-Einstellung | 1 Bild / 10 min | 1 Bild / 10 min | 1 Bild / 6 min | 1 Bild / 10 min |
| a Hinzugefügt nach dem Autoklavieren. | ||||
Tabelle 1:. Technische Daten für Oberflächen Motilität Assay Vorbereitung Inklusive OberflächenMotilität Assay Vorbereitung Spezifikationen für P. aeruginosa, B. subtilis und M. xanthus.
| Signal | Grüne Fluoreszenz | Rote Fluoreszenz I | Rote Fluoreszenz II | Lumineszenz |
| Protein oder Farbstoff | Grüne Fluoreszenz Protein (GFP) | mCherry Protein oder Nilrot Rhamnolipid Fleck | SYTO® 64 | Luciferase von lux-Operon |
| Anregungswellenlänge (nm) | 480 ± 10 | 540 ± 10 | 590 ± 10 | Ab |
| Emissionswellenlänge (nm) | 535 ± 17,5 | 600 ± 17,5 | 670 ± 17,5 | Kein Filter |
| Belichtungszeit (sec) | 30 | 60 | 60 | 240 |
| f- Stopp | 4.0 | 4.0 | 2.5 | 1.1 |
| FOV (mm) | 190 | 190 | 140 | 120 |
| Brennebene (mm) | 27,5 | 27,5 | 12.2 | 4 |
| Binning (Pixel) | Die Sonne Geht Auf | 2 x 2 | Die Sonne Geht Auf | 8 x 8 |
Tabelle 2: Imaging Spezifikation Bruker Abbildungsstation Spezifikationen für rote und grüne Fluoreszenz und Lumineszenz-Imaging von bakteriellen Oberflächenwachstum..
Diskussion
Erzielung reproduzierbarer Schwärmen in einem Labor kann eine Herausforderung sein, wie Schwarm Assays sind sehr empfindlich gegenüber Umwelteinflüssen, wie Feuchtigkeit und verfügbaren Nährstoffen. Der kritischste Aspekt einer Oberfläche Motilität Plattenassay ist Feuchtigkeit auf der Agaroberfläche. Vor der Beimpfung müssen Schwarm Medien trocken genug, um Bakterienzellen vom Schwimmen über die Oberfläche Flüssigkeit zu verhindern, aber nicht so trocken wie zu hemmen wimmelt Motilität 5 sein. Die Inkubation sollte in einem ausreichend feuchten Umgebung zu nehmen: zu wenig Feuchtigkeit im Test Austrocknen während der Inkubation führen, während zu viel Feuchtigkeit kann zu künstlichen oder Artefakt Oberfläche Verbreitung führen. Es sei denn, eine feuchtigkeitsgesteuerten Inkubator zur Hand, kann Inkubator und Labor Feuchtigkeit drastisch ändern. Folglich könnte ein weiterer Wasservorratsbehälter, einen Luftbefeuchter oder ein Entfeuchter im Inkubator ist zur Übertrocknung oder die Ansammlung von überschüssiger Feuchtigkeit zu verhindern, während die relat werdenive Feuchtigkeit in der Nähe von 80%. Die Aufrechterhaltung dieses ideale Luftfeuchtigkeit kann sich als Herausforderung, wenn saisonale Feuchtigkeitsschwankungen signifikant sind. Wenn dies der Fall ist, wird der Schwarm Assay-Protokoll einige Anpassungen erfordern, um saisonale Änderungen in der Feuchtigkeit zu berücksichtigen. Wir haben festgestellt, dass eine Veränderung der Schwarm Medien Trockenzeit ist der einfachste Weg, um für die saisonale Feuchtigkeitsschwankungen anzupassen. Konstantfeuchteüberwachung sowohl innerhalb als auch außerhalb des Inkubators, wird empfohlen. Ferner ist es empfehlenswert, dass die Forscher zu kalibrieren und zu bestätigen ihre Instrumente, Inkubatoren, Schuppen, etc. als kleinere Fehler in der Temperatur, Volumen oder Mengen von Medienkomponenten können Reproduzierbarkeit dieser Assays beeinträchtigen.
Es sollte auch beachtet werden, dass die Art und die Größe der Platte in dem Assay verwendet werden kann, Plattenfeuchtigkeit beeinflussen und somit Schwärmen werden. Airtight Platten nicht auslassen überschüssige Feuchtigkeit, was ermutigend Schwimm Beweglichkeit. Im Gegensatz dazu offenflächigen Platten erlauben zu viel Feuchtigkeit entweichen. Eine Petrischalebietet eine ideale Umgebung, weil es Öffnungen off genug überschüssige Feuchtigkeit zu verhindern, dass Flüssigkeit aufzubauen, behält aber genug Feuchtigkeit, um das Medium vor dem Austrocknen zu verhindern. Diese Methode nennt eine Oberfläche Motilität Assay-Protokoll, das für hohe Bildqualität ermöglicht. Um den Agar klar für die Bildgebung 60 mm Durchmesser Gerichte werden mit 7,5 ml Agar-Medien gefüllt zu halten. Wenn detaillierte Bildgebung nicht benötigt wird, können Mengen von bis zu 20 ml auch reproduzierbare Ergebnisse.
Während wimmelt Beweglichkeit kann auf eine breite Palette von Agar-Konzentrationen erreicht werden, der optimale Bereich von Agar zum Schwärmen ist abhängig von der Spezies. Insgesamt höhere Agar Konzentrationen hemmen wimmelt Beweglichkeit und damit die benötigte Zeit, um eine Bild-ready Schwarm Steigerungen zu produzieren. P. aeruginosa schwärmt der Regel auf Agar-Konzentrationen zwischen 0,4-0,7% 1, jedoch finden wir, dass optimale Schwärmen in einem viel engeren Bereich (0,4-0,5%) auftritt. Andere, wie B. subtilis und S. Darm-ein Schwarm mit 0,6% Agar und Vibrio parahaemolyticus in 1,5% Agar 10. Die erforderliche Agarkonzentration wird auch durch die Art und Marke Agar bestimmt. Höhere Reinheit Nährböden, wie Edel Agar, stark verbessern schwärmen in P. aeruginosa und werden bevorzugt Agar 13,14 über granuliert. Jedoch sind diese gereinigte Versionen von Agar auch anfälliger für Karamelisierung während der Autoklav-Sterilisationszyklus; je nach Gerät, eine verkürzte / modifiziert Sterilisation Sequenz (die Abgaszyklus möglicherweise ändern, um längere Hitzeeinwirkung zu verhindern) kann erforderlich sein Schwarm Medien vorzubereiten mit Edel-Agar werden.
Medienzusammensetzung spielt auch eine Rolle bei der beobachteten Schwarm Phänotyp 3. P. aeruginosa wimmelt Motilität Studien werden in der Regel unter Verwendung von minimal Nährmedien. Wir bevorzugen FAB Medium 4,8 (Werkstoff-Tabelle), aber auch andere Medien, wie M9, LB oder leichte Abweichungen zu diesen gemeinsamen Medien,erfolgreich 9,15,16 verwendet. Rankenbildung am besten zu FAB mit Glukose als Kohlenstoffquelle und Casaminosäuren (CAA) ergänzten Minimalmedium erreicht, jedoch ohne eine zusätzliche Stickstoffquelle (das heißt, (NH 4) 2 SO 4) 6,13. Wenn Rankenbildung oder Morphologie ist nicht der Schwerpunkt der Studie, dann FAB-Minimalmedium (Werkstoff-Tabelle, Tabelle 1) frei von CAA empfohlen, so dass die Auswirkungen von bestimmten Kohlenstoffquellen und / oder zusätzliche Nährstoffe können im Detail untersucht werden. Andere Arten, wie B. subtilis (hier vorgestellten), sind vielseitig Schwärmer, der fähig ist Schwärmen auf LB-Agar und granuliert. Diese Arten Schwarm einfach und erfordert nur ~ 10 Stunden, um eine vollständige Schwarm zu entwickeln. Diese schnelle wimmelt Rate macht nach dem Fortschreiten der Schwarm möglicherweise schwierig, aber unser Protokoll macht solche Tracking sehr machbar. Die Fähigkeit, Schwarm Zeitraffer-Bildgebung durchführen stellt eine substanliche Leichtigkeit in Schwarm Datenerfassung, insbesondere von solchen begeisterter Schwärmer.
Wir stellen eine robuste, umfassende, Zwei-Phasen-Protokoll und Richtlinien zur Verbesserung der Durchführung und Reproduzierbarkeit der Bakterienoberfläche Motilität Forschung ausgerichtet und wurden in erster Linie betont Aspekte wichtig, Flagellen-vermittelte Schwärmen zu untersuchen. Dieser Schwarm Testprotokoll ausführliche Informationen zu wichtigen Aspekten der Medienzusammensetzung und den Umgang mit Oberflächenbeweglichkeit Platten, um eine größere Konsistenz und Reproduzierbarkeit innerhalb und zwischen den Forschungsgruppen bieten. Dies wird die Grundlage des Vergleichs zwischen den verschiedenen Forschungsstudien zu verbessern. Darüber hinaus bietet die vorgestellte Ansatz und das Protokoll mittels Forschung zu Schwärmen und Oberflächenbeweglichkeit weniger anfällig gegenüber Umweltänderungen zu machen, indem die Forscher wissen, dass diese Faktoren wirken sich auf ihre Arbeit und Bereitstellung von Lösungsmöglichkeiten (zum Beispiel, wie kleine Veränderungen in Agar beeinflussen wimmelt 4,5 ). Darüber hinaus, um das Protokoll vorgesehenquantifizieren makroskopischen Aspekte Schwärmen, bietet die Möglichkeit, viele Eigenschaften von bakteriellen Oberflächenwachstum, die bisher nicht quantifizierbar waren zu messen.
Wir haben nicht alle Oberflächen bewegliche Bakterien in der Entwicklung dieses Protokolls untersucht. Als solches wird erwartet, dass das Protokoll Modifikationen werden für die hier nicht dargestellten Spezies erforderlich sein. Die Effizienz dieses Protokolls wird durch die inhärenten Beschränkungen der Ausrüstung und der verwendeten Materialien beschränkt. Beispielsweise sind Temperatur Studien nicht möglich, da noch mit dem Bruker Abbildungsstation, da die Temperatursteuerung nicht ein Merkmal der Ausrüstung. Darüber hinaus kann die Verwendung von Farbstoffen (wie Nilrot um Rhamnolipide zu färben) kinetische und Konzentrationsbeschränkungen 8 haben. Diese Technik stützt sich stark auf die Verarbeitung und Auswertung von Digitalbildern; verbesserte Automatisierung der Datenanalyse (zB durch zusätzliche Macros Skriptfunktion in ImageJ) würde die Zeit für die Analyse benötigt reduzierenund erweitern Sie die Nützlichkeit der Daten. Schließlich, aufgrund der Robustheit der Bildgebungsprotokoll, zukünftige Anwendungen sollte die Erweiterung dieser Technik auf weniger einheitliche Wachstumsoberflächen können, die für Oberflächen von Umwelt- und pathogenen Bakterien besiedelt sind, untersuchen wollen.
Offenlegungen
Veröffentlichungskosten für diesen Artikel wurden teilweise durch die Bruker Corporation gesponsert.
Danksagungen
(; Bis MA und JDS R01GM100470 und 1R01GM095959-01A1) und einem Core Facility Zuschuss von der Indiana Clinical and Translational Sciences Institute (teilweise durch NIH Zuschusses # TR000006 UL1 finanziert, teilweise Unterstützung für diese Arbeit wurde von der National Institutes of Health zur Verfügung gestellt, um JDS).
Materialien
| Name | Company | Catalog Number | Comments |
| Reagentsa | |||
| FAB Minimal Media: | Prepare every ~4 weeks. Top to 1 L with nanopure H2O. | ||
| (NH4)2SO4 | Sigma | A4418 | 2 g. Not used in P. aeruginosa tendril formation studies. |
| Na2HPO4 x 7H2O | Sigma-Aldrich | S9390 | 9 g |
| KH2PO4 | Sigma | P5655 | 3 g |
| NaCl | BDH | BDH8014 | 3 g |
| MgCl2 x 6H2O solution (198 g/L) | Fisher Scientific | M33 | 1 ml |
| CaCl2 x 2H2O solution (14 g/L) | Fisher Scientific | C79 | 1 ml |
| Trace metal solution (see below) | n/a | n/a | 1 ml |
| Trace Metal Solution: | Top to 1 L with nanopure H2O. Maintain in a glass bottle, stirring and covered with foil. | ||
| CaSO4 x 2H2O | Sigma-Aldrich | 255548 | 200 mg |
| MnSO4 x H2O | Sigma-Aldrich | M7634 | 20 mg |
| CuSO4 x 5H2O | Fisher Scientific | C493 | 20 mg |
| ZnSO4 x 7H2O | Sigma-Aldrich | Z4750 | 20 mg |
| CoSO4 x 7H2O | Sigma-Aldrich | C6768 | 10 mg |
| NaMoO4 x 2H2O | Sigma | S6646 | 10 mg |
| H3BO3 | Fisher Scientific | A74 | 5 mg |
| FeSO4 x 7H2O | Sigma-Aldrich | F7002 | 200 mg |
| CTT Media: | Prepare as needed. Top to 100 ml with nanopure H2O. | ||
| Tris-HCl, 1 M solution (adjust to pH 8.0) | Amresco | 0234 | 1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 8.0 and filter sterilize (0.2 μm pore). |
| K2HPO4, 1 M solution (adjust to pH 7.6) | Sigma-Aldrich | P3786 | 0.1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 7.6 and filter sterilize (0.2 μm pore). |
| MgSO4 solution | Fisher Scientific | M65 | 0.8 ml. Prepare a 1 M stock solution in nano pure H2O. Filter sterilize (0.2 μm pore). |
| Casitone | BD Diagnostics | 225930 | 1 g |
| Additional Reagents: | |||
| LB Broth, Lennox | BD Diagnostics | 240230 | 2% (wt/vol) |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | 30 mM for overnight broth cultures; 12 mM for swarm media. Prepare a 1.2 M filter sterilized stock solution in nano pure H2O. Add to media after autoclaving. |
| Casamino acids (CAA) | Amresco | J851 | 0.10% (wt/vol). Recommended for P. aeruginosa tendril formation studies. Add to media prior to autoclaving. |
| Agar, Noble | Sigma-Aldrich | A5431 | 0.45% (wt/vol). Preferred Noble agar for P. aeruginosa surface motility studies. Add to media prior to autoclaving. |
| Agar, Noble | Affymetrix | 10907 | 1.50% (wt/vol). Used in M. xanthus surface motility studies. Not recommended for P. aeruginosa motility studies. Add to media prior to autoclaving. |
| Agar, Granulated | Fisher Scientific | BP1423 | 0.60% (wt/vol) |
| Higgins Waterproof Black India Ink | Higgins | HIG44201 | 0.50% (vol/vol). Mix ink with inoculum to test swarm media surface moisture. |
| SYTO® 64 Red Fluorescent Nucleic Acid Stain | Invitrogen | S-11346 | Use 4 μl (for P. aeruginosa) or 8 μl (for M. xanthus) of SYTO® 64 per 100 ml of molten agar (added after autoclaving). |
| Relevant Materials and Equipment | |||
| Petri dish, sterile, 150 mm x 15 mm (Dia. x H) | VWR | 25384-326 | |
| Petri dish, sterile, 100 mm x 15 mm (Dia. x H) | VWR | 25384-342 | |
| Petri dish, sterile, 60 mm x 15 mm (Dia. x H) | VWR | 25384-092 | |
| In-Vivo Xtream | Bruker | Use for the macroscopic imaging of surface motility studies. http://www.bruker.com/products/preclinical-imaging/opticalx-ray-imaging/in-vivo-xtreme/overview.html | |
| Bruker MI software | Bruker | http://www.bruker.com/fileadmin/user_upload/8-PDF-Docs/PreclinicalImaging/Brochures/MI-software-brochure.pdf | |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| aSee MSDS of reagents for handeling and disposal information. | |||
Referenzen
- Kearns, D. B. A field guide to bacterial swarming motility. Nature Reviews: Microbiology. 8 (9), 634-644 (2010).
- Burall, L. S., et al. et al.Proteus mirabilis. genes that contribute to pathogenesis of urinary tract infection: Identification of 25 signature-tagged mutants attenuated at least 100-fold. Infection and Immunity. 72 (5), 2922-2938 (2004).
- Shrout, J. D., et al. The impact of quorum sensing and swarming motility on Pseudomonas aeruginosa. biofilm formation is nutritionally conditional. Mol Microbiol. 62 (5), 1264-1277 (2006).
- Kamatkar, N. G., Shrout, J. D. Surface hardness impairment of quorum sensing and swarming for Pseudomonas aeruginosa. PLoS One. 6 (6), e20888 (2011).
- Tremblay, J., Déziel, E. Improving the reproducibility of Pseudomonas aeruginosa. swarming motility assays. Journal of Basic Microbiology. 48 (6), 509-515 (2008).
- Caiazza, N. C., Shanks, R. M., O'Toole, G. A. Rhamnolipids modulate swarming motility patterns of Pseudomonas aeruginosa. Journal of Bacteriology. 187 (21), 7351-7361 (2005).
- Du, H., et al. High density waves of the bacterium Pseudomonas aeruginosa. in propagating swarms result in efficient colonization of surfaces. Biophysical Journal. 103 (3), 601-609 (2012).
- Morris, J. D., et al. Imaging and analysis of Pseudomonas aeruginosa. swarming and rhamnolipid production. Appl Environ Microbiol. 77 (23), 8310-8317 (2011).
- Tremblay, J., Richardson, A. P., Lépine, F., Déziel, E. Self-produced extracellular stimuli modulate the Pseudomonas aeruginosa. swarming motility behaviour. Environmental Microbiology. 9 (10), 2622-2630 (2007).
- Partridge, J. D., Harshey, R. M. Swarming: flexible roaming plans. J Bacteriol. 195 (5), 909-918 (2013).
- Patrick, J. E., Kearns, D. B. Laboratory strains of Bacillus subtilis .do not exhibit swarming motility. Journal of Bacteriology. 191 (22), 7129-7133 (2009).
- . . Molecular Imaging. , (2014).
- Harshey, R. M., Matsuyama, T. Dimorphic transition in Escherichia coli. and Salmonella typhimurium.: surface-induced differentiation into hyperflagellate swarmer cells. Proceedings of the National Academy of Sciences, USA. 91 (18), 8631-8635 (1994).
- Rashid, M. H., Kornberg, A. Inorganic polyphosphate is needed for swimming, swarming, and twitching motilities of Pseudomonas aeruginosa. Proc Nat Acad Sci U.S.A.. 97 (9), 4885-4890 (2000).
- Caiazza, N. C., Merritt, J. H., Brothers, K. M., O'Toole, G. A. Inverse regulation of biofilm formation and swarming motility by Pseudomonas aeruginosa. PA14. Journal of Bacteriology. 189 (9), 3603-3612 (2007).
- Kuchma, S. L., et al. Cyclic-di-GMP-mediated repression of swarming motility by Pseudomonas aeruginosa.: the pilY1. gene and its impact on surface-associated behaviors. J Bacteriol. 192 (12), 2950-2964 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten