Method Article
세균 표면 운동성 분석의 준비, 이미징 및 정량화
요약
Swarming motility is influenced by physical and environmental factors. We describe a two-phase protocol and guidelines to circumvent the challenges commonly associated with swarm assay preparation and data collection. A macroscopic imaging technique is employed to obtain detailed information on swarm behavior that is not provided by current analysis techniques.
초록
박테리아 표면 운동성은, 예컨대 득시글 거리는 일반적으로 특정 한천의 농도 및 성장 배지의 특정 영양소 때때로 포함을 필요로 플레이트 어 세이를 이용하여 실험실에서 시험된다. 이러한 명시 매체 표면 성장 조건의 제제는 박테리아 증식하지만 얇은 액체 필름 내에서 이들 표면 위에 박테리아 코디 운동성 아니라 허용 유리한 조건을 제공하는 역할을한다. 떼 판과 다른 표면 운동 플레이트 분석의 재현성은 큰 문제가 될 수 있습니다. 특히 0.4 %의 한천 범위 -0.8 % (중량 / 부피), 크게 무리의 분석 결과에 영향을 미칠 수있는 프로토콜 또는 실험실 환경에서의 작은 변화에서 운동을 나타내지 더 "온대 swarmers"에 대한. 이들 플레이트 어 세이의 액체 - 고체 - 공기 계면에서 "습윤성"또는 물 함량은 종종 제어 될 키 변수이다. 득시글 거리는을 평가하는 추가 과제는 O를 정량화하는 방법이다어떤 두 개 (또는 그 이상)의 실험 사이 bserved 차이. 다음을 준비하고 이미지 떼 분석하기 위해 세부에게 다양한 두 단계 프로토콜을, 우리. 우리는 일반적으로 떼 분석 매체 준비와 이러한 분석 데이터의 정량화와 관련된 문제를 회피하기위한 지침을 포함한다. 우리는 특히 시간 경과 광학 영상을 가능하게 녹색 형광 단백질 (GFP), 루시 페라 제 (럭스 오페론)와 같은 형광 발광 생물 유전자 기자를 표현 박테리아, 또는 휴대 얼룩을 사용하여 우리의 방법을 설명한다. 우리는 추가로 동일한 실험 집단 종 경쟁 추적하는 방법 우리의 능력을 입증한다.
서문
대부분의 박테리아는자가 추진의 다양한 수단을 사용하여 표면 상에 이동한다. 일부 운동성 표현형은 반고체 플레이트 분석법 조성물과 연관된 액체의 환경에 의해 영향을받는 플레이트 어 세이를 이용하여 실험실에서 조사 할 수있다. 유용한 표면 운동성 플레이트 어 세이의 서브 세트는 상기 기체 상 통상적으로 실내 공기를 포함한다. 로컬 환경 고체 표면, 액체 환경, 가스 환경 등록 : 따라서, 임의의 특정 표면 운동성 분석의 결과는, 3상의 제어 인터페이스의주의를 요구한다.
예컨대 삼상 분석에서 가장 많이 연구 운동 모드는 집단으로 알려져있다. 운동을 치고하는 것은 표면 1에 얇은 액체 필름을 통해 자신의 편모에 의해 추진되는 박테리아 세포의 조정 그룹 운동이다. 그것은 일반적으로 0.4 %를 -0.8 %를 함유하는 반고체 플레이트 어 세이 (중량 / 부피)를 사용하여 실험실에서 검토되고 한천 1. 의 배열인간의 병원균 탐험과 인간의 호스트를 식민지화하기 위해이 운동 동작을 이용한다. 예를 들어, 테우스 mirabilis에는 요도를 이동하는 운동을 치고 도달 방광과 신장 2 식민지화 사용합니다. 집단 운동은 일반적으로 형성 생물막하는 전구체 단계, 많은 사람의 병원균 3의 발병의 주요 원인으로 간주됩니다.
진을 치고 표현형 종의 박테리아들 사이 매우 다양합니다; 실험 성공 및 재현성이 강하게 3-5 중 다른 영양 성분, 한천 종류 및 조성, 살균 프로토콜 (예를 들어, 오토 클레이브), 반 - 고체 배지 경화, 및 주위 습도 (예를 들면, 계절 변화)과 같은 요인에 의존한다. 표면 운동 응답의 변화는 이러한 연구와 중대한 영향력 미디어 및 발휘할 수 환경에서 발생하는 문제를 강조한다. 이러한 슈도모나스 (Pseudomonas)와 같은 일부 집단 종, 집단 경구 용관찰 된 표현형 및 첨부 떼 팽창률이 크게 달라질 수 있지만 3 ility는, 미디어의 다양한 조성물에 발생할 수있다. 결합, 이러한 요소는 표면 운동 연구는 매우 도전 할 수 있습니다. 실험실 내에서 계절 변동이 세 상 분석에 영향을 미칠 수있다 : 분석은 겨울의 건조한 공기 여름의 습한 공기에 더 악화 기능을 할 수있다. 여기에서 우리는 표면 운동 플레이트 연구를 수행 할 때 가장 주목할만한 몇 가지 문제를 회피하는 일반적인 가이드 라인을 제시한다.
일부 표면 운동성 연구를 들어, 특정 표현형의 발달은 중대한 관심사이다. 대부분의 전부는 아니지만, 발표 된 연구는 P.의 득시글 거리는을 검사합니다 녹농균은 접종 센터 3-9에서 발산 이루고 또는 도형의 형성을 보여줍니다. P.의 차이 루기 노자 균주 5,8-을 설명되었지만 이루고 존재 또는 부재의 대부분은 구체적으로 지정에 기인 할 수있다C 매체와 프로토콜은 이러한 떼 운동성 플레이트 분석에 사용됩니다. 여기에 우리가 P.에 대한 덩굴 형성 떼을 촉진하는 방법에 대한 자세한 내용을 포함 녹농균. P. 때문에 녹농균은 단지 하나의 많은 집단 박테리아, 우리는 바실러스 서브 틸리 스 (Bacillus subtilis)의 득시글 거리는과 Myxococcus의 산토스의 활공을 검사하는 우리의 방법에 대한 세부 사항을 포함한다. P.처럼 녹농균, B의 현재 연구 서브 틸리와 M. 산토스, 연구자와 같은 주제의 배열 포자 형성, 운동, 스트레스 반응 및 전환 동작 1,10의 측면을 식별하기 위해 노력하고 있습니다에 걸쳐있다. 집단이 세포 집단에 대한 특정 동작 (들)의 패턴 및 역학을 계량 할 필요가있다.
표면 운동성 데이터 수집, 분석 및 해석은 복잡하고 정성이 될 수 있습니다. 우리는 영역 및 형태들 뒤덮 이외에 제공 세균 떼 상세한 거시적 분석 프로토콜을 개발했다이지는 (예를 들면, 직경), 떼 확장 속도와 박테리아 또는 bioproduct 밀도 분포 7에 대한 정량적 동적 정보. 또한,이 방법은 세균의 상호 작용 (8)의 광범위한 관점을 수득 가능한 형광 단백질, 발광, 및 염료를 이용할 수 있고,뿐만 아니라 떼 내의 바이오의 합성 (예, 녹농균 7,8 rhamnolipid) 추적.
프로토콜
1. 군집 분석 미디어 준비 및 접종 4,5,7,8,11
- 미디어 준비
참고 : 아래에서 설명하는 매체 구성은 P.에 적용 할 수있다 aeruginosa의 덩굴 형성 연구. P. 표 1에 용지 사양을 참조하십시오 녹농균, B. 서브 틸리 스, 그리고 M. 산토스, 표면 운동성 분석.- 자기 교반 막대로 교반하여 FAB 마이너스 200 ㎖ (NH 4) 2 SO 4 떼 매체 (재료 표), 노블 한천 0.9 g, 카사 미노산 및 0.2g의 (표 1)를 섞는다. 실험 사이의 일관성을 향상시키기 위해 소량 (100 ~ 300 ml)에 사용합니다.
- 22 분, 121.1 ° C의 온도에 노출, 및 빠른 통기 옵션의 노출 시간을 사용하여 200 ml의 아가 / 유체 혼합물을 압력솥. 오토 클레이브 멸균 설정은 적절한 한천 용융을 허용하지만, 한천 캐러멜 화를 방지한다.
참고 : 빛나는 한천 캐러멜하는 경향이있다화; 세균의 운동성이있는 캐 한천에 변경됩니다. - 멸균 사이클이 완료 직후에 수분이 증발하여 손실을 방지하기 위해 용지 병의 뚜껑을 닫는다. 그러나 꽉 캡핑이 병에 -like 효과 "를 밀봉 진공"가 발생할 수 있습니다.
- 실온 (RT)에서 교반하면서 50 ℃로 냉각시키고, 매체를 멸균 1.2 M 글루코스 2 ㎖를 추가한다. 또한, (최대 15 시간 이상)을 사용하고, 표시된대로 진행 준비가 될 때까지 60 ° C 배양기 또는 물 욕조에 용지를 넣습니다. 매체 중의 기포의 형성을 방지하기 위해, 자기 교반 막대를 사용하여 완전히 혼합; 심지어 집단 방지 할 한천의 표면에 거품.
참고 : 그림과 같이 다른 분석의 경우,이 단계에서 필요에 따라 추가적인 영양소 또는 염료로 멸균 할 수 없습니다 열에 민감한 구성 요소를 추가 (예를 들어, 100 ml의 당 8 μL 인비 트 로젠 SYTO 63 염료의 추가 이미지에 M. 산토스를 한천을 녹인 Representati에서) 아래의 결과를했습니다. 일부 염료의 첨가 비 염료 제어에 대해 확인해야 기준선 득시글 동작에 영향을 미칠 수있다. - 실험실 후드, 분취 액 7.5 60mm 직경의 폴리스티렌 배양 접시 당 멸균 미디어 ml의 단일 층을 유지 판 (누적하지 않음). 큰 득시글 거리는 표면, 나누어지는 100mm 직경 페트리 접시 당 미디어의 25 ml의하십시오. 그것은 심지어 수평 표면 상에 요리를 기입하는 것이 중요하다. 표면이 수평 여부를 확인하기 위해 황소의 눈 높이를 사용합니다.
참고 : P. 들어 접시 당 특정 미디어 볼륨을 사용 aeruginosa의 분석은 일관성과 재현성을 향상시킬 수 있습니다. B. 들어 서브 틸리와 M. 특정 볼륨 씩 비교 산토스, 분석, 붓는 손 수율 결과.
- 플레이트 경화
- 작은 접시 (60mm)의 경우, 30 분 (뚜껑이없는 즉,) 발견 후드 (반 고체 및 입상 초과 액체로 설정 모두) 녹은 한천 배지는 치료 할 수 있습니다. 큰플레이트 (100mm)는 긴 경화 시간 (토론 참조)가 필요합니다.
참고 : 또한, 일부 분석은 덮여 벤치 최고 하룻밤 (20-24 시간) (즉, 뚜껑에) 단일 층 (표 일)에 경화 판 필요할 수도 있습니다. 집단 모두 초과 불충분 한 수분에 민감합니다. 주어진 실험실의 습도, 공기 흐름, 온도는 세균의 최적의 득시글 거리는을 촉진하기 위해 경화 판에 변화를 필요로 할 수 있습니다. - 건조 기간이 끝난 직후 플레이트에 접종. 추가 사용에 대한 번호판을 보관하지 마십시오.
- 10 μL에 0.50 %의 혼합물 (부피 / 용적) 히긴스 방수 블랙 인도 잉크 및 세균 접종 11 테스트 판을 잡아 내 "잉크 확산 테스트"를 수행합니다. 잉크 / 접종 혼합물 미디어의 표면에 (즉, 방울 형태를 유지하지 않는) 쉽게 확산 할 경우, 미디어는 건조 시간이 더 필요합니다.
참고 : 습도에 특히 민감 종 (들어 예를 들어, P. 녹농균)는 플레이트가 충분히 건조 여부를 결정하기 위해 빠른 "잉크 확산 테스트"(11)을 수행합니다.
- 10 μL에 0.50 %의 혼합물 (부피 / 용적) 히긴스 방수 블랙 인도 잉크 및 세균 접종 11 테스트 판을 잡아 내 "잉크 확산 테스트"를 수행합니다. 잉크 / 접종 혼합물 미디어의 표면에 (즉, 방울 형태를 유지하지 않는) 쉽게 확산 할 경우, 미디어는 건조 시간이 더 필요합니다.
- 작은 접시 (60mm)의 경우, 30 분 (뚜껑이없는 즉,) 발견 후드 (반 고체 및 입상 초과 액체로 설정 모두) 녹은 한천 배지는 치료 할 수 있습니다. 큰플레이트 (100mm)는 긴 경화 시간 (토론 참조)가 필요합니다.
- 군집 분석 접종
- 신선한 (<실온에서 방치하면 5 일 이전) 원성 국물 (LB) 플레이트 문화에서 고립 된 식민지와 국물 문화 미디어 (자세한 내용은 표 1 참조)의 6 ml에 접종한다. 30 ° C에서 국물 문화 하룻밤 (≤18 시간)을 품어 수평 흔들림 (240 RPM)와 37 ° C.
- 밤새 국물 문화의 1-5 μL와 함께, 또는 "파고"에 의해 더럽혀 떼 판을 접종 멸균 치아 한천 선택하거나 와이어 접종 바늘.
참고 :이 접종을 스패 터링의 가능성을 감소하고 무리 표면 영역에 추가 수분을 추가 방지하기 때문에 우리는 후자의 방법을 선호한다.
- 군집 분석 인큐베이션
- 일반적인 분석의 경우, 30 °에서 떼 분석 플레이트를 품다C 또는 (B. subtilis에 대한 또는 42 ° C; 표 1) 37 ° C - 이것은이 박테리아 다릅니다. 과량의 수분이 뚜껑 아닌 한천에 응축되도록 배양 동안 플레이트를 전환.
참고 : 온도가 표현형뿐만 아니라 반응 속도에 영향을 줄 수 있습니다. P. 들어 aeruginosa의 메뚜기는 37 ° C에서 배양 30 ° C에서 배양보다 빠른 성장과 떼 확장에 이르게; 그러나, 이러한 메뚜기의 형태는 종종 온도의 변화와 다릅니다. - 시간 경과 영상의 경우, 영상 스테이션 (자세한 내용은 표 1 참조)로 전송하기 전에 적절한 온도에서 떼 판을 배양한다.
참고 :이 사전 이미징 배양이 떼가 자신의 개발을 시작하고 또는 운동을 치고위한 최적이 아닐 수도 있습니다 새로운 환경으로 이동하기 전에 설립 될 수 있습니다.
- 일반적인 분석의 경우, 30 °에서 떼 분석 플레이트를 품다C 또는 (B. subtilis에 대한 또는 42 ° C; 표 1) 37 ° C - 이것은이 박테리아 다릅니다. 과량의 수분이 뚜껑 아닌 한천에 응축되도록 배양 동안 플레이트를 전환.
표면 운동성 분석 실험 7,8 2. 육안 이미징
- 시간 경과 이미징을위한 상업 생체 내 이미징 역 내부 명확한 영상 접시에 사전 영상 잠복기 장소 떼 분석 판 후. 이미지 최대 6, 60mm 직경 또는 네 번에 직경 100 mm 플레이트. 카메라 촬상 평면 아래에서 이미지를 캡쳐하므로, 광로 (8)를 방해하지 않도록 반전 플레이트. 대안 적으로, 실험 기간 동안 30 ° C 또는 37 ° C (표 1)에서 부화 한 플레이트를 설정된 시간 간격으로 배양기로부터 제거 묘화 될.
- 똑바로 접종 미디어를 보유하고있는 판 상대의 상단에있는 페트리 접시의 뚜껑을 놓습니다. 촬영하는 동안 과도한 건조를 방지하고, 실험을하는 동안 습도를 유지하기 위해 다른 명확한 트레이를 사용하여 전체 세트를 둘러싸 물 페트리 접시의 뚜껑을 채 웁니다.
- 메신저를 사용하여 실온에서 분자 영상을 사용하여 (MI) 소프트웨어 (12), 실행 분석 (들)표 2에 설명 된 설정을 노화. 시간 경과 영상의 경우, 필요한 단계 및 사양의 프로토콜을 설정합니다.
(3) 데이터 처리 및 해석 (7, 8)
- 이미지 처리
- 파일> 내보내기 내보내기 또는 다중 선택> 파일 (들)을 수출하는 수출 위치 : 16 비트 TIFF 파일로 일괄 수출 이미지에 사용 MI 소프트웨어.
- 하나의 이미지를 열거 나 시간 경과 시리즈를 가져 ImageJ에 사용 :
- 하나의 이미지를 엽니 다 파일> 열기
- 가져 오기 시간 경과 이미지 시퀀스 : 파일> 가져 오기 순서 및 "숫자로 정렬 이름"을 선택합니다.
- 큰 시간 경과 파일의 경우, 적절한 범주 (즉, GFP, RFP 등)로 보낸 이미지를 쌓아 "가져 오기 순서"창에서 "가상 스택을 사용"을 선택합니다.
- 필요한 경우, 8 비트 파일에 16 비트의 이미지 파일을 변경할: 이미지> 유형> 8 비트
참고 : 일부 ImageJ에 도구가 8 비트 이미지를 필요로합니다. - 이미지 또는 시간 경과 시퀀스에 대한 강도 신호를 반전해야하는 경우를 결정합니다. (예를 들어, 형광 표지 성장) 이미지의 밝은 점에 커서를 올려 놓고 ImageJ에 도구 모음에서 신호 강도 "값"을 확인합니다. 이어서, 플레이트 외부 영역 암점에 커서를 배치하고 신호 강도에 유의. 다크 스팟에 대한 신호 세기가 밝은 장소에 대한 강도보다 큰 경우, 화상 신호 강도 (이하에게 하위 단계 1-2에 준한다) 반전되어야.
- 강도 신호 전환 : 편집> 반전
- 이미지> 조회 테이블> 반전 LUT : 룩업 테이블 전환
- 배경 빼기 :> 프로세스를 배경 빼기, 한 반 하나의 이미지 차원 (이다 픽셀 반경 "롤링 볼 반경"를 사용 예를 들어, 2,000 X 2,000 P 1,000 픽셀ixel 이미지).
- 인위적으로 이미지 또는 시간 경과 순서 색상 : 이미지> 조회 테이블을하고 목록 옵션에서 적절한 색상을 선택합니다.
- 두 개 이상의 채널을 시청할 수있는 동영상의 경우, 병합 이전 영화 (영상 처리, 8 단계)로 저장에 색을 균형. 개방, 함께 ImageJ에에있는 모든 이미지 스택 이미지를 병합 한 후 이미지> 색상> 채널 합병을 선택하고 색상 채널 각 더미를 할당합니다.
- > 파일로 저장하고 원하는 형식과 사양를 선택 AVI 또는 QuickTime 동영상 등의 시간 경과 순서을 저장합니다.
- 데이터 분석
- 세균 표면의 성장 영역을 취득하는 것은 확장 속도를 정량화하기
- ImageJ에 열기 이미지 (들)
- 에서 "STRAIGHT"도구를 사용하여 분석 플레이트의 중앙을 가로 지르는 선을 그리고 그 길이를 측정, 픽셀 단위로 판의 직경을 계산하려면 다음과 같이 분석> 측정
- ImageJ에의 기본 측정 유닛은 PI이고XEL. 이전 공정에서 얻어진 화소 길이 (60mm 접시에 대해 예를 들어, 60) 분석 플레이트의 직경을 분할하여 변환 계수를 구하는.
- mm로 픽셀에서 측정 단위를 변경 : 이미지> 속성을
- 이전 단계에서 계산 된 변환 계수를 "mm"를 "단위 길이"및 "픽셀 너비", "높이 (픽셀)"및 "복셀 깊이"로 변경. 여러 이미지에서이 변환 계수를 유지하기 위해 "글로벌"상자를 선택합니다.
참고 : ImageJ에 닫고 다시 열, 또는 이미지의 시야를 변경하는 경우 (즉, 하나의 이미지를 다른 것보다 더 확대된다), 변환 계수를 계산해야합니다. 또한, 모든 픽셀 단위로 분석 한 다음 mm로 변환 수행합니다.
- 이전 단계에서 계산 된 변환 계수를 "mm"를 "단위 길이"및 "픽셀 너비", "높이 (픽셀)"및 "복셀 깊이"로 변경. 여러 이미지에서이 변환 계수를 유지하기 위해 "글로벌"상자를 선택합니다.
- 모든 프레임의 경우, 추적 및 OU를 추적하려면 도구 모음에서 "자유형 선택"도구를 사용하여 떼의 면적을 측정> 측정 분석 : 떼의 tline 및 사용 영역을 측정합니다. 파일> 다른 이름으로 저장 :이 Microsoft Excel 또는 유사한 프로그램의 추가 분석을 위해 저장 될 수있는 측정이 로그 생성
- 세균 표면 성장 강도를 취득하는 것은 표면 증가율을 정량화하기
- 배경 (이미지 처리, 5 단계)을 감산하면, 메뚜기 (데이터 분석, 단계 1)의 최대 면적을 결정하는 시퀀스의 마지막 프레임을 사용한다.
- 박테리아 표면 성장 주위에 상자를 그립니다 도구 모음에서 "타원형"선택 도구를 사용합니다.
- "회색 값을 평균"> 설정 측정을 분석하고 선택 사용 상자에 픽셀의 강도 측정을 의미 설정합니다.
- 분석> 측정 : 시퀀스의 첫 번째 프레임으로 이동하는 동안, 시간 경과 시퀀스의 각 프레임에 대한 강도 신호 측정을 구하십시오. 이 미의 추가 분석을 위해 저장 될 수 있습니다 측정이 로그 생성이며 Microsoft Excel 또는 유사한 프로그램 : 파일> 다른 이름으로 저장
- 이전 섹션 (데이터 분석, 2 단계)로 대체. 설치에 ImageJ에 매크로 플러그인을 사용하여 매크로 표면 성장 강도 측정 스크립트를 실행합니다.
- 설치 여러 프레임을 동시에 분석 할 수있는 자동화 된 측정 스크립트 플러그인> 새로 만들기> 매크로를 상자에 제공된 스크립트 (아래) 붙여 ImageJ에 매크로 텍스트 파일로 저장 : 파일> 다른 이름으로 저장을하고 "아래 ImageJ에 응용 프로그램 폴더에 저장 매크로 ".
numberOfFrames = N
대한 (I = 0; 내가 numberOfFrames을 <; 내가 ++) {
( '측정')를 실행;
실행 ( '다음 슬라이스 [>]');
}
참고 : 다음은 변수 "N"은 프레임의 정의되지 않은 번호입니다. - 스크립트를 실행하기 전에 이미지 시퀀스 내의 프레임들의 수를 반영하기 위해 각 실험에서 매크로 플러그인 "을 numberOfFrames"편집. 사용 : 플러그인> 매크로>편집 및 형식 시퀀스의 프레임의 정확한 수와 저장 (파일> 저장).
- 데이터 분석 - 2 단계에서 하위 단계 1-3를 수행 한 시퀀스의 첫 번째 프레임에있는 동안 매크로 플러그인을 실행 플러그인> 매크로> 실행을. 파일> 다른 이름으로 저장 :이 Microsoft Excel 또는 유사한 프로그램의 추가 분석을 위해 저장 될 수있는 측정이 로그 생성
- 설치 여러 프레임을 동시에 분석 할 수있는 자동화 된 측정 스크립트 플러그인> 새로 만들기> 매크로를 상자에 제공된 스크립트 (아래) 붙여 ImageJ에 매크로 텍스트 파일로 저장 : 파일> 다른 이름으로 저장을하고 "아래 ImageJ에 응용 프로그램 폴더에 저장 매크로 ".
- 세균 표면의 성장 영역을 취득하는 것은 확장 속도를 정량화하기
결과
판 준비의 변화는 크게 운동을 치고 영향을 미칠 수있다. 용융 한천 배지의 주입 후 경화 또는 건조 시간은 표면 운동성 분석 및 시간에 따른 세균의 운동성에 얇은 액체 필름의 존재에 영향을 미칩니다. 영양 조성물의 변경은 또한 여러 박테리아 집단에 영향을 미친다.도 1a는 인도 잉크의 확산 및 고초균의 초기 접종 확산시 건조 시간의 단기 효과를 나타낸다 (11).도 1b는 건조 시간도 1C 쇼 효과를 나타낸다 P.를 집단에 의한 후속 덩굴 현상시 황산 암모늄의 효과 [(NH 4) 2 SO 4] 녹농균 5.
정량 가능한 데이터가 여러 촬상 전략을 사용하여 표면 운동성 엔드 이미지로부터 얻을 수있다.도 2에는 대표적인 표면 성장률 결과를 나타낸다 P. aeruginosa의 집단과 관련된 GFP 형광 이미지;를 B. 서브 틸리 득시글 거리는 및 관련 생물 발광 이미지; 및 Myxococcus의 산토스, 표면 성장과 SYTO의 관련 적색 형광 이미지 세포를 64 스테인드.
단지 검사 및 종점의 촬상 결과를 넘어 데이터 수집의 확장은도 7을 3. 표면 성장 세균 동특성 (들)의 연구 허용 P.의 예를 도시 은 녹농균 (GFP 발현 세포에 대한 묘화) 치고 및 관련 rhamnolipid 생산 P.의 팽창률을 보여 이러한 이미지 데이터 - 제나 정량도 표시된다 (나일 레드 지질 얼룩이 이미지화) aeruginosa에 진을 치고. 비디오 1 B.의 시간 경과를 보여줍니다 틸리 득시글 거리는에는 룩스 발현 균주의 발광을 사용하여 몇 군데. 비디오 2 8 P. 시간 경과를 보여줍니다 녹농균 (녹색 발현 GFP를) 및 살모넬라 엔테 혈청 형 Typhimurium의 (적색 발현 LUX).
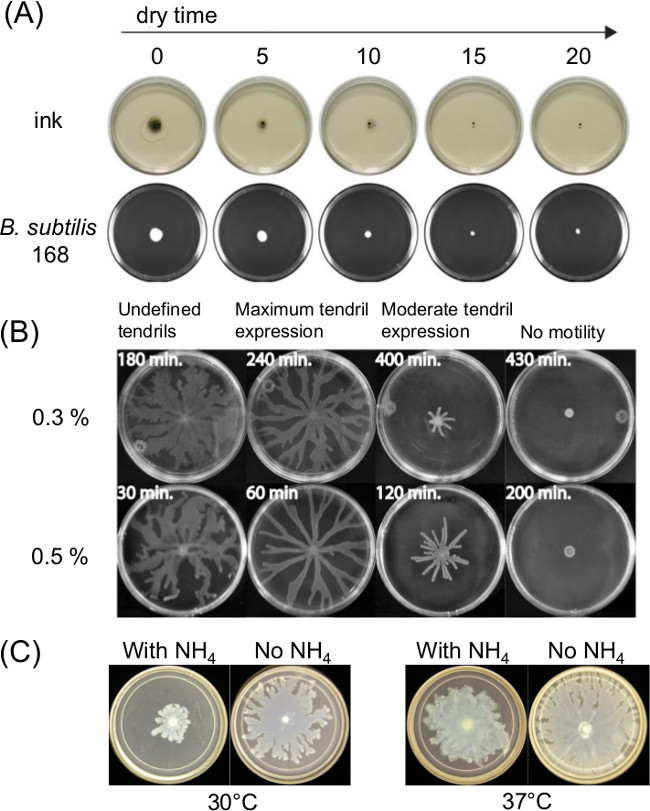
도 1 :. 효과 한천 표면에 수분 (A) 한천 건조 시간의 분석 결과에 영향 및 B. 종균위한 확산 표면 운동성 분석 준비 요인의 예로 서브 틸리 스 (참고 8)에 P., (B) 한천 건조 시간 녹농균은, 및 (C)의 존재 또는 P.에 황산 암모늄의 부재 (권한 참조 5에서 재판) 진을 치고 aeruginosa의 득시글 거리는과 덩굴 형성.
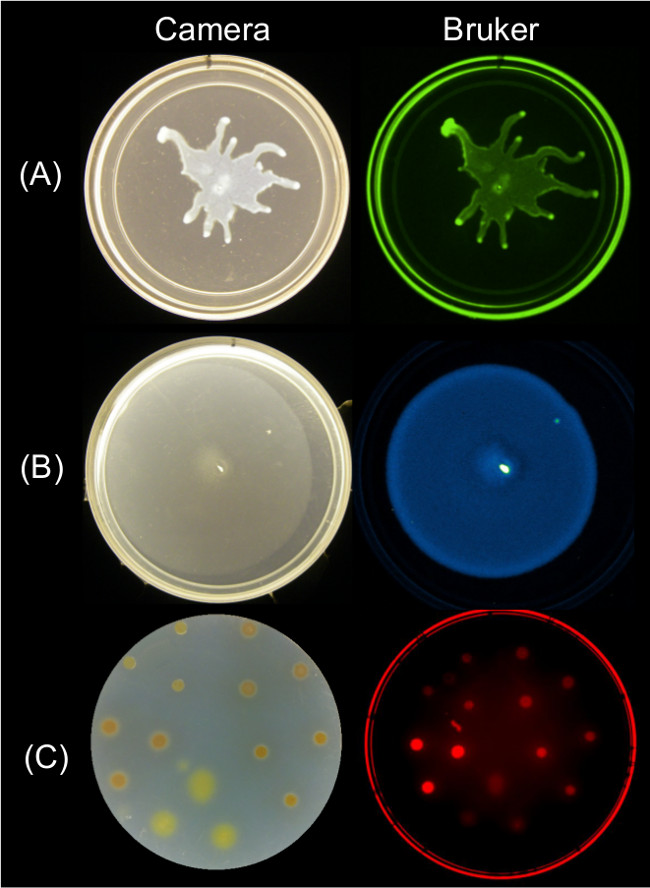
그림 2 : 교류 직류(A)를 도시 P. 브루 커 촬상 국 (왼쪽)의 측 카메라에 의한 화상. 브루 커 측 화상 (오른쪽)를 사용하여 세균의 촬상면 성장 운동성을위한 접근법 없는데 녹농균 나타내는 GFP-군데, 녹색 형광 설정을 사용하여 (B) B. SYTO로 염색 럭셔리 생물 발광 기자-군데 발광 설정을 사용하고, (C) M.의 산토스, 표현 서브 틸리 스 레드 형광 II 설정을 사용하여 64-군데. 설정 세부 사항은 표 2를 참조하십시오.
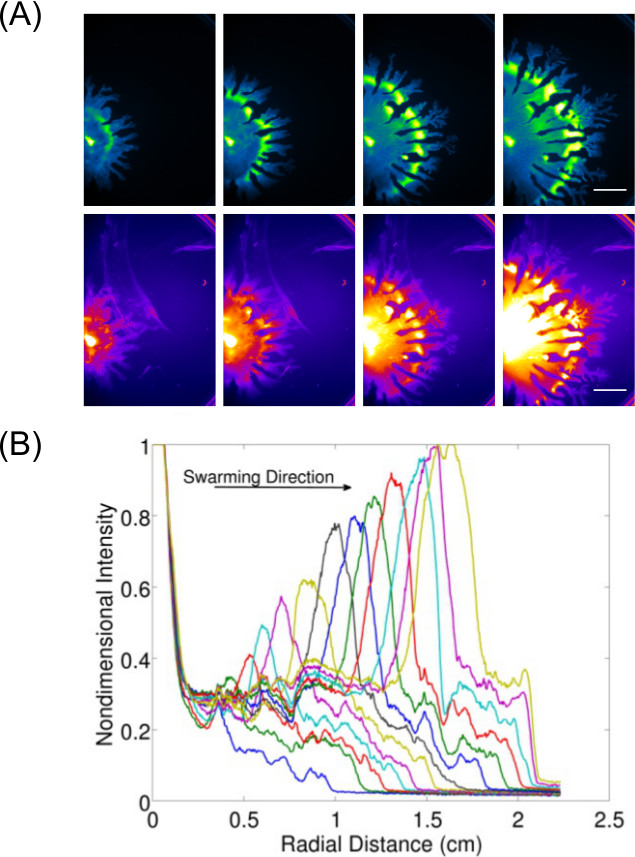
그림 3 :. 표면 운동성 분석의 정성 및 정량 분석 세포 밀도 분포의 (A) 시간 경과 분석, rhamnolipid 생산 (나일 레드 지질 얼룩은 붉은 형광을 사용하여 몇 군데내가 설정; P.의 셀 밀도 분포 이미지에서의 팽창 속도의 스케일 바 = 15mm), 및 (B) 정량 녹농균 떼. (허가 참조 6에서 재판.)
비디오 1. B.의 시간 경과 영상 서브 틸리 떼. B. 서브 틸리 룩스을 표현하고 발광 설정을 사용하여 기록했다. 설정 세부 사항은 표 2를 참조하십시오.
비디오 2. 종간 경쟁은 시간 경과 영상으로 시각화. P. 떼를 녹농균 (녹색, GFP를 표현하고 녹색 형광 설정을 사용하여 기록)과 S. 엔테 혈청 형 티피 뮤 리움 (빨간색, EXPRES럭스을 노래하고) 발광 설정을 사용하여 기록했다. 설정 세부 사항은 표 2를 참조하십시오. (참고 7의 허가를 다시 인쇄합니다.)
| 녹농균 | P. aeruginosa의 덩굴 형성 연구 | B. 서브 틸리 | M.에 산토스, | |
| 밤새 국물 문화 미디어 | FAB에 30 mM의 포도당 | FAB에 30 mM의 포도당 | LB | CTT |
| 밤새 국물 문화 배양 온도는 | 37 ° C | 37 ° C | 37 ° C | 30 ° C에서 30 시간 |
| 스웜 미디어 | FAB | FAB 마이너스 (NH 4) 2 SO 4 | 2 % (중량 / 부피) LB | CTT |
| 스웜 미디어 : 추가 구성 요소 | 12 mM의 포도당 | 10 % (중량 / 부피) CAA, 12 mM의 포도당 | N / A | SYTO® (64) |
| 한천 | 한천, 노블 | 한천, 노블 | 과립 한천 | 한천, 노블 어피 메트릭스 |
| 한천 농도 (중량 / 부피) | 0.45 % | 0.45 % | 0.60 % | 1.50 % |
| 스웜 플레이트 크기 | 60mm | 60mm | 100mm | 150mm |
| 접시 당 미디어 볼륨 | 7.5 ml의 | 7.5 ml의 | 손 붓고 | 손 붓고 |
| 스웜 미디어 설정 / 건조 방법 | 후드; 플레이트 발견 | 후드; 플레이트 발견 | 벤치 탑; 플레이트 커버 | 벤치 탑; 플레이트 커버 |
| 스웜 미디어 설정 / 건조 시간 | 30 분 | 30 분 | 박 (20 -24 시간) | 박 (20 -24 시간) |
| 군집 분석 배양 온도는 | 30 또는 37 ° C | 30 ° C | 37 ° C | 30 ° C |
| 시간 경과 이미징을위한 배양 | 적어도 4 시간 동안 30 ° C | 적어도 4 시간 동안 30 ° C | 2 시간 동안 37 ° C | 12 시간 동안 RT |
| 시간 경과 포착 길이 | 24 시간 | 24 시간 | 10 시간 | 66 시간 |
| 시간 경과 설정 | 일 프레임 / 10 분 | 1 프레임 / 10 분 | 1 프레임 / 6 분 | 1 프레임 / 10 분 |
| 는 고압 증기 멸균 후 추가되었습니다. | ||||
도표 1 :. 표면 운동성 분석 준비에 대한 사양은 표면을 포함P.에 대한 운동성 분석 준비 사양 녹농균, B. 서브 틸리 스, 그리고 M. 산토스.
| 신호 | 녹색 형광 | 레드 형광 I | 레드 형광 II | 발광 |
| 단백질 또는 염료 | 녹색 형광 단백질 (GFP) | mCherry 단백질 또는 나일 레드 rhamnolipid 얼룩 | SYTO® (64) | 럭스 오페론에서 루시 페라 제 |
| 여기 파장 (㎚) | 480 ± 10 | 540 ± 10 | 590 ± 10 | 떨어져서 |
| 발광 파장 (㎚) | 535 ± 17.5 | 600 ± 17.5 | 670 ± 17.5 | 어떤 필터가 없습니다 |
| 노출 시간 (초) | (30) | (60) | (60) | (240) |
| F- 스톱 | 4.0 | 4.0 | 2.5 | 1.1 |
| FOV (mm) | (190) | (190) | (140) | (120) |
| 초점면 (mm) | 27.5 | 27.5 | 12.2 | 4 |
| 비닝 (화소) | 없음 | 2 × 2 | 없음 | 8 × 8 |
표 2 : 이미징 사양 적색 및 녹색 형광 브루 커 촬상 스테이션 사양 및 세균 성장 표면의 발광 촬상..
토론
떼 분석은 습도, 영양분 등의 환경 요인에 매우 민감한으로 검사실에서 재현 득시글 거리는 달성하는 것은 어려울 수 있습니다. 표면 운동성 분석 플레이트의 가장 중요한 측면은 한천 표면에 수분이다. 이전 접종에, 떼 미디어 운동 5 진을 치고 억제하기로 표면 액체에 걸쳐 수영에서 박테리아 세포를 방지하기 위해 충분히 건조하지만, 그렇게 건조하지해야합니다. 배양은 충분히 습한 환경에서 이루어져야 : 너무 많은 수분이 인공 또는 인공적 표면 확산으로 이어질 수있는 반면 너무 적은 수분, 배양 동안 분석 건조 아웃이 발생할 수 있습니다. 습도 제어 인큐베이터 손에 있지 않으면, 인큐베이터 및 실험실 습도가 크게 달라질 수 있습니다. 따라서, 인큐베이터 내에서 추가로 물이 저수지, 가습기 또는 제습기는 relat을 유지하면서 건조 또는 과도한 수분의 축적을 통해 방지해야 할 수도 있습니다80 % 근처 필자 습도. 계절 습도 변화가 중요한 경우이 이상적인 습도를 유지하는 것은 어려운 증명할 수 있습니다. 이 경우, 메뚜기 분석 프로토콜은 습도의 계절 변화를 설명하기 위해 일부 조정이 필요하다. 우리는 떼 미디어 건조 시간을 수정하면 계절의 습도 변화를 조절하는 가장 간단한 방법입니다 것으로 나타났습니다. 일정한 습도 모니터링, 내부 및 인큐베이터의 외부 좋습니다. 또한,이 연구는 이러한 분석의 재현성에 영향을 미칠 수 있습니다 자신의 악기, 인큐베이터 등 저울, 온도, 부피 등의 사소한 오류 또는 미디어 구성 요소의 양을 교정하고 확인하는 것이 좋습니다.
또한, 분석에 사용 된 플레이트의 종류와 크기가 플레이트 습기에 영향을 주며, 따라서 집단 수 있음을 유의해야한다. 밀폐 판은 과도한 습기, 이렇게 격려 수영 운동을 배출하지 않습니다. 반면, 개방에 직면 판은 너무 많은 수분을 탈출 할 수 있습니다. 페트리 접시이 액체가 구축 방지하기 위해 충분한 여분의 수분을 배출합니다 때문에 이상적인 환경을 제공하지만, 건조에서 매체를 방지하기 위해 충분한 수분을 유지합니다. 이 방법은 고품질의 이미징을 허용 표면 운동성 분석 프로토콜 세부. 한천 미디어 7.5 ml로 가득 이미징 60mm 직경 요리에 대한 명확한 한천을 유지합니다. 자세한 영상이 필요하지 않은 경우, 20 ml의 최대 볼륨은 또한 재생 가능한 결과를 제공 할 수 있습니다.
집단 운동은 한천 농도의 다양한에 달성 할 수 있지만, 득시글 거리는 필요한 한천의 최적 범위는 종에 따라 달라집니다. 총체적으로,보다 높은 농도의 아가 운동성 치고 억제하고, 결과적으로 필요한 시간은 화상 - 준비 떼가 증가를 생성한다. P.을 그러나 우리는 최적의 득시글 거리는 훨씬 좁은 범위 (0.4 %)에서 발생하는 것을 발견 % 1 0.4-0.7 사이에 루기 노사는 일반적으로 한천 농도에 메뚜기. 같은 B와 기타, 서브 틸리와 S. 장의1.5 % 한천 (10)에서 0.6 % 한천에서 떼 및 장염 비브리오. 필요한 농도는 한천 배지의 종류 및 브랜드에 의해 결정된다. 높은 순도 한천 노블 아가처럼 강하게 P.에 치고 강화 13, 14 한천 과립을 통해 녹농균 및이 바람직하다. 그러나, 한천의 이러한 정제 버전은 오토 클레이브 멸균주기 동안 캐러멜 화에 더 많은 경향이있다; 악기에 따라 짧아 / 변성 살균 시퀀스 노블 한천을 사용 떼 매체를 제조해야 할 수 (가능한 연장 된 열 노출을 방지 배기 사이클을 변경하는).
미디어 조성물은 또한 관찰 떼 표현형 3의 역할을한다. P.을 aeruginosa에 진을 치고 운동 연구는 일반적으로 최소 영양 배지를 사용하여 수행됩니다. 우리는 FAB 선호하는 매체 4,8 (자료 표),하지만 같은 M9, LB, 또는 이러한 일반적인 미디어에 약간의 차이와 같은 다른 미디어,성공적으로 9,15,16 사용되어왔다. 덩굴 형성이 가장 탄소원 및 카사 미노산 (CAA)로서 글루코오스가 보충 된 최소 배지 FAB에 달성되지만, 추가로, 질소 공급원 (즉, (NH 4) 2 SO 4) 6,13-없이. 덩굴 형성 또는 형태학 연구의 주요 초점 아니라면, FAB 최소 배지 (원료 테이블; 표 1) 특정 탄소 소스 및 / 또는 추가 영양소 효과를 상세하게 조사 될 수 있도록 CAA없는 권장된다. 같은 B와 다른 종, 서브 틸리가 (여기에 제시), LB, 입자가 굵은 한천에 진을 치고있는 다양한 swarmers입니다. 이 종은 전체 떼를 개발하는 만 ~ 10 시간을 필요로하는, 쉽게 떼. 이 빠른 집단 비율은 잠재적으로 어려운 떼의 진행에 따라 만들지 만 우리의 프로토콜은 매우 가능 추적 등 수 있습니다. 떼 시간 경과 이미징을 수행 할 수있는 능력은 substan을 제공합니다은 최초는 특히 열렬한 swarmers에서 떼 데이터 수집에 용이.
우리는 실행 및 박테리아 표면 운동 연구의 재현성을 향상하기위한 강력하고 포괄적 인 두 단계 프로토콜과 가이드 라인을 소개하고 주로 편모 매개 득시글 거리는을 검토하는 것이 중요 측면을 강조했다. 이 떼 분석 프로토콜 내에서 연구 그룹 사이에 큰 일관성과 재현성을 제공하기 위해 미디어 조성과 표면 운동 판의 처리의 중요한 측면을 자세히 설명합니다. 이는 다른 조사 연구 중의 비교에 기초하여 향상된다. 또한, 제시된 방법과 프로토콜 등의 요소가 자신의 작품과 예를 들어, 한천의 작은 변화가 미치는 영향을 4,5 진을 치고 (가능한 솔루션을 제공에 영향을 미칠 것을 알고 연구원함으로써 환경 변화에 득시글 거리는 표면 운동에 대한 연구가 덜 민감하기 위해 수단을 제공 ). 또한, 프로토콜에 제공이전 정량화 하였다 박테리아 성장 표면의 많은 특성 측정하는 기회를 제공 득시글의 거시적 인 측면을 정량화.
우리는이 프로토콜의 개발에 모든 표면 운동성 박테리아를 조사하지 않았다. 이와 같이,이 프로토콜 수정이 여기에 제시되지 종에 요구 될 것으로 예상된다. 이 프로토콜의 효율은 사용되는 장비 및 재료의 고유 한 한계에 의해 제한됩니다. 온도 제어 기기 기능 없기 때문에 예를 들면, 온도 관련 연구는 아직은 브루 촬상 스테이션 불가능하다. 또한, (rhamnolipids 스테인 같은 나일 레드 등) 염료의 사용은 운동 및 농도 한계 8을 가질 수있다. 이 기술은 강하게 처리 및 디지털 이미지의 분석에 의존한다; 데이터 분석의 개선 자동화 (예컨대, 추가적인 매크로 ImageJ에 스크립트의 기능을 이용하여) 분석에 필요한 시간을 감소시킬그리고 데이터의 유용성을 확장. 마지막으로 촬상 프로토콜의 견고성으로 인해, 미래의 애플리케이션 환경 및 병원성 박테리아 집락 표면에 더 관련이 적은 균일 한 성장 표면을 조사하기 위해이 기술을 확장하는 것을 목표로한다.
공개
이 기사에 대한 출판 비용은 부분적으로 공사 Bruker 후원했다.
감사의 말
(, MA와 JDS에 R01GM100470과 1R01GM095959-01A1)와 NIH 부여 # UL1 TR000006에 의해 부분적으로 자금을 지원 인디애나 임상과 번역 상 과학 연구소에서 핵심 시설 부여 (,이 작업에 대한 일부 지원은 건강의 국가 연구소에 의해 제공되었다에 JDS).
자료
| Name | Company | Catalog Number | Comments |
| Reagentsa | |||
| FAB Minimal Media: | Prepare every ~4 weeks. Top to 1 L with nanopure H2O. | ||
| (NH4)2SO4 | Sigma | A4418 | 2 g. Not used in P. aeruginosa tendril formation studies. |
| Na2HPO4 x 7H2O | Sigma-Aldrich | S9390 | 9 g |
| KH2PO4 | Sigma | P5655 | 3 g |
| NaCl | BDH | BDH8014 | 3 g |
| MgCl2 x 6H2O solution (198 g/L) | Fisher Scientific | M33 | 1 ml |
| CaCl2 x 2H2O solution (14 g/L) | Fisher Scientific | C79 | 1 ml |
| Trace metal solution (see below) | n/a | n/a | 1 ml |
| Trace Metal Solution: | Top to 1 L with nanopure H2O. Maintain in a glass bottle, stirring and covered with foil. | ||
| CaSO4 x 2H2O | Sigma-Aldrich | 255548 | 200 mg |
| MnSO4 x H2O | Sigma-Aldrich | M7634 | 20 mg |
| CuSO4 x 5H2O | Fisher Scientific | C493 | 20 mg |
| ZnSO4 x 7H2O | Sigma-Aldrich | Z4750 | 20 mg |
| CoSO4 x 7H2O | Sigma-Aldrich | C6768 | 10 mg |
| NaMoO4 x 2H2O | Sigma | S6646 | 10 mg |
| H3BO3 | Fisher Scientific | A74 | 5 mg |
| FeSO4 x 7H2O | Sigma-Aldrich | F7002 | 200 mg |
| CTT Media: | Prepare as needed. Top to 100 ml with nanopure H2O. | ||
| Tris-HCl, 1 M solution (adjust to pH 8.0) | Amresco | 0234 | 1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 8.0 and filter sterilize (0.2 μm pore). |
| K2HPO4, 1 M solution (adjust to pH 7.6) | Sigma-Aldrich | P3786 | 0.1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 7.6 and filter sterilize (0.2 μm pore). |
| MgSO4 solution | Fisher Scientific | M65 | 0.8 ml. Prepare a 1 M stock solution in nano pure H2O. Filter sterilize (0.2 μm pore). |
| Casitone | BD Diagnostics | 225930 | 1 g |
| Additional Reagents: | |||
| LB Broth, Lennox | BD Diagnostics | 240230 | 2% (wt/vol) |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | 30 mM for overnight broth cultures; 12 mM for swarm media. Prepare a 1.2 M filter sterilized stock solution in nano pure H2O. Add to media after autoclaving. |
| Casamino acids (CAA) | Amresco | J851 | 0.10% (wt/vol). Recommended for P. aeruginosa tendril formation studies. Add to media prior to autoclaving. |
| Agar, Noble | Sigma-Aldrich | A5431 | 0.45% (wt/vol). Preferred Noble agar for P. aeruginosa surface motility studies. Add to media prior to autoclaving. |
| Agar, Noble | Affymetrix | 10907 | 1.50% (wt/vol). Used in M. xanthus surface motility studies. Not recommended for P. aeruginosa motility studies. Add to media prior to autoclaving. |
| Agar, Granulated | Fisher Scientific | BP1423 | 0.60% (wt/vol) |
| Higgins Waterproof Black India Ink | Higgins | HIG44201 | 0.50% (vol/vol). Mix ink with inoculum to test swarm media surface moisture. |
| SYTO® 64 Red Fluorescent Nucleic Acid Stain | Invitrogen | S-11346 | Use 4 μl (for P. aeruginosa) or 8 μl (for M. xanthus) of SYTO® 64 per 100 ml of molten agar (added after autoclaving). |
| Relevant Materials and Equipment | |||
| Petri dish, sterile, 150 mm x 15 mm (Dia. x H) | VWR | 25384-326 | |
| Petri dish, sterile, 100 mm x 15 mm (Dia. x H) | VWR | 25384-342 | |
| Petri dish, sterile, 60 mm x 15 mm (Dia. x H) | VWR | 25384-092 | |
| In-Vivo Xtream | Bruker | Use for the macroscopic imaging of surface motility studies. http://www.bruker.com/products/preclinical-imaging/opticalx-ray-imaging/in-vivo-xtreme/overview.html | |
| Bruker MI software | Bruker | http://www.bruker.com/fileadmin/user_upload/8-PDF-Docs/PreclinicalImaging/Brochures/MI-software-brochure.pdf | |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| aSee MSDS of reagents for handeling and disposal information. | |||
참고문헌
- Kearns, D. B. A field guide to bacterial swarming motility. Nature Reviews: Microbiology. 8 (9), 634-644 (2010).
- Burall, L. S., et al. et al.Proteus mirabilis. genes that contribute to pathogenesis of urinary tract infection: Identification of 25 signature-tagged mutants attenuated at least 100-fold. Infection and Immunity. 72 (5), 2922-2938 (2004).
- Shrout, J. D., et al. The impact of quorum sensing and swarming motility on Pseudomonas aeruginosa. biofilm formation is nutritionally conditional. Mol Microbiol. 62 (5), 1264-1277 (2006).
- Kamatkar, N. G., Shrout, J. D. Surface hardness impairment of quorum sensing and swarming for Pseudomonas aeruginosa. PLoS One. 6 (6), e20888 (2011).
- Tremblay, J., Déziel, E. Improving the reproducibility of Pseudomonas aeruginosa. swarming motility assays. Journal of Basic Microbiology. 48 (6), 509-515 (2008).
- Caiazza, N. C., Shanks, R. M., O'Toole, G. A. Rhamnolipids modulate swarming motility patterns of Pseudomonas aeruginosa. Journal of Bacteriology. 187 (21), 7351-7361 (2005).
- Du, H., et al. High density waves of the bacterium Pseudomonas aeruginosa. in propagating swarms result in efficient colonization of surfaces. Biophysical Journal. 103 (3), 601-609 (2012).
- Morris, J. D., et al. Imaging and analysis of Pseudomonas aeruginosa. swarming and rhamnolipid production. Appl Environ Microbiol. 77 (23), 8310-8317 (2011).
- Tremblay, J., Richardson, A. P., Lépine, F., Déziel, E. Self-produced extracellular stimuli modulate the Pseudomonas aeruginosa. swarming motility behaviour. Environmental Microbiology. 9 (10), 2622-2630 (2007).
- Partridge, J. D., Harshey, R. M. Swarming: flexible roaming plans. J Bacteriol. 195 (5), 909-918 (2013).
- Patrick, J. E., Kearns, D. B. Laboratory strains of Bacillus subtilis .do not exhibit swarming motility. Journal of Bacteriology. 191 (22), 7129-7133 (2009).
- . . Molecular Imaging. , (2014).
- Harshey, R. M., Matsuyama, T. Dimorphic transition in Escherichia coli. and Salmonella typhimurium.: surface-induced differentiation into hyperflagellate swarmer cells. Proceedings of the National Academy of Sciences, USA. 91 (18), 8631-8635 (1994).
- Rashid, M. H., Kornberg, A. Inorganic polyphosphate is needed for swimming, swarming, and twitching motilities of Pseudomonas aeruginosa. Proc Nat Acad Sci U.S.A.. 97 (9), 4885-4890 (2000).
- Caiazza, N. C., Merritt, J. H., Brothers, K. M., O'Toole, G. A. Inverse regulation of biofilm formation and swarming motility by Pseudomonas aeruginosa. PA14. Journal of Bacteriology. 189 (9), 3603-3612 (2007).
- Kuchma, S. L., et al. Cyclic-di-GMP-mediated repression of swarming motility by Pseudomonas aeruginosa.: the pilY1. gene and its impact on surface-associated behaviors. J Bacteriol. 192 (12), 2950-2964 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유