Method Article
Erfassen von Gewebereparatur in Zebrafisch-Larven mit Zeitrafferhellstereomikroskopie
In diesem Artikel
Zusammenfassung
We present a protocol for capturing the dynamics of zebrafish larval tail fin regeneration on a whole-tissue scale using brightfield-based stereomicroscopy. This technique enables capturing the regeneration dynamics with single cell resolution. This methodology can be adapted to any stereomicroscope equipped with a CCD camera and time-lapse software.
Zusammenfassung
The zebrafish larval tail fin is ideal for studying tissue regeneration due to the simple architecture of the larval fin-fold, which comprises of two layers of skin that enclose undifferentiated mesenchyme, and because the larval tail fin regenerates rapidly within 2-3 days. Using this system, we demonstrate a method for capturing the repair dynamics of the amputated tail fin with time-lapse video brightfield stereomicroscopy. We demonstrate that fin amputation triggers a contraction of the amputation wound and extrusion of cells around the wound margin, leading to their subsequent clearance. Fin regeneration proceeds from proximal to distal direction after a short delay. In addition, developmental growth of the larva can be observed during all stages. The presented method provides an opportunity for observing and analyzing whole tissue-scale behaviors such as fin development and growth in a simple microscope setting, which is easily adaptable to any stereomicroscope with time-lapse capabilities.
Einleitung
The ability of an organism to orchestrate tissue repair processes after injury is crucial for its survival 1. While all animals have the capacity to heal their wounds, the extent to which tissues regenerate differs greatly among species. Vertebrate species such as zebrafish, salamanders and frog tadpoles have the remarkable ability to regenerate lost tissues, including their appendages, portions of their eyes, heart, and central nervous system 2-4. Mammalian species, such as the African spiny mouse and rabbits, are capable of regenerating holes in their pinnae 5-7, and humans and mice regenerate portions of their liver as well as their digit tips during fetal and juvenile stages 8-12. Although it is not well understood yet why and how certain species regenerate tissues more effectively than others, the presence of similar genetic pathways suggests that these mechanisms may lie dormant in species without great regeneration potential 13,14. Thus elucidating tissue repair and regeneration mechanisms in species with satisfactory regeneration outcomes will benefit regeneration in humans.
We have chosen the larval zebrafish tail fin as a paradigm to demonstrate its regeneration with time-lapse brightfield stereomicroscopy. The zebrafish larval tail fin is anatomically simple as compared to the more complex adult structures, consisting of a two-layered, infolded epithelium with somatosensory axons innervating the skin that surrounds medially located mesenchymal cells 15. Despite the anatomical differences, larval tail fin regeneration is somewhat comparable to adult fin regeneration in terms of the molecular signatures and the outgrowth responses 16,17. As compared to the adult fin, imaging larval tail fin regeneration has however several advantages: 1) larval fin regeneration is completed within just 2-3 days 16, 2) larvae can be mounted in low-melt agarose, and 3) larvae do not require feeding until ~ 5 days post fertilization (dpf) due to the presence of the yolk sac. This makes zebrafish larvae ideal for observing tissue repair dynamics in vivo.
The presented method enables the capture of detailed dynamics underlying the early processes of fin regeneration. Many studies have utilized fluorescence-based confocal microscopy to study cellular and subcellular biological processes in embryonic and larval zebrafish. Sophisticated confocal imaging setups are however often not accessible to everyone and highly expensive as compared to other imaging techniques. In contrast, the presented methodology utilizes a Discovery V12 stereomicroscope equipped with Axiovision software and a time-lapse module, thus providing a more affordable alternative to expensive imaging equipment to examine tissue behaviors. We demonstrate that this method can be utilized for imaging tissue regeneration with high temporal resolution at a minimal cost. The implications for this method could extend beyond basic biology to advance mammalian regeneration studies using organ cultures, for therapeutic development through pharmacological and genetic screens, and it can serve as a teaching tool in a classroom setting.
Protokoll
Zebrafisch (Perlmutt-Stamm) wurden nach etablierten Protokollen gezüchtet und aufgewachsen. Alle Anstrengungen wurden unternommen, um das Leiden zu minimieren, unter Verwendung von 0,4 mM Tricaine für Anästhesie und 1 mM Tricaine um Sterbehilfe. Zebrafisch-Embryonen und Larven wurden in strikter Übereinstimmung mit der guten Tierpraxis behandelt, als durch den entsprechenden Ausschuss (MDI Biological Laboratory Tierkern IACUC Nummer 13-20) zugelassen. Diese Studie wurde von der National Human Genome Research Institute Animal Care und Verwenden Committee, MDIBL Institutional Assurance # A-3562-01 unter Protokoll # 14 bis 09 zugelassen.
Hinweis: Der Imaging-Verfahren, das fin Regeneration im Zebrafisch-Larven werden in den folgenden Schritten zusammengefasst erfasst:
1. Anhebung der Zebrafisch auf Larvenstadien
- Sammeln Sie die Eier und legen etwa 50 Eier in eine 100 x 25 mm Petrischale mit 0,03% Instant Ocean Salz in VE-Wasser mit 0,00004% Methylenblau ergänzt. Inkubieren O / N in einem 28,5 ° C Inkubator.
- Am nächsten Morgen nehmen Sie die toten Embryonen mit einer Glaspipette und spülen Sie die Eier in ein Sieb mit 0,03% Instant Ocean Salz in VE-Wasser (als Embryo Medium).
Anmerkung: Medium wie Ringers 18. Hanks 18 E2 19 E3 20 und Danieau 21. Mai vorzuziehen. - sup> Add frischen Embryo Medium in die Schale. Bei der Verwendung von pigmentierten Stämme, wahlweise mit 0,2 mM 1-Phenyl-2-thioharnstoff (PTU), wie PTU wird Melanogenese und somit Pigmentierung der Larven zu verhindern. Lassen Sie die Embryonen weiter im Brutschrank bis 2 Tage nach der Befruchtung oder beliebigen anderen Larvenstadium entwickeln.
2. Herstellung der Abbildungskammer
- Methode 1: Imaging Kammern aus PVC oder Teflon Rohr (Bild 1)
Hinweis: Diese Methode ist ähnlich wie Concha und Adams (1998) 22.- Erwerben Trinkwasser hochwertigem Kunststoff oder Teflonschlauch aus dem Baumarkt mit 25 mm Außen einda 20 mm Innendurchmesser. Schneiden Sie den Schlauch an Ringen von etwa 10 mm Dicke mit einer ebenen Fläche auf jeder Seite zu machen. Verwenden> 200 Schleifpapier, um die Kanten zu glätten.
- Reinigen Sie die Ringe mit warmem Wasser und 70% Ethanol und lassen Sie sie an der Luft trocknen.
- Mit einer Pipettenspitze, gelten Silikonfett auf die Hälfte eines Ringes und befestigen Sie den Ring zu einem 75 mm x 25 mm Deckglas. Alternativ können Sie ein 3-ml-Spritze mit Silikonfett anstelle einer Pipettenspitze gefüllt.
Hinweis: Da es schwierig ist, das Silikonfett in die 3 ml Spritze einzufügen, fügen Silikonfett auf eine 30 ml Spritze ersten und verwenden diese zum Füllen der 3-ml-Spritze.
- Methode 2: Herstellung einer Petrischale als Abbildungskammer.
- Erwerben Sie 35 oder 60 mm Durchmesser Petrischalen mit einem Deckglas mit dem Deckel (Abbildung 2A) befestigt. Alternativ kann, wie in Figur 3 der Distel & Köster (2007) 23 gezeigt, zu bohren eine Öffnung klein genug, um halt ein Deckglas in den Deckel eine kleine Petrischale und anzuwenden Silikonfett an der Außenseite mit einer 3 ml Spritze. Mit einem sauberen Pipettenspitze, sorgfältig befestigen einen runden oder quadratischen Deckglas mit der gewünschten Dicke auf der Außenseite (2B).
- Um sicherzustellen, dass die Agarose, die für die Montage Aufenthalte während des Sicherungsvorgangs fest angebracht verwendet, schließen Sie ein feines Kunststoffgitter innerhalb des Rings. Zuerst schneiden Sie die Maschen des Fenster-Bildschirm aus dem Baumarkt erhalten, in die Größe des Innenringdurchmesser mit einer feinen Schere mit einem Winkel gemacht. Dann schneiden Sie ein kleines Rechteck> doppelt so groß wie der Larve in die Mitte des Netzes (Bild 1, 2).
- Anwenden vier kleine Punkte aus ungiftigen Silikonfett auf die Schnittstelle zwischen dem Deckglas und dem Kammerring (1A).
- Pinzette benutzen, um das Netz fest an der Unterseite des Deckglas zu befestigen.
3. Montage und Imaging der Pre-injfiguriert Larve (Dieser Schritt ist optional)
Hinweis: Dieser Schritt ist für Vergleiche zwischen den amputiert und regeneriert Rippenlänge, wie die Amputation Flugzeug nach fin Regeneration nicht in Zebrafisch-Larven zu erkennen.
- Bereiten Sie eine 0,5 bis 1,2% niedrigschmelzende Agarose-Lösung in Embryo Medium zur Immobilisierung der Probe.
- Erhitzen Sie die Agarose in der Mikrowelle und dann die Flüssigkeit Agarose in 1,5-ml-Röhrchen, die auf 42 ° C vorgewärmt werden im Thermoblock.
- Das heiße Agarose abkühlen auf 42 ° C, die über mehrere Wochen bei dieser Temperatur gehalten werden kann. Versuchen zu vermeiden Pipettieren der Larven in Agarose über 42 ° C, da dies nachteilig für die Tiere.
- Anesthetize mehreren Larven unter Verwendung von 10 ml 0,4 mM Tricaine (pH 7) in Embryomedium in einem 60 mm Durchmesser Petrischale. Bereiten Sie die Tricaine nach den Zebrafisch Buch Rezepte 18.
- Alternativ können Sie auch 10 ml einer 1: 1000-Verdünnung von 99% 2-Phenoxyethanol in einer 60 mm Durchmesser Petrischale. Poke die Larven mit einem verschlossenen Microloader Pipettenspitze, um ihre Anschlagdynamik, bevor Sie fortfahren zu bewerten. Verwenden Sie nur nicht mehr reagiert Larven.
- Übertragen Sie eine Larve in das 42 ° C Agarose-Lösung mit einer Glaspasteurpipette. Überschüssige Flüssigkeit nicht zu übertragen in die Agarose, da sonst der Agarose wird zu verdünnen und nicht erstarrt.
- Entsorgen Sie die Restflüssigkeit aus der Pipetten und übertragen Sie die Larve mit einem Tropfen Agarose in eine kleine Petrischale (35 oder 60 mm Durchmesser). Positionieren Sie die Larve auf die Seite für die Bildgebung der Schwanzflosse.
- Ermöglichen die Agarose verfestigt. Beurteilen Sie die Agarose mit einer Kunststoffpipettenspitze; die Spitze wird in die Agarose einzutauchen, wenn es zu flüssig ist. Sobald die Agarose verfestigt hat, wird eine kleine Einbuchtung bei Berührung mit einer Pipettenspitze sichtbar. Nach dem Erstarren hinzufügen Tricaine Lösung und fahren Sie mit dem Stereomikroskop, das später für Zeitraffer-Bildgebung verwendet wird.
Anmerkung: Dieser Schritt kann auch, indem Sie den narkotisierten Larve auf einer Petrischale mit 1,5% Agarose in Embryo Medium beschichtet durchgeführt werden. - Verwenden Sie ein Stereomikroskop mit Zeitraffer-Software. Wählen Sie eine geeignete objektive und Vergrößerung, die später für Zeitraffer-Bildgebung verwendet wird. Hier verwenden Sie ein 3,5 x 16 mm Arbeitsabstand Objektivlinse auf einem Stereomikroskop. Je nach Wunsch nutzen alternative Mikroskope und Objektive aber wählen Sie eine geeignete Vergrößerung um mögliche xy-Drift und das Wachstum der Flosse während des Sicherungsvorgangs zu berücksichtigen.
- Wählen Sie die Kamera Erkennungsmodus am Mikroskop.
- In der Software, wählen Sie die "Live" Modus, um die Larve auf dem Bildschirm anzuzeigen.
- Öffnen Sie das Fenster "Eigenschaften", um die Helligkeit automatisch zu erkennen.
- Manuelle Einstellung der Kontrast am Mikroskop Durchleuchtung Basis.
- Bewegen Sie die Larve aus dem Sichtfeld und wählen Sie die Shading-Korrektur-Funktion, um Hintergrund nicht zu minimierenise.
- Positionieren Sie die Larve wieder in das Sichtfeld und einen Schnappschuss. Speichern Sie das Bild.
- Entfernen Sie die Agarose aus der Larve von ersten Kratzen der Agarose aus dem Kopf. Auf diese Weise kann die Larve aus der Agarose durch den Kopf leichtes Ziehen vom restlichen Agarose mit einem verschlossenen Microloader Pipettenspitze oder ein Insekt Stift geschoben werden.
- Mit einem Glas Pasteur-Pipette übertragen die Larve an die frische Tricaine Lösung.
4. Amputation Assay
- Bereiten Sie eine 1,5% igen Lösung mit Embryo Medium und gießen Sie eine dünne Schicht in eine Petrischale. Lassen Sie die Agarose fest werden.
- Unter einem Stereomikroskop, legen Sie die Larve seitwärts auf die verfestigte Agarose und Amputation der Schwanzflosse mit einer 23 G Injektionsnadel mit leichtem Druck (3A).
5. Montage der Larve für Zeitraffer-Imaging
- Gehen Sie wie in den Schritten 3.1 - 3.5 (3B).
- Übertragen Sie einen Tropfen von 0,5 bis 1,2% flüssige Agarose bei 42 ° C, die die Larven in die Abbildungskammerring (Schritt 2.1), richten Sie die Larve und lassen Sie die Agarose fest werden. Füllen Sie den Ring mit Tricaine Lösung. Alternativ, wenn die Petrischale Kammer (Schritt 2.2) verwendet wird, montieren Sie die Larve auf den Deckel Deckglas und füllen Sie den Deckel mit Tricaine Lösung.
- Um eine einwandfreie Wundheilung oder Geweberegeneration auftreten lassen, vorsichtig abkratzen Agarose umgibt das distale Schwanzflosse mit einem bedeckten Microloader Pipettenspitze oder ein Insekt Stift. Versuchen Sie nicht, die Flosse wiederholt (3C) verletzen.
- Dekantiert man die Tricaine Lösung, die die entfernt Agarose und füllen Sie den Kammerring mit frischem Tricaine Lösung.
- Bewerben Silikonfett auf die Oberseite der Kammer Ring und fügen Sie eine 75 mm x 25 mm Glasplatte. Versuchen, um Lufteinschlüsse in der Kammer zu vermeiden, wie sie mit Hellabbildungs stören und trocknet die Larve im Laufe der Zeit.
- Bei Verwendung einer Petrischaleein Abbildungskammer, gelten Silikonfett auf den oberen Rand der unteren Kammer und die untere Kammer mit Tricaine Lösung zu füllen. Dekantieren Sie vorsichtig die Tricaine Lösung im Deckel und drehen Sie den Deckel über die Larve in die Tricaine Lösung von der unteren Kammer in einem leichten Winkel einzutauchen, um Lufteinschlüsse zu vermeiden. Die Kammer wird durch die Silikonfett abgedichtet werden.
6. Zeitraffer-Imaging
- Setzen Sie sich auf einen beheizten Inkubationskammer wie in 23,24 (Abbildung 4) .Den Inkubationskammer um das Mikroskop und schalten Sie die Hitze beschrieben. Einstellen der Temperatur auf 28 ° C für ca. 10 - 20 min, oder bis die Temperatur stabilisiert hat.
- Öffnen Sie die Vorderseite des beheizten Inkubationskammer und legen Sie die Imaging-Kammer auf das Stativ mit dem Deckglas nach oben in Richtung des Ziels.
- Positionieren Sie den Larvenflosse in einer Weise, dass zwei Drittel des Sichtfeld bleibt unbesetzt. Dies gewährleistet die Erfassung von derWachstum und die Regeneration des Rippenverlauf des Abbildungsverfahrens, ohne die Larven zu repositionieren.
- Stellen Sie die montierten Larve bis 28 ° C für ca. 30 Minuten vor Beginn der Zeitrafferaufnahme auf Veränderungen in Hell Intensität oder Potentialverschiebungen der Agarose zu vermeiden. Alternativ nutzen vorgewärmten Puffer Bildgebung nach kürzerer Stellzeit starten.
- So richten Sie die Zeitrafferaufnahme, öffnen Sie die 6D Mehrdimensionale Bildaufnahme-Fenster in der Software AxioVision und wählen Sie die Option Z-Stapel und Zeitraffer.
- Optional) auf der Registerkarte Z-Stapel und Scheibe-Modus, wählen Sie die Schichtdicke und wählen Sie die Start / Stop-Modus dann.
- Definieren Sie die obere und untere Position des Stapels.
- Auf der Registerkarte Zeitraffer, wählen Sie das Intervall und die Dauer des Films und starten Sie dann den Film durch Drücken der Start-Taste. Wir fanden, dass 30-min-Intervallen ausreichend und dieses Intervall nicht übermäßig Daten zu erzeugen; jedoch shorter Intervalle können verwendet werden.
- Überprüfen Sie die Position und Z-Stapel-Dimensionen in der ersten Stunde, wenn die Larve nicht voreingestellt. Gegebenenfalls ist die Larve wieder nach einem Tag, wie die Larve kann verschoben haben.
- Speichern Sie die Datei am Ende der Zeitrafferaufnahme und fahren Sie mit der Nachbearbeitung und Quantifizierungen mit Bildanalyse-Software zur Verfügung, wie zum Beispiel Imaris 25 oder der Open-Source-Software-Pakete Bild J 26 und 27 Fiji.
7. Datenanalyse
- Die Bestimmung der Rippenlänge.
- Öffnen Sie die Zeitraffer-Film in der Bildbearbeitungssoftware und speichern Sie die Dateien im proprietären Dateiformat, um die Leistungsfähigkeit der Software zu verbessern.
- Wählen Sie das orthogonale Ansicht, einzelne Abschnitte als projiziert Stapel anzuzeigen. Für Driftkorrektur, unter der Fidschi-Menü Plugins, dann Registrierung und "Richtige 3D Drift". Dies wird ein Fidschi-Fenster zu öffnen und führen Sie die Drift-Korrekturen. RichtigDrehdrift im Imaris Spots Funktion. Alternativ installieren Sie die STACKREG und TURBOREG Plugins in Bild J und importieren Sie nach Fidschi. Wählen Sie die gewünschte Transformationsalgorithmus in der STACKREG Plugin.
- Distanzen (zB Wund Durchmesser oder Rippenlänge) zu messen, wählen Sie die Option "Add New Messpunkte" in der oberen linken Symbolleiste.
- Unter "Konfigurieren Liste der sichtbaren Statistik Werte" in der unteren linken Menü wählen Sie die Statistikwerte angezeigt werden.
- In der "Line Mode" auf der Registerkarte Einstellungen die Option "Paare (AB, CD, ...)".
- In 'Etiketten Eigenschaften "wählen Sie" Name "und" Entfernung ", um den Abstand zwischen den Punkten A und B neben der Messlinie angezeigt.
- Wechseln Sie in den Modus "Bearbeiten" und halten Sie die Shift-Taste, um den ersten Punkt am Ende der Chorda aus. Dann nutzen Sie die gleiche Konfiguration, um den zweiten Punkt am distalen fin-Marge aus.
- Unter dem Reiter "Statistik", wählen Sie die Festplatte Taste (Alle exportieren) in der rechten unteren zur Anzeige und Export der Abstand im Bild.
- Wiederholen Sie die Messungen zu ausgewählten Zeiten, indem Sie den Schieberegler unter dem Bild auf der rechten Seite. Anstatt neue Messpunkte können die vorherigen, indem Sie zunächst den Punkt mit der linken Maustaste, und gleichzeitiges Drücken der Shift und die linke Maustaste an die neue Position verschoben werden.
- Alternativ zu der Möglichkeit, Messstellen, nutzen die Scheibe Betrachter zur Entfernungsmessung. In der Scheibe Bild-Modus, blättern Sie zu einer gewünschten Position und klicken Sie auf den ersten und zweiten Position mit der linken Maustaste. Der Abstand wird angezeigt. Mit dieser Option jedoch nicht für den Datenexport zu ermöglichen.
- Bestimmen fin Länge und Fläche in ImageJ.
- Öffnen Sie die Zeitraffer-Film in ImageJ mit einem Plugin, das .zvi Dateiformat erkennt. Alternativ laden in einem QuickTime Datei oder TIFF-Sequenz.
Hinweis: Wenn Sie eine unkomprimierte TIFF-Datei-Format, werden die Bildabmessungen nicht angegeben werden. - Wenn das Öffnen einer anderen Dateiformat ohne Dateiinformationen wählen Sie 'Set-Skala "im Menü" Analysieren ", zuerst die Bildweite und Einheit definieren. In der 'Set-Skala Menü', geben Sie den "Abstand in Pixeln", unter geben Sie den 'Bekannte Abstand "für den Pixelwert (dies kann durch die Messung der Anzahl der Bildpunkte auf einer Skala bar, die dem Bild hinzugefügt hat, bekommen und klicken Sie auf Messen, um das Ergebnis zu erhalten), und die "Längeneinheit" (in der Regel "um"). Dann klicken Sie auf OK.
- Für fin Flächenmessungen wählen Sie die "Freihandauswahl" in der Werkzeugleiste und stellen die Flosse Bereich, indem Sie die linke Maustaste gedrückt, während Zeichnung entlang der Kontur der Flosse. Für fin Längenmessungen, wählen Sie die 'Straight' Zeilenwerkzeug und ziehen Sie eine Linie zwischen den gewünschten Stellen zu seingemessen.
- Klicken Sie auf das "Measure" Option unter "Analysieren", um den Bereich und die Länge der Flosse an. Wiederholen Sie diesen Schritt so oft zu mehreren Zeitpunkten des Films wie nötig.
- Öffnen Sie die Zeitraffer-Film in ImageJ mit einem Plugin, das .zvi Dateiformat erkennt. Alternativ laden in einem QuickTime Datei oder TIFF-Sequenz.
- Mit Statistik-Software können die Daten grafisch dargestellt werden.
Ergebnisse
Das vorgestellte Verfahren eignet sich zur Gewebereparatur Dynamik in Abhängigkeit von Amputations aufzuklären. Der Film zeigt, dass die Amputation des fin zunächst löst eine Tabaksbeutel Effekt, durch Kontraktionen über Aktin-Myosin-Kabel, die in der Gegenwart sind gekennzeichnet fin-fach 28 (Abbildung 5 A, B). Damit einhergehend werden die Zellen aus der Wunde (siehe Film) extrudiert. Die Kontraktion kann somit ein Mittel, um Zellen, die wahrscheinlich dazu bestimmt sind, Zelltod zu vertreiben. Unsere Ergebnisse zeigen weiter, dass die Entwicklungs Wachstum der Larven erfolgt unabhängig von der Regeneration (Film), während Flossenregeneration erst etwa 14 Stunden nach der Amputation zu initiieren, wie Rippenlänge und Fläche über den Zeitverlauf von 36 Stunden nach Amputation (5C gemessen , D). Die gesamte regenerative fin Wachstum nach 1,5 Tage betrug etwa 60% der ursprünglichen Rippenlänge (5E). Zusammengenommen zeigen diese Ergebnisse, dass eine Amputation tr Iggers fin Ziehen, Extrusion von Zellen aus der Wunde und eine zeitlich verzögerte regenerative Antwort. Während extrudierte Zellen wahrscheinlich bestimmt, Zelltod, der Natur dieser Zellen muss noch weiter geklärt werden.

Abbildung 1. Imaging Kammerring Montage
(A) ein Kunststoffring, der an einem Deckglas mit Silikonfett befestigt ist. Ein Kunststoffgitter ist an der Innenseite der Kammer mit vier kleine Punkte Silikonfett befestigt. (B) Die Kammer, die die montierten Larve mit Tricaine Lösung gefüllt und ein Glasobjektträger ist an der Oberseite befestigt. (C) Ein 2 montiert Tage alte Larven (Pfeil) bei höherer Vergrößerung dargestellt, um seine Größe in Bezug auf das Gitter abbilden."_blank"> Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 2. Imaging Kammeranordnung aus Petrischalen hergestellt. (A) ist ein kommerzielles Glas Glasboden Petrischale mit einem Kunststoffnetz auf das Deckglas befestigt. (B) gezeigt, ist ein selbst erstellter Petrischale Kammer mit einem Loch in den Deckel und einem Deckglas von außen mit Silikonfett angebracht gebohrt. Das Netz und Larven im Inneren der Kammer mit Tricaine Lösung angebracht. Um die Kammer abzudichten, ist Silikonfett auf den oberen, äußeren Rand der unteren Kammer und dem oberen Deckel befestigt angewendet. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 3. Schema der Amputation und Montage von einer Larve für die Bildgebung. (A) Für die Amputation, schreiben Sie eine betäubt Larve auf einem Agarose-beschichteten Petrischale und Amputation der Schwanzflosse mit einer Spritzennadel. (B) Für die Montage, übertragen Sie die Larve mit einer Transferpipette in ein 1,5-ml-Röhrchen mit 42 ° C flüssige Agarose gefüllt und einen Tropfen, der die Larve in die Abbildungskammer richten Sie die Fische und decken Agarose mit Embryo Medium das verfestigt. (C) abkratzen Agarose aus der Schwanzflosse mit einem bedeckten Microloader Pipettenspitze oder einem ähnlichen Werkzeug und ersetzen Embryo Medium durch frisches Medium. (D) Bild der Heckflosse unter einem Stereomikroskop. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.

Abbildung 4. Selbst erstellte beheizten Inkubationskammer. (AC) Gezeigt wird ein beheiztes Inkubationskammer aus Karton, Luftpolsterfolie und Klettverschluss gemacht. Eine Kabelkuppel Heizung (ursprünglich für Hühnerei Inkubation entwickelt) ist mit der Kammer mit Aluminiumband angebracht. Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
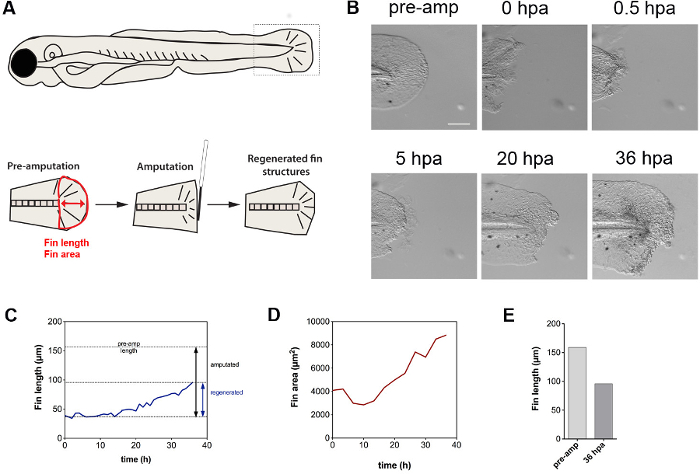
Abbildung 5. Fin Regenerationsdynamik. (A) Schematische Darstellung der verwendeten Schwanzflosse Amputation Assay und Quantifizierungsverfahren, um die Rippenlänge (roter Pfeil) und die Fläche (red Umriss des fin) bestimmen. (B) Schwanzflosse Amputation zunächst löst Kontraktion der Flosse, gefolgt von regegenerativer Gewebe Auswuchs. Die Flosse erfährt auch entwicklungs Wachstum, wie von der Seitengrößenanstieg belegt. (C) gezeigt, ist die Rippenlänge als Funktion der Zeit auf, und ein lineares Wachstum der regenerativen Start bei ~ 14 hpa. (D) Die Quantifizierung der Rippenbereich zeigt ein anfänglich in der Größe, die mit der Kontraktion der Rippe zugeschrieben werden kann abnehmen. Nach ~ 14 Stunden, die Rippengröße steigt mit einer linearen Rate. (E) Vergleich der Flossenlänge vor der Amputation und nach 36 h zeigt, ~ 60% Nachwachsen. Maßstabsbalken: 100 & mgr; m Abkürzungen: Vorverstärker, Pre-Amputation; Stunden nach der Amputation, hpa; regen, Regeneration; Amp, Amputation Bitte klicken Sie hier, um eine größere Version dieses Bild anzuzeigen.
Film . Fin Regeneration über den Zeitverlauf von 36hr. Gezeigt ist eine Schwanzflosse eines 2,5 Tage alte Larven im Verlaufe der Regeneration. Ab 30 Minuten nach der Amputation regenerative Wachstum wird in Intervallen von 30 Minuten auf einem Stereomikroskop mit einem 3.5x Objektiv abgebildet.
Diskussion
Die vorgestellte Methode ermöglicht die Beobachtung der Wundheilung und Geweberegeneration in lebenden Zebrafisch-Larven mit In-vivo-Zeitraffer-Bildgebung auf einem Hellfeld Stereomikroskop mit einem vergleichsweise einfachen Aufbau. Dieses Verfahren erfordert einige wichtige Aspekte, die wir getestet haben, die das Ergebnis optimieren: 1) Niedrige Agarose-Konzentrationen (~ 0.5%) die Wachstumshindernisse des stetig wachsenden Larven Zebrafisch zu minimieren, 2) Die Entfernung der Agarose auf der Flosse ist wichtig, nicht um den Heilungsprozess zu verdunkeln, 3) Einfangen der Agarose in einem Kunststoffnetz behält die Agarose und Tier in einer stabilen Position während des gesamten Verfahrens, und 4) eine geeignete Temperatur-kontrollierte Umgebung, die für die Lebensfähigkeit der Larven ist. Wir haben einen beheizten Inkubationskammer 23,24, die Luftpolsterfolie, die auf Karton geklebt wird verwendet, und eine drahtgebundene Kuppel Heizung, um die Temperatur und Luftzirkulation bei minimalem Schwankungen während der Steuerung angepasstbildgebendes Verfahren. Diese einfache und kostengünstige Kammer hergestellt an Mikroskop passen. Eine ähnliche beheizten Inkubationskammer wurde auch für die Bildgebung Mäuse und Küken Entwicklung 24,29 genutzt.
Es wird empfohlen, vor der Amputation Larven werden für eine vorher Amputation Bild montiert, demontiert eine Amputation, und erneut für Zeitraffer-Bildgebung. Obwohl es möglich ist, diese Schritte in einem einzigen Schritt in der endgültigen Bildraum durchzuführen ist, in unserer Erfahrung haben wir festgestellt, dass Amputation der Schwanzflosse auf einem Deckglas ist nicht optimal, da sie reißt das Gewebe und führt nicht zu einer sauberen Schnitt führen. Die Agarose-Basis Amputation Verfahren unter Verwendung einer Spritzennadel wurde ursprünglich von Kawakami und Kollegen (2004) 16 beschrieben, und ist auch in unserer Erfahrung, ideal, die Amputationen durchzuführen. Somit ist das ziemlich komplizierte Reihe von Schritten, die wir vorgestellt und gerechtfertigt und gewährleistet eine optimale Regeneration Ergebnis.
Wir haben gezeigt, dass larval Zebrafisch auf 2 dpf bis zu 1,5 Tage in Agarose und Tricaine Lösung abgebildet werden. Wir verwendeten pH-optimierte Tricaine (pH 7) mit Instant Ocean Salz, die nicht mit der Gesundheit der Probe stören nicht für das vorgestellte Bild Zeitraum hergestellten Lösung. Wir haben vorher jedoch auch gezeigt, dass die Verwendung von Tricaine in Danieau Medium ermöglicht Zeitraffer-Bildgebung von 2,5 dpf Larven Zebrafisch auf einem konfokalen Mikroskop für mindestens 2 Tage 30. Somit kann eine optimale Pufferbedingungen Larven Gesundheit und die Länge des Abbildungs erstrecken. Alternativ können niedrigere Konzentrationen Tricaine für Anästhesie, oder 2-Phenoxyethanol, die wir festgestellt, auch bei Larven und adulten Stadien für mindestens 60 Stunden toleriert bei 28ºC verwendet werden.
Defekte in fin Regeneration zu vermeiden, entfernen wir die Agarose aus der Schwanzflosse vor der Bildgebung. Unsere Daten zeigen, daß innerhalb von 1,5 Tagen wurde das Flosse bis etwa 60% aufbereitet. Diese Regenerationsrate steht im Einklang mit einer früheren Studie zu definieren 3 Tage pros eine durchschnittliche Zeit für die Schwanzflosse Regeneration im Zebrafisch-Larven bis zu 6 dpf 16. Alternative Methoden zur Agarose könnte jedoch genutzt werden, um den Fisch für die Bildgebung zu montieren. Beispielsweise dünne Plasmagerinnsel 31 oder fluoriertes Ethylenpropylen (FEP) Rohre mit Methylcellulose überzogen und mit sehr niedrigen Agarose-Konzentrationen (0,1%) aufgefüllt wurden für Lichtschnittmikroskopie 32 empfohlen und kann geeignet sein für unsere dargestellt Methode. Jedoch nicht zu empfehlen Methylcellulose und 0,1% Agarose, da sie erfordern, daß die Probe an dem Boden der Kammer aufgrund des Fehlens der Verfestigung dieser Medien montiert ist. Sehr hohe Konzentrationen von Methylcellulose wird zudem erzeugen Luftblasen auf der Basis unserer Erfahrung, und diese können mit dem bildgebenden Verfahren stören. Wenn diese Medien werden mit Hilfe der Bodenkammer bevorzugt wird, ist es wichtig, dass ein geeigneter Arbeitsabstand zwischen der Objektivlinse und der Probe vorhanden ist. Es sollte angemerkt werden, dass mEthylcellulose als Einschlussmittel ist nur für die bis zu 1 Tag empfohlen, da es mit Larven Gesundheit 32 stören.
Montage der Probe im Deckel kann in einer langsamen Gravitationsabwärtsdrift führen. Es wird daher ebenfalls mehrere Abschnitte zu jedem Zeitpunkt, die entweder in einer einzigen Ebene oder nur Bilder, die in der Brennebene sind, können für den Zusammenbau des fertigen Film extrahiert werden projiziert werden können empfohlen. Abbildung der Probe am unteren Kammer könnte eine alternative Methode, um potenzielle Abwärtsdrift zu vermeiden. Plasmagerinnsel könnte nützlich, um eine Drift zu vermeiden, da das Plasma an der äußeren Hüllschicht (EVF, periderm) 31 haften und daher kann die Probe zu stabilisieren. Dies muss jedoch nicht getestet werden, und wie lange Larven Zebrafisch in Plasmagerinnsel aufrechterhalten werden, ohne sich mit Larven Gesundheit oder Rippen Regeneration.
Unser Film wurde unter Verwendung von einzelnen Abschnitten zusammengesetzt (26 um)eines aufgezeichneten z-Stapel, die die volle Dicke der Rippe (~ 10 & mgr; m) und die für potentielle z-Drift des Rippen während des Abbildungsverfahrens berücksichtigt bedeckt. Um 3-D-Daten zu erhalten, ist es auch möglich, z-Stapel in einzelne Bilder zu projizieren. Da dies in Unschärfe des Bildes führen kann Hell Entfaltung wünschen übrig. Software, wie beispielsweise zu entfalten oder Autoquant X3 könnte für diesen Zweck verwendet werden. Alternativ können mathematische Algorithmen (in Tadrous 33 beschrieben) zum Erhalt einer Punktverteilungsfunktion des hohen Signal-zu-Rausch-Verhältnis (SNR) aufgetragen werden. Erzielung eines hohen SNR stellt eine der Haupthürden im Hell Entfaltung. Obwohl dieses Verfahren erfordert einen hohen Kontrast und dünne Probendicke, wäre es für die Bildgebung der Schwanzflosse angebracht sein aufgrund seiner reduzierten Breite.
Ein klarer Vorteil des vorgestellten Abbildungsverfahren ist, dass es schnell anpassungsfähig an jede Stereomikroskop mit einer CCD-Kamera ein ausgestattet istd Zeitraffer-Software und bietet eine kostengünstige Alternative zu teureren konfokale Abbildungssysteme. Während diese Methode verwendet keine Fluoreszenz für die Zellerkennung, kann es für solche Anwendungen durch die Verwendung eines automatisierten Systems zur Jalousiesteuerung und Post-Imaging-Software Entfaltungs 34 erweitert werden. Dies würde Benutzern ermöglichen, weiter zu beobachten Wundheilung und Regenerationsprozesse mit einzelnen Zelle oder subzellulärer Auflösung über längere Zeiträume.
Die optische Klarheit und mit der embryonalen und larvalen Zebrafisch Leichtigkeit gehandhabt werden kann, und die Anpassungsfähigkeit dieser Methode zu Stereomikroskopen ist es für den Unterricht Grundwirbeltierbiologie in einem Klassenzimmer geeignet. Diese Methode kann den Studierenden ein besseres Verständnis für die grundlegende biologische Prozesse die Reparatur von Gewebe und Regeneration zugrunde liegen. Andere biologische Prozesse, die mit einem ähnlichen Verfahren erfasst worden sind, sind Zebrafisch Embryonalentwicklung 23,34 und HerzFunktion (unveröffentlicht). Dieses Verfahren bietet auch die Möglichkeit zur Überwachung der Wundreparatur und -regeneration bei Larven, die genetisch und pharmakologisch manipuliert.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
We thank the MDI Biological Laboratory animal core service facility for zebrafish maintenance. Research reported in this publication was supported by Institutional Development Awards (IDeA) from the National Institute of General Medical Sciences of the National Institutes of Health under grant numbers P20GM104318 (for COBRE) and P20GM103423 (INBRE) and Department of Defense – USAMRAA (W81XWH-BAA-1) grant.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Bullseye Agarose | MidSci | BE-GCA500 | |
| Low-melt agarose | Fisher BioReagents | BP1360-100 | |
| 1-phenyl-2-thiourea | Alfa Aesar | L06690 | |
| Instant Ocean Aquarium Salt | Pet store | ||
| Methylene Blue (0.1% solution) | Sigma | M9140 | |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10505 | |
| 2-Phenoxyethanol | Sigma-Aldrich | 77699 | |
| Petri Dish 35 x 15 mm | BD Falcon | 351008 | |
| Petri Dish 60 x 15 mm | BD Falcon | 351007 | |
| Petri Dish 100 x 25 mm | BD Falcon | 351013 | |
| 5.75 inch boroschillate glass pipets | Fisher | ||
| 35 mm Glass Top Glass Bottom Dish (Glass: 0.085-0.115mm) | MatTek Corporation | D35-20-0-TOP | |
| Superfrost/Plus microscope slides | Fisherbrand | 12-550-15 | |
| Glass coverslips | Electron Microscopy Services | 72191-75 | |
| Glass coverslips | Warner Instruments | CS-18R15 | |
| Phifer Phiferglass Insect Screen Charcoal - 48" | Home Depot | ||
| High vacuum grease | Dow Corning | ||
| Microloader pipette tips 20 µl | Eppendorf | 930001007 | |
| Fine Scissors - Sharply Angled Up | Fine Science Tools | 14037-10 | |
| 3 ml Luer-Lok™ disposable syringe | BD | 309657 | |
| 60 ml Luer-Lok™ disposable syringe | BD | 309653 | |
| 23 G syringe needles | BD | 305145 | |
| Dumont #5 Forceps | Fine Science Tools | 11295-00 | |
| Equipment | |||
| LabDoctor Mini Dry Bath | MidSci | ||
| Discovery.V12 compound microscope | Zeiss | ||
| Plan Apo S 3.5X objective | Zeiss | ||
| AxioCam MRm | Zeiss | ||
| Axiovision software, Release 4.8.2SP1 (12-2011) | Zeiss | ||
Referenzen
- San Miguel-Ruiz, J. E., García-Arrarás, J. E. Common cellular events occur during wound healing and organ regeneration in the sea cucumber Holothuria glaberrima. BMC Dev Biol. 7, 115 (2007).
- Poss, K. D., Keating, M. T., Nechiporuk, A. Tales of regeneration in zebrafish. Dev Dyn. 226, 202-210 (2003).
- Akimenko, M. A., Marí-Beffa, M., Becerra, J., Old Géraudie, J. Old questions, new tools, and some answers to the mystery of fin regeneration. Dev Dyn. 226, 190-201 (2003).
- Slack, J. M. Regeneration research today. Dev Dyn. 226, 162-166 (2003).
- Seifert, A. W., et al. Skin shedding and tissue regeneration in African spiny mice (Acomys). Nature. 489, 561-565 (2012).
- Goss, R. J., Grimes, L. N. Epidermal downgrowths in regenerating rabbit ear holes. J Morphol. 146, 533-542 (1975).
- Williams-Boyce, P. K., Daniel, J. C. Comparison of ear tissue regeneration in mammals. J Anat. 149, 55-63 (1986).
- Allan, C. H., et al. Tissue response and Msx1 expression after human fetal digit tip amputation in vitro. Wound Repair Regen. 14, 398-404 (2006).
- Borgens, R. B. Mice regrow the tips of their foretoes. Science. 217, 747-750 (1982).
- Han, M., Yang, X., Lee, J., Allan, C. H., Muneoka, K. Development and regeneration of the neonatal digit tip in mice. Dev Biol. 315, 125-135 (2008).
- Muneoka, K., Allan, C. H., Yang, X., Lee, J., Han, M. Mammalian regeneration and regenerative medicine. Birth Defects Res C Embryo Today. 84, 265-280 (2008).
- Takeo, M., et al. Wnt activation in nail epithelium couples nail growth to digit regeneration. Nature. 499, 228-232 (2013).
- Akimenko, M. A., Johnson, S. L., Westerfield, M., Ekker, M. Differential induction of four msx homeobox genes during fin development and regeneration in zebrafish. Development. 121, 347-357 (1995).
- Reginelli, A. D., Wang, Y. Q., Sassoon, D., Muneoka, K. Digit tip regeneration correlates with regions of Msx1 (Hox 7) expression in fetal and newborn mice. Development. 121, 1065-1076 (1995).
- Brien, G. S., et al. Coordinate development of skin cells and cutaneous sensory axons in zebrafish. Journal of Comparative Neurology. 520, 816-831 (2012).
- Kawakami, A., Fukazawa, T., Takeda, H. Early fin primordia of zebrafish larvae regenerate by a similar growth control mechanism with adult regeneration. Dev Dyn. 231, 693-699 (2004).
- Yoshinari, N., Ishida, T., Kudo, A., Kawakami, A. Gene expression and functional analysis of zebrafish larval fin fold regeneration. Dev Biol. 325, 71-81 (2009).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Detrich, H. W., Westerfield, M., Zon, L. I. The Zebrafish: Cellular and Developmental Biology, part A. Preface. Methods Cell Biol. 100 (13), (2010).
- Dahm, N. -. V. a. . Zebrafish: A Practical Approach, Issue 975. , 303 (2002).
- Detrich, H., Westerfield, M., Zon, L. . The Zebrafish: 2nd Edition Genetics, Genomics and Informatics. , (2005).
- Concha, M. L., Adams, R. J. Oriented cell divisions and cellular morphogenesis in the zebrafish gastrula and neurula: a time-lapse analysis. Development. 125, 983-994 (1998).
- Distel, M., Köster, R. W. In vivo time-lapse imaging of zebrafish embryonic development. CSH Protoc. 2007, (2007).
- Kulesa, P. M., Kasemeier-Kulesa, J. C. Construction of a Heated Incubation Chamber around a Microscope Stage for Time-Lapse Imaging. CSH Protoc. 2007, (2007).
- . Bitplane. Imaris V 6.1.0 Reference Manual. , (2008).
- Abramoff, M. D., Magalhaes, P. J., Ram, S. J. . Image Processing with ImageJ. , 36-42 (2004).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9, 676-682 (2012).
- Mateus, R., et al. In vivo cell and tissue dynamics underlying zebrafish fin fold regeneration. PLoS One. 7, e51766 (2012).
- Jones, E. A., et al. et al.Dynamic in vivo imaging of postimplantation mammalian embryos using whole embryo culture. Genesis. 34, 228-235 (2002).
- Rieger, S., Senghaas, N., Walch, A., Köster, R. W. Cadherin-2 controls directional chain migration of cerebellar granule neurons. PLoS Biol. 7, e1000240 (2009).
- Langenberg, T., Brand, M., Cooper, M. S. Imaging brain development and organogenesis in zebrafish using immobilized embryonic explants. Dev Dyn. 228, 464-474 (2003).
- Kaufmann, A., Mickoleit, M., Weber, M., Huisken, J. Multilayer mounting enables long-term imaging of zebrafish development in a light sheet microscope. Development. 139, 3242-3247 (2012).
- Tadrous, P. J. A method of PSF generation for 3D brightfield deconvolution. J Microsc. 237, 192-199 (2010).
- Distel, M., Babaryka, A., Köster, R. W. Multicolor in vivo time-lapse imaging at cellular resolution by stereomicroscopy. Dev Dyn. 235, 1100-1106 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten