Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Protokoll zur Messung der thermischen Eigenschaften einer unterkühlten Synthetic Sand-Wasser-Gas-Methanhydrat Probe
In diesem Artikel
Zusammenfassung
We present a protocol for measuring the thermal properties of synthetic hydrate-bearing sediment samples comprising sand, water, methane, and methane hydrate.
Zusammenfassung
Methane hydrates (MHs) are present in large amounts in the ocean floor and permafrost regions. Methane and hydrogen hydrates are being studied as future energy resources and energy storage media. To develop a method for gas production from natural MH-bearing sediments and hydrate-based technologies, it is imperative to understand the thermal properties of gas hydrates.
The thermal properties' measurements of samples comprising sand, water, methane, and MH are difficult because the melting heat of MH may affect the measurements. To solve this problem, we performed thermal properties' measurements at supercooled conditions during MH formation. The measurement protocol, calculation method of the saturation change, and tips for thermal constants' analysis of the sample using transient plane source techniques are described here.
The effect of the formation heat of MH on measurement is very small because the gas hydrate formation rate is very slow. This measurement method can be applied to the thermal properties of the gas hydrate-water-guest gas system, which contains hydrogen, CO2, and ozone hydrates, because the characteristic low formation rate of gas hydrate is not unique to MH. The key point of this method is the low rate of phase transition of the target material. Hence, this method may be applied to other materials having low phase-transition rates.
Einleitung
Gashydrate sind kristalline Verbindungen , die Käfigstrukturen von wasserstoffgebundenen Wassermoleküle umfassen enthält Gastmoleküle in den Käfig 1. Große Mengen an Methanhydrat (MHS) in den Meeresboden und Permafrostregionen sind interessante Zukunftsenergieressourcen , sondern globale Klimabedingungen 2 beeinflussen können.
Im März 2013 führte die Japan Oil, Gas und Metals National Corporation die erste Offshore - Produktionstest der Welt Gas aus natürlichen MH haltigen Sedimenten im östlichen Nankai Trough mit dem "Entspannungsmethode" 3,4 zu extrahieren.
Gashydrate können Gase wie Methan speichern 1 Wasserstoff 5, CO 2 1,6 und Ozon 7. Daher Methan und Wasserstoff Hydrate werden als potentielle Energiespeicher und Transportmedien untersucht. Die CO 2 -Emissionen in die Atmosphäre, CO 2 seques freigegeben zu reduzieren ,tration CO 2 Hydrate in Tiefseesedimenten verwendet haben 6 untersucht worden. Ozon wird zur Zeit in der Wasserreinigung und Lebensmittel Sterilisation verwendet. Studien von Ozon Konservierungstechnologie durchgeführt worden , weil sie chemisch instabil 7 ist. Die Ozonkonzentration in Hydrate ist viel höher als die in mit Ozon angereichertem Wasser oder Eis 7.
Um die Gasproduktion aus natürlichen MH haltigen Sedimenten und Hydrat-basierte Technologien zu entwickeln, ist es zwingend notwendig, um die thermischen Eigenschaften von Gashydraten zu verstehen. Allerdings sind die thermischen Eigenschaften Daten und Modellstudien von Gashydrat haltigen Sedimenten knapp 8.
Die "Entspannungsmethode" kann verwendet werden, MH im Sediment Porenraum zu trennen von der Porendruck unterhalb des Hydratstabilität abnimmt. Bei diesem Verfahren ändern sich die Sedimentporenraum-Komponenten aus dem Wasser und von MH zu Wasser, MH, und Gas. Die thermischen Eigenschaften 'Messungder letztgenannte Bedingung ist schwierig, weil die Schmelzwärme von MH die Messungen beeinflussen können. Um dieses Problem zu lösen, Muraoka et al. Geführt , um die Messung "thermischen Eigenschaften bei unterkühlten Bedingungen während MH Bildung 9.
Mit diesem Video-Protokoll erläutern wir die Messmethode unterkühlten synthetischen Sand-Wasser-Gas-MH Probe.
Abbildung 1 zeigt den Versuchsaufbau für die thermischen Eigenschaften des künstlichen Methanhydrat tragenden Sediments gemessen wird . Der Aufbau ist der gleiche wie in Bezug auf 9 dargestellt ist . Das System umfasst im Wesentlichen einen Hochdruckbehälter, Druck- und Temperaturkontrolle und thermischen Eigenschaften des Messsystems. Der Hochdruckbehälter ist aus zylindrischen rostfreiem Stahl mit einem Innendurchmesser von 140 mm und einer Höhe von 140 mm zusammengesetzt ist; dessen Innenvolumen mit dem Totvolumen entfernt ist 2.110 cm 3, und seine Druckgrenze beträgt 15 MPa. Die transie nt Ebene Quelle (TPS) Technik wird verwendet , 10 um die thermischen Eigenschaften zu messen. Neun TPS Sonden mit Einzelradien 2.001 mm sind im Inneren des Behälters angeordnet. Das Layout der neun Sonden 9 ist in Figur 2 in Bezug auf 9 dargestellt ist . Die TPS-Sonden sind mit den thermischen Eigenschaften 'Analysator mit einem Kabel und schaltet manuell während des Experiments. Die Einzelheiten des TPS - Sensor, Anschlussbild und Einrichtung im Behälter sind in den S1 gezeigt, 2 und 3 der unterstützenden Informationen in Bezug auf 9.
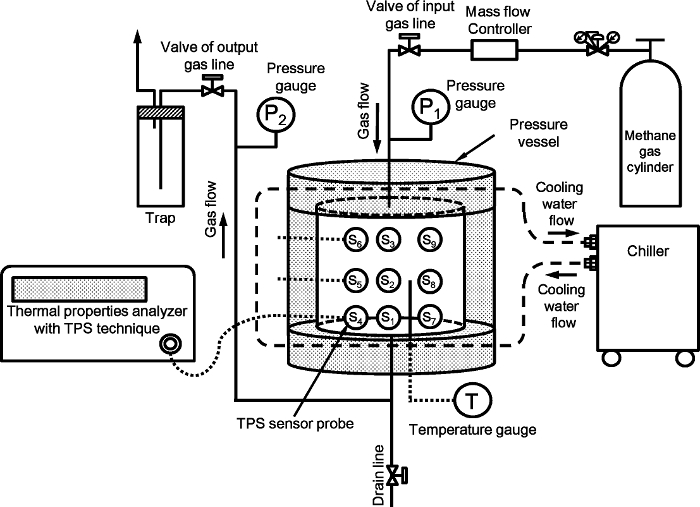
Abb . 1: Der Versuchsaufbau für die thermischen Eigenschaften des künstlichen Methanhydrat-Lager Sediment Messung Die Figur ist aus Referenz 9 geändert.3956fig1large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
Die TPS-Verfahren wurde verwendet, um die thermischen Eigenschaften jeder Probe zu messen. Die Verfahrensprinzipien sind in 10 beschrieben. In diesem Verfahren ist die zeitabhängige Temperaturanstieg & Delta; T ave,
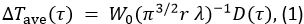
woher
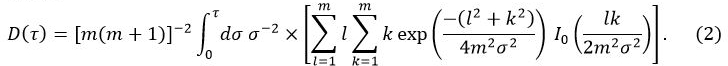
In Gleichung 1, W 0 die Ausgangsleistung von dem Sensor ist, r der Radius der Sensorsonde, λ die thermische Leitfähigkeit der Probe, α das thermische Diffusionsvermögen ist, und t die Zeit vom Beginn der Stromversorgung an die Sensorsonde. D (τ) ist eine dimensionslose zeitabhängige Funktion. τ durch (& agr; t / r) 1/2 gegeben. In Gleichung 2, m ist die Anzahl der konzentrischen Ringe der Sonde TPS und I 0 ist eine modifizierte Bessel - Funktion. Die Wärmeleitfähigkeit, Temperaturleitfähigkeit und die spezifische Wärme der Probe gleichzeitig durch Inversion Analyse auf die Temperaturerhöhung angewandt bestimmt als Kraft auf die Sensorsonde zugeführt wird.
Protokoll
Hinweis: Bitte konsultieren Sie alle relevanten Sicherheitsdatenblätter wie diese Studie Hochdruck brennbare Methangas und einen großen Hochdruckbehälter verwendet. Tragen Sie einen Helm, Schutzbrille und Sicherheitsschuhe. Wenn die Temperatur-Steuersystem aufhört, steigt der Druck in dem Gefäß mit MH Dissoziation. Um Unfälle zu vermeiden, ist die Verwendung eines Sicherheitsventilsystem dringend empfohlen, zur Freigabe automatisch das Methangas in die Atmosphäre. Das Sicherheitsventil-System kann ohne Stromversorgung arbeiten.
1. Herstellung der Sand-Wasser-Methan - Gasproben 9
- Platzieren Sie den Hochdruckbehälter auf dem Rütteltisch.
- Gießen Sie 1,5 l reines Wasser in einer Flasche Wasser und 4000 g Quarzsand in einer Sandflasche. Genau zu wiegen, die Massen von Sand und Wasser in den Sand und Wasserflaschen sind.
- Gießen Sie 1 Liter reines Wasser in den Hochdruckbehälter mit einem Innenvolumen von 2110 cm 3 aus einer Wasserflaschebis das Wasser füllt die Hälfte des Innenbehälters.
- Schalten Sie den Rütteltisch der gesamte Behälter vibriert. Stellen Sie die Schwingungsfrequenz und die Stromversorgung zu 50 Hz und 220 W. Tragen Sie die Schwingung bis zum Abschluss der Stufe 1.5. Entfernen Sie die Restluft in der Ablaufleitung und Sintermetallfilter am Boden des Behälters durch den Behälter vibriert.
- Pour 3.300 g Quarzsand aus einer Sandflasche in das Gefäß mit einer konstanten Rate von etwa 1 g sec -1 unter Verwendung eines Trichters gehalten in der Nähe der Wasseroberfläche , während der gesamte Behälter in Schwingungen versetzt wird einheitliche Packung zu gewährleisten.
- Stoppen Sie die Vibration, wenn das Wasser den Rand des Behälters erreicht.
- Platzieren einen Ring als temporäre Wand auf den Rand des Gefäßes zu verhindern, dass Wasser zu verschütten.
- Vibrieren des Gefäßes wieder bei 50 Hz und 220 W.
- Wenn der Sand den Rand des Gefäßes (Höhe 140 mm) erreicht, schaltet sich die Schwingung aus.
- Entfernen Sie die temporäre Wand und Porenwasserüber mit the Ablaufleitung. Gießen Sie das überschüssige Porenwasser in die Wasserflasche.
- Verpacken Sie den Sand durch das Schiff einmal vibriert oder zweimal bei 50 Hz und 300 W für 1 Sekunde und mehr Sand hinzufügen, wenn nötig.
- Wiegen Sie die Massen von Sand und Wasser in den Sand und Wasserflaschen. Berechnen Sie die Sand und Wassermassen in den Behälter aus den Massendifferenzen in den Sand und Wasserflaschen. In diesem Experiment wurden die Massen von Sand und Wasser in das Gefäß 3.385 g und 823,6 g, respectively. Die Masse des Wassers in dem Gefäß ist als w insgesamt bezeichnet.
- Decken Sie den Hochdruckbehälter mit einem Edelstahldeckel und ziehen Sie die Schrauben von diagonal gegenüberliegenden Paaren in Folge.
- Bewegen Sie den Hochdruckbehälter vom Rütteltisch auf die Tabelle für das Experiment bestimmt.
- Decken Sie den Hochdruckbehälter mit dem Wärmeisolator, um die Temperatur zu steuern.
- Verbinden die Hochdruckleitungen und die Kühlwasserströmungsleitungen mit dem Hochdruckbehälter.
- Öffnen die Ventile der Eingangs- und Ausgangsgasleitungen. Belüften 10 L Methan mit einer Geschwindigkeit von 800 ml min -1 bis keine überschüssige Wassereinleitungen in die Falle unter Atmosphärendruck. Der Sand Entladung wird durch einen Sintermetallfilter befestigt auf dem Boden des Gefäßes verhindert. Das restliche Wasser bleibt auf der Sandoberfläche, weil die hydrophile Quarzsand die Wassermoleküle adsorbiert.
- Wiegen Sie die Masse des Wassers in der Falle, w trap, das Gasvolumen in dem Behälter zu bestimmen. Bestimmen Sie die Masse an Restwasser, w res, in dem Gefäß unter Verwendung der Gleichung w res = w total - w Falle. In diesem Fall war w res und w trap 360,6 g und 463,0 g, respectively.
- Bestimmen Sie die Probe Porosität unter Verwendung der Formel Ѱ = 1 - V Sand / V - Zelle, wobei V Sand das Volumen von ter Sand durch das Verhältnis der Sandmasse zur Sanddichte bestimmt (dh ρ s = 2630 kg m -3) und V Zelle ist das innere Volumen des Behälters. Die Porosität Ѱ der Probe betrug 0,39.
- Schließen Sie das Ventil der Ausgangsgasleitung. Injizieren Methan der Porendruck des Methans in dem Gefäß auf etwa 12,1 MPa bei Raumtemperatur zu erhöhen (dh 31,6 ° C).
- Schließen Sie das Ventil der Eingangsgasleitung.
- Beginnen, den Druck und die Temperatur in dem Behälter während des Experimentes Aufzeichnen der Datenlogger verwendet. Die Datenerfassungsintervall beträgt 5 Sekunden. Die gesamte Versuchsdauer beträgt ca. 3.000 min.
2. MH Synthese und Bewertung "Thermische Eigenschaften der unterkühlten Probe 9
- Schalten Sie den Kühler zum Kühlen des Gefäßes von Raumtemperatur auf 2,0 ° C durch das Kühlmittel zirkuliert. Lassen Sie das Kühlmittel zirkulieren vom Kühler to den Boden des Behälters, von dort auf den Deckel des Behälters und schließlich zurück in die Kältemaschine. Die Temperaturänderungsrate in dem Behälter betrug etwa 0.001 ° C s -1.
- Legen Sie die Messparameter über das TPS-Analyzer-Software. Stellen Sie den Sensortyp Design # 7577 zum Sensor. Eingestellt , die Ausgangsleistung W 0 bis 30 mW und die Messzeit auf 5 sec. Beachten Sie, dass die entsprechenden Parameter geändert werden sollte, wenn der Sensortyp oder Probenbedingungen ändern. Die Parameter der Temperatur von 1 ° C bis 1,5 ° C zu erhöhen.
- Berechnen der Unterkühlungsgrad & Delta; T sup, mit der folgenden Gleichung:
AT sup = T eq (P) - T. (3)
T eq (P) ist die Gleichgewichtstemperatur von MH als Funktion des Drucks P. T eq (P) berechnet unter Verwendung der CSMGem Software 1.0; P und T der Druck und die Temperatur in dem Gefäß unter Verwendung von Druck- und Temperaturmessgeräte gemessen. - Gleichzeitig messen die Wärmeleitfähigkeit, Wärmeleitzahl und volumetrische spezifische Wärme mit der TPS - Analysator nach & Delta; T sup größer als 2 ° C ist.
- Schalten Sie die TPS-Sonde mit dem thermischen Eigenschaften Analysator nach jeder Messung. Schalten Sie die Kabel zwischen den TPS - Sonden und den Analysator manuell während des Experiments 9. Der Anschlussplan ist in Abbildung S2 in Bezug auf 9 gezeigt. Die Schaltfolge für jeden Sensor nicht. 6 → 2 → 7 → 5 → 1 → 9 → 4 → 3 → 8 → 6 .... Die Sequenz ist von dem Abstand zwischen den Sensoren basieren, die so weit wie möglich eingestellt wird, um die Restwärme zu beeinträchtigen, die Messungen zu verhindern. Daten sammeln alle 3-5 min.
- Wiederholen Sie die Messungen bis & #916; T sup erreicht 2 ° C erneut. In diesem Experiment sup Δ T steigt zunächst mit der Zeit. Nach & Delta; T sup den Maximalwert erreicht, nimmt & Delta; T sup allmählich auf 0 ° C , da der Druck unter Bildung von MH abnimmt. Überprüfen Sie, ob AT sup von mehr als 2 ° C vor den TPS - Messungen ist Gleichung 3.
- Stellen Sie sicher, dass das Temperaturprofil nicht durch MH Schmelz beeinflusst wird. Wenn MH während der Messungen schmilzt, steigt die Temperatur nicht, weil Schmelzen von MH eine endotherme Reaktion ist. Überprüfen Sie das Temperaturprofil während der Messungen und wird im Ergebnisteil diskutiert.
- Führen Sie die Analyse der thermischen Eigenschaften für alle Temperaturprofildaten der TPS-Technik.
3. Berechnung der Sättigung Änderung der Probe 9,11
Hinweis:Der Sättigungsgrad für MH, Wasser und Gas in der Probe als Funktion der Zeit t wird die Zustandsgleichung des Gases berechnet. Die Berechnungsdetails und Gleichungen verwendet werden , zuvor beschriebenen 11.
- Berechnen Sie die Methangasvolumen V Gas, t zum Zeitpunkt t
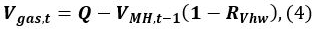
wobei Q der anfängliche Volumen des Gases in dem Gefäß ist, V MH, t - 1 ist das Volumen des MH zum Zeitpunkt t - 1 ist , und R VHW ist das Volumenverhältnis von Wasser und MH.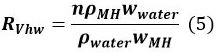
In Gleichung 5 ist , n die Anzahl der Hydratisierung MH (~ 6), ρ und ρ MH Wasser entsprechen der Dichte von MH und Wasser sind, und w und w MH Wasser bezeichnen die Molekularmasse von MH und Wasser, respectively. - Berechne den Betrag & Delta; M t (mol) von MH aus t gebildet - 1 bis t
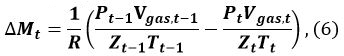
wobei R die Gaskonstante ist, P der Druck des Methangas und Z t (T Gas, t, P Gas, t) ist der Kompressionskoeffizient von Methan zur Zeit t. Wir haben 9 und Sakamoto et al. 11 haben die Benedict-Webb-Rubin (BWR) Gleichung verwendet, wie von Lee und Kesler modifiziert, für die Berechnung der Z t 12, 13. Für diese Berechnung werden die Formeln (3-7,1) - 7 Referenz 13 - (3-7,4) der BWR Gleichung 13 und die Lee-Kesler Konstanten sind in den Tabellen 3 verwendet. - Berechnen Sie die Volumenänderung Δ V MH, t von MH von t - 1 bis t
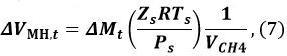
wobei P s der Bezugsdruck von 101325 Pa, T s ist , ist die Referenztemperatur von 273,15 K, Z s ist der Kompressionskoeffizient bei P s und T s (Z s ~ 1) und V CH4 ist das Verhältnis des Methangasvolumen in der Volumeneinheit MH [Nm 3 m -3]. Verwenden Sie einen V CH4 Wert von 165,99 [Nm 3 m -3]. - Berechnen des Volumens V MH, t von MH zum Zeitpunkt t
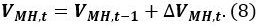
- Berechne das Volumen des Wassers V Wasser, t in dem Druckbehälter zum Zeitpunkt t
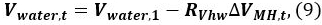
wobei V Wasser, 1 ist das Anfangsvolumen des Wassers. - Wiederholen Sie die Berechnungen unter Verwendung der Gleichungen. 4-9 zum Zeitpunkt t = 2, 3, ... die Änderung der Sättigung von Wasser, Methan und MH 11 zu bestimmen. Die Anfangsbedingung t = 1, dh, V Gas, 1 = Q. Die P und T zum Zeitpunkt t werden von den Datenprotokollen 9 entnommen. Die Berechnungsergebnisse werden in dem folgenden Abschnitt dargestellt.
Ergebnisse
Figur 2a zeigt das Temperaturprofil , das nicht von MH Schmelz beeinflusst wird. & Dgr; T c ist die Temperaturänderung aufgrund der thermischen Konstanten "Messung. 2b das Temperaturprofil zeigt , das von MH Schmelz beeinflusst wird. Das Profil in Figur 2b nicht durch Gleichungen 1 und 2 untersucht werden , da diese Gleichungen unter der Annahme , stabile Probenbedingungen abgeleitet werden.
Diskussion
Die Wirkung der Bildung Wärme MH auf der Messung geschätzt. Die Bildung von Wärme MH wurde von Produkten Änderungsrate des S h geschätzt , wie in 3b und die Bildungsenthalpie H = 52,9 kJ mol -1 für MH 14 gezeigt. Infolgedessen wurde die maximale Temperaturänderung 0,00081 ° C s -1. Dies war viel niedriger als der Temperaturanstieg & Dgr; T c des TPS - Sensor zwischen 1 ° C und 1,5 ° C während des Zeitinterva...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
Diese Studie wurde finanziell von der MH21 Research Consortium für Methanhydrat Ressourcen in Japan und der National Methanhydratförderung Programm durch das Ministerium für Wirtschaft, Handel und Industrie unterstützt. Die Autoren möchten T. Maekawa und S. Goto für die Unterstützung bei den Experimenten zu danken.
Abgedruckt Zahlen mit freundlicher Genehmigung von (Muraoka, M., Susuki, N., Yamaguchi, H., Tsuji, T., Yamamoto, Y., Energy Fuels, 29 (3), 2015, 1345-1351, 2015, DOI.: 10.1021 / ef502350n). Copyright (2015) American Chemical Society.
Materialien
| Name | Company | Catalog Number | Comments |
| TPS thermal probe, Hot disk sensor | Hot Disk AB Co., Sweden | #7577 | Kapton sensor type, sensor radius 2.001 mm |
| Hot disk thermal properties analyzer | Hot Disk AB Co., Sweden | TPS 2500 | |
| Toyoura standard silica sand | Toyoura Keiseki Kogyo Co., Ltd., Japan | N/A | |
| Methane gas, 99.9999% | Tokyo Gas Chemicals Co., Ltd., Japan | N/A | Grade 6 N, Volume 47 L, Charging pressure 14.7 MPa |
| Water Purification System, Elix Advantage 3 | Merck Millipore., U.S. | N/A | 5 MΩ cm (at 25 °C) resistivity |
| Vibrating table, Vivratory packer | Sinfonia Technology Co. Ltd., Japan | VGP-60 | |
| Chiller, Thermostatic Bath Circulator | THOMAS KAGAKU Co., Ltd., Japan | TRL-40SP | |
| Coorant, Aurora brine | Tokyo Fine Chemical Co.,Ltd., Japan | N/A | ethylene glycol 71 wt% |
| Temparature gage | Nitto Kouatsu., Japan | N/A | Pt 100, sheath-type platinum resistance temperature detector |
| Pressure gage | Kyowa Electronic Instruments., Japan | PG-200 KU | |
| Data logger | KEYENCE., Japan | NR-500 | |
| Mass flow controller | OVAL Co., Japan | F-221S-A-11-11A | Maximum flow 2,000 N ml/M, maximum design pressure 19.6 MPa |
Referenzen
- Sloan, E. D., Koh, C. A. . Clathrate Hydrates of Natural Gases, 3rd ed. , (2007).
- Hatzikiriakos, S. G., Englezos, P. The relationship between global warming and methane gas hydrates in the earth. Chem. Eng. Sci. 48 (23), 3963-3969 (1993).
- Yamamoto, K. Overview and introduction: pressure core-sampling and analyses in the 2012-2013 MH21 offshore test of gas production from methane hydrates in the eastern Nankai Trough. Mar. Petrol. Geol. 66 (Pt 2), 296 (2015).
- Fujii, T., et al. Geological setting and characterization of a methane hydrate reservoir distributed at the first offshore production test site on the Daini-Atsumi Knoll in the eastern Nankai Trough, Japan. Mar. Petrol. Geol. 66 (Pt 2), 310 (2015).
- Mao, W. L., et al. Hydrogen clusters in clathrate hydrate. Science. 297 (5590), 2247-2249 (2002).
- Lee, S., Liang, L., Riestenberg, D., West, O. R., Tsouris, C., Adams, E. CO2 hydrate composite for ocean carbon sequestration. Environ. Sci. Technol. 37 (16), 3701-3708 (2003).
- Muromachi, S., Ohmura, R., Takeya, S., Mori, H. Y. Clathrate Hydrates for Ozone Preservation. J. Phys. Chem. B. 114, 11430-11435 (2010).
- Waite, W. F., et al. Physical properties of hydrate-bearing sediments. Rev. Geophys. 47 (4), (2009).
- Muraoka, M., Susuki, N., Yamaguchi, H., Tsuji, T., Yamamoto, Y. Thermal properties of a supercooled synthetic sand-water-gas-methane hydrate sample. Energy Fuels. 29 (3), 1345-1351 (2015).
- Gustafsson, S. E. Transient plane source techniques for thermal conductivity and thermal diffusivity measurements of solid materials. Rev. Sci. Instrum. 62 (3), 797-804 (1991).
- Sakamoto, Y., Haneda, H., Kawamura, T., Aoki, K., Komai, T., Yamaguchi, T. Experimental Study on a New Enhanced Gas Recovery Method by Nitrogen Injection from a Methane Hydrate Reservoir. J. MMIJ. 123 (8), 386-393 (2007).
- Lee, B. I., Kesler, M. G. A generalized thermodynamic correlation based on three-parameter corresponding states. AIChE J. 21 (3), 510-527 (1975).
- Reid, R. C., Prausnitz, J. M., Poling, B. E. Chapter 3, Unit 3, 7. The properties of gases and liquids. , 47-49 (1987).
- Anderson, G. K. Enthalpy of dissociation and hydration number of methane hydrate from the Clapeyron equation. J. Chem. Thermodyn. 36 (12), 1119-1127 (2004).
- Waite, W. F., deMartin, B. J., Kirby, S. H., Pinkston, J., Ruppel, C. D. Thermal conductivity measurements in porous mixtures of methane hydrate and quartz sand. Geophys. Res. Lett. 29 (24), 82-1-82-4 (2002).
- Kumar, P., Turner, D., Sloan, E. D. Thermal diffusivity measurements of porous methane hydrate and hydrate-sediment mixtures. J. Geophys. Res. 109 (B1), (2004).
- Huang, D., Fan, S. Measuring and modeling thermal conductivity of gas hydrate-bearing sand. J. Geophys. Res. 110 (B1), (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten