Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein einfaches und effizientes Protokoll für die katalytische Insertion Polymerisation von Functional Norbornene
In diesem Artikel
Zusammenfassung
We describe the catalytic insertion polymerization of 5-norbornene-2-carboxylic acid and 5-vinyl-2-norbornene to form functional polymers with a very high glass transition temperature.
Zusammenfassung
Norbornen kann durch eine Vielzahl von Mechanismen polymerisiert werden, einschließlich Insertion der Polymerisation, wobei die Doppelbindung polymerisiert wird, und der bicyclische Natur des Monomers konserviert ist. Das resultierende Polymer, Polynorbornen, hat eine sehr hohe Glasübergangstemperatur, T g, und interessante optische und elektrische Eigenschaften. Jedoch wird die Polymerisation von funktionellen Norbornene durch diesen Mechanismus durch die Tatsache , daß das endo substituierten Norbornen - Monomer weist im allgemeinen eine sehr geringe Reaktivität kompliziert. Darüber hinaus ist die Trennung des endo substituierten Monomeren aus der exo - Monomer eine mühsame Aufgabe. Hier präsentieren wir ein einfaches Protokoll für die Polymerisation von substituierten Norbornene (endo: exo ca. 80:20) entweder eine Carbonsäure oder ein Anhänger Doppelbindung trägt. Das Verfahren erfordert nicht, dass beide Isomere getrennt werden, und geht mit niedrigen Katalysatormengen (0,01 bis 0,02 Mol%). Die Polymerlager-AnhAmeise Doppelbindungen kann weiter in hoher Ausbeute umgewandelt werden, ein Polymer, das Epoxyseitengruppe Gruppen zu leisten. Diese einfache Verfahren kann mit einer Vielzahl von funktionellen Gruppen, wie Ester, Alkohole, Imide, Doppelbindungen, Carbonsäuren, Brom-Alkyle, Aldehyde und Anhydride herzustellen Polynorbornene angewendet werden.
Einleitung
Norbornen, NBE, die Diels-Alder - Addukt von Ethylen und Cyclopenta (erhalten durch "Cracken" von Dicyclopentadien (DCPD)), wird leicht polymerisiert entweder radikalische Polymerisation, 1 kationischen Polymerisation, 2 Ringöffnungs- Metathesepolymerisation 3 und katalytische Insertion mit Polymerisation. 4, 5, 6, 7 im Gegensatz zu den anderen Mechanismen führt die katalytische Einsetzen der Polymerisation zu der Bildung eines sehr hohen Glasübergangstemperatur (T g) polymer , wobei das bicyclische Rückgrat NBE konserviert ist. Eine Vielzahl von Katalysatoren wie Metallocenkatalysatoren und späten Übergangsmetallkatalysatoren können die Polymerisation von NBE zur Förderung verwendet werden. 4, 5, 6, 7 jedoch aufgrund seiner geringen Löslichkeit und aufgrund von Schwierigkeiten im Zusammenhang mit der Verarbeitung eines sehr hohen T g Polymer, das PNBE Homopolymer hat, zu unserem Wissen, fand nie Gebrauch.
Funktionelle Polynorbornene (PNBEs) haben die Aufgabe erhebliche Kontrolle in den letzten 20 Jahren, weil sie die hohen T g durch die bi- starren Wiederholungseinheit sowie wünschenswerte Eigenschaften ausgestattet sind durch ihre Funktionalitäten vermittelt kombinieren. 8, 9, 10 NBE Monomere aus recht einfachen und billigen Ausgangsmaterialien erhalten wird , eine Ein-Schritt - Diels-Alder - Reaktion zwischen Cyclopentadien und einem funktionalisierten Dienophil verwendet wird . Allerdings führt die Diels-Alder - Reaktion auf zwei Stereoisomere, endo und exo, die sehr unterschiedliche Reaktivitäten aufweisen. 11, 12 in der Tat, die endo - StereoIsomer ist weniger reaktiv als exo - Form und deaktiviert den Katalysator. 11, 12 somit in der Vergangenheit erforderte die Herstellung von funktionellen Polynorbornene gewöhnlich die Trennung der endo- und exo Stereoisomeren und wurde nur die exo Stereoisomer verwendet wird . Eine solche Trennung Verfahren war zeitaufwendig und führte zur Akkumulation von nicht umgesetztem endo Stereoisomere als unerwünschter Abfall.
Kürzlich haben wir gezeigt, dass die Polymerisation von funktionalisierten NBEs beide Stereoisomere enthält machbar ist in der Tat. 13 Wir haben somit in der Lage gewesen , eine Vielzahl von substituierten PNBEs, enthaltend funktionelle Gruppen wie Ester, Anhydride, Aldehyde, Imide, Alkohole und Doppelbindungen herzustellen. Aufgrund ihrer hohen T g und Funktionalität zeigen diese Polymere wünschenswerte Eigenschaften. Wir beschreiben hier zwei Methoden funktionelle Polymere herzustellen. Die erste führt zuDie Synthese des wasserlöslichen Polymers Poly (5-Norbornen-2-carbonsäure), PNBE (CO 2 H), ein kationisches Pd - Katalysators (1). 13, 14 Das gleiche Polymerisationsverfahren kann verwendet werden , um funktionelle PNBEs mit verschiedenen pendant Funktionalitäten herzustellen, wie Ester, Alkohole, Imide, Brom-Alkyle, Aldehyde und Anhydride. In unseren Händen, diese kationischen Katalysator Pd kann nicht für NBEs verwendet werden mit anhängenden Doppelbindungen, wie beispielsweise 5-Vinyl-2-norbornen. In diesem Fall führt ein teilweises Einsetzen des Pendeldoppelbindung während der Polymerisation zur Bildung eines vernetzten Materials. Daher stellen wir hier ein zweites Verfahren zur Bildung von Poly gewidmet (5-Vinyl-2-norbornen), PNBE (vinyl), unter Verwendung von Pd 2 (dba) 3: AgSbF 6: PPh 3 als ein in situ - Katalysator. 14 Die Anhänger Vinylgruppen des Polymers werden dann epoxidiert weiter zu führen , zu the Bildung PNBE (Epoxy) (Abbildung 1). Sowohl PNBE (CO 2 H) und PNBE (epoxy) gefunden wurden zur Bildung von Duroplast - Harze mit einem T g so hoch wie 350 ° C zu führen. 14 Somit ist die einfache hier beschriebene Verfahren erlaubt es , effizient auf Polymere mit einem sehr hohen T g herzustellen und eine Vielzahl von funktionellen Gruppen, die für zahlreiche Anwendungen eingesetzt werden kann.
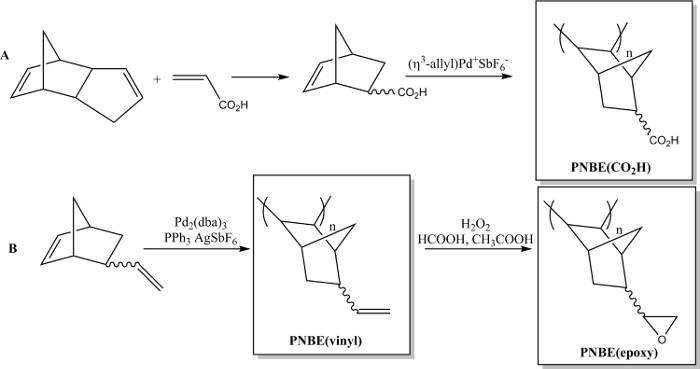
Abbildung 1: Funktionelle PNBEs hergestellt durch Pd - katalysierte Polymerisation. (A) Herstellung von PNBE (CO 2 H), (B) Herstellung von PNBE (vinyl) und PNBE (epoxy). Die gestrichelte Bindung zeigt ein Gemisch aus endo- und exo - Isomeren. Bitte klicken Sie hier , um eine größere Version dieses fi anzuzeigenAbbildung.
Protokoll
1. Herstellung von Poly (5-Norbornen-2-carbonsäure), PNBE (CO 2 H)
- Herstellung des Monomers NBE (CO 2 H)
- Abwiegen Acrylsäure (AA) (327 g, 4,5 mol, 2 Äq.) Und Hydrochinon (4,9 g, 4,5 x 10 -2 mol, 0,02 Äq.) Und fügen Sie sie in einen 2 l Rundkolben , ausgerüstet mit einem Kühler und ein magnetischer Rührstab. Wird der Kolben bei 150 ° C ein Silikon Ölbad.
- Sobald Reflux abgerechnet wird, fügen Sie DCPD (300 g, 2,3 mol, 1 Äq.) In einer einzigen Portion, und dann die Temperatur auf 170 ° C erhöhen.
- Verlassen, die Reaktion bei dieser Temperatur für 16 h. Beachten Sie die Farbänderung von klar bis gelbbraun.
- Nehmen Sie eine Probe durch Extraktion mit einer Pasteur - Pipette und analysieren es durch 1 H - NMR (unter Verwendung von CDCl 3 als Lösungsmittel) 15. Beachten Sie die Erscheinung von NBE (Doppelbindung Signale zwischen 6,0 und 6,5 ppm, Abbildung 2 oben). 16
- Reinigung von NBE (CO 2 H)
- Ersetzen Sie den Kondensator mit einer einfachen Destillation Aufbau (ein Plateau) mit einem Kondensator verbunden, in dem kaltes Wasser zirkuliert.
- Legen Sie die Reaktion Setup unter Vakuum gesetzt ca. 1 mmHg. Das Gemisch wird bei 100 ° C, und sammeln eine klare Flüssigkeit (ca. 40 ml) , die verworfen werden können.
- Ersetzen Sie den Sammelkolben mit einem 500-ml-Rundkolben. Erhitzen Sie das Ölbad auf 155 ° C, und beobachten Sie die tropfenweise Destillation von NBE (CO 2 H) (317 g, 2,3 Mol. Ausbeute = 98%). Die Destillation erfolgt über 7 h.
- Analysieren Sie die farblose Flüssigkeit durch 1 H - NMR - Reinheit sowie endo zu beurteilen: exo Proportionen (Abbildung 2, unten). 15 Die endo: exo - Verhältnis ändert sich mit der Zeit für die Destillation als auch mit der Erwärmungszeit für die Herstellung des rohen NBE (CO 2 H) verwendet. Typischerweise endo:exo - Verhältnisse zwischen 50:50 und 80:20 erhalten (60:40 in diesem Fall).
- Polymerisation von NBE (CO 2 H)
- Platzieren 300 g (2,3 mol, 5,000 Äq.) NBE (CO 2 H) in einem 500 - mL - Rundkolben mit einem magnetischen Rührstab ausgestattet. Entgasen die Flüssigkeit durch Stickstoff für 30 min hydriert.
- Wiegen Allylpalladium- (II) -chlorid - Dimer, [PdCl (C 3 H 5)] 2 (76 mg, 4,2 x 10 -1 mmol, 1 Äqu. Pd) , und fügen Sie die Lösung. In Silber Antimonat AgSbF 6 (180 mg, 5,2 x 10 -1 mmol, 1,2 Äq.).
- Unter Rühren lösen sich die Pd-Salz durch Erhitzen auf 70 ° C, und daß die Temperatur bei 70 ° C unter einem leichten Stickstofffluss. Nach 7 bis 8 h, stoppt das Rühren aufgrund einer Viskositätserhöhung.
- Die Reaktion nach 36 h.
- Kühlen Sie die Rundkolben mit flüssigem Stickstoff. Mit einem Spatel, brechen das Polymer in kleine Stücke schneiden.
- In einem 2 l Becherglas equipped mit einem magnetischen Rührstab, fügen Sie 750 ml Ethylacetat. Fügen Sie die Polymerbrocken auf die Ethylacetat unter kräftigem Rühren. Fahren Sie für 2 h gerührt wurde.
- Filtern Sie die Lösung über einen Durchmesser von 15 cm Büchner-Trichter ausgestattet mit einem Papierfilter (Klasse 413, 15 cm Durchmesser).
- Waschen Sie das Polymer mit Ethylacetat dreimal (jeweils 500 ml Waschen). Trocknen das Polymer (123 g, 9,4 x 10 -1 mol, Ausbeute = 41%) in einem Vakuumofen eingestellt bei 50 ° C für 12 h.
2. Herstellung von PNBE (vinyl)
- Die Polymerisation von NBE (Vinyl)
- Entgasen Toluol (ca. 200 ml) und NBE (vinyl) (ca. 200 ml) von mit N 2 für 30 min sprudeln und in einem Handschuhfach legen.
- Im Handschuhfach, Load Toluol (100 g) in einem 250 ml Rundkolben.
- Hinzufügen , Pd 2 (dba) 3 (76 mg, 1,6 x 10 -1 mmol, 1 eq. Pd), AgSbF 6 (68 mg, 2,0 x 10 -1 mmol, 1,2 eq.) und Triphenylphosphin PPh 3 (43 mg, 1,6 x 10 -1 mmol, 1 eq.) , die nacheinander zu der Toluollösung.
- Das Gemisch wird auf 70 ° C bis zur vollständigen Auflösung auftritt. Es tritt innerhalb von 10 min.
- In 100 g (8,0 x 10 -1 mol, 5.000 Äq.) NBE (Vinyl) zu dieser lila Lösung.
- Man rührt bei 70 ° C für 72 h.
- Entfernen Sie die Lösung aus der Glovebox, und übertragen Sie die viskose schwarze Lösung in einen 1 l Glasflasche mit einem magnetischen Rührstab enthält.
- In Toluol (200 ml) und umrühren.
- Hinzufügen Siliciumdioxidpulver (Kieselgel 40-63 um, 10 g). Rühre bei Raumtemperatur für 16 h.
- Stopp Rühren und ließ das Pulver für mindestens 2 h, um für die Silicapartikel absetzen zu sedimentieren.
- Filtern Sie die Lösung über einen Durchmesser von 15 cm Büchner-Trichter ausgestattet mit einem Papierfilter (Klasse 413, 15 cm Durchmesser). Vermeiden Gießen sedimentiert Silicapartikel in dem Büchner-Trichter.
- Spülen Sie die Silica parkeln mit Toluol (50 ml) und es durch den Büchner-Trichter filtrieren.
- Hinzufügen Methanol (1,2 l) in einen 4-Liter-Becher mit einem Magnetrührstab ausgestattet.
- Fügen Sie alle der Toluollösung des Polymers zu dem Methanol allmählich unter kräftigem Rühren enthält, und weiterhin für 30 min gerührt wurde.
- Filtern Sie das Polymer über einen Durchmesser von 15 cm Büchner-Trichter ausgestattet mit einem Papierfilter (Klasse 413, 15 cm Durchmesser). Waschen Sie das Polymer mit drei Teilmengen von Methanol (400 ml jeweils). Ändern Sie den Filterpapier zwischen jedem Waschen.
- Beurteilen Sie die Polymer Reinheit durch 1 H - NMR in CDCl 3, um zu sehen , ob das enthaltene Restmonomer (Doppelbindung Signale zwischen 6,0 und 6,3 ppm) ist. 15, 16 Wenn dies der Fall ist, weiter mit Methanol gewaschen.
- Trocknen des Polymers (75 g, 6,3 x 10 -1 mol, Ausbeute = 78%) unter Vakuum bei Raumtemperatur über Nacht.
3.Herstellung von PNBE (Epoxy)
- Epoxidierung von PNBE (Vinyl)
- Zugabe von 150 g Dichlormethan in einen 500 ml Rundkolben, der mit einem Magnetrührer und einem Kühler ausgestattet.
- Hinzufügen PNBE (vinyl) (15 g, 1,3 x 10 -1 mol, 1 Äq.) Mit bis zur vollständigen Auflösung gerührt wurde.
- Der Kolben wird in einem Eisbad und lassen Sie es 15 Minuten abkühlen lassen.
- In einem getrennten Behälter zusammen mischen Ameisensäure (30 g, 6,5 x 10 -1 mol, 5 Äq.) Und Essigsäure (5 g, 8,3 x 10 -2 mol, 0,6 Äq.). Die zusammen Säuren zu der Polymerlösung.
- Lassen Sie es für 15 Minuten abkühlen lassen.
- Hinzufügen wßrigen Wasserstoffperoxidlösung (30%) (75 g, 6,5 x 10 -1 mol, 5 Äq.) Zu der Polymerlösung.
- Man rührt 18 h. Das Eisbad muss nicht entfernt werden, da die Temperatur allmählich auf Umgebungstemperatur zu erhöhen.
- Nehmen Sie eine kleine Probe, fällt das Polymer mit Aceton und analysieren es durch 1 H - NMR in CD Cl 3. 15 Wenn das Signal für die Doppelbindung (δ = 4,5-6,0 ppm) ausreichend verringert wird (Abbildung 3), um zum nächsten Schritt übergeben. Typischerweise ist das Verhältnis des Integrals der Doppelbindungen zu den anderen Protonen weniger als 1:20 (1:83 in Abbildung 3). Ansonsten gehen die Reaktion.
- Hinzufügen Aceton (750 ml) in einen 4-Liter-Becher mit einem Magnetrührstab ausgestattet.
- Fügen Sie die Polymerlösung zu dem Aceton allmählich unter kräftigem Rühren 15 min.
- Filtern Sie das Polymer über einen Durchmesser von 15 cm Büchner-Trichter ausgestattet mit einem Papierfilter (Klasse 413, 15 cm Durchmesser).
- Waschen der Polymer viermal mit Aceton (jeweils 200 ml).
- Ändern Sie den Filterpapier zwischen jedem Waschen.
- Trocknen des Polymers (7,5 g) unter Vakuum bei Raumtemperatur über Nacht.
g "/>
Abbildung 2: 1 H - NMR - Spektren der rohen (oben) und gereinigter (unten) NBE (CO 2 H). Das gereinigte Produkt wird durch einfache Destillation erhalten. Man beachte die Peaks , die verwendet werden , um die endo zu beurteilen: exo - Verhältnis. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
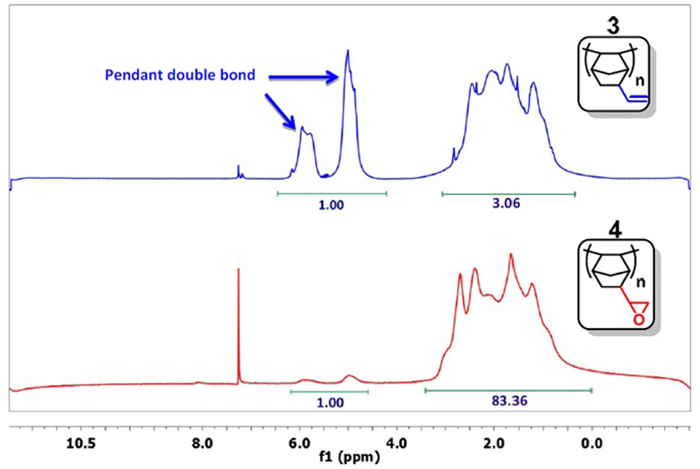
Abbildung 3: 1 H - NMR - Spektren von PNBE (vinyl) (blau) und PNBE (Epoxy) (rot). Beachten Sie, das Verhältnis 1: 3 zwischen den Integralen der Vinylgruppe (δ = 4,5-6,0 ppm) und die anderen Protonen im PNBE (vinyl) Spektrums. Nach der Reaktion mit H 2 O 2, verringert sich das Verhältnis auf 1:83, so dass die Epoxidierung von Vinylgruppe Bestätigung aufgetreten ist.nk "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
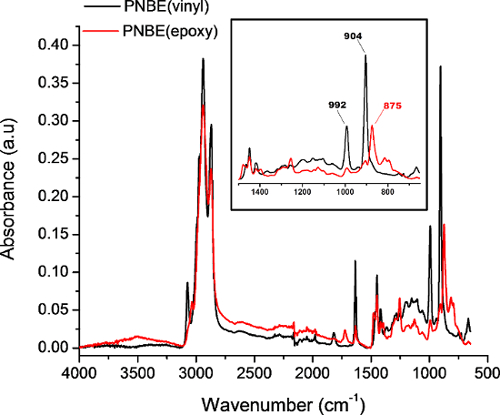
Abbildung 4: FTIR - Spektren von PNBE (Vinyl) (schwarz) und PNBE (Epoxy) in abgeschwächter Totalreflexion Modus erworben. Legen Sie eine Zoom der charakteristischen Banden von PNBE (Vinyl) und PNBE (Epoxy). Die 902 cm -1 und 992 cm -1 Banden entsprechen der C = CH out-of-plane Biege, wohingegen die 875 cm -1 Band zu dem Epoxidring Verformung entspricht. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Ergebnisse
Die NBE Monomere werden hergestellt durch einfaches Diels-Alder-Reaktion von DCPD und einem geeigneten Dienophil, beispielsweise Acrylsäure (AA). Normalerweise wird DCPD geknackt Cyclopenta (CPD) vor der Reaktion zu erhalten. 17 frisch aufgebrochenes CPD wird dann in der Diels-Alder - Reaktion in Eingriff. Jedoch in diesem Protokoll beide Rißbildung und Diels-Alder Schritte gleichzeitig durchgeführt werden, in einer Eintopfreaktion. Somit sobald CPD gebildet wi...
Diskussion
Das hier vorgeschlagene Verfahren ist einfach und leicht zugänglich für Scale-up. Alle Chemikalien könnten verwendet werden, wie ohne Reinigung erhalten. Beachten Sie, dass die Reaktion bei einer niedrigeren Skala durchführen (zB Waagen ≤1 g) in der Regel niedrigere Erträge liefert aufgrund eines unvermeidbaren Materialverlust bei der Handhabung und der Sammlung.
Die Katalysatoren werden in situ auf der Reaktion von kommerziellen Pd Verbindungen mit Kationisierungsmi...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
The authors acknowledge funding from Fonds de Recherche du Québec - Nature et Technologies, from Conseil Recherches en Sciences Naturelles et Génie (program INNOV) and PrimaQuébec.
Materialien
| Name | Company | Catalog Number | Comments |
| acrylic acid | Sigma-Aldrich | 147230 | |
| hydroquinone | Sigma-Aldrich | H9003 | |
| dicyclopendadiene | Sigma-Aldrich | 454338 | |
| palladium allyl dichloride dimer | Sigma-Aldrich | 222380 | |
| silver hexfluoro antimonate | Sigma-Aldrich | 227730 | |
| liquid nitrogen | Local Facility | NA | |
| ethyl acetate | Fischer Scientific | E14520 | |
| 5-vinyl-2-norbornene | Sigma-Aldrich | 148679 | |
| toluene | Fischer Scientific | T290-4 | |
| palladium dba | Sigma-Aldrich | 227994 | |
| triphenyl phosphine | Sigma-Aldrich | 93090 | |
| silica gel 40-63 microns | Silicycle | Siliaflash | |
| methanol | Fischer Scientific | BPA412-20 | |
| dichloromethane | EMD Millipore | DX08311 | |
| formic acid | Sigma-Aldrich | F0507 | |
| acetic acid | Sigma-Aldrich | 320099 | |
| hydrogen peroxide solution | Sigma-Aldrich | 216763 | |
| acetone | Fischer Scientific | A18-200 |
Referenzen
- Gaylord, N. G., Mandal, B. M., Martan, M. Peroxide-induced polymerization of norbornene. J. Polym. Science, Polym. Lett. Ed. 14 (9), 555-559 (1976).
- Janiak, C., Lassahn, P. G. The vinyl homopolymerization of norbornene. Macromol. Rapid Comm. 22 (7), 479-493 (2001).
- Bielawski, C. W., Grubbs, R. H. Living ring-opening metathesis polymerization. Prog. Polym. Sci. 32 (1), 1-29 (2007).
- Blank, F., Janiak, C. Metal catalysts for the vinyl/addition polymerization of norbornene. Coord. Chem. Rev. 253 (7-8), 827-861 (2009).
- Kaminsky, W., Boggioni, L., Tritto, I. Cycloolefin polymerization. Polymer Science: A Comprehensive Reference, 10 Volume Set. 3, 843-873 (2012).
- Boggioni, L., Tritto, I. State of the art of cyclic olefin polymers. MRS Bull. 38 (3), 245-251 (2013).
- Goodall, B., Rieger, B., Baugh, L., Kacker, S., Striegler, S. Cycloaliphatic polymers via late transition metal catalysis. Late Transition Metal Polymerization Catalysis. , 101-154 (2003).
- Zhou, W., He, X., Chen, Y., Chen, M., Shi, L., Wu, Q. Vinyl-addition copolymerization of norbornene and polar norbornene derivatives using novel bis(β-ketoamino)Ni(II)/B(C6F5)3/AlEt3 catalytic systems. J. Appl. Polym. Sci. 120 (4), 2008-2016 (2011).
- Müller, K., Jung, Y., Yoon, D. Y., Agarwal, S., Greiner, A. Vinyl-type polymerization of alkylester-substituted norbornenes without endo/exo separation. Macromol. Chem. Phys. 211 (14), 1595-1601 (2010).
- Boffa, L. S., Novak, B. M. Copolymerization of polar monomers with olefins using transition-metal complexes. Chem. Rev. 100 (4), 1479-1494 (2000).
- Funk, J. K., Andes, C. E., Sen, A. Addition Polymerization of Functionalized Norbornenes: The Effect of Size Stereochemistry, and Coordinating Ability of the Substituent. Organometallics. 23 (8), 1680-1683 (2004).
- Hennis, A. D., Polley, J. D., et al. Novel, efficient, palladium-based system for the polymerization of norbornene derivatives: Scope and mechanism. Organometallics. 20 (13), 2802-2812 (2001).
- Commarieu, B., Claverie, J. P. Bypassing the lack of reactivity of endo-substituted norbornenes with the catalytic rectification-insertion mechanism. Chem. Sci. 6 (4), 2172-2182 (2015).
- Commarieu, B., Potier, J., et al. Ultrahigh Tg epoxy thermosets based on insertion polynorbornenes. Macromoecules. 49 (3), 920-925 (2016).
- Pirrung, M. C. . The Synthetic Organic Chemist's Companion. , (2007).
- Kanao, M., Otake, A., Tsuchiya, K., Ogino, K. Stereo-selective synthesis of 5-norbornene-2-exo-carboxylic acid-Rapid isomerization and kinetically selective hydrolysis. Int. J. Org. Chem. 2 (1), 26-30 (2012).
- Huertas, D., Florscher, M., Dragojlovic, V. Solvent-free Diels-Alder reactions of in situ generated cyclopentadiene. Green Chem. 11 (1), 91-95 (2009).
- Pierre, F., Commarieu, B., Tavares, A. C., Claverie, J. High Tg sulfonated insertion polynorbornene ionomers prepared by catalytic insertion polymerization. Polymer. 86, 91-97 (2016).
- Woo, H. G., Li, H. . Advanced functional materials, Chapter 1.6.8,30. 1, (2011).
- Kim, D. -. G., Bell, A., Register, R. a. Living vinyl addition polymerization of substituted norbornenes by a t-Bu3P-Ligated Methylpalladium Complex. ACS Macro Letters. 4 (3), 327-330 (2015).
- Seung, H., S, A., Baek, K., Sang, S., Intech, S. i. l. a. g. u. i. ,. M. .. A. .. ,. e. d. .. ,. Low Dielectric Materials for Microelectronics. Dielectric Material. , 59-76 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten