Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un protocole simple et efficace pour l'insertion catalytique Polymérisation de norbornènes fonctionnels
Dans cet article
Résumé
We describe the catalytic insertion polymerization of 5-norbornene-2-carboxylic acid and 5-vinyl-2-norbornene to form functional polymers with a very high glass transition temperature.
Résumé
Norbornène peut être polymérisé par une variété de mécanismes, y compris la polymérisation par insertion selon laquelle la double liaison est polymérisé et la nature du monomère bicyclique est conservée. Le polymère, polynorbornène résultant, a une très haute température de transition vitreuse, T g, et les propriétés optiques et électriques intéressantes. Cependant, la polymérisation des norbornènes fonctionnels par ce mécanisme est compliqué par le fait que le monomère de norbornène endo substitué a en général une très faible réactivité. En outre, la séparation du monomère endo substitué à partir du monomère exo est une tâche fastidieuse. Ici, nous présentons un protocole simple pour la polymérisation des norbornènes substitués (endo: exo ca. 80:20) portant soit un acide carboxylique ou une double liaison pendentif. Le procédé ne nécessite pas que les deux isomères séparés, et procède à des charges catalytiques faibles (0,01 à 0,02% en mole). Les Pend polymères portantdoubles liaisons fourmis peuvent encore être transformées avec un rendement élevé, pour obtenir un polymère portant des groupes époxy pendants. Ces procédures simples peuvent être utilisés pour préparer les polynorbornènes avec une variété de groupes fonctionnels, tels que des esters, des alcools, des imides, des doubles liaisons, des acides carboxyliques, des groupes alkyles bromés, les aldéhydes et les anhydrides.
Introduction
Norbornène, le BNE, le produit d' addition de Diels-Alder de l' éthylène et du cyclopentadiène (obtenu par «craquage» du dicyclopentadiène (DCPD)), est facilement polymérisé en utilisant soit une polymérisation radicalaire, une polymérisation cationique, 2 à ouverture de cycle métathèse polymérisation 3 et l' insertion catalytique polymérisation. 4, 5, 6, 7 Contrairement aux autres dispositifs, la polymérisation catalytique d'insertion conduit à la formation d'une très haute température de transition vitreuse (T g) de polymère dans lequel le squelette bicyclique de NBE est conservée. Une variété de catalyseurs tels que des catalyseurs à base de métallocènes et de transition tardive de catalyseurs métalliques peuvent être utilisés pour favoriser la polymérisation de NBE. 4, 5, 6, 7 Toutefois, en raison de sa faible solubilité et en raison de difficultés liées au traitement d'un polymère très élevé T g, l'homopolymère PNBE a, à notre connaissance, n'a jamais trouvé d'emploi.
Polynorbornènes fonctionnels (PNBEs) ont fait l'objet d' une attention considérable au cours des 20 dernières années, car ils combinent la Tg élevée transmise par l'unité de répétition rigide bicyclique, ainsi que des propriétés souhaitables dotés par leurs fonctionnalités. 8, 9, 10 NBE monomères sont obtenus à partir des charges d' alimentation plutôt simples et peu coûteuses, en utilisant une réaction en une seule étape de Diels-Alder entre le cyclopentadiène et le diénophile fonctionnalisée. Cependant, la réaction de Diels-Alder conduit à deux stéréoisomères endo et exo, qui ont des réactivités très différentes. 11 12 En fait, la stéréo endoisomère est moins réactif que forme exo et désactive le catalyseur. 11 12 Ainsi, dans le passé, la préparation des polynorbornènes fonctionnels habituellement nécessaire la séparation des stéréo - isomères endo et exo, et seul le stéréoisomère exo- a été utilisé. Une telle procédure de séparation était temps, et a conduit à l'accumulation de stéréoisomères endo ne ayant pas réagi comme déchets indésirables.
Récemment, nous avons montré que la polymérisation de NBES fonctionnalisés contenant les deux stéréoisomères est en effet possible. 13 Nous avons ainsi pu préparer divers PNBEs substitués, contenant des groupes fonctionnels tels que les esters, les anhydrides, les aldéhydes, les imides, les alcools et les doubles liaisons. En raison de leur T g et la fonctionnalité élevée, ces polymères présentent des propriétés souhaitables. Nous décrivons ici deux méthodes pour préparer des polymères fonctionnels. Le premier conduit àla synthèse du poly polymère hydrosoluble (acide 5-norbornène-2-carboxylique), PNBE (CO 2 H), en utilisant un catalyseur au palladium cationique (figure 1). 13 14 Le même procédé de polymérisation peut être utilisé pour préparer PNBEs fonctionnels avec différentes fonctionnalités pendantes, tels que les esters, les alcools, les imides, les bromo-alkyle, les aldéhydes et les anhydrides. Dans nos mains, ce catalyseur au palladium cationique ne peut pas être utilisé pour des suspensions NBES contenant des doubles liaisons, tels que le 5-vinyl-2-norbornène. Dans ce cas, une insertion partielle de la double liaison de la suspension lors de la polymérisation conduit à la formation d'un matériau réticulé. Par conséquent, nous présentons une seconde méthode dédiée à la formation de poly (5-vinyl-2-norbornène), PNBE (vinyle), en utilisant du Pd 2 (dba) 3: AgSbF 6: PPh 3 en tant que catalyseur in situ. 14 Les groupes vinyle pendants du polymère sont ensuite époxydes, de conduire à thla formation d'e de l' PNBE (époxy) (figure 1). Les deux PNBE (CO 2 H) et PNBE (époxy) ont été trouvés pour conduire à la formation de résines thermodurcissables avec un T g aussi élevée que 350 ° C. 14 Ainsi, la méthode simple décrite ici permet de préparer efficacement des polymères ayant une Tg très élevée et ayant une variété de groupes fonctionnels qui peuvent être utilisés pour de nombreuses applications.
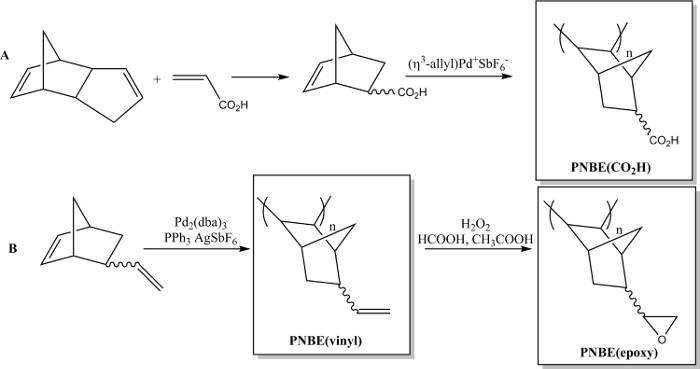
Figure 1: PNBEs fonctionnels préparés par Pd polymérisation catalysée. (A) préparation de PNBE (CO 2 H), (B) préparation de PNBE (vinyle) et PNBE (époxy). La liaison en pointillés indique un mélange d'isomères endo et exo. S'il vous plaît cliquer ici pour voir une version plus grande de cette figurer.
Protocole
1. Préparation de poly (acide 5-norbornène-2-carboxylique), PNBE (CO 2 H)
- Préparation de la NBE monomère (CO 2 H)
- Peser l' acide acrylique (AA) (327 g, 4,5 mol, 2 éq.) Et d' hydroquinone (4,9 g, 4,5 x 10 -2 mol, 0,02 éq.) Et les ajouter à un ballon de 2 litres à fond rond équipé d'un condenseur et une barre d'agitation magnétique. Chauffer le ballon à 150 ° C en utilisant un bain d'huile de silicone.
- Une fois que le reflux est réglé, ajouter DCPD (300 g, 2,3 mol, 1 éq.) En une seule portion, puis augmenter la température à 170 ° C.
- Laisser la réaction à cette température pendant 16 h. Observez le changement de couleur du clair au jaune-brun.
- Prélever un échantillon par extraction à l' aide d' une pipette Pasteur et l' analyser par RMN 1 H (CDCl 3 en utilisant comme solvant) 15. Observer l'apparition de NBE (signaux de double liaison entre 6,0 et 6,5 ppm, Figure 2 en haut). 16
- Purification de NBE (CO 2 H)
- Remplacer le condenseur avec une installation simple de distillation (un plateau) relié à un condenseur dans lequel l'eau froide est mise en circulation.
- Mettez la configuration de réaction sous vide réglé à env. 1 mmHg. Chauffer le mélange à 100 ° C, et de recueillir un liquide clair (environ 40 mL) qui peut être mis au rebut.
- Remplacer le flacon de collecte avec un ballon à fond rond de 500 mL. Chauffer le bain d'huile à 155 ° C et on observe la distillation goutte à goutte de NBE (CO 2 H) (317 g, 2,3 mol. Rendement = 98%). La distillation prend plus de 7 h.
- Analyser le liquide incolore par RMN 1 H pour évaluer la pureté ainsi que endo: exo proportions (Figure 2, en bas). 15 Les endo: exo rapport change avec le temps utilisé pour la distillation, ainsi qu'avec le temps de chauffage utilisé pour la préparation du NBE brut (CO 2 H). En règle générale, endo:exo rapports entre 50:50 et 80:20 sont obtenus (60:40 dans ce cas).
- Polymérisation de NBE (CO 2 H)
- Placer 300 g (2,3 mol, 5,000 éq.) De NBE (CO 2 H) dans un ballon à fond rond de 500 mL équipé d'un barreau d'agitation magnétique. Dégazer le liquide par barbotage d'azote pendant 30 min.
- Peser allylpalladium (II) dimère de chlorure, [PdCl (C 3 H 5)] 2 (76 mg, 4,2 x 10 -1 mmol, 1 éq. De Pd) et l' ajouter à la solution. Ajouter l' argent antimoniate AgSbF 6 (180 mg, 5,2 x 10 -1 mmol, 1,2 éq.).
- Sous agitation, on dissout le sel de Pd par chauffage à 70 ° C et maintenir la température à 70 ° C sous un léger flux d'azote. Après 7 à 8 h, l'agitation cesse en raison d'une augmentation de la viscosité.
- Arrêter la réaction après 36 h.
- On refroidit le ballon à fond rond avec de l'azote liquide. Avec une spatule, briser le polymère en petits morceaux.
- Dans un bécher de 2 L. equipé avec une barre d'agitation magnétique, ajouter 750 ml d'acétate d'éthyle. Ajouter les morceaux de polymère à l'acétate d'éthyle sous agitation vigoureuse. Continuer de remuer pendant 2 h.
- On filtre la solution sur un diamètre de 15 cm entonnoir de Büchner équipé d'un papier filtre (qualité 413, 15 cm de diamètre).
- Laver le polymère avec l'acétate d'éthyle trois fois (500 ml à chaque lavage). Sécher le polymère (123 g, 9,4 x 10 -1 mol, rendement = 41%) dans une étuve sous vide réglée à 50 ° C pendant 12 h.
2. Préparation du PNBE (vinyle)
- Polymérisation de NBE (vinyl)
- Dégazer le toluène (environ 200 ml) et NBE (vinyle) (environ 200 ml) en faisant barboter du N2 pendant 30 min et les placer dans une boîte à gants.
- À l'intérieur de la boîte à gants, le toluène de charge (100 g) dans un ballon à fond rond de 250 ml.
- Ajouter Pd 2 (dba) 3 (76 mg, 1,6 x 10 -1 mmol, 1 éq. De Pd), AgSbF 6 (68 mg, 2,0 x 10 -1 mmol, 1,2 éq.) et de triphénylphosphine PPh3 (43 mg, 1,6 x 10 -1 mmol, 1 éq.) successivement à la solution de toluène.
- Chauffer le mélange à 70 ° C jusqu'à dissolution complète se produit. Il se produit à moins de 10 min.
- On ajoute 100 g (8,0 x 10 -1 mol, 5,000 éq.) De NBE (vinyle) à cette solution pourpre.
- Sous agitation à 70 ° C pendant 72 h.
- Retirer la solution de la boîte à gants, et transférer la solution noire visqueuse à une bouteille en verre de 1 L contenant une barre d'agitation magnétique.
- Ajouter du toluène (200 ml) et mélanger.
- Ajouter de la poudre de silice (gel de silice 40-63 um, 10 g). On agite à la température ambiante pendant 16 h.
- Arrêtez de remuer et laisser la poudre reposer pendant au moins 2 h pour que les particules de silice à sedimentate.
- On filtre la solution sur un diamètre de 15 cm entonnoir de Büchner équipé d'un papier filtre (qualité 413, 15 cm de diamètre). Évitez de verser des particules de silice sédimentées dans l'entonnoir de Büchner.
- Rincer le pair de siliceticles avec du toluène (50 ml) et filtrer à travers l'entonnoir de Büchner.
- Ajouter du méthanol (1,2 L) à un 4 L bêcher muni d'un barreau d'agitation magnétique.
- Ajouter l'ensemble de la solution de toluène contenant le polymère au methanol progressivement, sous agitation vigoureuse, et on maintient l'agitation pendant 30 minutes.
- Filtrer le polymère sur un diamètre de 15 cm entonnoir de Büchner équipé d'un papier filtre (qualité 413, 15 cm de diamètre). Laver le polymère avec trois aliquotes de méthanol (400 ml chacun). Changer le papier filtre entre chaque lavage.
- Évaluer la pureté du polymère par RMN 1 H dans CDCl 3, afin de voir si le monomère résiduel est présent (signaux double liaison entre 6,0 et 6,3 ppm). 15, 16 Si tel est le cas, continuer le lavage avec du methanol.
- Sécher le polymère (75 g, 6,3 x 10 -1 mol, rendement = 78%) sous vide à la température ambiante pendant une nuit.
3.Préparation de PNBE (époxy)
- Époxydation du PNBE (vinyle)
- Ajouter 150 g de dichlorométhane dans un ballon à fond rond de 500 ml équipé d'un agitateur magnétique et d'un condenseur.
- Ajouter PNBE (vinyle) (15 g, 1,3 x 10 -1 mol, 1 éq.) Sous agitation jusqu'à dissolution complète.
- Placer la fiole dans un bain de glace et le laisser refroidir pendant 15 min.
- Dans un récipient séparé, mélanger l' acide formique (30 g, 6,5 x 10 -1 mol, 5 éq.) Et de l' acide acétique (5 g, 8,3 x 10 -2 mol, 0,6 éq.). Ajouter les acides combinés à la solution de polymère.
- Laisser refroidir pendant 15 min.
- Ajouter une solution de peroxyde d'hydrogène aqueux (30%) (75 g, 6,5 x 10 -1 mol, 5 éq.) À la solution de polymère.
- Agiter pendant 18 h. Le bain de glace n'a pas besoin d'être retiré, lorsque la température augmente progressivement jusqu'à la température ambiante.
- Prenez un petit échantillon, précipiter le polymère avec de l' acétone, et l' analyse par RMN 1 H dans CD Cl 3. 15 Si le signal de la double liaison (δ = 4.5-6.0 ppm) est suffisamment diminué (Figure 3), passer à l'étape suivante. Typiquement, le rapport de l'intégrale des doubles liaisons vers les autres protons est inférieur à 01:20 (1:83 sur la figure 3). Sinon, poursuivre la réaction.
- Ajouter de l'acétone (750 ml) à une 4 L bêcher muni d'un barreau d'agitation magnétique.
- Ajouter la solution de polymère à l'acétone progressivement sous agitation vigoureuse pendant 15 min.
- Filtrer le polymère sur un diamètre de 15 cm entonnoir de Büchner équipé d'un papier filtre (qualité 413, 15 cm de diamètre).
- Laver le polymère à quatre reprises avec de l'acétone (200 ml à chaque fois).
- Changer le papier filtre entre chaque lavage.
- Sécher le polymère (7,5 g) sous vide à température ambiante pendant une nuit.
g "/>
Figure 2: 1 spectres RMN H du brut ( en haut) et purifié ( en bas) NBE (CO 2 H). Le produit purifié est obtenu par simple distillation. Notez les pics qui sont utilisés pour évaluer l'endo: exo ratio. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
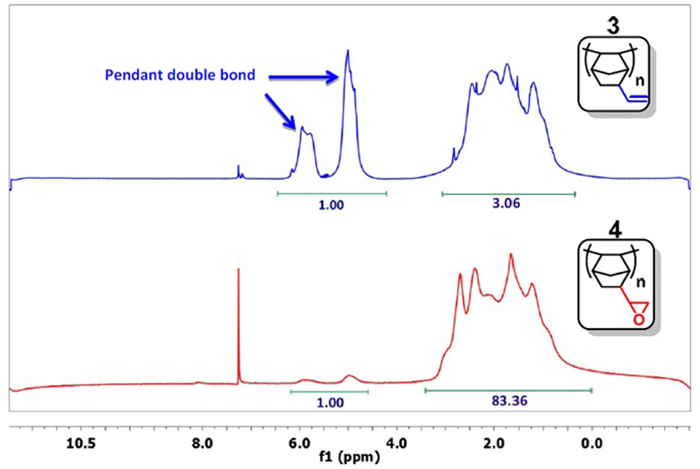
Figure 3: 1 spectres RMN H du PNBE (vinyle) (bleu) et PNBE (époxy) (rouge). Noter le rapport 1: 3 entre les intégrales du groupe vinyle (δ = 4,5 à 6,0 ppm) et les autres protons du PNBE (vinyle) spectre. Après réaction avec H 2 O 2, le rapport diminue à 1:83, ce qui confirme que l' époxydation du groupe vinyle est survenue.nk "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
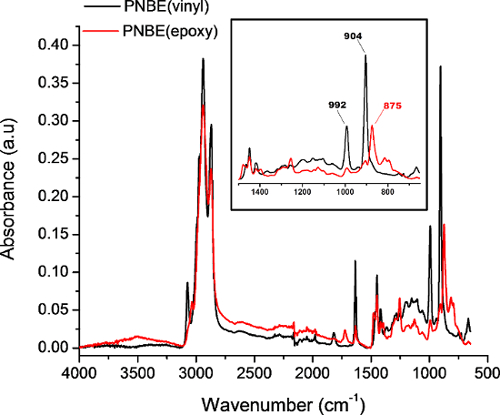
Figure 4: spectres FTIR du PNBE (vinyle) (noir) et PNBE (époxy) acquise en mode totale atténuée de réflectance. Insérer montre un zoom des bandes caractéristiques de PNBE (vinyle) et PNBE (époxy). Les 902 cm -1 et 992 cm -1 bandes correspondent à la liaison C = CH hors du plan de cintrage, tandis que la bande 875 cm - 1 correspond à la déformation du cycle époxyde. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Résultats
Les monomères NBE sont préparés par une simple réaction de Diels-Alder de DCPD et d'un diénophile convenable, par exemple l'acide acrylique (AA). Normalement, DCPD est fissuré pour obtenir cyclopentadiène (CPD) avant la réaction. 17 CPD fraîchement concassé est ensuite engagé dans la réaction de Diels-Alder. Cependant, dans ce protocole, les deux étapes de craquage et de Diels-Alder sont effectuées de manière concomitante, dans une réaction...
Discussion
La méthode proposée ici est simple, et facilement prête à plus grande échelle. Tous les produits chimiques peuvent être utilisés tels que reçus sans autre purification. Notez que l' exécution de la réaction à une échelle inférieure (par exemple des échelles ≤1 g) , on obtient généralement des rendements plus faibles en raison d'une perte inévitable de matériel lors de la manipulation et de la collection.
Les catalyseurs sont formés in situ lors ...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
The authors acknowledge funding from Fonds de Recherche du Québec - Nature et Technologies, from Conseil Recherches en Sciences Naturelles et Génie (program INNOV) and PrimaQuébec.
matériels
| Name | Company | Catalog Number | Comments |
| acrylic acid | Sigma-Aldrich | 147230 | |
| hydroquinone | Sigma-Aldrich | H9003 | |
| dicyclopendadiene | Sigma-Aldrich | 454338 | |
| palladium allyl dichloride dimer | Sigma-Aldrich | 222380 | |
| silver hexfluoro antimonate | Sigma-Aldrich | 227730 | |
| liquid nitrogen | Local Facility | NA | |
| ethyl acetate | Fischer Scientific | E14520 | |
| 5-vinyl-2-norbornene | Sigma-Aldrich | 148679 | |
| toluene | Fischer Scientific | T290-4 | |
| palladium dba | Sigma-Aldrich | 227994 | |
| triphenyl phosphine | Sigma-Aldrich | 93090 | |
| silica gel 40-63 microns | Silicycle | Siliaflash | |
| methanol | Fischer Scientific | BPA412-20 | |
| dichloromethane | EMD Millipore | DX08311 | |
| formic acid | Sigma-Aldrich | F0507 | |
| acetic acid | Sigma-Aldrich | 320099 | |
| hydrogen peroxide solution | Sigma-Aldrich | 216763 | |
| acetone | Fischer Scientific | A18-200 |
Références
- Gaylord, N. G., Mandal, B. M., Martan, M. Peroxide-induced polymerization of norbornene. J. Polym. Science, Polym. Lett. Ed. 14 (9), 555-559 (1976).
- Janiak, C., Lassahn, P. G. The vinyl homopolymerization of norbornene. Macromol. Rapid Comm. 22 (7), 479-493 (2001).
- Bielawski, C. W., Grubbs, R. H. Living ring-opening metathesis polymerization. Prog. Polym. Sci. 32 (1), 1-29 (2007).
- Blank, F., Janiak, C. Metal catalysts for the vinyl/addition polymerization of norbornene. Coord. Chem. Rev. 253 (7-8), 827-861 (2009).
- Kaminsky, W., Boggioni, L., Tritto, I. Cycloolefin polymerization. Polymer Science: A Comprehensive Reference, 10 Volume Set. 3, 843-873 (2012).
- Boggioni, L., Tritto, I. State of the art of cyclic olefin polymers. MRS Bull. 38 (3), 245-251 (2013).
- Goodall, B., Rieger, B., Baugh, L., Kacker, S., Striegler, S. Cycloaliphatic polymers via late transition metal catalysis. Late Transition Metal Polymerization Catalysis. , 101-154 (2003).
- Zhou, W., He, X., Chen, Y., Chen, M., Shi, L., Wu, Q. Vinyl-addition copolymerization of norbornene and polar norbornene derivatives using novel bis(β-ketoamino)Ni(II)/B(C6F5)3/AlEt3 catalytic systems. J. Appl. Polym. Sci. 120 (4), 2008-2016 (2011).
- Müller, K., Jung, Y., Yoon, D. Y., Agarwal, S., Greiner, A. Vinyl-type polymerization of alkylester-substituted norbornenes without endo/exo separation. Macromol. Chem. Phys. 211 (14), 1595-1601 (2010).
- Boffa, L. S., Novak, B. M. Copolymerization of polar monomers with olefins using transition-metal complexes. Chem. Rev. 100 (4), 1479-1494 (2000).
- Funk, J. K., Andes, C. E., Sen, A. Addition Polymerization of Functionalized Norbornenes: The Effect of Size Stereochemistry, and Coordinating Ability of the Substituent. Organometallics. 23 (8), 1680-1683 (2004).
- Hennis, A. D., Polley, J. D., et al. Novel, efficient, palladium-based system for the polymerization of norbornene derivatives: Scope and mechanism. Organometallics. 20 (13), 2802-2812 (2001).
- Commarieu, B., Claverie, J. P. Bypassing the lack of reactivity of endo-substituted norbornenes with the catalytic rectification-insertion mechanism. Chem. Sci. 6 (4), 2172-2182 (2015).
- Commarieu, B., Potier, J., et al. Ultrahigh Tg epoxy thermosets based on insertion polynorbornenes. Macromoecules. 49 (3), 920-925 (2016).
- Pirrung, M. C. . The Synthetic Organic Chemist's Companion. , (2007).
- Kanao, M., Otake, A., Tsuchiya, K., Ogino, K. Stereo-selective synthesis of 5-norbornene-2-exo-carboxylic acid-Rapid isomerization and kinetically selective hydrolysis. Int. J. Org. Chem. 2 (1), 26-30 (2012).
- Huertas, D., Florscher, M., Dragojlovic, V. Solvent-free Diels-Alder reactions of in situ generated cyclopentadiene. Green Chem. 11 (1), 91-95 (2009).
- Pierre, F., Commarieu, B., Tavares, A. C., Claverie, J. High Tg sulfonated insertion polynorbornene ionomers prepared by catalytic insertion polymerization. Polymer. 86, 91-97 (2016).
- Woo, H. G., Li, H. . Advanced functional materials, Chapter 1.6.8,30. 1, (2011).
- Kim, D. -. G., Bell, A., Register, R. a. Living vinyl addition polymerization of substituted norbornenes by a t-Bu3P-Ligated Methylpalladium Complex. ACS Macro Letters. 4 (3), 327-330 (2015).
- Seung, H., S, A., Baek, K., Sang, S., Intech, S. i. l. a. g. u. i. ,. M. .. A. .. ,. e. d. .. ,. Low Dielectric Materials for Microelectronics. Dielectric Material. , 59-76 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon