Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung und Auswertung der
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Here, we describe a protocol for radiolabeling and in vivo testing of tridentate 99mTc(I) chelate-tetrazine derivatives for pre-targeting and bioorthogonal chemistry.
Zusammenfassung
Pre-targeting combined with bioorthogonal chemistry is emerging as an effective way to create new radiopharmaceuticals. Of the methods available, the inverse electron demand Diels-Alder (IEDDA) cycloaddition between a radiolabeled tetrazines and trans-cyclooctene (TCO) linked to a biomolecule has proven to be a highly effective bioorthogonal approach to imaging specific biological targets. Despite the fact that technetium-99m remains the most widely used isotope in diagnostic nuclear medicine, there is a scarcity of methods for preparing 99mTc-labeled tetrazines. Herein we report the preparation of a family of tridentate-chelate-tetrazine derivatives and their Tc(I) complexes. These hitherto unknown compounds were radiolabeled with 99mTc using a microwave-assisted method in 31% to 83% radiochemical yield. The products are stable in saline and PBS and react rapidly with TCO derivatives in vitro. Their in vivo pre-targeting abilities were demonstrated using a TCO-bisphosphonate (TCO-BP) derivative that localizes to regions of active bone metabolism or injury. In murine studies, the 99mTc-tetrazines showed high activity concentrations in knees and shoulder joints, which was not observed when experiments were performed in the absence of TCO-BP. The overall uptake in non-target organs and pharmacokinetics varied greatly depending on the nature of the linker and polarity of the chelate.
Einleitung
99m Tc bleibt die dominierende Radioisotop in der diagnostischen Nuklearmedizin verwendet wird , mit mehr als 50 Millionen Bildgebungsverfahren pro Jahr weltweit durchgeführt 1, 2, 3. Die Mehrheit der 99m Tc Mittel werden klinisch Perfusion Radiopharmaka. Es gibt eine begrenzte Anzahl von aktiv gezielte Verbindungen , in denen 99m Tc gerichtet ist eine spezifische Biomarker durch Ligation an ein Targeting - Konstrukt zu binden. Die Erzeugung gezielter 99m Tc - Radiopharmaka wird häufig durch den Einfluß von 99m Tc-Ligand - Komplexe auf die Fähigkeit des dirigierenden Moleküls zu binden , um die Biomarker von Interesse gehinderte oder die Isotopen - Halbwertszeit nicht lang genug ist für die Verwendung mit höherem Molekulargewicht Biomoleküle wie Antikörper. Letzteres erfordert üblicherweise mehrere Tage vor Bildern, um für das Biomolekül erworben werden von Nicht-Ziel zu löschen tiss ues. Pre-Targeting bietet einen alternativen Ansatz, diese Herausforderungen zu überwinden.
Pre-Targeting mit bioorthogonale Chemie kombiniert wurde ein effektiver Weg gezeigt werden , für die Entwicklung neuer molekularer Bildgebungssonden sowohl für Fluoreszenz und Radio-Imaging - 4, 5, 6, 7, 8. Die inversem Elektronenbedarf Diels-Alder (IEDDA) Reaktion zwischen 1,2,4,5-Tetrazin (Tz) und trans -Cycloocten (TCO) -Derivate, wie in Figur 1 gezeigt ist , hat sich als besonders wirksam 6 erwiesen. Die IEDDA Reaktion mit diesen Komponenten können schnell Kinetik in PBS (k 2 ≈ 6000 M -1 s -1) und eine hohe Selektivität aufweisen, wodurch es ideal für in - vivo - Pre-Targeting - Anwendungen macht 9, 10.
e_content "> Die am häufigsten verwendete Ansatz umfasst ein TCO-derived Targeting - Vektor Verwaltung und eine ausreichende Verzögerung Folgezeit ein radioaktiv markiertes Tetrazin verabreicht. Radiolabeled Tetrazinen basierend auf 11 C, 18 F, 64 Cu, 89 Zr und 111 In gewesen 11 berichtete, 12, 13, 14, 15. im Gegensatz dazu gibt es nur einen Bericht eines 99m ist Tz-Tc markiert, die eine HYNIC - Typ - Liganden wurde unter Verwendung von der Verwendung von Co-Liganden erfordern Protein zu verhindern Bindung und den Abbau in vivo 16. Alternativ berichten wir hier die Synthese von 99m Tc (I) markiertem Tetrazinen eine Familie von Liganden , die mit einem [99m Tc (CO) 3] + Kern stabil dreizähnige Komplexe bilden. 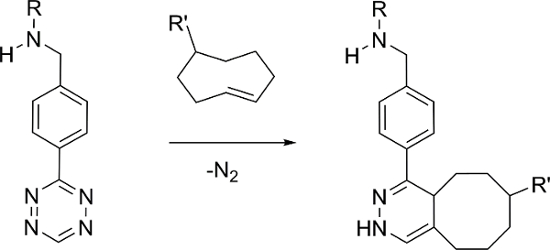
Abbildung 1: Die bioorthogonale IEDDA Reaktion zwischen Tetrazin und trans -Cycloocten. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Die Familie von Liganden hergestellt enthalten dreizähnigen Chelate , die in der Polarität und der Natur der Linkergruppe zwischen der Metallbindungsbereich und dem Tz (Abbildung 2) variieren. Das Ziel war es, ein 99m zu identifizieren Tc-Tetrazin , dass effektiv lokalisieren und reagieren mit TCO-markierten Stellen in vivo konstruieren konnte und schnell klar , wenn sie nicht gebunden, um eine hohe Ziel-zu-Nichtziel - Verhältnisse zu erhalten. Um die Liganden zu testen, ein TCO-Derivat einer Bisphosphonat (TCO-BP) wurde 17 verwendet. Wir haben bereits gezeigt, dass TCO-BP zu den Bereichen der aktiven Knochenmetabolismus lokalisiert und reagieren mitradiomarkierten Tetrazinen in vivo 18. Es ist eine bequeme Reagenz neue Tetrazinen zu testen, da es in einem einzigen Schritt hergestellt werden können, und Experimente können in normalen Mäusen durchgeführt werden, in denen die Lokalisierung in erster Linie in den Gelenken (Knie und Schultern) auftritt.
Access restricted. Please log in or start a trial to view this content.
Protokoll
In Tierstudien wurden von der Tierforschung Ethikrat an der McMaster University in Übereinstimmung mit Canadian Council on Animal Care (CCAC) Richtlinien zugelassen.
1. Die radioaktive Markierung von Tz-dreizähnigen Liganden mit 99m Tc
ACHTUNG: Die folgenden Verfahren erfordern die Verwendung von radioaktiven Verbindungen. Die Arbeiten sollten nur in einem zugelassenen Labor mit der Einhaltung von Sicherheits- und Entsorgungsvorschriften erfolgen. Mikrowellen-Reaktionen sollten in einer Mikrowelle durchgeführt werden, die speziell für die chemische Synthese konstruiert.
- Synthese von [99m Tc (CO) 3 (H 2 O) 3] + 19, 20
- In einem Mikrowellenfläschchen kombinieren 8 mg K 2 [BH 3 CO 2], 15 mg Na 2 CO 3, 20 mg Na 2 B 4 O 7 · 10H 2 O und 25 mg KOCO [CH (OH)]2 COONa · 4H 2 O Purge das Fläschchen für 10 Minuten mit Argongas.
- 4 ml 99m TcO 4 - (~ 1,100 MBq, ~ 30 mCi) in 0,9% Kochsalzlösung in das Fläschchen.
- Die Reaktion wird in einer Mikrowelle für 3,5 min bei 110 ° C nach 10 s Rühren eine gute Durchmischung der Reagenzien zu gewährleisten.
- Der pH-Wert der Lösung auf 3,5-4 mittels ~ 400 & mgr; l von 1 M HCl. Stellen Sie sicher, pH-Papier verwenden.
- Die radioaktive Markierung von Tetrazin - Liganden 1-5
- Man löst 2 mg jedes Liganden (Verbindungen 1-5) in 250 & mgr; l MeOH 21.
- Nach Eintragen von 250 & mgr; l [99m Tc (CO) 3 (H 2 O) 3] + (~ 74 MBq, ~ 2 mCi) zu jeder Lösung.
- Das Reaktionsgemisch wird eine Mikrowelle für 20 min bei 60 ° C verwendet wird.
Hinweis: dieser Schritt für alle 5 Tetrazinen identisch war. - Für Verbindungen 2- 5, verdampfe das Lösungsmittel und Wieder DISSOLve die resultierenden Produkte in 1 ml 1: 1 v / v DCM: TFA.
- Wärme , die gelösten Reaktionsprodukte (2-5) bei 60 ° C in einer Mikrowelle für 6 min (2-4) oder 10 min (5).
- Nach dem Abkühlen auf Raumtemperatur, dampfe das Lösungsmittel unter Verwendung eines Verdampfers (36 ° C, 8 mbar, 3 min, 6000 rpm) und lösen die getrocknete Verbindung in 1: 1 ACN: H 2 O oder 1: 1 MeOH: H 2 O, vor der HPLC-Reinigung.
- Reinige den 99m Tc-markierten Verbindungen (1-5), einschließlich des markierten Produkts von unmarkiertem Liganden Tetrazin Trennung unter Verwendung von HPLC (C18 Umkehrphase). Typischerweise verwenden eines Elutionsgradienten von 30:70 ACN: H 2 O (beide mit 0,1% TFA) bis 40:60 ACN: H 2 O über 20 min (18 min) und ein C 18 analytisches 4,6 x 100 mm Säule. Verwenden sowohl UV (254 nm) und gamma-Detektion.
- Nehmen Sie eine kleine Probe jedes Produkts und vergleichen ihre HPLC-Retentionszeit, die der Co-injektiert, nicht-radioaktive, Re-markierten Standards (0,125 mg in 20% Methanol-H 2 O). Die Re-markiertem Standard wird in der UV - HPLC - Spur identifiziert, und zur gleichen Zeit wie die 99m Tc-markierte Verbindung , in der γ-HPLC - Spur eluieren. Diese Co-Injektion zeigt Peaks bei vergleichbaren Retentionszeiten, die Identität der 99m Tc-Verbindung bestätigt gekennzeichnet.
- Dampfe das Lösungsmittel von HPLC-Fraktionen unter Verwendung eines Verdampfers (36 ° C, 8 mbar, 3 min, 6.000 rpm).
- Formulieren der gereinigten Verbindung in einer Konzentration von 7,4 kBq / & mgr; l in PBS, enthaltend 0,5% BSA und 0,01% Tween-80.
- Um die markierten Verbindungen sind stabil zu gewährleisten, führen Sie eine in - vitro - Stabilitätsstudie. Inkubieren der formulierten Verbindung bei 37 ° C für 1, 4 und 6 h, eine kleine Menge (3,7 MBq) der Mischung auf dem HPLC an jedem Zeitpunkt Injizieren Stabilität zu bewerten.
2. Pre-gezielte Bio-Verteilung Studies
- Vorbereitung der Tiere
- Mit 7-9 Wochen alt, weiblich Balb / c-Mäuse (n = 3), zu verwalten TCO-BP in Kochsalzlösung (20 mg / kg) (5 ug / ul) formuliert, über Schwanzveneninjektion.
- Bewegen Sie die Maus in der physischen Rückhaltevorrichtung, und identifizieren die sich Venen an den Seitenflächen des Schwanzes und wischen Sie mit einem Alkoholtupfer. Bei etwa 2 cm vom Ende des Schwanzes, legen Sie eine 30-Gauge-Nadel in einem flachen Winkel parallel zur Ader. Langsam drücken Sie den Kolben Nadel zu injizieren, entfernen und reinigen Gazeschwamm an der Injektionsstelle mit leichtem Druck, bis die Blutung aufhört gelten.
- Bei 1 h nach der Injektion von TCO-BP, verabreichen ~ 0,74 MBq (20 uCi) von 99m Tc-Tetrazin in 100 ul 0,5% BSA formuliert, 0,01% Tween-80 in PBS, via Schwanzveneninjektion.
- Bio-Verteilungsstudien
- Bei dem gewünschten Zeitpunkt (t = 6 h), anästhesieren die Mäuse unter Verwendung von 3% Isofluran und 2% Sauerstoff-Gasgemisch. Demonstrieren Sie ein zue Prise Rückzug auf der narkotisierten Maus, um sicherzustellen, dass sie unter chirurgische Ebene der Anästhesie sind.
- Sammeln Blut (1 ml) über eine Spritze Herzpunktur vorbehandelt mit Heparin verwendet wird. Bewegen Sie die Maus auf dem Rücken mit der Nase in die Nase Kegel für die weitere Anästhesie und suchen Sie den Xiphoidbasis auf das Tier.
- Legen Sie eine 25 G-Nadel, leicht nach links von der Mittellinie des Tieres unter dem Xiphoidbasis, bei einem Winkel von 20 °. Voll führen Sie die Nadel, und langsam auf den Kolben zurückziehen Blut in der Nadel-Ansatz, um zu sehen, ob das Herz durchbohrt wurde. Etwas die Nadel nachstellen, während der Kolben bei Bedarf halten, um das Herz zu durchbohren. ziehen langsam Blut in die Spritze.
- Euthanize das Tier durch Genickbruch, während der Narkose.
- Legen Sie jedes Tier in einen Plastikbeutel und verwenden Sie einen Dosiskalibrators (99m Tc - Einstellung) , um den ganzen Körper Aktivitätsniveau zu messen.
- Sammeln Sie die folgenden Gewebe und Flüssigkeiten in vorge wiegened Zählrohre: Blut, Knochen (Knie und Schulter), Gallenblase, Nieren, Leber, Magen (mit Inhalt), Dünndarm (mit Inhalt), Dickdarm und Blinddarm (mit Inhalt), der Schilddrüse und der Trachea, der Harnblase mit Urin und Schwanz.
- Spülen Sie geeignete Gewebe (ohne Blut, Gallenblase und Harnblase) in PBS Blut zu entfernen und trocken tupfen, bevor das Gewebe in geeigneten Zählrohre platzieren.
- Platzieren Sie Tierkadaver in eine Plastiktüte und messen Rest ganzen Körper Aktivität eine Dosis-Kalibrator verwenden.
- Wiegen Sie jedes Röhrchen eine Gewebeprobe enthält. Subtract Anfangsgewicht des Rohrs Masse des Gewebes zu erhalten.
- Verwenden , um eine Dosis - Kalibrator (99m Tc - Einstellung) die Menge an Aktivität in einer Testprobe (100 ul) zu der Zeit der Einspritzung für jede Maus gemessen.
ANMERKUNG: Diese Testprobe ist gleich dem Injektionsvolumen, wodurch die Aktivitätszählung zum Zeitpunkt der Injektion geben. - Zum Zeitpunkt der Gewebemessung eineliquot 5 ul des zuvor verwendeten Testprobe. Verwenden , um einen Multidetektor - Gammazähler (99m Tc - Einstellung) und zähle die Zählung pro Minute (CPM) für die 5 & mgr; l Testprobe zu erhalten.
- Verwenden Sie die beiden erhaltenen Werte in 2.2.9 und 2.2.10 die Aktivität und CPM - Beziehung 1 unter Verwendung der Gleichung zu berechnen einen Umrechnungsfaktor zu erhalten (CPM uCi -1).
(1)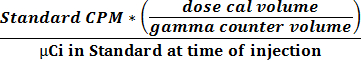
- Verwenden, um die Gamma-Zähler die Menge an Radioaktivität in jedem Gewebe oder Flüssigkeitsprobe zu messen.
- Verwenden der Gleichung 1 die Aktivitätsmenge in jedem Gewebe oder Flüssigkeit, die zum Zeitpunkt der Messung in Bezug auf die gesamten injizierten Dosis berechnet. Dieser Wert wird dann durch Organgewicht normalisiert und als Prozent injizierte Dosis pro Gramm (dh% ID / g) Gewebe berichtet.
- Führen Sie die Schritte 2.1.2 bis 2.2.13 ein negatives Kontrollexperiment durchzuführen unter Verwendung der 99m Tc-markierten Tetrazin - Liganden in der Absence von TCO-BP. Opfer-Mäuse (n = 3) bei 0,5, 1, 4 und 6 h nach der Injektion und zu erhalten Gewebe oder Flüssigkeit, wie oben beschrieben.
Access restricted. Please log in or start a trial to view this content.
Ergebnisse
Die Liganden wurden unter Verwendung von verschiedenen Linkern synthetisiert und Chelatoren über eine einfache reduktive Aminierung Strategie (Abbildung 2), gefolgt von Kupplung des Produktes mit einem handelsüblichen Tetrazin 22, 23. Die radioaktive Markierung wurde mit der gleichen Methode für alle Verbindungen durchgeführt und war in hohem Maße reproduzierbar. Das Verfahren wurde durch Variieren des pH, d...
Access restricted. Please log in or start a trial to view this content.
Diskussion
Eine Sammlung von Tetrazin-linked dreizähnigen Chelate verschiedener Polaritäten wurde hergestellt, und die Nützlichkeit der 99m Tc - Komplexe in der IEDDA Reaktion mit einer TCO - Derivat in vivo bewertet. Eine effektive und reproduzierbare 99m Tc wurde Markierungsverfahren für fünf Tetrazin-Chelate entwickelt, wobei der Ligand - Konzentration 10 -3 M. war der Markierungsschritt durch Entfernung der Schutzgruppe von t- Butyl - Gruppen (für die Verbindungen
Access restricted. Please log in or start a trial to view this content.
Offenlegungen
The authors declare they have no competing financial interests.
Danksagungen
This work supported by research grant funding from the Natural Sciences and Engineering Research Council (NSERC) of Canada, the Ontario Institute for Cancer Research (OICR, #P.SI.015.8), and the Canadian Cancer Society (CCS, #703857). The authors acknowledge the contributions of Dr. Denis Snider who provided assistance in preparing the manuscript.
Access restricted. Please log in or start a trial to view this content.
Materialien
| Name | Company | Catalog Number | Comments |
| Argon gas | Alphagaz | --- | --- |
| Na2CO3 | EMD Millipore | 106395 | --- |
| Na2B4O7·10H2O | Anachemia | S9640 | --- |
| KNaC4H4O6·4H2O | Anachemia | 217255 | --- |
| Technelite 99mTc generator | Lantheus medical imaging | --- | Source of 99mTcO4- |
| 0.9% Saline | Lantheus medical imaging | --- | To elute generator |
| 1 M HCl | Lab Chem | --- | --- |
| MeOH | Caledon | --- | --- |
| ACN | Caledon | --- | HPLC grade |
| Millipore H2O | Thermo Fisher Scientific | Barnstead Nanopure | --- |
| DCM | Caledon | --- | --- |
| TFA | Caledon | --- | --- |
| PBS | Thermo Fisher Scientific | 10010023 | pH 7.4 1x |
| BSA | Sigma Aldrich | A7906 | --- |
| Tween80 | Sigma Aldrich | P8047 | --- |
| Isoflurane | CDMV | 108737 | Supplier: Fresenius Kabi Animal Health |
| HPLC | Waters | 1525 Binary Pump, 2998 Photodiodde Array Detector, E-SAT/IN, Bioscan Flowcount PMT detector (item # 15590) | --- |
| HPLC column for analysis and purification of compounds 2-4 | Phenomenex | 00G-4435-E0 | Gemini® 5 µm C18 110 Å, LC Column 250 x 4.6 mm |
| HPLC column for analysis and purification of compounds 1 and 5 | Waters | 186003115 | XBridge BEH C18 Column, 130 Å, 5 µm, 4.6 mm x 100 mm |
| Microwave Reactor | Biotage | Initiator 8 | --- |
| Biotage V10 Evaporator | Biotage | Serial # V1041 | --- |
| Dose calibrator | Capintec, Inc. | CRC-25R | --- |
| Gamma counter | Perkin Elmer | Wizard 1470 Automatic Gamma Counter | --- |
| Animal room scale | Mettler Toledo | XP105 Delta Range | --- |
| Microwave vials | Biotage | 355629 | 0.5-2 mL |
Referenzen
- Jurisson, S. S., Lydon, J. D. Potential Technetium Small Molecule Radiopharmaceuticals. Chem. Rev. 99 (9), 2205-2218 (1999).
- Kluba, C. A., Mindt, T. L. Click-to-chelate: Development of Technetium and Rhenium-Tricarbonyl Labeled Radiopharmaceuticals. Molecules. 18, 3206-3226 (2013).
- Amato, I. Nuclear Medicines Conundrum. Chem. Eng. News. 87 (36), 58-70 (2009).
- Hnatowich, D. J., Virzi, F., Rusckowski, M. Investigations of Avidin and Biotin for Imaging Applications. J. Nucl. Med. 28 (8), 1294-1302 (1987).
- Blackman, M. L., Royzen, M., Fox, J. M. Tetrazine Ligation: Fast Bioconjugation Based on Inverse-Electron-Demand Diels-Alder Reactivity. J. Am. Chem. Soc. 130 (41), 13518-13519 (2008).
- Devaraj, N. K., Weissleder, R., Hilderbrand, S. A. Tetrazine-Based Cycloadditions: Application to Pretargeted Live Cell Imaging. Bioconjugate Chem. 19 (12), 2297-2299 (2008).
- Rossin, R., et al. In Vivo Chemistry for Pretargeted Tumor Imaging in Live Mice. Angew. Chem., Int. Ed. 49 (19), 3375-3378 (2010).
- Zeglis, B. M., et al. Optimization of a Pretargeted Strategy for the PET Imaging of Colorectal Carcinoma via the Modulation of Radioligand Pharmacokinetics. Mol. Pharmaceutics. 12 (10), 3575-3587 (2015).
- Rossin, R., et al. Highly Reactive trans-Cyclooctene Tags with Improved Stability for Diels-Alder Chemistry in Living Systems. Bioconjugate Chem. 24 (7), 1210-1217 (2013).
- Rossin, R., Robillard, M. S. Pretargeted Imaging Using Bioorthogonal Chemistry in Mice. Curr. Opin. Chem. Biol. 21, 161-169 (2014).
- Denk, C., et al. Development of a 18F-Labeled Tetrazine with Favorable Pharmacokinetics for Bioorthogonal PET Imaging. Angew. Chem., Int. Ed. 53 (36), 9655-9659 (2014).
- Herth, M. M., Andersen, V. L., Lehel, S., Madsen, J., Knudsen, G. M., Kristensen, J. L. Development of a 11C-labeled Tetrazine for Rapid Tetrazine-Trans-Cyclooctene Ligation. Chem. Commun. 49 (36), 3805-3807 (2013).
- Li, Z., et al. Tetrazine-Trans-Cyclooctene Ligation for the Rapid Construction of 18F Labeled Probes. Chem. Commun. 46 (42), 8043(2010).
- Nichols, B., Qin, Z., Yang, J., Vera, D. R., Devaraj, N. K. 68Ga Chelating Bioorthogonal Tetrazine Polymers for the Multistep Labeling of Cancer Biomarkers. Chem. Commun. 50 (40), 5215-5217 (2014).
- Zeglis, B. M., et al. A Pretargeted PET Imaging Strategy Based on Bioorthogonal Diels-Alder Click Chemistry. J. Nucl. Med. 54 (8), 1389-1396 (2013).
- García, M. F., et al. 99mTc-Bioorthogonal Click Chemistry Reagent for In Vivo Pretargeted Imaging. Bioorg. Med. Chem. 24 (6), 1209-1215 (2016).
- Russell, R. G. G. Bisphosphonates: The First 40 Years. Bone. 49 (1), 2-19 (2011).
- Yazdani, A., et al. A Bone-Seeking Trans-Cyclooctene for Pretargeting and Bioorthogonal Chemistry: A Proof of Concept Study Using 99mTc and 177Lu-Labeled Tetrazines. J. Med. Chem. , (2016).
- Alberto, R., et al. A Novel Organometallic Aqua Complex of Technetium for the Labeling of Biomolecules: Synthesis of [99mTc(OH2)3(CO)3]+ from [99mTcO4]- in Aqueous Solution and its Reaction with a Bifunctional Ligand. J. Am. Chem. Soc. 120 (31), 7987-7988 (1998).
- Alberto, R., Ortner, K., Wheatley, N., Schibli, R., Schubiger, A. P. Synthesis and properties of boranocarbonate: A convenient in situ CO source for the aqueous preparation of [99mTc(OH2)3(CO)3. J. Am. Chem. Soc. 123 (13), 3135-3136 (2001).
- Lu, G., et al. Synthesis and SAR of 99mTc/Re-labeled Small Molecule Prostate Specific Membrane Antigen Inhibitors with Novel Polar Chelates. Bioorg. Med. Chem. Lett. 23 (5), 1557-1563 (2013).
- Maresca, K. P., et al. Small Molecule Inhibitors of PSMA Incorporating Technetium-99m for Imaging Prostate Cancer: Effects of Chelate Design on Pharmacokinetics. Inorg. Chim. Acta. 389, 168-175 (2012).
- Bartholomä, M. D., et al. Insight into the Mode of Action of Re(CO)3 Thymidine Complexes. ChemMedChem. 5 (9), 1513-1529 (2010).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten