Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подготовка и оценка
В этой статье
Резюме
Here, we describe a protocol for radiolabeling and in vivo testing of tridentate 99mTc(I) chelate-tetrazine derivatives for pre-targeting and bioorthogonal chemistry.
Аннотация
Pre-targeting combined with bioorthogonal chemistry is emerging as an effective way to create new radiopharmaceuticals. Of the methods available, the inverse electron demand Diels-Alder (IEDDA) cycloaddition between a radiolabeled tetrazines and trans-cyclooctene (TCO) linked to a biomolecule has proven to be a highly effective bioorthogonal approach to imaging specific biological targets. Despite the fact that technetium-99m remains the most widely used isotope in diagnostic nuclear medicine, there is a scarcity of methods for preparing 99mTc-labeled tetrazines. Herein we report the preparation of a family of tridentate-chelate-tetrazine derivatives and their Tc(I) complexes. These hitherto unknown compounds were radiolabeled with 99mTc using a microwave-assisted method in 31% to 83% radiochemical yield. The products are stable in saline and PBS and react rapidly with TCO derivatives in vitro. Their in vivo pre-targeting abilities were demonstrated using a TCO-bisphosphonate (TCO-BP) derivative that localizes to regions of active bone metabolism or injury. In murine studies, the 99mTc-tetrazines showed high activity concentrations in knees and shoulder joints, which was not observed when experiments were performed in the absence of TCO-BP. The overall uptake in non-target organs and pharmacokinetics varied greatly depending on the nature of the linker and polarity of the chelate.
Введение
99m Tc остается доминирующим радиоизотопные используется в диагностической ядерной медицины, с более чем 50 миллионов процедур визуализации , проведенных за год во всем мире 1, 2, 3. Большинство 99m Tc агентов , используемых клинически являются радиофармпрепаратов типа перфузию. Есть ограниченное количество активно целевых соединений , в которых 99m Тс направлен связать конкретную биомаркером через лигирования к конструкции прицеливания. Создание целевых 99m Tc радиофармпрепаратов часто затруднено влиянием 99m Tc-лигандов комплексов на способность целевой молекулы , чтобы связать биомаркера интерес, или изотопы Период полураспада не достаточно долго для использования с более высокими биомолекул молекулярной массой такие как антитела. Последнее, как правило, требует нескольких дней, прежде чем изображения получены для того, чтобы биомолекулы, чтобы очистить от нецелевых Tiss ЕЭС России. Pre-нацеливание предлагает альтернативный подход для преодоления этих проблем.
Предварительно таргетирования в сочетании с биоортогональные реакции было показано, является эффективным способом для разработки новых зондов молекулярной визуализации как для флуоресценции и радио-томографии 4, 5, 6, 7, 8. Реакция обратного спроса электронный Дильса-Альдера (IEDDA) между 1,2,4,5-тетразин (TZ) и транс -cyclooctene (TCO) производных, как показано на рисунке 1, было показано, что особенно эффективным 6. Реакцию IEDDA с этими компонентами могут проявлять быструю кинетику в PBS (K 2 ≈ 6000 M -1 с -1) и высокой селективностью, что делает его идеальным для предварительного таргетинга приложений в естественных условиях 9, 10.
e_content "> Наиболее распространенным подходом включает введение ТСО полученный нацеливающего вектора и после достаточного периода задержки, радиоизотопный тетразин вводят. радиоактивно меченных тетразины на основе 11 C, 18 F, 64 Cu, 89 Zr и 111 In было сообщила 11, 12, 13, 14, 15. в отличие от этого , есть только один отчет о 99m Tc-меченого Тг, который был подготовлен с использованием типа лиганда ГНА , требующую использования сопутствующих лигандов для предотвращения связывания белка и деградации в естественных условиях 16. в качестве альтернативы, мы сообщаем здесь синтез 99m Tc (I) маркированы тетразины с использованием семейства лигандов , которые образуют стабильные тридентатные комплексы с [99m Tc (CO) 3] + ядро. 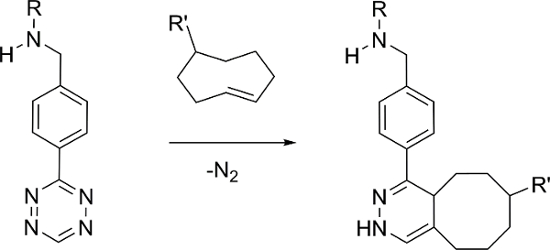
Рисунок 1: bioorthogonal реакция IEDDA между тетразин и транс - -cyclooctene. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Семейство лигандов , приготовленных содержат тридентатные хелаты , которые различаются по полярности и от природы группы линкера между области связывания металла и Tz (рисунок 2). Цель состояла в том, чтобы идентифицировать 99m Tc-тетразин конструкция , которая может эффективно локализовать и реагировать с TCO-меченых участков в естественных условиях и быстро ясно , когда он не связан, с тем , чтобы принести высокую цель-к-нецелевых коэффициентов. Для тестирования лиганды, ТШО-производное бисфосфоната (ТСО-ВР) использовали 17. Ранее мы показали, что TCO-BP локализуется в областях активного костного метаболизма и может взаимодействовать срадиоактивномеченые тетразины в естественных условиях 18. Это удобный реагент для тестирования новых тетразины, так как он может быть получен в одну стадию, и эксперименты могут быть выполнены в нормальных мышей, где локализация происходит в первую очередь в суставах (колени и плечи).
Access restricted. Please log in or start a trial to view this content.
протокол
Исследования на животных были одобрены советом животных по этике исследований в Университете МакМастер в соответствии с Канадским советом по уходу за животными (ССАС) руководящих принципов.
1. радиоактивной из Tz-тридентатных ЛИГАНДАМИ с 99m Tc
ВНИМАНИЕ: Следующие процедуры требуют использования радиоактивных соединений. Работа должна осуществляться только в лицензированной лаборатории с соблюдением техники безопасности и утилизации правил. Реакции Микроволновые следует проводить в микроволновой печи, специально предназначенных для химического синтеза.
- Синтез [99m Тс (СО) 3 (H 2 O) 3] + 19, 20
- В микроволновую ампулу смешайте 8 мг K 2 [BH 3 CO 2], 15 мг Na 2 CO 3, 20 мг Na 2 B 4 O 7 · 10H 2 O и 25 мг KOCO [СН (ОН)]2 COONa · 4H 2 O. Продуть флакон в течение 10 мин аргоном.
- Добавить 4 мл 99m TCO 4 - (~ 1,100 МБк, ~ 30 мКи) в 0,9% -ном солевом растворе в ампулу.
- Реакционную смесь нагревают в микроволновой печи в течение 3,5 мин при температуре 110 ° С после 10 с перемешиванием, чтобы обеспечить тщательное смешивание реагентов.
- Доводят рН раствора до 3,5-4 с помощью ~ 400 мкл 1 М HCl. Проверка с помощью рН бумаги.
- Радиоактивной из тетразин лигандов 1-5
- Растворите 2 мг каждого лиганда (соединения 1-5) в 250 мкл МеОН 21.
- Добавьте 250 мкл [99m Тс (СО) 3 (H 2 O) 3] + (~ 74 МБк, ~ 2 мКи) к каждому раствору.
- Реакционную смесь нагревают с помощью микроволнового течение 20 мин при 60 ° С.
Примечание: Этот шаг был одинаков для всех 5 тетразинов. - Для получения соединений 2- 5, выпарить растворитель и повторно dissolве полученных продуктов в 1 мл 1: 1 об / об ДХМ: ТФК.
- Нагреть растворенные продукты реакции (2-5) при 60 ° С в микроволновой печи в течение 6 мин (2-4) или 10 мин (5).
- После охлаждения до комнатной температуры, выпаривают растворитель , используя испаритель (36 ° С, 8 мбар, 3 мин, 6000 оборотов в минуту) и растворяют высушенный соединение в соотношении 1: 1 ACN: H 2 O или 1: 1 MeOH: H 2 O, перед очисткой ЖХВД.
- Очищают 99m Tc-меченого соединения (1-5), в том числе отделение меченого продукта от немеченого лиганда тетразин, с помощью высокоэффективной жидкостной хроматографии (C 18 с обращенной фазой). Как правило, используют градиент элюции 30:70 ACN: H 2 O (оба с 0,1% TFA) до 40:60 ACN: H 2 O в течение 20 мин (18 мин) и аналитической колонке C 18 4,6 х 100 мм. Использование в УФ-области (254 нм) и регистрации гамма.
- Возьмите небольшую пробу каждого меченого продукта и сравнить его время удерживания ВЭЖХ, что и со-инъекцected, нерадиоактивного, Re-меченого стандарта (0,125 мг в 20% метанол-H 2 O). Стандартный меченый Повторно идентифицируется в трассировке УФ - ВЭЖХ, и будет элюировать в то же самое время, что и 99m Tc-меченого соединения в γ-ВЭЖХ следа. Это совместное введение показывает пики при сравнимых временах удерживания, подтверждающие личность 99m Tc-меченого соединения.
- Выпаривают растворитель из фракций ВЭЖХ с использованием испарителя (36 ° C, 8 мбар, 3 мин, 6000 оборотов в минуту).
- Формулирование Очищенное соединение в концентрации 7,4 кБк / мкл в PBS, содержащем 0,5% БСА и 0,01% Tween-80.
- Для того, чтобы обеспечить меченые соединения стабильны, выполняют экстракорпорального исследование устойчивости в. Выдержите сформулированное соединение при 37 ° С в течение 1, 4 и 6 ч, вводя небольшое количество (3,7 МБк) смеси на ВЭЖХ в каждый момент времени для оценки стабильности.
2. Предварительно целенаправленные исследования Био-распределительные
- Подготовка животных
- Использование 7-9-недельного возраста, женщины-BALB / C мышей (n = 3), введение ТСО-ВР сформулировали в физиологическом растворе (20 мг / кг) (5 мкг / мкл), с помощью в хвостовую вену.
- Поместите мышь в физическом устройстве удержания, а также определить вены, расположенные на боковых поверхностях хвоста и протереть тампоном, смоченным спиртом. По прошествии около 2 см от кончика хвоста, вставьте 30 иглы калибра под небольшим углом, параллельно вене. Медленно нажмите на поршень, чтобы впрыснуть, удалить иглу и не применять чистую марлевую губкой в месте инъекции с небольшим давлением до остановки кровотечения.
- Через 1 ч после инъекции TCO-BP, администрировать ~ 0,74 МБк (20 мкКи) из 99m Tc-тетразин Сформулированные в 100 мкл 0,5% БСА, 0,01% твин-80 в PBS, с помощью в хвостовую вену.
- Исследования Био-распределительные
- В желаемый момент времени (Т = 6 ч), анестезию мышей с использованием 3% изофлуран и 2% -ной смеси газообразного кислорода. Продемонстрировать ке снятие щепотка на наркозом мыши, чтобы гарантировать, что они находятся под хирургической плоскости анестезии.
- Собирают кровь (1 мл) с помощью пункции сердца с использованием шприца предварительно обработанной гепарином. Место мыши на спине с носом в носовом обтекателе для продолжения анестезии и найти мечевидного отростка на животном.
- Вставка 25 G иглу, слегка слева от средней линии животного под мечевидного отростка, под углом 20 °. Полностью вставить иглу, и медленно потяните на себя поршень, чтобы увидеть кровь в ступице иглы, если сердце проколоты. Слегка подрегулировать иглу, удерживая поршень, при необходимости, чтобы проколоть сердце. Медленно потянуть кровь в шприц.
- Эвтаназии животное шейным смещением, в то время как под анестезией.
- Поместите каждое животное в полиэтиленовый пакет и использовать дозы калибратор (99m Tc установка) для измерения весь уровень активности тела.
- Соберите следующие ткани и жидкости в предварительно взвешиватьред считая пробирки: кровь, кости (колено и плечо), желчного пузыря, почек, печени, желудка (с содержанием), тонкий кишечник (с содержанием), толстой кишки и слепой кишки (с содержимым), щитовидной железы и трахею, мочевой пузырь с мочой , и хвост.
- Промыть соответствующие ткани (за исключением крови, желчного пузыря и мочевого пузыря) в PBS, чтобы удалить кровь и промокните насухо перед размещением тканей в соответствующих счетных трубок.
- Поместите туши животного в полиэтиленовый пакет и измерить остаточную всю активность тела с использованием дозы калибратор.
- Взвесить каждую пробирку, содержащую образец ткани. Вычесть начальный вес трубы, чтобы получить массу ткани.
- Используйте дозы калибратор (99m Тс настройка) для измерения количества активности в исследуемом образце (100 мкл) в момент впрыска для каждой мыши.
Примечание: Образец теста равен объему впрыска, таким образом, давая счетчик активности в момент инъекции. - Во время измерения ткани, вliquot 5 мкл тестируемого образца, используемого ранее. Использование мульти-детектора гамма - счетчика (99m Tc настройка) и считать , чтобы получить значение в минуту (CPM) для испытуемого образца 5 мкл.
- С помощью двух значений , полученных в 2.2.9 и 2.2.10 , чтобы вычислить активность и отношения СРМ с помощью уравнения 1 , чтобы получить коэффициент преобразования (CPM мкКи -1).
(1)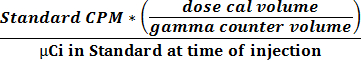
- С помощью гамма-счетчика для измерения количества радиоактивности в каждом образце ткани или жидкости.
- С помощью уравнения 1, чтобы вычислить количество активности в каждой ткани или жидкости, во время измерения по отношению к общей вводили дозы. Это значение затем нормализовали по массе органа и выражают в процентном содержании вводили дозы на грамм (т.е.% ID / г) ткани.
- Выполните шаги 2.1.2 2.2.13 провести отрицательный контрольный эксперимент с использованием 99m Tc-меченых лигандов тетразин в Absenв.п. ТШО-BP. Жертвоприношение мышей (n = 3) в 0,5, 1, 4 и 6 ч после инъекции и получения ткани или жидкости, как описано выше.
Access restricted. Please log in or start a trial to view this content.
Результаты
Лиганды , были синтезированы с использованием различных сшивающих агентов и энтеросорбенты с помощью простого восстановительного аминирования стратегии (рисунок 2), за которой следует соединение продукта с коммерчески доступным тетразин 22,
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Коллекция тетразина-сшитый тридентатных хелатов различной полярностью был подготовлен, и оценивали полезность их 99m Tc комплексов в реакции IEDDA с производным TCO в естественных условиях. Эффективная и воспроизводимый метод маркировки 99m Tc была разработана для пяти тетра...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
The authors declare they have no competing financial interests.
Благодарности
This work supported by research grant funding from the Natural Sciences and Engineering Research Council (NSERC) of Canada, the Ontario Institute for Cancer Research (OICR, #P.SI.015.8), and the Canadian Cancer Society (CCS, #703857). The authors acknowledge the contributions of Dr. Denis Snider who provided assistance in preparing the manuscript.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Argon gas | Alphagaz | --- | --- |
| Na2CO3 | EMD Millipore | 106395 | --- |
| Na2B4O7·10H2O | Anachemia | S9640 | --- |
| KNaC4H4O6·4H2O | Anachemia | 217255 | --- |
| Technelite 99mTc generator | Lantheus medical imaging | --- | Source of 99mTcO4- |
| 0.9% Saline | Lantheus medical imaging | --- | To elute generator |
| 1 M HCl | Lab Chem | --- | --- |
| MeOH | Caledon | --- | --- |
| ACN | Caledon | --- | HPLC grade |
| Millipore H2O | Thermo Fisher Scientific | Barnstead Nanopure | --- |
| DCM | Caledon | --- | --- |
| TFA | Caledon | --- | --- |
| PBS | Thermo Fisher Scientific | 10010023 | pH 7.4 1x |
| BSA | Sigma Aldrich | A7906 | --- |
| Tween80 | Sigma Aldrich | P8047 | --- |
| Isoflurane | CDMV | 108737 | Supplier: Fresenius Kabi Animal Health |
| HPLC | Waters | 1525 Binary Pump, 2998 Photodiodde Array Detector, E-SAT/IN, Bioscan Flowcount PMT detector (item # 15590) | --- |
| HPLC column for analysis and purification of compounds 2-4 | Phenomenex | 00G-4435-E0 | Gemini® 5 µm C18 110 Å, LC Column 250 x 4.6 mm |
| HPLC column for analysis and purification of compounds 1 and 5 | Waters | 186003115 | XBridge BEH C18 Column, 130 Å, 5 µm, 4.6 mm x 100 mm |
| Microwave Reactor | Biotage | Initiator 8 | --- |
| Biotage V10 Evaporator | Biotage | Serial # V1041 | --- |
| Dose calibrator | Capintec, Inc. | CRC-25R | --- |
| Gamma counter | Perkin Elmer | Wizard 1470 Automatic Gamma Counter | --- |
| Animal room scale | Mettler Toledo | XP105 Delta Range | --- |
| Microwave vials | Biotage | 355629 | 0.5-2 mL |
Ссылки
- Jurisson, S. S., Lydon, J. D. Potential Technetium Small Molecule Radiopharmaceuticals. Chem. Rev. 99 (9), 2205-2218 (1999).
- Kluba, C. A., Mindt, T. L. Click-to-chelate: Development of Technetium and Rhenium-Tricarbonyl Labeled Radiopharmaceuticals. Molecules. 18, 3206-3226 (2013).
- Amato, I. Nuclear Medicines Conundrum. Chem. Eng. News. 87 (36), 58-70 (2009).
- Hnatowich, D. J., Virzi, F., Rusckowski, M. Investigations of Avidin and Biotin for Imaging Applications. J. Nucl. Med. 28 (8), 1294-1302 (1987).
- Blackman, M. L., Royzen, M., Fox, J. M. Tetrazine Ligation: Fast Bioconjugation Based on Inverse-Electron-Demand Diels-Alder Reactivity. J. Am. Chem. Soc. 130 (41), 13518-13519 (2008).
- Devaraj, N. K., Weissleder, R., Hilderbrand, S. A. Tetrazine-Based Cycloadditions: Application to Pretargeted Live Cell Imaging. Bioconjugate Chem. 19 (12), 2297-2299 (2008).
- Rossin, R., et al. In Vivo Chemistry for Pretargeted Tumor Imaging in Live Mice. Angew. Chem., Int. Ed. 49 (19), 3375-3378 (2010).
- Zeglis, B. M., et al. Optimization of a Pretargeted Strategy for the PET Imaging of Colorectal Carcinoma via the Modulation of Radioligand Pharmacokinetics. Mol. Pharmaceutics. 12 (10), 3575-3587 (2015).
- Rossin, R., et al. Highly Reactive trans-Cyclooctene Tags with Improved Stability for Diels-Alder Chemistry in Living Systems. Bioconjugate Chem. 24 (7), 1210-1217 (2013).
- Rossin, R., Robillard, M. S. Pretargeted Imaging Using Bioorthogonal Chemistry in Mice. Curr. Opin. Chem. Biol. 21, 161-169 (2014).
- Denk, C., et al. Development of a 18F-Labeled Tetrazine with Favorable Pharmacokinetics for Bioorthogonal PET Imaging. Angew. Chem., Int. Ed. 53 (36), 9655-9659 (2014).
- Herth, M. M., Andersen, V. L., Lehel, S., Madsen, J., Knudsen, G. M., Kristensen, J. L. Development of a 11C-labeled Tetrazine for Rapid Tetrazine-Trans-Cyclooctene Ligation. Chem. Commun. 49 (36), 3805-3807 (2013).
- Li, Z., et al. Tetrazine-Trans-Cyclooctene Ligation for the Rapid Construction of 18F Labeled Probes. Chem. Commun. 46 (42), 8043(2010).
- Nichols, B., Qin, Z., Yang, J., Vera, D. R., Devaraj, N. K. 68Ga Chelating Bioorthogonal Tetrazine Polymers for the Multistep Labeling of Cancer Biomarkers. Chem. Commun. 50 (40), 5215-5217 (2014).
- Zeglis, B. M., et al. A Pretargeted PET Imaging Strategy Based on Bioorthogonal Diels-Alder Click Chemistry. J. Nucl. Med. 54 (8), 1389-1396 (2013).
- García, M. F., et al. 99mTc-Bioorthogonal Click Chemistry Reagent for In Vivo Pretargeted Imaging. Bioorg. Med. Chem. 24 (6), 1209-1215 (2016).
- Russell, R. G. G. Bisphosphonates: The First 40 Years. Bone. 49 (1), 2-19 (2011).
- Yazdani, A., et al. A Bone-Seeking Trans-Cyclooctene for Pretargeting and Bioorthogonal Chemistry: A Proof of Concept Study Using 99mTc and 177Lu-Labeled Tetrazines. J. Med. Chem. , (2016).
- Alberto, R., et al. A Novel Organometallic Aqua Complex of Technetium for the Labeling of Biomolecules: Synthesis of [99mTc(OH2)3(CO)3]+ from [99mTcO4]- in Aqueous Solution and its Reaction with a Bifunctional Ligand. J. Am. Chem. Soc. 120 (31), 7987-7988 (1998).
- Alberto, R., Ortner, K., Wheatley, N., Schibli, R., Schubiger, A. P. Synthesis and properties of boranocarbonate: A convenient in situ CO source for the aqueous preparation of [99mTc(OH2)3(CO)3. J. Am. Chem. Soc. 123 (13), 3135-3136 (2001).
- Lu, G., et al. Synthesis and SAR of 99mTc/Re-labeled Small Molecule Prostate Specific Membrane Antigen Inhibitors with Novel Polar Chelates. Bioorg. Med. Chem. Lett. 23 (5), 1557-1563 (2013).
- Maresca, K. P., et al. Small Molecule Inhibitors of PSMA Incorporating Technetium-99m for Imaging Prostate Cancer: Effects of Chelate Design on Pharmacokinetics. Inorg. Chim. Acta. 389, 168-175 (2012).
- Bartholomä, M. D., et al. Insight into the Mode of Action of Re(CO)3 Thymidine Complexes. ChemMedChem. 5 (9), 1513-1529 (2010).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены