Method Article
Die Messung der T-Zell-Alloreaktivität Mit Imaging Durchflusszytometrie
In diesem Artikel
Zusammenfassung
Dieses Dokument beschreibt ein Verfahren zur Alloreaktivität in einer gemischten Population von T-Zellen unter Verwendung von Mess Cytometry Abbildungsströmung.
Zusammenfassung
Die Messung der immunologischen Reaktivität gegenüber Spender-Antigenen bei Transplantatempfängern ist wahrscheinlich für die erfolgreiche Reduktion oder den Entzug der Immunsuppression von entscheidenden Bedeutung. Die gemischte Leukozytenreaktion (MLR), limitierenden Verdünnungsassays und trans-vivo Allergien vom verzögerten Typ (DTH) Assay werden alle auf diese Frage angewandt worden, aber diese Verfahren beschränkt sind prädiktive Fähigkeit und / oder erhebliche praktische Beschränkungen auf, die ihre Nützlichkeit verringern. Imaging Durchflusszytometrie ist ein Verfahren, das die quantitativen multiparametrischer Potenzen von Durchflusszytometrie mit den bildgebenden Fähigkeiten der Fluoreszenzmikroskopie kombiniert. Wir haben vor kurzem die Verwendung eines bildgebenden Durchflusszytometrie Ansatz gemacht, den Anteil an Empfänger-T-Zellen zur Bildung von reifen immune Synapsen mit Donor- Antigen-präsentierenden Zellen (APCs) in der Lage zu definieren. Mit einem gut charakterisierten Maus Herztransplantation Modell haben wir gezeigt , dass die Häufigkeit von in - vitro - Immun Synapsen unter T-APC membrane Kontaktereignisse vorhergesagt stark Ergebnis Allograft in Ablehnung, Toleranz und eine Situation, in der Transplantation das Überleben auf induzierte regulatorische T-Zellen abhängt. Die Häufigkeit von T-APC Kontakten erhöht mit T-Zellen von Mäusen während der akuten Abstoßung und verringerte mit T-Zellen von Mäusen, nicht reagierenden gerendert Alloantigen. Die Zugabe von regulatorischen T - Zellen auf das in vitro - System reduziert verlängerte T-APC - Kontakte. Entscheidend ist, wurde dieser Effekt auch mit humanem polyklonal erweitert, natürlich vorkommende regulatorische T-Zellen zu sehen, die dafür bekannt ist, um die Abstoßung von menschlichen Geweben in humanisierter Maus-Modellen zu steuern. Die Weiterentwicklung dieses Ansatzes kann für eine tiefere Charakterisierung des alloreaktiven T-Zellkompartiment bei Transplantatempfängern ermöglichen. In Zukunft Weiterentwicklung und Evaluierung dieser Methode menschliche Zellen verwendet, können die Grundlage für die Tests verwendet bilden Patienten zur Immunsuppression Minimierung auszuwählen, und es kann verwendet werden, um die Auswirkungen von Tolerogen zu messenic-Therapien in der Klinik.
Einleitung
Organtransplantation hat die Versorgung von Patienten im Endstadium von Erkrankungen der Niere, Leber, Herz und Lunge verwandelt. Durch Unterschiede in der Haupt- und Neben Histokompatibilitatsantigene sind jedoch Allotransplantate von Empfänger-T-Zellen sofort abgelehnt, wenn Immunsuppressiva verwendet werden, nicht. Diese Mittel haben zahlreiche Nebenwirkungen, einschließlich der Risiken für Krebs und Organdysfunktion. Ein großes klinisches Ziel ist es daher, die Dosis der Immunsuppression auf das Minimum zu senken erforderlich Allograft-Abstoßung zu verhindern. Diese Ebene ist wahrscheinlich, je nach dem Grad der Aktivierung des angeborenen Immunsystems variieren; der Grad der Nichtübereinstimmung Alloantigen Spender-Empfänger; und zwischen den Patienten Unterschiede in der Immunfunktion, Pharmakokinetik und Pharmakodynamik.
Leider 1, Transplantation Ärzte haben keine Werkzeuge zum genauen Spender Reaktivität bei einzelnen Patienten zu beurteilen. die gemischteLeukocyten Reaktion (MLR) kann Donator Reaktivität detektieren, aber es funktioniert nicht zuverlässig Transplantats Ergebnis 2, 3, vorherzusagen. Limitierenden Verdünnungsassays, Zytokin -ELISPOTs und die trans-vivo - Assay entweder Messung eine begrenzte Anzahl von Antworten oder nicht praktikabel 4, 5, 6, 7, 8 .Gene Expressionsprofile haben ergeben Signaturen Betriebstoleranz bezogen 9, 10, 11, 12 und Ablehnung 13, 14, 15, aber diese sind nicht immer verallgemeinerbar über Bevölkerung 16 und hat letztlich Nützlichkeit bei einzelnen Patienten beschränkt. Sequenzbasierte Analyses des T-Zell - Rezeptor (TCR) von T - Zellen im peripheren Blut 17 oder 18 in der MLR proliferierenden sind ebenfalls entwickelt worden, erfordern jedoch eine weitere Validierung.
Konzeptionell wäre es wünschenswert, einen Assay zu haben, dass die frühesten erforderlichen Schritte in Empfänger-T-Zellen-Aktivierung durch ein Spenderantigen erkennt. Da die Zellen über Tage Kultivierung (wie in der MLR) Artefakte einführen kann, ein solcher Test würde erfordern, idealerweise nicht die Messung von nachgelagerten Ereignisse wie Proliferation oder Effektor-Funktion. Ebenso wäre es jedoch auch wünschenswert sein, dass der Test da rein beschreibende Einschätzungen auf ein Element von T-Zell-Funktion, abhängig (ZB TCR - Sequenzierung) kann nicht zwischen anergisch und funktionellen T - Zellen zu unterscheiden.
Zahlreiche Studien haben gezeigt, dass eine längere T-APC Kontakt für die Bildung eines Immun Synapse erforderlich ist, was ein erster wichtiger istSchritt in der T-Zell - Antwort 19, 20, 21, 22. Wir berichteten vor kurzem , dass, während des dynamischen In - vitro - Zeitraffer - Bildgebung, etwa 5 - 10% der Maus - CD4 + T - Zellen mit allogenen Knochenmark abgeleiteten dendritischen Zellen (BMDCs) 23 lang anhaltende Kontakte bilden. Die Häufigkeit des längeren Kontakts wurde bei Tieren erhöht , die ein Pfropf verworfen, während bei Mäusen zuvor tolerant auf die gleichen Antigene , gerenderte, blieb es in untransplanted Mäusen auf Niveau 23 gesehen. Längere Wechselwirkungen wurden in Gegenwart des Empfänger Tregs reduziert und in ihrer Abwesenheit erhöht, und wir beobachteten ähnliche Phänomene unter Verwendung von humanen T - Zellen und allogenen Monozyten abgeleiteten DCs (MoDCs) 23.
Allerdings machte die Aufzählung der verlängerten Kontakte innerhalb eines polyklonalen T-Zell-population ist zeitaufwendig und arbeitsintensiv. Wir haben daher den Einsatz von Imaging-Zytometrie allogenen Immunsynapsenbildung zu untersuchen, fließen. Imaging Fluss umfasst die Zytometrie multiparametrischer Datenerfassungs- und Analysefunktionen herkömmlicher Durchflusszytometrie mit den Einzelzellen-Bildgebungsfähigkeiten der Fluoreszenzmikroskopie. Diese Technik wird von anderen Forschern verwendet worden , durch monoklonale T - Zellen 24, 26, 27 oder in der Anwesenheit von Superantigenen 28 immune Synapsenbildung zu untersuchen. In solchen Einstellungen jedoch reicht die Frequenz der reagierenden T - Zellen von 30-100%, während alloreaktiven T - Zellen in der Regel 5-15% des gesamten T-Zellen - Repertoires 29, 30, 31, 32 zu repräsentieren geschätzt. Wichtigerweise haben wir gezeigt, dass Abbildungs Durchflusszytometrie av produzieren kannery vergleichbares Maß der alloreaktiven T-Zellen - Frequenz 23 und dass Änderungen in der Synapse Frequenz innerhalb einer polyklonalen T-Zellpopulation prädiktiven sind Pfropf Ergebnis 23. Derzeit hat dieser Ansatz optimierte die direkte Alloreaktivität von CD4 + T - Zellen zu messen, aber im Prinzip könnte es auch zu untersuchen , CD8 + T - Zellen und den indirekten Weg entwickelt werden. Indirekte Alloreaktivität wird angenommen , dass zunehmend relevant wird bei längeren Zeiten nach der Transplantation , 33. Wir entwickeln derzeit diese Methode menschliche Zellen zu verwenden, die für die Prüfung bei Patienten ermöglichen. So wird in der Zukunft kann das Gesamtkonzept für die funktionelle Bewertung der T-Zell-Antworten bei Transplantatempfängern vor der Transplantation nützlich sein; unmittelbar nach der Transplantation; und in den langfristigen, wenn Drogen Minimierung wird ein wichtiges Ziel.
Protokoll
1. Bereiten Sie Reagenzien und Materialien Erforderliche
- Bereiten phosphatgepufferter Salzlösung (PBS), enthaltend 2% fötales Rinderserum (FBS) ( „Waschpuffer“). Bereiten PBS mit 2% FCS, das 0,1% nicht-ionisches Detergens ( „Perm-Waschpuffer“; siehe die Tabelle des Materials). Bereiten PBS mit 1,5% Formaldehyd.
HINWEIS: ACHTUNG! Formaldehyd ist ätzend und potenziell krebserregend und muss behandelt werden, während geeignete persönliche Schutzausrüstung zu tragen. - Bereiten PBS, enthaltend 2% FBS und 0,5 mM Ethylendiamintetraessigsäure (EDTA) für die magnetische Zelltrennung ( "MCS-Puffer").
- Bereiten 50 ug / ml Phalloidin-Fluoresceinisothiocyanat (Phalloidin-FITC) in Dimethylsulfoxid (DMSO). Bereiten einer 1 mg / ml Kernfärbung (zB 1 mg / ml 7-Aminoactinomycin (7-AAD) in DMSO oder Bisbenzimid-Farbstoff; siehe Tabelle of Materials) in DMSO. Bereiten Sie Fluorochrom-markierten Antikörper geeignet für die Zellen von Interesse unddie Abbildungs Durchflusszytometer.
- Erhält tierische Gewebe (zB, Lymphknoten und Milz) als Quelle von T - Zellen und allogenen tierischen Geweben (zB Milz und Knochenmark) als Quelle für Antigen-präsentierende Zellen oder Vorläufer.
- Bereiten Zellkulturmedium (zB Rpmi (RPMI) 1640 oder Dulbeccos modifiziertem Eagle - Medium (DMEM) , ergänzt mit 10% FBS), 50 uM 2-Mercaptoethanol, Penicillin und Streptomycin und erhalten 24- und / oder 96- Well-Zellkulturplatten.
2. Bereiten Sie Antigen-präsentierenden Zellen
HINWEIS: Theoretisch könnte jede APC Bevölkerung mit dieser Methode untersucht werden. Immature Maus-Knochenmark stammenden dendritischen Zellen (DCs) als APCs in diesem Fall klagte wurden. Viele Protokolle existieren, um diese Zellen zu erzeugen (beispielsweise Referenzen 34 und 35). Kurz gesagt, wurde das folgende Protokoll verwendet.
- Flush Mark von Femur und Tibia in RPMI 1640 oder DMEM.
- Führen Sie die suspendierten Zellen durch einen 70 & mgr; m-Zellsieb kleine Stücke von Knochen und Zelltrümmer zu entfernen.
- Pelletieren Sie die Zellen durch Zentrifugation gesammelt und dann rotes Blutkörperchen lysieren, für 5 min bei Raumtemperatur mit einem Ammoniumchlorid-Puffer verwendet wird.
- Pelletieren Sie die Zellen durch Zentrifugation (400 × g, 5 min) und das Zellpellet resuspendieren.
- Wasche Zellen in von 5 bis 10 ml Waschpuffer, Pellet durch Zentrifugation (400 × g, 5 min) und Resuspension des Zellpellets.
- Reichern hämatopoetischen Vorläufer über eine Zelltrennsäule, indem die Zellen der Markierung mit biotinyliertem anti-CD3 (5 ug / ml), anti-B220 (5 ug / ml), anti-MHC-Klasse II (1 & mgr; g / ml) und anti-CD11b (5 ug / ml) Antikörper.
- Pelletieren Sie die Zellen durch Zentrifugation (400 × g, 5 min) und Resuspension des Zellpellets.
- Inkubieren der Zellen mit anti-Biotin magnetischen Microbeads (siehe Tabelle of Materials) bei 4 ° C für 10 min.
- Waschen und zu pelletieren Sie die Zellen (400 · g, 5 min) und erneut Suspend sie in 1 ml MCS-Puffer, bevor die markierten Zellen mit einer großen positiven Selektion (LS) Magnetzellseparationssäule grundiert mit 3 ml MCS-Puffer und platziert in seinem Magneten zu entfernen. Die Säule wird 3-mal mit 3 ml MCS-Puffer; Der Durchfluss die gewünschten Zellen enthält.
- Kultur der Zellen, die für 6 Tage in RPMI 1640 oder DMEM mit 2 rekombinantem Maus-GM-CSF (GM-CSF) und 2 ng / ml rekombinantem humanen transformierenden Wachstumsfaktor β1 (TGF-Beta1), ergänzt durch die Säule passieren ng / ml . Ersetzen Sie die Hälfte des Mediums alle 2 Tage mit frischem komplettem Medium, das 2 ng / ml GM-CSF und TGFß1.
HINWEIS: Human TGFß1 Aktivität in Mauszellen hat. Die Daten wurden unter Verwendung dieser unreifen DCs erzeugt. Andere Zellen (zB B - Zellen und reife DCs) geeignet als APCs sein , aber nicht in diesem Test getestet worden. - Kryokonservierung DCs in 90% Serum / 10% DMSO und lagern in flüssigem Stickstoff; zurück aufder Tag der Nutzung. Vor der Verwendung zählen die Anzahl der lebenden DCs in einem Hämozytometer Trypanblau-Ausschluss verwenden. das Zellpellet in Kulturmedium mit der geeigneten Dichte resuspendieren (siehe Schritt 4.1), bevor in Abschnitt 4 verwenden.
3. Bereiten Sie T-Zellen
- Verwenden negative Selektionsverfahren versehentlich zu vermeiden Übertragung aktivierende oder hemmende Signale an den Zellen.
HINWEIS: In diesem Beispiel werden CD4 + T - Zellen für die Analyse vorbereitet.- CD4 + T - Zellen aus der Milz der Maus, Mash die Milz durch einen 70 & mgr; m-Zellsieb mit dem Kolben einer Spritze herzustellen. Waschen Sie die Zellfilter mit Waschpuffer.
- Pellet die suspendierten Zellen durch Zentrifugation (400 × g, 5 min) und dann die roten Zellen lysieren, indem das Pellet in einer Ammoniumchlorid-Puffer für 5 min bei Raumtemperatur erneut suspendiert wird.
- Pelletieren Sie die Zellen durch Zentrifugation (400 × g, 5 min) und Resuspension des Pellets.
- Waschen Sie die Zelles in von 5 bis 10 ml Waschpuffer und Pellet durch Zentrifugation (400 × g, 5 min). Re-suspend das Pellet.
- Befleckt die Zellen mit biotinylierten Antikörpern gegen CD8, Haupthistokompatibilitätskomplex Klasse II (MHC II, 1 ug / ml) und CD19 (5 & mgr; g / ml). Inkubieren für 10 min bei 4 ° C.
- Waschen Sie die Zellen in 10 ml Waschpuffer und Pellet durch Zentrifugation (400 × g, 5 min). Re-suspend das Pellet.
- Inkubieren Sie die Zellen, die mit Anti-Biotin-magnetischen Mikrokügelchen (die Tabelle der Materialien sehen) gemäß den Anweisungen des Herstellers.
- Waschen Sie die Zellen in 10 ml Waschpuffer und Pellet durch Zentrifugation (400 × g, 5 min); resuspendieren Sie das Pellet.
- Resuspendieren der Zellen in 1 ml MCS - Puffer und bereichern die CD4 + T - Zellen über eine Magnetzellseparationssäule grundiert mit 3 ml MCS - Puffer auf einem Magneten. Die Säule wird 3-mal mit 3 ml MCS-Puffer. Säulendurchfluss wird die angereicherten T-Zellen enthalten.
- Mit dem Standard-Flow cytomeversuchen, bewerten Reinheit T-Zelle einen aliquoten der negativ selektierten Zellen. Befleckt die Zellen ein Fluorochrom-Streptavidin-Konjugat (beliebige biotinmarkierten Zellen zu identifizieren, die auf der Säule entfernt werden sollen), und einen Antikörper oder einen Antikörper zu identifizieren, die T-Zell-Population von Interesse (CD4 in diesem Fall); eine Reinheit von ≥85% ist akzeptabel , 23.
- Zählen Sie die T-Zellen in einem Hämocytometer durch Trypanblau-Ausschluß (≥90% Lebensfähigkeit ist akzeptabel).
HINWEIS: Die MCS - Puffer enthält EDTA, die vor dem Test entfernt werden müssen. Um dies zu erreichen, ein Pellet der Zellen durch Zentrifugation (400 × g, 5 min), und waschen in 1 ml Waschpuffer. Pelletieren Sie die Zellen nochmals (400 · g, 5 min) und Resuspension in Kulturmedium mit der geeigneten Dichte (siehe Schritt 4.1).
- Zählen Sie die T-Zellen in einem Hämocytometer durch Trypanblau-Ausschluß (≥90% Lebensfähigkeit ist akzeptabel).
4. Co-Inkubation T-Zellen und DCs
- Seed T-Zellen und DCs bei einem 2: 1 T: DC-Verhältnis in einer 24-Well-oder 96-well-Zellkulturplatte. Sicher gehen, dass die endgültigen Kulturvolumen betragen ≤500 ul für Platten mit 24 Vertiefungen oder ≤50 ul für Platten mit 96 Vertiefungen.
HINWEIS: Kleinere Volumina fördern Zell-Zell - Wechselwirkungen und lassen Raum für eine spätere Fixierung Puffer.- Justieren genaue Zellzahlen empirisch, aber als allgemeine Anleitung, verwendet werden 1 x 10 6 T - Zellen und 0,5 x 10 6 DCs pro Well (96-Well - Platte). Diese sollten die Mindestanzahl von Zellen in Betracht gezogen werden, weil mit weniger Zellen Auszählung von Immun Synapsen erschwert.
- Zur Erhöhung der Zellzahlen, replicate Vertiefungen und Pool nach Schritt 5 (Fixierung) aufgebaut.
HINWEIS: Bei Wiederholungsvertiefungen einrichten, ist es ratsam , DCs in allen Vertiefungen zunächst auf Saatgut und dann in alle Samen T - Zellen der Vertiefungen; dies minimiert Diskrepanzen in Inkubationszeit zwischen Brunnen.
- Zur Erhöhung der Zellzahlen, replicate Vertiefungen und Pool nach Schritt 5 (Fixierung) aufgebaut.
- Justieren genaue Zellzahlen empirisch, aber als allgemeine Anleitung, verwendet werden 1 x 10 6 T - Zellen und 0,5 x 10 6 DCs pro Well (96-Well - Platte). Diese sollten die Mindestanzahl von Zellen in Betracht gezogen werden, weil mit weniger Zellen Auszählung von Immun Synapsen erschwert.
- Inkubiere die Platte für 4 h bei 37 ° C in einem 5% CO 2 -Atmosphäre.
- Hinzufügen 3 mal das Kulturvolumen von 1,5% Formaldehyd in PBS in jeder Vertiefung und Inkubation für 30 min bei Raumtemperatur; tt ist wichtig, Zellen zu fixieren, bevor sie von der Platte auf das Entfernen der Störung der Zell-Zell-Wechselwirkungen zu minimieren.
- Übertragungszellen in der Platte in Röhrchen für anschließendes Waschen und Färben. In diesem Stadium beiseite legen zusätzliche Zellen für Single-Fleck Kontrollen. Abgesehen von diesen Kontrollen soll die gesamte Kultur mit dem Antikörper-Cocktail gefärbt werden (siehe Schritt 4.1.1).
6. Stain Cells
- Stain-Zellen in 100 & mgr; l Waschpuffer einen Cocktail der gewünschten Fluorochrom-konjugierten Antikörper für 30 Minuten bei Raumtemperatur, geschützt vor Licht enthält.
HINWEIS: Der Cocktail umfasst T - Zell-spezifische und APC-spezifische Antikörper. Fluorochrome sollte so gewählt werden, dass sie Zytometer die Konfiguration der Abbildungs fließen unterschieden werden können. in ter Experimente hier, blau fluorophorkonjugierten CD11b (5 ug / ml, finden Sie in der Tabelle der Materialien) und APC-konjugierten CD90.2 (5 ug / ml) verwendet wurden, gezeigt. - Waschen Sie die Zellen in 1 mL Waschpuffer und Zentrifuge für 5 min bei 400 x g. Man dekantiert die überstehende Flüssigkeit. Resuspendieren der Zellen in Perm-wash-Puffer, enthaltend FITC-Phalloidin auf 0,05-0,5 & mgr; g / ml, und für 30 min bei Raumtemperatur vor Licht geschützt inkubiert.
HINWEIS: Phalloidin FITC Konzentrationen von etwa 0,1 ug / ml gut für Mauszellen, aber die geeignete Konzentration wird durch die Lieferanten, Zelltyp und Abbildungs Durchflusszytometer variieren erwartet. - Waschen Sie die Zellen in 1 ml perm / Waschpuffer und Zentrifuge für 5 min bei 400 x g. Man dekantiert die überstehende Flüssigkeit. Resuspendieren der Zellen in perm / Waschpuffer Kernfarbstoff in der entsprechenden Konzentration (beispielsweise etwa 25 & mgr; g / ml 7-AAD) und Inkubation für 30 min bei Raumtemperatur vor Licht geschützt enthält.
- Waschen Sie die Zelles in 1 ml perm / Waschpuffer und Zentrifuge für 5 min bei 400 x g. Man dekantiert die überstehende Flüssigkeit. Wasche die Zellen einmal in Waschpuffer, Pellets und Resuspendieren in 50 bis 100 & mgr; l Waschpuffer, um die Zellen zu kleine, angeschnittene Mikrozentrifugenröhrchen übertragen.
- Weiter zur Datenerfassung sofort oder speichern, die Zellen bei 4 ° C lichtgeschützt für bis zu mehr Tagen vor der Akquisition auf der Abbildungs Durchflusszytometer.
HINWEIS: Die Zellen wurden auf diese Weise für bis zu 7 Tagen erfolgreich gespeichert. Eine längere Lagerung kann möglich sein, aber wurde nicht getestet.
7. Acquire Daten
- Initialisieren und konfigurieren Sie den Imaging-Durchflusszytometer gemäß den Anweisungen des Herstellers. Sorgen für Stabilität des Strömungs Kern vor irgendwelche Daten zu sammeln.
- Reservieren eines Kanals für Hellbildaufnahme. Acquire single-stain Steuerdaten mit dem Hellfeld- Kanal ausgeschaltet.
- Klicken Sie auf die Schaltfläche „Laden“ und insert ein Rohr mit einer vollständig gefärbten Probe (eine Probe, die mit allen erforderlichen Fluorochromen gefärbt wurde) enthält, in die Halterung.
- In den „Arbeitsbereich“ Fenstern wählen und eine neue Streudiagramm mit dem Seitenverhältnis über den Bereich und Gate-Singuletts zu schaffen, in dem das Seitenverhältnis nahe an 1 einen neuen Streudiagramm für jeden verwendeten Kanal erstellen (Intensität des Kanals in der horizontalen Achse) .
- Für jedes Fluorochrom, überprüfen Sie die positive Bevölkerung und bei Bedarf die Laserspannung in der „Illumination“ -Box.
- Unload das Rohr und lädt die erste einzelsträngige gefärbte Röhre.
- In dem „Acquisition Settings“ Feld, geben Sie die Beispielnamen und die Anzahl der Ereignisse, die gesammelt werden sollten; wenn es ein einziger Fleck (für Kompensationssteuerungen) ist, 1000 - 2000 Veranstaltungen sind ausreichend.
- In der „Kanäle“ Feld wählen Sie die Kanäle, die jede Probe mit wurde gefärbt. Für Single-Fleck Kontrollen sollten alle Kanäle mit brightf ausgewählt werdenield und Seitenstreuung ab. Klicken Sie auf die „Record“ Taste unter der „Erwerb“ Box; wenn die Anzahl der Ereignisse die angegebene Schwelle erreicht, wird Erfassung automatisch gestoppt.
- Klicken Sie auf die „Return“, um das Rohr zu entladen. Wiederholen Sie die Schritte 7.2.4 - 7.2.6 für jede einzelne Fleckenkontrolle. In Abhängigkeit von dem Zytometer und Software kann es nicht möglich sein , alle Tore in Abbildung 1 gezeigt während der Akquisition einzustellen (genaueres Gating wird während der Analyse durchgeführt, siehe Abschnitt 8).
- Acquire Proben wie für Einzel gefärbten Proben (in Schritt 7.2), aber in der „Kanäle“ -Box, wählen alle Kanäle, die einschließlich der Hellfeld- Kanal erforderlich sind.
- Vor dem Aufzeichnen von Daten, um zu bestätigen, dass die Kanalintensität zur Identifizierung der gewünschten Zellpopulationen geeignet ist. Wenn nicht, stellen Sie die Lasereinstellungen und Aufnehmen Single-Fleck Kontrollen mit den neuen Einstellungen, wie 7.2 in Schritt beschrieben.
- Für jedeProbe, erwerben mehrere Zehntausende von Veranstaltungen.
HINWEIS: Unter den meisten Bedingungen Zell-Zell - Kontakt Veranstaltungen sind eine kleine Minderheit der Gesamtzellzahl ( die meisten sind Einzelzellen). Im Allgemeinen ist es wünschenswert, mindestens 100 Ereignisse in dem Endmembran Kontakt Gate zu haben.
8. Analyse der Daten
- Analysieren Sie die Strömung erfassten Daten auf dem Imaging Cytometer unter Verwendung von analytischer Software zur Verfügung kostenlos von der Website des Herstellers (ein Benutzerkonto muss erstellt werden, finden Sie in der Tabelle der Materialien).
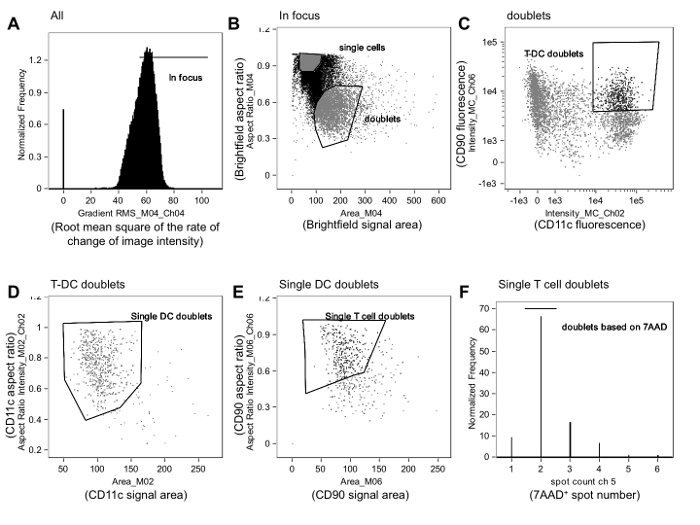
Abbildung 1. Gating - Strategie Gebrauchte Alloreaktive Immune Synapsen zu identifizieren. A. In-Fokus - Ereignisse von allen Ereignissen gated werden von Zellbildern Überprüfung auf der Wurzel basierend mittlere Quadrat der Änderungsrate des Bildintensitätsprofils (Gradient RMS) mit dem Hellfeld- channel (Kanal 4, Ch04), wie im Text beschrieben. B. Unter den In-Fokus - Ereignisse sind Doubletten aus einzelnen Zellen unterscheiden sich durch das Seitenverhältnis gegenüber der Fläche für den Kanal Hellfeld- Plotten. Einzelzellen sind in der Nähe des Seitenverhältnisses von 1 und haben eine kleinere Fläche geclustert, während Dubletts sind in der Nähe von 0,5 und eine größere Fläche. C. Fluoreszenzintensität des APC (in diesem Fall ein dendritische Zelle [DC] Marker CD11c) aufgetragen ist dann gegen Fluoreszenzintensität des T-Zell-Markers (in diesem Fall, CD90.2) und doppelt positive Ereignisse gated werden. Grenzen des Tores kann durch die Überprüfung Bilder von Veranstaltungen in der Nähe der Grenzen verfeinert werden. D. T-APC Dubletts werden dann verfeinert , so dass sie nur eine APC enthalten , indem das Seitenverhältnis im Vergleich zu dem Bereich des APC Markers Plotten (CD11c, Ch02). E. Diese sind single-APC Dubletts dann so verfeinert , daß sie durch Auftragen des Seitenverhältnisses im Vergleich zu dem Bereich nur eine T - Zelle enthaltender T-Zell-Marker (CD90.2, Ch06). F. Schließlich Ereignisse nur zwei Kerne enthalten , werden durch Auftragen eines Histogramms der Punktanzahl auf dem Kernfärbung Kanal (7-AAD, CH05) ausgewählt und Gating Ereignisse , die nur 2 7-AAD-positive Spots enthalten (dh Kerne). Die Ereignisse in diesem Gatter werden für Membrankontakt und Synapsenbildung analysiert, wie in Abbildung 2 beschrieben. Die Daten wurden in verblindet mit Bezug auf Behandlungszuordnung und werden von einem zuvor veröffentlichten Experiment 23 analysiert. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
HINWEIS: Die Gating - Strategie in diesem Abschnitt beschrieben wird , und ist in Abbildung 1 dargestellt. Analyse der Abbildungs Durchflusszytometrie Daten sollte in verblindet mit Bezug auf Behandlungszuordnung ausgeführt werden. Obwohl wir glauben, dass Immun Synapsen und nicht-synaptic Kontakte sind in der Regel leicht zu unterscheiden (siehe unten und Figuren 2 und 3), sollten blendender Bias von der Subjektivität minimieren inhärente Bildanalyse ergeben.
- Generieren einer Kompensationsmatrix durch die Single-stain Steuerdaten-Dateien in den Ausgleichs Assistenten laden. die einzelnen gebeiztes Dateien nach dem Laden, wählen Sie die Fluoreszenzkanäle in dem Experiment verwendet.
HINWEIS: Die Software automatisch eine Kompensationsmatrix erzeugt, aber dies manuell überprüft werden sollte , um sicherzustellen , dass die richtigen positiven Populationen ausgewählt wurden.- Doppelklicken Sie auf das Diagramm, um den Analysebereich einen Wert in der Matrix und hinzuzufügen. Erstellen Sie ein neues Tor bei Bedarf alle toten Zellen / Dubletten / Fehlalarme auszuschließen; Diese neue verfeinerte positive Population kann für jeden Kanal in dem Matrixfeld in der Dropdown-Menü ausgewählt werden.
- Wiederholen Sie das für jeden Kanal. Klicken Sie auf „Fertig stellen“, um die compensatio zu sparenn-Matrix (.ctm Datei).
- Erhalten, die eine Datenanalysedatei (.daf) aus der Rohdatei (.rif), indem die Datei in .rif Auswertesoftware Beladung und die Kompensationsmatrix anwenden.
- Sobald die Daten geladen sind, führt Gating-T-Zell-APC Kontaktereignisse zu identifizieren.
HINWEIS: Eine typische Gating - Strategie beinhaltet Ereignisse in-Fokus - Identifizierung, Dubletts Auswahl basierend auf Größenkriterien (die Fläche gegenüber dem Bildseitenverhältnis des Ereignisses), und T - Zell-APC Dubletts als Ereignisse auswählen , die für die T-Zell - double-positive und APC - Marker (1A-C).
ANMERKUNG: Das Seitenverhältnis ist das Verhältnis der Breite eines Ereignis zu seiner Höhe, die sie von Dubletten (Verhältnis nahe 0,5) Diskriminierung von Einzelzellen (Verhältnis nahe 1) ermöglicht. - Identifizieren in-Fokus - Ereignisse durch die Wurzel Quadrat der Geschwindigkeit der Änderung des Abbildungsintensitätsprofils bedeuten Plotten (Gradient RMS) in dem Hellfeld- Kanal (1A). Klicken Sie auf the Gradient RMS-Histogramm in einzelnen Behältern Zellereignisse anzuzeigen und ein Gate-anschießend Ereignisse out-of-focus ausgenommen.
- Plotten der Fläche gegenüber dem Bildseitenverhältnis des Hellfeld- Kanal und ein Gate zeichnen , die Dubletten , basierend auf Ereignis Form und Größe (1B) identifiziert. Bewertung von Bildern von Ereignissen nur innerhalb und außerhalb der Grenze dieses Tor kann den Analytiker helfen, die Gate-Größe und Position zu verfeinern. Dann bauen ein Diagramm dieser Dublett Ereignisse, bei denen die Intensität der T-Zell-Marker auf einer Achse angezeigt wird, und die Intensität des Markers APC erscheint auf der anderen Seite. Zeichnen Sie ein T-APC Dublette Gate Ereignisse positiv für beide Marker enthält.
- Unter den T-Zell-APC Dublette Ereignissen, wählen Sie Ereignisse, die nur eine T-Zelle und einen APC enthalten.
- Tun Sie dies durch das Seitenverhältnis im Vergleich zu Bereich für den APC Marker Plotten und durch Gating auf Dubletten einen einzigen APC (1D) enthält. Plot das Seitenverhältnis im Vergleich zu Bereich für die T-Zell-Markeer das UND - Gatter auf Dubletts eine einzelne T - Zelle (Figur 1E) enthält.
HINWEIS: Eine weitere Verfeinerung kann durch Auftragen eines Histogramms der Punktzahl Funktion Kernfärbung Fluoreszenz und Gating auf Ereignisse mit nur zwei Punkten (1F) , wie aufgebracht erreicht werden.
- Tun Sie dies durch das Seitenverhältnis im Vergleich zu Bereich für den APC Marker Plotten und durch Gating auf Dubletten einen einzigen APC (1D) enthält. Plot das Seitenverhältnis im Vergleich zu Bereich für die T-Zell-Markeer das UND - Gatter auf Dubletts eine einzelne T - Zelle (Figur 1E) enthält.
- In einigen Fällen werden die beiden Zellen innerhalb einer Dublette nicht in Kontakt stehen; Zellen zu identifizieren, in Kontakt miteinander, Objektmasken für APCs und T-Zellen definieren.
- Verwenden Sie die „Masken“ Option im Menü Analyse der Masken-Manager zu öffnen und definieren, eine neue Maske. Geben Sie einen Namen, wie „T-Zell-Objektmaske.“ Klicken Sie auf die „Function“ -Taste und im Dialogfenster wählen Sie „Objekt“.
- Wählen Sie den Kanal , in dem der T-Zell - Marker erkannt wird (zB Ch06). OK klicken."
HINWEIS: "Object (M06, Ch06, Tight)" wird im Funktionsfeld angezeigt. Diese Standardobjektmaske in der Regel works gut kann aber verlangen Optimierung. - Wiederholen dieses Prozesses eine APC Objektmaske in dem entsprechenden Kanal zu schaffen.
- Das APC und T-Zellen-Masken nach dem Identifizieren, Membrankontakt durch Auftragen T-Zell-Marker Fluoreszenzintensität in dem APC Objektmaske gegen APC Fluoreszenz-Intensität in der T-Zell-Objektmaske bestimmen. Auf dieser Handlung, zeichnet ein Gate, die miteinander nur Zellen in Kontakt enthält.
HINWEIS: In der Regel gibt es ziemlich klar doppelt positive und negative Populationen zwei (2A). Die Grenze zwischen den doppelt positiven und negativen Doppel Populationen kann durch Überprüfung Hellfeld- Bilder der Zellen in der Grenzregion eingestellt wird, um sicherzustellen, dass die Zellen in Kontakt innerhalb der Gate sind und daß Zellen, die nicht in Kontakt sind ausgeschlossen. - Zu diesem Zeitpunkt manuell die phalloidin FITC Bilder von Ereignissen innerhalb dieses Tor überprüfen, um reife Immun Synapsen von einfachen Zell-Zell-Kontakt zu unterscheiden. Use die „Tag-Bilder“ Funktion, um diese Bilder zu markieren.
HINWEIS: Der Prozentsatz der markierten Ereignisse (Immun Synapsen) im Innern dieses Tor kann als Index der direkten Alloreaktivität in der T-Zellpopulation verwendet wird , wird untersucht.
Ergebnisse
Diese Methode wurde verwendet , CD4 + T-Zell - Alloreaktivität in Mäusen Spender Alloantigene vor heterotope Herztransplantation Allograft tolerant gemacht zu untersuchen. CBA - Mäuse (H-2 k) wurden ein Protokoll gegeben tolerisierenden eines spenderspezifischen bestehend (B6, H-2 b) Bluttransfusion kombiniert mit einem nichtdepletierenden CD4 - Antikörper eines Monat vor einer B6 Herztransplantation erhalten. Dieses Protokoll führt zu einer langfristigen Überleben Allotransplantat , die auf Foxp3 + regulatorische T - Zellen 36, 37 abhängig ist. Sieben Tage nach der Transplantation wurden Milz- CD4 + T - Zellen aus tolerisiert erhalten und nicht-tolerierten Empfänger von B6 Herzallotransplantaten und wurden coinkubiert mit B6 - Knochenmark abgeleitete DCs entsprechend dieses Protokoll. Abbildung 2 zeigt repräsentative Daten aus diesem Experiment. Die Membran - Kontakt Gate ist in 2 gezeigtA, mit grünem Fadenkreuz auf einem synaptischen Ereignisse (linkes Feld, 1) angeordnet und auf einem nicht-synaptischen Ereignisse (rechtes Feld). 2B zeigt die Hellfeld- und Fluoreszenzkanäle für dieses Ereignis. Zur Reduzierung bias, wurden die Daten von einem Beobachter zu Behandlungszuordnung 23 verblindet analysiert. Wie in mehreren Beispielen in 3 gezeigt ist , beide aus nicht-tolerant gemacht (3A-B) und tolerant gemacht (3C-D) CBA Empfänger von B6 Herzen, sind Synapsen leicht von nicht-synaptische Kontakten durch das Vorhandensein eines dichten FITC-positiven Grat an der T-APC - Schnittstelle. Diese Ergebnisse zeigen, dass die visuelle Erkennung von Immun Synapsen gemacht durch Empfänger-T-Zellen-Spuren mit dem Grad der Alloreaktivität in dem Empfänger.
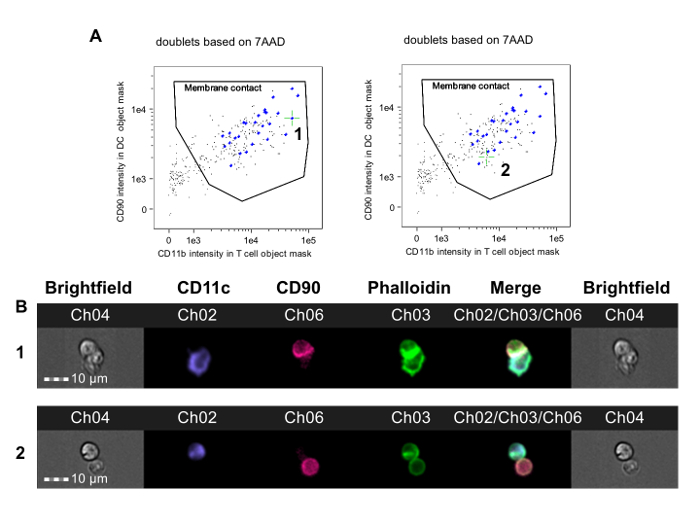
Abbildung 2. Identifizierung von T-APC Dubletten mit MembranKontakt und Immune Synapse Formation. Ereignisse in dem letzten Dublett Gatter (1F) analysiert. A. T-Zell - Marker Fluoreszenz in der Objektmaske APC wird aufgetragen gegen APC Marker Fluoreszenz in DC Objektmaske. Einige Dublette Ereignisse haben eine APC und ein T-Zell ohne Zell-Zell-Kontakt und erscheinen in der linken unteren Ecke des Grundstücks (Bilder nicht gezeigt). Ein Membran-Kontakt Gate kann so gezogen werden, dass nur Dubletts, in denen T-Zellen und APCs in Kontakt sind, umfasst. Bilder von jedem Ereignis in diesem Tor sind auf Anzeichen von Aktin Zytoskelett-Umlagerung in Phalloidin-FITC Kanal überprüft und kann mit Hilfe der Analysesoftware markiert werden. Die linke Tafel zeigt eine Immunsynapsenereignis (mit 1 gekennzeichnet und von grünem Fadenkreuz angedeutet), während die rechte Tafel einer Membrankontaktereignis ohne Immunsynapsenbildung (Fadenkreuz markiert durch grünes und 2 angegeben) angibt. Die Bestimmung der Synapsenbildung erfordert eine manuelle Überprüfung dieserBilder, Die obere Reihe zeigt Hellfeld- und Fluoreszenzkanal Bilder für ein Dublett mit einem Immun Synapse in B. B gezeigt (entspricht Ereignis 1 in A); Die untere Reihe zeigt ein Dublett mit Membran-Kontakt aber ohne Synapsenbildung (entspricht Ereignis 2 in A). Die Daten wurden in verblindet mit Bezug auf Behandlungszuordnung und werden von einem zuvor veröffentlichten Experiment 23 analysiert. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
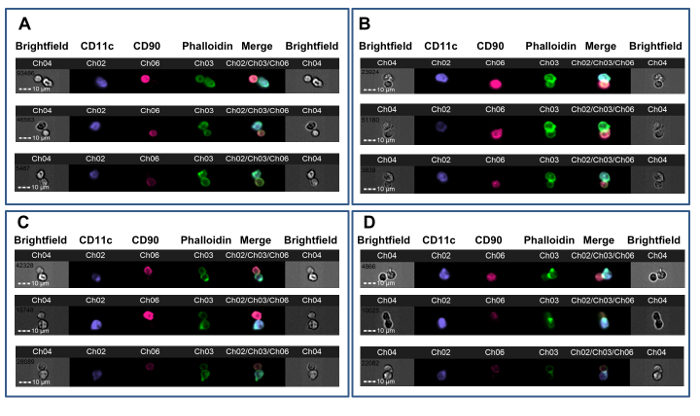
Abbildung 3. Beispiele für T-APC Synapsenbildung. CBA - Mäuse erhielten Allotransplantate von kardialen B6 Spender nach entweder keine Vorbehandlung (AB) oder nach der Toleranzinduktion mit B6 Vollblut unter der Abdeckung eines nichtdepletierenden Anti-CD4 - Antikörper ( rong> CD). Nach 7 Tagen wurden Milz- CD4 + T - Zellen für die Synapsenbildung mit B6 DCs getestet. A. Drei Beispiele für nicht-synaptischen Dubletts mit Membrankontakt aus einem nicht-tolerant gemacht Tiere. B. Drei Beispiele von Immun Synapsen von einem nicht-tolerierten Tiere. C. Drei Beispiele für nicht-synaptischen Dubletts mit Membran Kontakt von einem Tier tolerant gemacht. D. Drei Beispiele von Immun Synapsen von einem tolerisiert Tiere. Synapse-Bildung wird durch die Anwesenheit von einem hellen, FITC-positiven Grat an der T-APC-Schnittstelle (CH03) angegeben. Die Daten wurden in verblindet mit Bezug auf Behandlungszuordnung und werden von einem zuvor veröffentlichten Experiment 23 analysiert. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Tabelle 1. Antikörper und Farbstoffe in dieser Studie verwendet. Fluorochrom konjugierte Antikörper, Farbstoffe, Lieferanten und empfohlenen Konzentrationen sind in der Tabelle dargestellt. Die Abbildungs Durchflusszytometer Kanal, der verwendet wurde jedes Fluorochrom zu erkennen ist auch in der Tabelle gezeigt.
Diskussion
Imaging Durchflusszytometrie wurde verwendet , um Immunsynapsenbildung zwischen monoklonaler T - Zellen und APCs zu zeigen , oder in Gegenwart von Superantigenen 24, 25, 26, 27, 28. Dieses Verfahren nutzt die Tatsache , dass nach einem produktiven T - Zell-APC - Kontakt, die T - Zelle ihrer Aktinzytoskeletts umordnet, sie in Richtung der Kontaktstelle 21 polarisierend. Diese Umlagerung tritt nicht ohne TCR - Signalisierung, und es ist daher eine frühe Korrelat der T-Zell - Aktivierung 19, 20, 21. Die hier vorgestellte Methode paßt sich diesen Ansatz auf die Messung von alloreaktiven T-Zellen-Frequenz in polyklonalen T-Zellpopulationen. Als solches ist es in Zukunft als Grundlage für die Entwicklung von Assays für Spender reactivi dienen ty in der klinischen Transplantation.
Obwohl direkte Vergleiche noch nicht gemacht wurden, wird der Nachweis von alloreaktiven Immun Synapsen überlegen Vorhersagekraft als bei der herkömmlichen MLR zu haben. Zum Beispiel haben frühere Arbeiten gezeigt, dass in dem oben beschriebenen Protokoll tolerisierenden versagen die Ergebnisse eines MLR zuverlässig mit Transplantats Ergebnis 2 korrelieren.
Eine Reihe von Tests wurde für den betrieblich tolerant Zustand beim Menschen 9, 10, 11, obwohl diese nicht misst Effektor - Zell - Funktion in Antwort auf Alloantigen entwickelt. Im Gegensatz dazu Funktion IFNy ELISPOT - Tests messen 8 Effektor - T-Zellen , aber nicht das gesamte Spektrum der Zytokinsekretion erfassen , die 38 bis akute und chronische Allotransplantatabstoßung, wie IL-17 von Bedeutung sein kann,> 39. Der limitierende Verdünnungstest 4, der arbeitsintensiv ist, und die trans-vivo - Assay 6, die Mäuse, haben erhebliche praktische Einschränkungen erfordert , die deren Anwendung in einer klinischen Umgebung behindern würde. Die jüngsten Verbesserungen auf der Analyse von wuchernden Zellen unter Verwendung von TCR - Sequenzanalyse von T - Zellen in der MLR reagieren können von Wert sein, aber wie der Test hier vorgestellt, erfordern eine weitere Validierung in klinischen Studien 18, 40.
Die weitere Entwicklung des Immun Synapse Nachweistest erfordert, dass eine Reihe wichtiger Fragen beantwortet werden. Zunächst wird, wie der Test entwickelt misst Direkt Alloreaktivität. Der direkte Weg beinhaltet die Präsentation von allogenen MHC / Peptid-Komplexen auf dem Spender abgeleiteten APCs. Letztere werden in der Regel nach der Transplantation schnell beseitigt und weitere Alloantigen Präsentation ist Carried durch Empfänger APCs aus intaktem MHC-Donor (semi-direkten Weg) oder verarbeiteten Spenderantigene auf MHC selbst (indirekter Weg) zu präsentieren. Der indirekte Weg ist ein wichtiger Treiber der chronischen Allograft - Abstoßung 33, 41.
Im Prinzip soll es möglich sein , indirekte Immun Synapsen zu erkennen , diesen Test verwendet wird , sondern indirekt haben alloreaktiven T - Zellen , die eine viel niedrigere Frequenz als Direktfluege 42, 43, was bedeutet , dass die Analyse einer größeren Anzahl von Veranstaltungen benötigt werden. Eine zweite Überlegung ist , dass wir nur diesen Test unter Verwendung von CD4 + T - Zellen getestet, während der CD8 + T - Zellen , auch ein wichtiger Bestandteil der Anti-Donor - Antwort sind. Auch hier soll es möglich sein , CD8 + T - Zell-APC Synapsen mit dieser Methode zu erkennen. Eine weitere Einschränkung besteht darin, dass das Verfahren die manuelle Überprüfung und Analyse von Zellbildern in der letzten memb erfordertrane Kontakt Tor, und wir arbeiten derzeit an der Automatisierung von diesem Schritt.
Schließlich erfordert die Methode Test und Entwicklung bei Menschen und Vorstudien mit humanen Proben zur Zeit durchgeführt werden. Weitere phänotypische T-Zell - Untergruppe Analyse (dh Effektor, Speicher, regulatorische, etc.) in Kombination mit dem Nachweis von Immun Synapsen bei Transplantatempfängern würde einen leistungsfähigen Ansatz stellt das alloreaktiven T-Zell - Repertoire zur Charakterisierung und wird ein wichtiger Schwerpunkt sein zukünftige Arbeit.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
SCJ wurde von einer Internationalen Gesellschaft für Herz- und Lungentransplantation Research Fellowship und ein Royal College of Physicians und Chirurgen von Kanada Detweiler Reisen Fellowship.SM unterstützt wurde teilweise durch eine internationale Gesellschaft für Herz- und Lungentransplantation Career Development Award (bis SCJ) unterstützt. SS wurde von den National Institutes of Health Research Oxford Biomedical Research Centre.JH unterstützt wird, ist der Empfänger einer Niere Research UK Profi-Non-Clinical Fellowship. Diese Arbeit wurde durch die folgenden Zuschüsse an AB und KW finanziert: eine Wellcome Trust Programm Grant (082519Z07Z), eine British Heart Foundation Programm Grant (PG / 10 / 62,28504) und das EU-Rahmenprogramm 7 (eine Studie, BioDRIM). Die Autoren möchten Michael Parsons und die Flow Cytometry Core Facility am Lunenfeld-Tanenbaum Research Institute, Sinai Health System, Toronto für die Bereitstellung von Zugang zu und Unterstützung bei der Image Mark X Instrument danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Phosphate-buffered saline | Various | Varies | |
| Ethylenediamenetetraacetic acid, 0.5 M solution | Thermo Fisher Scientific | AM9260G | |
| Triton X-100 nonionic detergent | Sigma-Aldrich | X100 | |
| Beta-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Dimethyl sulfoxide | Sigma-Aldrich | D8418 | |
| Formaldehyde | Sigma-Aldrich | F1635 | Solution is 37% formaldehyde and so must be diluted 25 times for 1.5% solution |
| Cell strainers, 70 μm pore size | Fisher Scientific | 08-771-2 | |
| Phalloidin-fluorescein isothiocyanate | Sigma-Aldrich | P5282 | |
| 7-aminoactinomycin D | Thermo Fisher Scientific | A1310 | Reconstitute in DMSO |
| Allophycocyanin-conjugated anti-mouse CD90.2 | eBioscience | 17-0902 | |
| Pacific blue-conjugated anti-mouse CD11b | eBioscience | 48-0112 | Pacific blue has been replaced by eFluor 450 |
| Biotinylated anti-mouse CD3 | eBioscience | 13-0032 | |
| Biotinylated anti-mouse MHC class II | eBioscience | 13-5321 | |
| Biotinylated anti-mouse B220 | eBioscience | 13-0452 | |
| Biotinylated anti-mouse CD8 | eBioscience | 13-0081 | |
| Biotinylated anti-mouse CD19 | eBioscience | 13-0193 | |
| Anti-biotin microbeads | Miltenyi Biotec | 130-090-485 | |
| LS columns | Miltenyi Biotec | 130-042-401 | |
| MidiMACS magnetic cell separator | MIltenyi Biotec | 130-042-302 | |
| recombinant mouse GM-CSF | Peprotech | 315-03 | |
| recombinant human TGFβ1 | Peprotech | 100-21 | Human TGFβ1 has activity on mouse cells |
| Amnis ImageStream X Mark II | Amnis/EMD Millipore | N/A | Imaging flow cytometer; details available at http://www.emdmillipore.com/ |
| IDEAS Software | Amnis/EMD Millipore | N/A | Free download (registration required): https://www.amnis.com/index.php/page/Display/login%20%20 |
| Cell culture medium | Various | Varies | |
| Fetal bovine serum | Various | Varies | |
| Cell culture plates | Various | Varies |
Referenzen
- Cravedi, P., Heeger, P. S. Immunologic monitoring in transplantation revisited. Curr Opin Organ Transplant. 17 (1), 26-32 (2012).
- Pearson, T. C., et al. The assessment of transplantation tolerance induced by anti-CD4 monoclonal antibody in the murine model. Transplantation. 55 (2), 361-367 (1993).
- Strober, S., Benike, C., Krishnaswamy, S., Engleman, E. G., Grumet, F. C. Clinical transplantation tolerance twelve years after prospective withdrawal of immunosuppressive drugs: studies of chimerism and anti-donor reactivity. Transplantation. 69 (8), 1549-1554 (2000).
- Fussell, S. T., Donnellan, M., Cooley, M. A., Farrell, C. Cytotoxic T lymphocyte precursor frequency does not correlate with either the incidence or severity of graft-versus-host disease after matched unrelated donor bone marrow transplantation. Transplantation. 57 (5), 673-676 (1994).
- Roelen, D. L., et al. Relevance of cytotoxic alloreactivity under different immunosuppressive regimens in clinical islet cell transplantation. Clin Exp Immunol. 156 (1), 141-148 (2009).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J Clin Invest. 106 (1), 145-155 (2000).
- Poggio, E. D., Clemente, M., Hricik, D. E., Heeger, P. S. Panel of reactive T cells as a measurement of primed cellular alloimmunity in kidney transplant candidates. J Am Soc Nephrol. 17 (2), 564-572 (2006).
- Zitzner, J. R., Tambur, A. R. Role of ELISPOT Assays in Risk Assessment Pre- and Post-Kidney Transplantation. Cells. 1 (2), 100-110 (2012).
- Newell, K. A., et al. Identification of a B cell signature associated with renal transplant tolerance in humans. J Clin Invest. 120 (6), 1836-1847 (2010).
- Brouard, S., et al. Identification of a peripheral blood transcriptional biomarker panel associated with operational renal allograft tolerance. Proc Natl Acad Sci U S A. 104 (39), 15448-15453 (2007).
- Sagoo, P., et al. Development of a cross-platform biomarker signature to detect renal transplant tolerance in humans. J Clin Invest. 120 (6), 1848-1861 (2010).
- Halloran, P. F., Famulski, K. S., Reeve, J. Molecular assessment of disease states in kidney transplant biopsy samples. Nat Rev Nephrol. 12 (9), 534-548 (2016).
- Li, L., et al. Identification of common blood gene signatures for the diagnosis of renal and cardiac acute allograft rejection. PLoS One. 8 (12), e82153(2013).
- Khatri, P., et al. A common rejection module (CRM) for acute rejection across multiple organs identifies novel therapeutics for organ transplantation. J Exp Med. 210 (11), 2205-2221 (2013).
- Halloran, P. F., et al. Microarray diagnosis of antibody-mediated rejection in kidney transplant biopsies: an international prospective study (INTERCOM). Am J Transplant. 13 (11), 2865-2874 (2013).
- Mastoridis, S., Issa, F., Wood, K. J. Novel biomarkers and functional assays to monitor cell-therapy-induced tolerance in organ transplantation. Curr Opin Organ Transplant. 20 (1), 64-71 (2015).
- Miqueu, P., et al. Analysis of the peripheral T-cell repertoire in kidney transplant patients. Eur J Immunol. 40 (11), 3280-3290 (2010).
- Morris, H., et al. Tracking donor-reactive T cells: Evidence for clonal deletion in tolerant kidney transplant patients. Sci Transl Med. 7 (272), 272ra210(2015).
- Dustin, M. L., Bromley, S. K., Kan, Z., Peterson, D. A., Unanue, E. R. Antigen receptor engagement delivers a stop signal to migrating T lymphocytes. Proc Natl Acad Sci U S A. 94 (8), 3909-3913 (1997).
- Goldsmith, M. A., Weiss, A. Early signal transduction by the antigen receptor without commitment to T cell activation. Science. 240 (4855), 1029-1031 (1988).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Stoll, S., Delon, J., Brotz, T. M., Germain, R. N. Dynamic imaging of T cell-dendritic cell interactions in lymph nodes. Science. 296 (5574), 1873-1876 (2002).
- Juvet, S. C., Sanderson, S., Hester, J., Wood, K. J., Bushell, A. Quantification of CD4(+) T Cell Alloreactivity and Its Control by Regulatory T Cells Using Time-Lapse Microscopy and Immune Synapse Detection. Am J Transplant. 16 (5), 1394-1407 (2016).
- Ahmed, F., Friend, S., George, T. C., Barteneva, N., Lieberman, J. Numbers matter: quantitative and dynamic analysis of the formation of an immunological synapse using imaging flow cytometry. J Immunol Methods. 347 (1-2), 79-86 (2009).
- Burbach, B. J., et al. Distinct regulation of integrin-dependent T cell conjugate formation and NF-kappa B activation by the adapter protein ADAP. J Immunol. 181 (7), 4840-4851 (2008).
- Markey, K. A., et al. Cross-dressing by donor dendritic cells after allogeneic bone marrow transplantation contributes to formation of the immunological synapse and maximizes responses to indirectly presented antigen. J Immunol. 192 (11), 5426-5433 (2014).
- Moreau, H. D., et al. Dynamic in situ cytometry uncovers T cell receptor signaling during immunological synapses and kinapses in vivo. Immunity. 37 (2), 351-363 (2012).
- Wabnitz, G. H., Nessmann, A., Kirchgessner, H., Samstag, Y. InFlow microscopy of human leukocytes: A tool for quantitative analysis of actin rearrangements in the immune synapse. J Immunol Methods. , (2015).
- Ford, W. L., Simmonds, S. J., Atkins, R. C. Early cellular events in a systemic graft-vs.-host reaction. II. Autoradiographic estimates of the frequency of donor lymphocytes which respond to each Ag-B-determined antigenic complex. J Exp Med. 141 (3), 681-696 (1975).
- Macedo, C., et al. Contribution of naive and memory T-cell populations to the human alloimmune response. Am J Transplant. 9 (9), 2057-2066 (2009).
- Noorchashm, H., et al. A direct method for the calculation of alloreactive CD4+ T cell precursor frequency. Transplantation. 67 (9), 1281-1284 (1999).
- Suchin, E. J., et al. Quantifying the frequency of alloreactive T cells in vivo: new answers to an old question. J Immunol. 166 (2), 973-981 (2001).
- Lee, R. S., et al. Indirect recognition of allopeptides promotes the development of cardiac allograft vasculopathy. Proc Natl Acad Sci U S A. 98 (6), 3276-3281 (2001).
- Pickl, W. F., et al. Molecular and functional characteristics of dendritic cells generated from highly purified CD14+ peripheral blood monocytes. J Immunol. 157 (9), 3850-3859 (1996).
- Inaba, K., et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J Exp Med. 176 (6), 1693-1702 (1992).
- Francis, R. S., et al. Induction of transplantation tolerance converts potential effector T cells into graft-protective regulatory T cells. Eur J Immunol. 41 (3), 726-738 (2011).
- Saitovitch, D., Bushell, A., Mabbs, D. W., Morris, P. J., Wood, K. J. Kinetics of induction of transplantation tolerance with a nondepleting anti-Cd4 monoclonal antibody and donor-specific transfusion before transplantation. A critical period of time is required for development of immunological unresponsiveness. Transplantation. 61 (11), 1642-1647 (1996).
- Faust, S. M., et al. Role of T cell TGFbeta signaling and IL-17 in allograft acceptance and fibrosis associated with chronic rejection. J Immunol. 183 (11), 7297-7306 (2009).
- Yuan, X., et al. A novel role of CD4 Th17 cells in mediating cardiac allograft rejection and vasculopathy. J Exp Med. 205 (13), 3133-3144 (2008).
- Emerson, R. O., Mathew, J. M., Konieczna, I. M., Robins, H. S., Leventhal, J. R. Defining the alloreactive T cell repertoire using high-throughput sequencing of mixed lymphocyte reaction culture. PLoS One. 9 (11), e111943(2014).
- Stanford, R. E., Ahmed, S., Hodson, M., Banner, N. R., Rose, M. L. A role for indirect allorecognition in lung transplant recipients with obliterative bronchiolitis. Am J Transplant. 3 (6), 736-742 (2003).
- Benichou, G., Valujskikh, A., Heeger, P. S. Contributions of direct and indirect T cell alloreactivity during allograft rejection in mice. J Immunol. 162 (1), 352-358 (1999).
- Liu, Z., et al. Contribution of direct and indirect recognition pathways to T cell alloreactivity. J Exp Med. 177 (6), 1643-1650 (1993).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten