Method Article
Eine Pipettenspitze basierte Methode für das Seeding Zellen Tröpfchen mikrofluidischen Plattformen
In diesem Artikel
Zusammenfassung
Dieser Artikel stellt ein Protokoll für die Aussaat knappe Bevölkerung der Zellen mittels Pipettenspitzen Tröpfchen mikrofluidischen Geräten um höhere Effizienz der Kapselung von Zellen in Tröpfchen zu bieten.
Zusammenfassung
Unter verschiedenen mikrofluidischen Plattform Designs häufig verwendet für zelluläre Analyse bietet Tröpfchen-Mikrofluidik ein robustes Werkzeug für die Isolierung und Analyse von Zellen in den einzelligen Stadium durch den Wegfall des Einfluss externer Faktoren auf die zelluläre Mikroumgebung. Kapselung von Zellen in Tröpfchen wird durch die Poisson-Verteilung in Abhängigkeit von der Anzahl der Zellen in jedem Tropfen und die durchschnittliche Anzahl der Zellen pro Volumen von Tröpfchen diktiert. Primärzellen, insbesondere Immunzellen oder klinischen Proben können knapp werden und weniger Verlust-Kapselung der Zellen bleibt eine Herausforderung. In diesem Beitrag präsentieren wir eine neue Methodik, die Pipettenspitzen verwendet, um Zellen zu Tröpfchen-basierte mikrofluidischen Geräten ohne erheblichen Verlust von Zellen zu laden. Mit verschiedenen Zelltypen beweisen wir effiziente Zelle Kapselung in Tröpfchen, die eng mit der Kapselung Effizienz vorhergesagt durch die Poisson-Verteilung entspricht. Unsere Methode sorgt für Verlust-weniger Belastung der Zellen zu mikrofluidischen Plattformen und lässt sich leicht anpassen für nachgeschaltete Einzelzelle Analyse, z. B. zelluläre Interaktionen zwischen verschiedenen Zelltypen zu entschlüsseln.
Einleitung
In den letzten Jahren hat die Verwendung von Mikrofluidik als robuste und vielseitige Plattform für zelluläre Analyse der Ebene der einzelnen Zelle rasch erhöhte1. Diese Plattformen bieten Hochdurchsatz-Screening von Einzelzellen und biologische Moleküle mit hoher Präzision und Sensibilität mit sehr kleinen Stichprobe Band2,3,4. Unter den verschiedenen Arten von mikrofluidischen Designs ermöglichen Droplet-basierten Plattformen Hochdurchsatz-Analyse einzelner Zellen indem Sie sie in eine wässrige Phase Tropfen umgeben von einer nicht mischbaren Phase, die ermöglicht die präzise und genaue Kontrolle über die zelluläre isolieren Mikroumgebung5,6. Tröpfchen-basierte Mikrofluidik gibt die Flexibilität zu isolieren, einzelne oder mehrere Zellen in beiden, wässrige und Hydrogel Tröpfchen und ist wertvoll bei der Sondierung komplexen zellulären Verhaltens, z. B. Protein Sekretion oder zellulären Interaktionen7, 8 , 9. Signaling und Übersprechen zwischen Immunzellen durch Interaktionen mit anderen Zellen in der Mikroumgebung10beeinflusst werden können. Isolierung einzelner Zellen in Tröpfchen bietet eine effektive rauschfreie Analyselabor, frei vom Einfluss der äußeren Umweltfaktoren für effiziente und genaue Ergebnisse11,12. Ändern das Design einer Tröpfchen-Mikrofluidik-Plattform mit mehreren Buchten ermöglicht die Verkapselung von mehreren Zelltypen, zellulären Interaktionen über Zelle Paarung12,13zu studieren.
Der Prozess der Kapselung von Zellen in Tröpfchen ist zufällig und die Rate der Kapselung von Zellen kann mit Hilfe der Formel für die Poissonverteilung14,15statistisch ermittelt werden. Diese Rate der Kapselung abgeschätzt werden, indem man die durchschnittliche Rate von der Ankunft der Zellen an der Kreuzung der Tröpfchen und vorausgesetzt, dass die Ankunft der einzelnen Zellen unabhängig von der Ankunft der anderen Zellen16. Obwohl unabhängige Zelle Ankunft nicht garantiert werden kann, im Falle einer spärlich verteilte Zellen, die Annahme der Unabhängigkeit angesehen werden kann und die Wahrscheinlichkeit eines Tropfens, enthält eine oder mehrere Zellen vorhergesagt werden kann, in Abhängigkeit von der Anzahl der Zellen in jedem Tropfen und die durchschnittliche Anzahl der Zellen pro Tropfen16,17. Da diese Abschätzung der zellulären Kapselung in Tröpfchen hängt von der Anzahl der Zellen in jedem Tropfen vorhanden ist, kann man vermuten, dass Erhöhung der Konzentration der Zellen am Einlass die durchschnittliche Anzahl der Zellen in jedem Tropfen steigt 16. daher um einzelne Zelle Kapselung zu gewährleisten, die Zelle Konzentrationen müssen reduziert werden aber oft führt eine große Anzahl von leeren Tröpfchen18.
Verlust von Zellen während des Ladens von Anlage, Sedimentation, und/oder Verklumpung in der Spritze, Schläuche oder Produktions-Gerät ist ein gemeinsamer Nachteil verantwortlich für die Abweichung der tatsächlichen Kapselung Werte aus dem vorhergesagten Kapselung Werte19 . Dieses Problem wird weiter übertrieben, wenn seltene Immunzellen oder klinischen Proben seeding, da sie bereits in der Bevölkerung knapp und die Kapselung von nur ein paar Zellen, viel niedriger als erwartet, keine ausreichende Daten für experimentelle Analyse bietet. Plasmazytoide dendritische Zellen (pDCs) sind eine seltene Untergruppe von Immunzellen, die nur ca. 0,2 - 0,6 Prozent des gesamten weißen Blut-Zelle Bevölkerung20. Diese Zellen sezernieren massive Mengen von Typ-I-Interferone bei der Aktivierung und spielen dabei eine entscheidende Rolle in der Immunantworten21. Wenn das zelluläre Verhalten solcher seltenen Zellen in Tröpfchen zu studieren, ist es unerlässlich, Zellverlust während Cell seeding und Kapselung22zu verhindern. Es gibt mehrere design-Entwicklungen, die dafür gesorgt haben, dass die Kapselung der einzelnen Zellen in Tröpfchen mit aktiven Kapselung-Methoden, die zur Erzeugung von Tröpfchen mit verschiedenen physikalischen Kräfte wie akustische oder elektrische Kräfte nutzen Einzel-Zellen23,24. Diese Methoden haben jedoch ihre eigenen Grenzen in Bezug auf die Tröpfchen Produktion16.
In dieser Studie haben wir eine robuste und unkomplizierte Methode, die die Defizite der traditionellen Methoden für das Laden einzelner oder mehrerer Zellen zu mikrofluidischen Geräten umgeht. Unsere Methode, inspiriert von Rho Et Al., unterschiedlich große Pipettenspitzen für die Aussaat von Kleinmengen von seltenen Immunzellen zu Tröpfchen mikrofluidischen Plattformen ohne signifikante Stichprobe nutzt und Ergebnisse, die im Einklang mit theoretischen Vorhersagen-25. Diese Methode lässt sich leicht und erfolgreich für verschiedene Anwendungen, bei denen Droplet-basierte Mikrofluidik angepasst und eine Vielzahl von Zelltypen oder sogar Mikropartikel beantragt.
Protokoll
(1) 3-Inlet Polydimethylsiloxan (PDMS) Gerät Fertigung
- Messen 40 g der PDMS-Basis in eine Klimaanlage Mixer Tasse und fügen Sie 4 g PDMS Härtemittel auf der Basis Reagenz in der Tasse, sorgfältig, mit einer Pipette.
- Stellen Sie die Tasse in die Halterung des Mischers Klimaanlage und Messen Sie das Gesamtgewicht des Bechers mit dem Halter zu. Legen Sie den Wert von der Zentrifuge Ausgleichsgewicht am Mischpult Klimaanlage entsprechend.
- Mischen Sie die Basis und Härtemittel in der Klimaanlage Mischer bei 2.000 u/min für 2 min gefolgt von de-Schaum vor 2.000 u/min, 2 min.
- Bereiten Sie eine Aluminium-Boot mit einem Durchmesser ungefähr die gleiche Größe wie die von einem 100 mm-Silizium-Wafer. Die Silizium-Wafer hergestellt für das Replikat molding Prozesses in der Aluminium-Boot legen und dieses Setup in einer Petrischale (Durchmesser = 120 mm, Höhe = 20 mm).
Hinweis: Die Größe der Petrischale richtet sich nach der Größe der Silizium-Wafer. - Die Tasse aus der Halterung entfernen und den Teig bereits ausgehärteten PDMS (Inhalt des Bechers), sorgfältig auf die Silizium-Wafer.
- Legen Sie die Petrischale mit der Silizium-Wafer mit der bereits ausgehärteten PDMS-Mischung in den Exsikkator gestellt für ca. 20 min um die Luftblasen zu entfernen.
- Entfernen Sie die Petrischale nach 20 min und für die verbleibenden Luftblasen, die entfernt werden können.
- Legen Sie die Petrischale in einem Ofen bei 65 ° C für mindestens 3 h festgelegt.
- Nehmen Sie die Petrischale aus dem Ofen, nach 3 h, und ziehen Sie vorsichtig den ausgehärteten PDMS aus dem Siliziumwafer.
- Schneiden Sie PDMS Geräte entlang Schnittlinien, mit einem Messer oder einem Skalpell. Lochen Sie am ein- und Ausgang von jedem Gerät mit einem 1,2 mm Puncher. Reinigen Sie jede PDMS-Gerät mit Tesafilm, keine Staub oder Restwert Stücke von PDMS zu entfernen.
- Optional, Schlag mit Stickstoff, PDMS Reststücke zu entfernen.
- Bereiten Sie Glas-Folien durch Reinigung mit Seifenwasser, gefolgt von Isopropanol und trocken mit Stickstoff.
- Bindung eine saubere PDMS-Gerät mit einem sauberen Objektträger in einem Plasma Asher, Flow-Linien zu schließen. Verwenden Sie die folgenden Einstellungen: Power: 50 W, Zeit: 45 s, Bleed-Delay-Zeit: 2 s, Prozessgas: Gas 1 (Luft), Vent: beide Ventile Restricted vent Zeit: 60 s, Pumpe Spindown Zeit: 10 s, Vent Haltezeit: 0 s, Gaszeit Abschaltung: 1 s, Turbo Pumpen aktiviert : 0. trennen Sie alle anderen Gasleitungen.
Hinweis: Die Einstellungen für die Plasma-Asher nach der Marke des Plasmas variieren kann verwendet Asher. - Bereiten Sie die Silan-Lösung durch Zugabe von 50 µL Silan (1H, 1H, 2H, 2H-Perfluorooctyltriethoxysilane), 950 µL von fluorierten Öl.
Hinweis: Silan ist giftig. Bitte unter Abzug arbeiten. - Zeichnen Sie die vorbereiteten Silan-Lösung in einer Spritze, die mit einer Teflon-Schlauch verbunden ist.
- Salinize Sie das Gerät durch Spülen die vorbereiteten Silan-Lösung durch den Auslass des Gerätes.
- Stellen Sie das Gerät in einem Ofen bei 65 ° C für 30 min eingestellt.
- Das salinized Gerät aus dem Ofen nehmen und überschüssige Silan aus dem Gerät mit fluorierten Öl spülen.
- Stellen Sie das Gerät wieder in einem Ofen bei 65 ° C für mindestens 1 h zum Abschließen der Bindung festgelegt.
Hinweis: Das Protokoll kann hier angehalten werden.
2. Verlust-Less Zelle Kapselung
-
Zelle zu ernten
- Wieder aussetzen Sie Jurkat T-Zellen in Roswell Park Memorial Institute (RPMI) Medium bei Konzentrationen von 1.0x106 Zellen/mL, 2.0x106 Zellen/mL, 4.0x106 Zellen/mL und 8.0x106 Zellen/mL; pDCs in hämatopoetischen serumfreien Nährmedien (z. B. X-VIVO 15) bei Konzentrationen von 1.3x106 Zellen/mL, 3.0x106 Zellen/mL und 13.0x106 Zellen/mL; A549 Zellen in Dulbeccos geändert Eagle Medium (DMEM) in einer Konzentration von 1.0x106 Zellen/mL.
Hinweis: Die Art der Zellen und die Konzentration der Zellen auf das Experiment abhängig. Kennzeichnung von Zellen kann auch auf das Experiment durchgeführt werden.
- Wieder aussetzen Sie Jurkat T-Zellen in Roswell Park Memorial Institute (RPMI) Medium bei Konzentrationen von 1.0x106 Zellen/mL, 2.0x106 Zellen/mL, 4.0x106 Zellen/mL und 8.0x106 Zellen/mL; pDCs in hämatopoetischen serumfreien Nährmedien (z. B. X-VIVO 15) bei Konzentrationen von 1.3x106 Zellen/mL, 3.0x106 Zellen/mL und 13.0x106 Zellen/mL; A549 Zellen in Dulbeccos geändert Eagle Medium (DMEM) in einer Konzentration von 1.0x106 Zellen/mL.
-
Tipp-Laden für wässrige Tröpfchen-generation
- Bereiten Sie fluorierte Öl mit 3 % biokompatibel Tensid Mischung durch Zugabe von 3 mL Tensid auf 2 mL von fluorierten Öl vor.
Hinweis: Die Konzentration des Tensids hinzugefügt, um die fluorierten Öl bestimmt die Stabilität der Emulsion für unterschiedliche Inkubationszeiten. Die Konzentration des Tensids variiert je nach verwendeten für bestimmte Zelltypen Medien. - Zeichnen Sie die Ölmischung Phase in eine Spritze (1 mL). Entfernen Sie Luftblasen aus der Spritze und verbinden Sie es mit einem Teflon-Schlauch entsprechender Länge.
- Bereiten Sie eine Probe-Spritze durch Zeichnung biokompatible Mineralöl in einer Spritze. Luftblasen zu entfernen und die Spritze mit einer Teflon-Schlauch entsprechender Länge verbinden.
- Lochen Sie einen PDMS-Stecker mit einem Durchmesser von 5 mm aus einer ausgehärteten PDMS-Platte.
Hinweis: Die ausgehärtete PDMS-Platte kann mit Schritten 1,1 bis 1,9 vorbereitet werden. Verwenden Sie einen einfachen Silizium-Wafer statt einem hergestellte Silizium-Wafer. - Lochen Sie ein weiteres Loch in der Mitte des Steckers mit einem 1 mm-Puncher.
- Stecken Sie den Stecker in eine 200 µL Pipettenspitze vom Ende größer, so dass es eng anliegt.
Hinweis: Verwenden Sie eine 1.000 µL Pipettenspitze für größere Probenvolumen und größere Zellen. Für 1.000 µL Pipettenspitze können Stecker zwischen 5 mm und 7 mm Durchmesser verwendet werden. Mit einem Stecker Durchmesser 5 mm, ein Probenvolumen von rund 400 µL in der Pipettenspitze angesaugt werden kann. Wenn ein Stecker mit größerem Durchmesser verwendet (7 mm) ist, kann weitere Probenvolumen (rund 900 µL) abgesaugt werden. - Legen Sie die Schläuche, die mit der Spritze verbunden ist in der PDMS-Plug, der in der Pipettenspitze eingefügt wurde. Schieben Sie den Spritzenkolben langsam an die angeschlossenen Pipettenspitze mit Mineralöl zu füllen. Die restliche Luft aus der Pipettenspitze herausdrücken.
- Senken Sie die Pipettenspitze, verbunden mit der Spritze in der Probenlösung und aspirieren Sie ca. 150 µL der Probe in der Spitze.
- Wiederholen Sie die Schritte 2.2.4 zu 2.2.8, eine zweite Probe Spritze vorzubereiten.
- Legen Sie alle drei vorbereiteten Spritzen vorsichtig auf die Spritzenpumpe.
- Legen Sie beide die Pipettenspitzen, mit der Probe in die zwei inneren Buchten von PDMS-Chip. Legen Sie das Rohr mit der Ölmischung Phase in die äußere Bucht.
- Legen Sie den Wert für die Durchflussmengen an der Spritzenpumpe wie folgt: kontinuierliche Phase Lösung: 600 µL/h Zellproben: 100 µL/h, jeder. Geben Sie und legen Sie die Abmessungen der Spritze.
Hinweis: Der Durchmesser Einstellungen variieren basierend auf dem Typ der Spritze. - Starten Sie die Pumpe zum Spülen der Probenlösung durch die inneren Kanäle der Gerät und Öl durch den äußeren Kanal des Geräts.
- Schließen Sie einen Schlauch der entsprechenden Länge an die Steckdose zu sammeln die Tröpfchen wenn die Tropfenbildung stabil ist. Der Abholung richtet sich nach dem Experiment.
- Tröpfchen in einer Sperre Röhre zu sammeln. Fügen Sie 200 µL RPMI Medium (ohne Serum) auf die gesammelten Tropfen und inkubieren Sie die Probe.
Hinweis: Inkubation der gesammelten Tropfen variiert basierend auf das Experiment. Tropfen werden in einem Schloss Rohr erhoben, wenn Flow Cytometry-basierte Analyse oder Isolierung erfolgt nach dem Abrufen der Zellen von Tröpfchen durch das Brechen der Emulsion. Es ist möglich, die Tropfen in einem Glas zu sammeln, wenn das Experiment in Tröpfchen mikroskopische Analyse erfordert.
- Bereiten Sie fluorierte Öl mit 3 % biokompatibel Tensid Mischung durch Zugabe von 3 mL Tensid auf 2 mL von fluorierten Öl vor.
-
Emulsion zu brechen und Zelle abrufen durchflusszytometrischen Analyse
- Bereiten Sie 20 % 1H, 1H, 2H, 2H-Perfluoro-1-Octanol (PFO) Lösung (V/V) in fluorierten Öl durch Zugabe von 2 mL des PFO in 10 mL Flourinated Öl.
- Entfernen Sie überschüssiges Öl von der Unterseite der das Sammelröhrchen, die Tröpfchen, die mit einer Spritze mit.
- Die Emulsion zu brechen die Emulsion und lassen Sie die verkapselten Zellen in der wässrigen Phase fügen Sie 100 µL 20 % PFO Lösung hinzu. Tippen Sie auf und kurz mixen. An dieser Stelle nicht Wirbel tun. 1-2 min inkubieren.
Hinweis: Die Höhe PFO hinzugefügt richtet sich nach der Anzahl der Tröpfchen produziert. Hinzufügen Sie halten Sie das zusätzlicher PFO bis die Ölschicht komplett aufgelöst ist. Denken Sie daran, dass PFO giftig für die Zellen ist und PFO zu hohen oder zu lange Inkubation in PFO zu führen könnte Zelltod erhöhte. - Drehen Sie die Lösung kurz auf die niedrigste mögliche Rcf für 30 s.
- Bereiten Sie 100 mL kalte Phosphate-Buffered Kochsalzlösung (PBS) Lösung ergänzt mit 2 % fetalen Kalb Serum (FCS) (2 mL FCS in 98 mL PBS).
- Pipette 550 µL des wässrigen Anteils sofort nach Zentrifugation und überträgt es auf einen neuen Verschluss-Schlauch mit 500 µL kaltem PBS-Lösung mit 2 % FCS, ergänzt, wie im Schritt 2.3.5 vorbereitet. Lassen Sie Restöl sinken auf den Boden der neuen Sperre Röhre.
- Aspirieren Sie 950 µL der wässrigen Phase mit Zellen aus diesem Schloss Rohr sorgfältig, ohne jede Restöl Absaugen und übertragen Sie die Lösung zu einem neuen Lock Schlauch.
- Spin-down der Zellen in die neue Schleuse Röhre 10 min. lang.
- Wieder aussetzen Sie Zellen in 300 µL kaltem PBS-Lösung mit 2 % FCS, ergänzt, wie im Schritt 2.3.5 vorbereitet.
Hinweis: Die Zellen können auch in eine andere geeignete Lösung wie Medien je nach dem Experiment wieder ausgesetzt werden. Färben Sie die Zellen, basierend auf das Experiment für Analyse mit Durchflusszytometrie.
3. Handy koppeln
-
Zelle zu ernten und Färbung
- Jurkat T-Zellen, aus Kultur-Kolben, zählen und spin-down der Zellen bei 1.500 u/min, 5 min.
- Entfernen Sie den Überstand zu und wieder auszusetzen Sie 1.0x106 Zellen in 1 mL PBS zu einer Konzentration von 1.0x106 Zellen/mL. PBS hinzugefügt hängt die Zellzahl.
- Wiederholen Sie die Schritte 3.1.1, 3.1.2, eine zweite Stichprobe von Jurkat T-Zellen mit der gleichen Zellkonzentration vorzubereiten.
- Waschen Sie beide Proben zweimal mit 1 mL PBS bei 1.500 u/min für 5 min.
- Wieder aussetzen einer Zellprobe mit 1,25 µM Carboxyfluorescein Succinimidyl Ester (CFSE) Farbstoff und die Zellprobe mit 1,25 µM weit roten Farbstoff oder 1,25 µM Zelle Verbreitung Farbstoff in einer Zelle Konzentration von 1.0x106 Zellen/mL. Die gesamte Färbelösung ist 1 mL für 1.0x106 Zellen.
Hinweis: Zellen können mit verschiedenen Farbstoffen je nach Filter in das Durchflusszytometer oder in dem Fluoreszenzmikroskop gekennzeichnet werden. - Inkubieren Sie die Zellproben mit Farbstoffen für 10 min bei 37 ° c
- Die Färbung Reaktion durch Zugabe von 1 mL Eis kalt FCS nach 10 min zu stoppen.
- Waschen Sie die Zellproben zweimal mit 1 mL PBS bei 1.500 u/min, 5 min.
- Wieder aussetzen der Zellproben in RPMI Medien in einer Konzentration von 10.0x106 Zellen/mL, für jede Farbe.
-
Tipp-Laden für die Produktion von Agarose Hydrogel Tröpfchen zum Handy koppeln
Hinweis: Für Zelle Paarung mit Agarose Hydrogel Tröpfchen, behalten Sie die Temperatur des Systems zwischen 27 ° C und 37 ° C im gesamten Tröpfchen Generierung und Sammlung Prozess um zu verhindern, der die Hydrogele Gelier- und zelluläre Lebensfähigkeit9zu rechtfertigen.- Lösen Sie extrem niedrige gelierende Temperatur Agarose durch Erhitzen bis zu 75 ° C mit PBS-Puffer in einer Konzentration von 4 % (w/V auf) und rühren Sie die Mischung für 20 Minuten.
- Mischen Sie die Agarose-Lösung mit beschrifteten Jurkat T Zellen zu einer Agarose-Konzentration von 2 % (w/V). Wiederholen Sie diesen Vorgang für die anderen Probe mit anders gekennzeichneten Zellen.
- Bereiten Sie fluorierte Öl mit 2 % Tensid Mischung durch Zugabe von 20 mL Tensid, 30 mL von fluorierten Öl (Öl-Phase-Gemisch).
- Folgen Sie den Schritten 2.2.2 - 2.2.14.
Hinweis: Aufgrund der viskosen niedrig schmelzende Agarose und stabile Tröpfchen Produktion sicherzustellen, legen Sie den Wert der Fördermengen auf die Spritzenpumpen wie folgt: Öl-Phase Mischung: 2.000 µL/h Zellproben: 200 µL/h. Geben Sie und legen Sie die Abmessungen der Spritze. - Sammeln Sie die Tropfen in einem Schloss-Rohr und inkubieren Sie die Tropfen bei 4 ° C für 60 min.
-
Emulsion zu brechen und Agarose Bead Abruf für FACS Analyse
- Entfernen Sie nach der Inkubation der Tröpfchen für 60 min überschüssiges Öl aus der Schloss-Tube, die Tröpfchen, die mit einer Spritze mit.
- Fügen Sie 200 µL des PFO, die Öl-Interphase aus Tröpfchen zu entfernen.
Hinweis: Die Höhe des PFO hinzugefügt, um das Rohr hängt die Menge der Tropfen produziert. Hinzufügen Sie halten Sie das zusätzlicher PFO bis die Ölschicht komplett aufgelöst ist. - Waschen Sie die gesammelten Agarose Korne zweimal mit 1 mL kaltem PBS Öl vollständig durch Zentrifugation bei 1.500 u/min, 10 min zu entfernen.
- Analysieren Sie die gesammelten Agarose Korne mit Durchflusszytometrie.
Hinweis: Es ist auch möglich, die Perlen unter dem Fluoreszenzmikroskop zu beobachten.
Ergebnisse
Für unsere Experimente verwendeten wir eine 3-Einlass PDMS basierend mikrofluidischen Gerät mit der Höhe von 25 µm (Abbildung 1). In dieser Geräte-Setup verwendet wir den äußeren Einlass zum Spülen des Öls mit Tensid und die zwei inneren Buchten für die Spülung der wässrigen Phasen mit Zellsuspensionen oder Medien. Nach der Generierung und Sammlung sind die Tröpfchen für ein paar Stunden off Chip inkubiert, bevor nachgelagerte Analyse mit flow Cytometry. Während der Inkubationszeit können Serumkomponenten präsent in den Medien interagieren mit dem Tensid und verursachen Tröpfchen zu instabil und zerfallen. Es ist daher wichtig, eine optimierte Konzentration des Tensids fluorierten Öl hinzuzufügen. Wir testeten die Stabilität der Prozess Tröpfchen mit hämatopoetischen serumfreien Nährmedien mit 2 % Humanserum mit unterschiedlichen Konzentrationen an Tensid in fluorierten Öl ergänzt. Es kann hergeleitet werden aus Abbildung 2 , die diesen Prozess Tröpfchen sehr stabil für bis zu 24 Stunden, wenn Sie mindestens 3 % Tensid wird hinzugefügt, um die Ölphase. Ähnliche Ergebnisse wurden bei RPMI Medien mit und ohne Zusatz von 10 % FCS (Daten nicht gezeigt). Deshalb Tröpfchen Stabilität stark abhängig von der optimalen Tensid Konzentration bei der Arbeit mit verschiedenen Quellen von Nährmedien und Serumkomponenten.
Um die Kapselung Effizienz unseres Ansatzes zu demonstrieren ausgesät wir zuerst die Zellen mittels Schläuche verbunden zu spritzen, das ist der herkömmliche Ansatz für die Aussaat von Zellen(Abbildung 3). Wir Jurkat T-Zellen bei verschiedenen Konzentrationen von 1.0x106 Zellen/mL, 2.0x106 Zellen/mL und 4.0x106 Zellen/mL geerntet und erreicht einen Wirkungsgrad von Kapselung, der niedriger als die vorhergesagten Werte (Abbildung 3B war). 1.0x106 Zellen/ml war der Anteil der Tröpfchen, die eine einzelne Zelle enthalten 2,5 %, was nicht erhöht hatte, sogar bei Verwendung höhere Zelle Konzentrationen. Zur Steigerung der Effizienz der Zellen-laden wir unsere vorherigen Ansatz modifiziert und den Schlauch auf die Hälfte der Länge auf einer erhöhten Stativ montiert und geladen die Zellsuspension in der Hälfte, die mit dem PDMS-Gerät (Abb. 4A) befestigt war. Mit diesem Ansatz, gekapselt wir Jurkat T-Zellen bei verschiedenen Konzentrationen von 1.0x106 Zellen/mL, 2.0x106 Zellen/mL, und 4.0x106 Zellen/mL und auch seltene pDCs in verschiedenen Konzentrationen von 1.0x106 Zellen/mL, 2.0x106 Zellen/mL, und 12.0x106 Zellen/mL. Wir erwarten bessere Kapselung Preise verhindert Zelle Sedimentation mit dieser Methode. Allerdings waren bei allen Konzentrationen getestet, die experimentellen Ergebnisse deutlich, dass die vorhergesagten Poisson (Abbildung 4B und Abbildung 4C) Werte.
Mit Hilfe unserer Tipp-Loading-Ansatz wir unsere Zelle Kapselung Preise um experimentelle Ergebnisse im Einklang mit der statistisch vorausgesagten Werte (Abb. 5A) optimiert. Für unterschiedliche Konzentrationen von Jurkat T-Zellen die erhaltenen Kapselung Effizienz abgestimmt unsere berechnete Werte in allen Konzentrationen (Abb. 5B). Bemerkenswert ist, sogar mit adhärenten Zellen wie A549 Tumorzellen, die in der Regel zur Verklumpung, beobachteten wir eine leicht verbesserte Verkapselung Effizienz bei einer zelluläre Konzentration von 1.0x106 Zellen/mL (Abbildung 5C). Wir bewerten auch die Wirksamkeit unseres Systems weniger verfügbar und knappen pDCs in andere Zelle Konzentrationen des 1.0x106 Zellen/mL, 3.0x106 Zellen/mL und 13.0x106 Zellen/mL (Abbildung 5D) Kapseln. Um das Laden von möglicherweise größere Mengen von mehr als 200 µL zu erleichtern, haben wir z.B.beim Arbeiten mit Zelllinien oder reichlicher primäre Immunzellen auch Kapselung Zelleffizienz mit 1000 µL Tipps (blau). Wir bewiesen, dass diese 1.000 µL Tipps eine ähnliche Kapselung-Effizienz im Vergleich zu den 200 µL Spitzen (gelb) (Abbildung 5E gab).
Abhängig von der Chip Design und Forschung-Frage auf der hand, unser Tipp laden Technik lässt sich Zellen durch einen Einlass für sondieren in zellulären Heterogenität oder mehrere Eingänge parallel zur Dekodierung zellulärer Interaktionen zu laden. Wir verglichen die Beladung der Jurkat T-Zellen (in einer Konzentration von 10.0x106 Zellen/mL) aus einem Einlass zu zwei unterschiedlich beschriftete Populationen von Jurkat T-Zellen (bei einer kombinierten Konzentration von 10,0 X106 Zellen/mL) aus zwei Buchten (Abbildung 6 A und Abbildung 6B). Während der Kapselung wurden die Tröpfchen erzeugt mit ultraniedriger gelierende Temperatur Agarose und geliert nach der Produktion in Form Agarose Hydrogel Perlen, die spätere nachgelagerte Analyse über Mikroskopie und Flow Cytometry (Abbildung 6 erlaubt C und Abbildung 6D). Mikroskopische Analyse ergab, dass die Zelle Paarung auf verschiedene Kombinationen für hohen Durchsatz Zelle Paarung (Abbildung 6C) erzielt wurde. Darüber hinaus die gleiche Einwohnerzahl von Hydrogel Perlen durch Durchflusszytometrie ergab, dass Perlen ohne Zellen aus Perlen mit Zellen basierend auf den unterschiedlichen weiterleiten (FSC, Größe) und verrutscht (SSC, Granularität) getrennt werden können streuen Muster (Abbildung 6 D). Anspritzung auf die Bevölkerung von Perlen ohne Zellen bestätigt einen Mangel an Zelle Kapselung durch das Fehlen von fluoreszierenden Signale. Darüber hinaus zeigte die Anspritzung auf die Wulst Bevölkerung mit Zellen die Existenz von mehrere Sub-Populationen indikativ für die Kapselung von anders gekennzeichneten Jurkat T-Zellen. Unsere Ergebnisse zeigen, dass effiziente Handy koppeln erreicht werden kann, basierend auf beide mikroskopischen durchflusszytometrischen Analyse fließen und einen leicht erhöhten Kapselung Wirkungsgrad im Vergleich zu den Poisson-Vorhersage (Abbildung 6E zeigte).
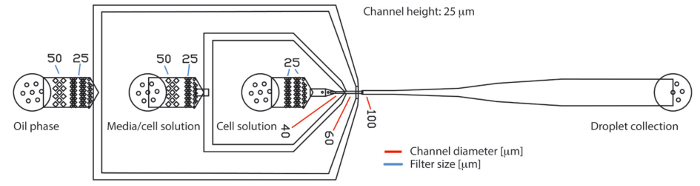
Abbildung 1 . Basierten PDMS Tröpfchen mikrofluidischen Gerät mit drei Eingängen und einem Ausgang. Das Gerät besteht aus drei Buchten für kontinuierlichen Ölphase, Zellkulturmedien und Zellsuspension, beziehungsweise. Die erzeugten Tröpfchen werden am Ausgang gesammelt. Es fließen die Proben Laminarly bis zur Fluss-Fokussierung Kreuzung, wo sie in Tröpfchen eingekapselt sind. An den Einlässen Filter Strukturen halten große Partikel wie Protein oder Zelle Aggregate zurück. Der Durchmesser der Lücken in der Filterstruktur werden durch blaue Linien gekennzeichnet. Der Durchmesser der Kanäle an der Düse Produktion werden durch rote Linien gekennzeichnet. Die Kanalhöhe auf den ganzen Chip war 25 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 . Droplet Stabilität über 24 Stunden. Die Diagramme zeigen den Bereich der Tröpfchen mit hämatopoetischen serumfreien Kultur Medien + 2 % Humanserum, im Laufe der Zeit für die drei verschiedenen Konzentrationen von Tensid A) 0,5 % (B) 3 % (C) 5 %. Bitte klicken Sie hier für eine größere Version dieser Figur.
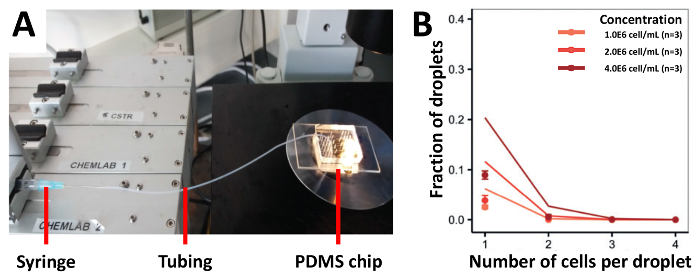
Abbildung 3 . Schlauch basierend Zelle laden Ansatz. Jurkat-T-Zellen sind in unterschiedlichen Konzentrationen an das Gerät mit einer Spritze mit Schlauch verbunden geladen. (A) die Abbildung zeigt den Versuchsaufbau B) die Zelle Kapselung Rate durch Lichtmikroskopie bestimmt. Punkte: experimentell ermittelten Werte; Geschlossen Linien: Poisson-Verteilung. Fehlerbalken stellt Standardfehler von Mittelwert dar. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 4 . Kapselung von verschiedenen Zelltypen in verschiedenen Konzentrationen mit einem senkrechten Rohr Ansatz laden. Jurkat T-Zellen und pDCs (von verschiedenen Konzentrationen) wurden gekapselt, um die Leistungsfähigkeit der Zelle Kapselung festzustellen. A) die Abbildung zeigt den Versuchsaufbau für das vertikale Rohr laden Ansatz. B) die Grafik zeigt die Kapselung Effizienz der Jurkat T Zellen. C) die Grafik zeigt die Kapselung Effizienz des pDCs. Punkte: experimentell ermittelten Werte; Geschlossen Linien: Poisson-Verteilung. Fehlerbalken stellt Standardfehler von Mittelwert dar. Bitte klicken Sie hier für eine größere Version dieser Figur.
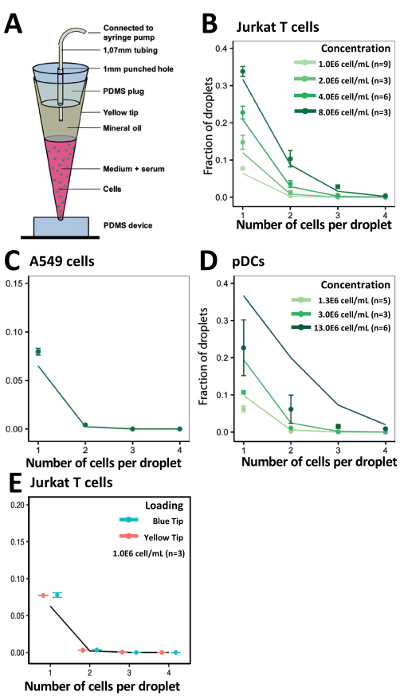
Abbildung 5 . Tipp laden Ansatz zu verschiedenen Zellen Typen Kapseln. (A) schematische Darstellung der Spitze laden Technik. B) die Grafik zeigt die Kapselung Effizienz der Jurkat Zellen. C) die Grafik zeigt die Kapselung Effizienz A549 Zellen. D) die Grafik zeigt die Kapselung Effizienz des pDCs. E) die Grafik zeigt die Kapselung Effizienz der Jurkat T Zellen mit 200 µL Pipettenspitzen (gelb) und 1.000 µL Pipettenspitzen (blau). Punkte: experimentell ermittelten Werte; Geschlossen Linien: Poisson-Verteilung. Fehlerbalken stellt Standardfehler von Mittelwert dar. Bitte klicken Sie hier für eine größere Version dieser Figur.
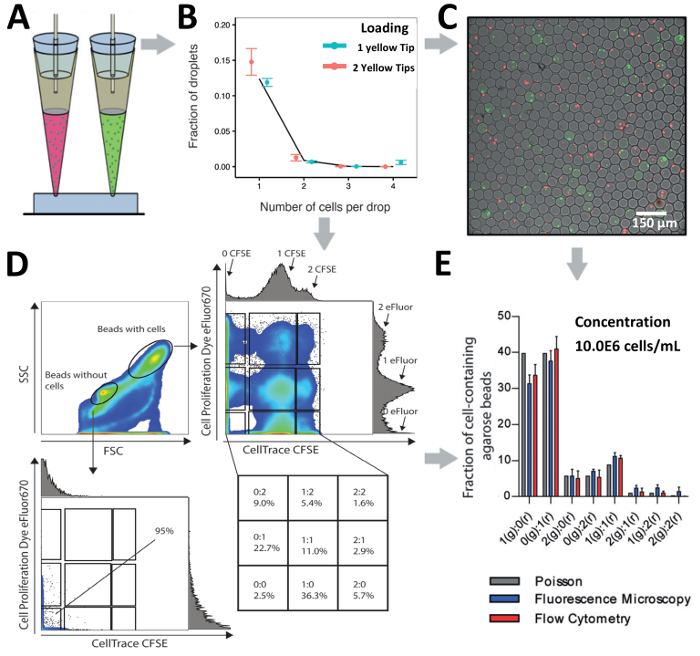
Abbildung 6 . Zelle in Tröpfchen Paarung. (A) schematische Darstellung der Spitze laden Ansatz für das pairing verschiedener Zellen aus 2 Buchten in Tröpfchen. B) die Grafik zeigt die Kapselung der Jurkat T Zellen mit einem ein- oder zwei Eingänge parallel. Die Zellkonzentration für ein Tipp ist 2.0x106 Zellen/mL und die Zellkonzentration für zwei Tipps beide 1.0x106 Zellen/mL. Punkte: experimentell ermittelten Werte; Geschlossen Linien: Poisson-Verteilung. C) der Fluoreszenz mikroskopisch kleine Überlagerungen von Hydrogel Perlen und beschriftete Jurkat T-Zellen. D) Die Grafik zeigt die durchflusszytometrischen Analyse von gekoppelten Zellen in Agarose Hydrogel Perlen. Die Handlung zeigt forward Scatter und seitliche Streuung. E) Vergleich der Zellzahlen in Agarose Hydrogel Perlen wie von Fluoreszenz-Mikroskopie und Flow-Zytometrie erkannt. Bars: Mittelwert; Schnurrhaare: Standardfehler von Mittelwert, n ≥ 4. Fehlerbalken stellt Standardfehler von Mittelwert dar. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
In diesem Protokoll haben wir bewiesen, dass eine effiziente und einfache Technik, laden und Zellen in Tröpfchen für Hochdurchsatz einzellige Analyse zu Kapseln und kontrollierte Paarung für zelluläre Wechselwirkungsstudien Zelle durchzuführen. Darüber hinaus haben wir mehrere konventionelle Ansätze, um Zellen mit mikrofluidischen Geräten laden verglichen und zeigte, dass unser Tipp laden Ansatz ein effizienteres Verfahren im Vergleich zu anderen Methoden ist.
Studium der klinischen Proben oder seltene Zelltypen in Anzahl von Tropfen-basierte Mikrofluidik knapp besitzen einige Herausforderungen. Wie wir auch unter Beweis gestellt haben, tendenziell Zellen Sediment in Spritzen und Oberfläche des Schlauches, dadurch Vermeidung zellulärer Kapselung um die vorhergesagten Werte entsprechen. Um dieses Problem zu umgehen, verwenden Sie einige Gruppen rühren Bars in den Spritzen. Jedoch ist bei der Verwendung von seltenen und begrenzte Zellpopulationen das gesamte Zellvolumen auch begrenzt, dabei Begrenzung der Verwendung von großen Spritzen und rühren Bars. Darüber hinaus wir ersetzt auch häufiger verwendeten Schläuche mit Teflon beschichtete Schläuche um Zellhaftung zu verhindern, aber diese Methode nicht zur Verbesserung der Ergebnisse und wenn der Schlauch zu lang ist, verschlimmert das Problem der Zellhaftung (Daten nicht gezeigt). Alternativ haben wir eine senkrechte Röhre laden Ansatz wo wurden die Zellen in den Schlauch und nicht in die Spritze zu verhindern den Verlust von Zellen in großen Spritze Bänden geladen. Mit dieser Technik, können Zellen mit kleinen Probenvolumen geladen werden, z. B. pDCs sind selten und begrenzt. Außerdem wird die Probe aus dem Schlauch an das Gerät senkrecht zur Zelle Sedimentation verhindern geladen. Das Rohr für die Zelle Aussaat verwendet hat kleine Abmessungen und Mikrokanälen verglichen werden kann. Der Ablauf im Schlauch ist Druck angetrieben und folgt eine parabolische Geschwindigkeit Profil26. Dies bedeutet, dass die maximale Strömungsgeschwindigkeit in der Mitte des Schlauches ist und Mindestgeschwindigkeit an den Rändern der Schlauch27 ist. Bei eine Bevölkerung der Zellen durch die Schläuche spülen, verursacht die Geschwindigkeit Steigung die Zellen verschoben werden, zu den Rändern hin wo sie beruhigen, denn die Geschwindigkeit an der Grenze nahe bei Null liegt. Die Sedimentation oder Beilegung von Zellen in den Schlauch reduziert dabei die Kapselung Effizienz wie in die repräsentativen Ergebnisse gezeigt wo die experimentellen Daten nicht mit dem vorhergesagten Modell übereinstimmt.
Ein weiteres häufig angepasste Lösung verwendet von Wissenschaftlern mit Tröpfchen Mikrofluidik, ist die Dichte der Zellkulturmedien durch Zugabe von Reagenzien wie Iodinaxol gegen Cell Sedimentation in Spritzen19passende Dichte zu erhöhen. Jedoch Dichte passende Reagenzien kann zelluläre Verhalten beeinflussen und negativ beeinflussen die Zytokin-Sekretion von Zellen (Daten nicht gezeigt)28.
Obwohl mehrere kleine und große Änderungen in konventionellen Zelle laden Techniken leichte Verbesserungen in Kapselung Wirkungsgrade zeigte, entsprach der erhaltenen Versuchsergebnisse die theoretischen Berechnungen noch nicht. Mit der Spitze laden Ansatz konnten wir jedoch die überwinden die Grenzen der bisherigen Methoden und Kapselung Effizienz geregelt von der Poisson-Statistik. Diese Technik ist nicht nur vorteilhaft für Aussetzung Ladezellen aber auch zum Laden von adhärenten Zellen, wie primären Keratinozyten und A549 mikrofluidischen Chips aufgebracht werden. Bei der Verwendung von reichlich Zell-Linien, zum Beispiel A549, K562, etc., kann größere Probenvolumen verwendet werden. Daher, je nach Volumen der Probe unterschiedliche Größe Pipettenspitzen können auch verwendet werden und diese einfache Technik kann für einzellige Kapselung und mehrere Zelle Kapselung angepasst werden.
Während niedrige Zellkonzentration erforderlich ist, um die Kapselung der einzelnen Zellen in Tröpfchen zu gewährleisten, sind höhere Konzentrationen der Zellen gewünscht, um die durchschnittliche Zahl der Zellen eingekapselt in jedem Tropfen für Studien im Zusammenhang mit Handy koppeln. Es gibt verschiedene einzellige Methoden, die zuvor auf mikrofluidischen Chips oder Microfabricated Nanowells29,30,31paar Immunzellen beschrieben wurden. In Tröpfchen Mikrofluidik diktiert Poisson Statistiken, dass diese 1:1-Zelle für zwei verschiedene Zelltypen Paarung bei optimalen Zelle Konzentrationen erreicht werden kann. Basierend auf die Poisson-Vorhersage, gibt es auch eine Wahrscheinlichkeit, dass Tröpfchen andere Kombinationen enthalten könnten. 1:1 Zelle Paarung zelluläre Interaktionen auf Ebene der einzelnen Zelle und führt zu erhöhten zellulären Verständnis zu studieren wünschenswert sein kann, hat mehrere Zelle Paarung auch große Vorteile. Es ermöglicht, um den Einfluss mehrerer Zellen einer Zelle Art auf die andere Zelle Art zu begreifen. Übersprechen zwischen verschiedenen Immunzellen helfen, um eine effektive Immunantwort gegen verschiedene Infektionen und Krankheitserreger zu generieren und auch unser Immunsystem32Robustheit verleiht. Als solche kann zelluläre Kommunikation mit hoher Präzision in unterschiedlichen Kontexten, z. B. 1:1, 2:1, 1:2, 2:2, 3:1 usw.abgefragt werden. ertragreiche mehr Verständnis auf wie single oder Paare von Zellen steuern die Induktion der Immunantwort. Dies ist besonders interessant, zum Beispiel die Fähigkeit der natürlichen Killerzellen oder zytotoxischen T-Zellen, seriell ihre jeweiligen Zielzellen töten zu studieren.
Wie besprochen, für mehrere Verkapselung von Zellen in Tröpfchen, sind höhere Konzentrationen der Zelle erwünscht. Jedoch beim Laden von Zellen aus einem Einlass für Zelle Kapselung, höhere Konzentrationen von Zellprobe können dazu führen, dass Zellen Aggregat am Einlass. Dadurch niedrigere Kapselung und höhere Abweichung von den Sollwerten. Um dieses Problem zu umgehen, können die Zellen aus zwei separate Einlässe als auch geladen werden. Theoretisch wäre es möglich, andere mikrofluidischen Geräte mit mehreren Buchten um noch höhere Ebenen der Zelle Kapselung zu erreichen wo, durchschnittlich auf x Anzahl der Zellen gerechtfertigt ist zu entwickeln. In dieser Studie untersuchten wir die Kapselung Effizienz Jurkat T-Zellen, wenn aus einem Einlass und zwei Buchten, die mit der gleichen Gesamtkonzentration geladen und ähnliche Kapselung Effizienz erhalten. Diese Änderung erlaubt Forschern, zwei verschiedene Zelltypen auf Chip.
Während diese Methode hilft bei der Ladezellen mikrofluidischen Geräte ohne erheblichen Verlust von Zellen, gibt es bestimmte Vorsichtsmaßnahmen, die beachtet werden müssen. Wenn die Spritzen mit Mineralöl und Absaugen die Zellprobe in Pipettenspitzen füllen, Einbeziehung von Luftblasen vermieden werden und das gesamte System sollte frei von Luft. Es ist auch wichtig im Auge zu behalten, die das Mineralöl mit der Probe nicht mischen sollte. Pipettenspitzen, mit Proben, ist fest in die Buchten von mikrofluidischen Gerät, mit größter Vorsicht, um Leckagen und weitere Einbeziehung von Luftblasen zu verhindern einzutragen. Zusammenfassend lässt sich sagen, ist Tipp-laden eine einfache, aber robuste Technik, die für Hochdurchsatz-Analyse der zellulären Verhalten durch Kapselung der Zelle ohne erheblichen Verlust von Zellen in einer kosteneffektiven Weise ermöglicht. Bei Verwendung mit optimalen Probe Konzentrationen am Eingang dieser Ansatz der Ladezellen mit Pipettenspitzen ist sehr flexibel und kann für verschiedene Zelltypen, besonders für seltene primäre Immunzellen zu Effizienzsteigerung Kapselung, nah an angepasst werden prognostizierte Modelle.
Offenlegungen
Wir haben nichts zu veröffentlichen.
Danksagungen
Wir danken der Eindhoven University of Technology für die großzügige Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 1H,1H,2H,2H-Perfluoro-1-octanol | Sigma-Aldrich | 171468-5G | |
| 1H,1H,2H,2H-Perfluorooctyltriethoxysilane | Fluorochem/UK | S13150 | Silane (toxic) |
| Agarose (Ultra-low Gelling Temperature) | Sigma-Aldrich | 9012-36-6 | |
| BD Wegwerpspuiten met Luer-Lok-punten | Fisher Scientific | 10630694 | Syringe |
| Biopsy Punch 1.2 mm | Harris Uni-Core | ||
| Cell Proliferation Dye eFluro 670 | eBioscience | 65-0840-85 | |
| CellTrace CFSE | Invitrogen | C34554 | |
| CellTrace Far Red Cell | Invitrogen | C34564 | |
| Eppendorf Tubes | Eppendrof Tubes | Safe-Lok tubes 1 mL and 2 mL | |
| Glass Slide | Sigma Aldrich | CLS294775X38-72EA | Corning microscope slides, plain L × W 75 mm × 38 mm |
| Harvard Pumps | Harvard Apparatus | C-400750; C-400727 | Syringe pumps |
| HFE-7500 3M Novec Engineered fluid | Fluorochem/UK | 51243 | Flourinated oil |
| Kai Biopsy Punch 5 mm | Amstel Medical | 1980130 | |
| Luer stub | Instechlabs/USA | LS20S | Luer stub, 20ga (pink) x 0.5in (12mm), non-sterile |
| Mineral oil (Light) | Sigma Aldrich | M8410-1L | |
| Phosphate buffered saline | Sigma-Aldrich | P4417-50TAB | Tablets |
| Pico-Surf 1 (5%in Novec 7500) | Sphere Fluidics | 020317-09 | Surfactant |
| Plasma Asher | Emitech | K1050X | Plasma asher |
| RPMI 1640 Medium | Gibco | 11875093 | |
| Silicone Elastomer Base 184 | Sylgard | 9355218 | PDMS base |
| Silicone Elastomer Curing Agent | Sylgard | 9355218 | Curing Agent |
| Stainless steel catheter coupler | Instechlab/USA | SC20/15 | 20ga x 15mm, non-sterile |
| TFE Teflon Tubing | Sigma-Aldrich | 58696-U | PTFE Tubing L × O.D. × I.D. 50 ft × 1/16 in. × 0.031 in. |
| Thinky mixer ARE-250 | EX-4025F | Conditioning mixture |
Referenzen
- Yin, H., Marshall, D. Microfluidics for single cell analysis. Current Opinion in Biotechnology. 23 (1), 110-119 (2012).
- Meyvantsson, I., Beebe, D. J. Cell Culture Models in Microfluidic Systems. Annual Review of Analytical Chemistry. 1, 423-429 (2008).
- Yi, C., Li, C. W., Ji, S., Yang, M. Microfluidics technology for manipulation and analysis of biological cells. Analytica Chimica Acta. 560, 1-23 (2006).
- Wang, H. Y., Bao, N., Lu, C. A microfluidic cell array with individually addressable culture chambers. Biosensors and Bioelectronics. 24, 613-617 (2008).
- Zhang, Y., et al. A programmable microenvironment for cellular studies via. microfluidics-generated double emulsions. Biomaterials. 34 (19), 4564-4572 (2013).
- Teh, S. -. Y., Lin, R., Hung, L. -. H., Lee, A. P. Droplet microfluidics. Lab on a chip. 8 (2), 198-220 (2008).
- Hu, H., et al. Efficient cell pairing in droplets using dual-color sorting. Lab Chip. 15 (20), 3989-3993 (2015).
- Brouzes, E., et al. Droplet microfluidic technology for single-cell high-throughput screening. Proceedings of the National Academy of Sciences. 106 (34), 14195-14200 (2009).
- Chokkalingam, V., et al. Probing cellular heterogeneity in cytokine-secreting immune cells using droplet-based microfluidics. Lab on a Chip. 13 (42), 4740 (2013).
- den Haan, J. M. M., Arens, R., van Zelm, M. C. The activation of the adaptive immune system: Cross-talk between antigen-presenting cells, T cells and B cells. Immunology Letters. 162 (2), 103-112 (2014).
- Shah, G. J., Ohta, A. T., Chiou, E. P. -. Y., Wu, M. C., Kim, C. -. J. EWOD-driven droplet microfluidic device integrated with optoelectronic tweezers as an automated platform for cellular isolation and analysis. Lab on a Chip. 9 (12), 1732 (2009).
- Griffiths, A. D., Tawfik, D. S. Miniaturising the laboratory in emulsion droplets. Trends in Biotechnology. 24 (9), 395-402 (2006).
- Lagus, T. P., Edd, J. F. High-throughput co-encapsulation of self-ordered cell trains: cell pair interactions in microdroplets. RSC Advances. 3, 43 (2013).
- Moon, S., Ceyhan, E., Gurkan, U. A., Demirci, U. Statistical modeling of single target cell encapsulation. PLoS ONE. 6 (7), (2011).
- Abate, A. R., Chen, C. -. H., Agresti, J. J., Weitz, D. A. Beating Poisson encapsulation statistics using close-packed ordering. Lab on a Chip. 9 (18), 2628 (2009).
- Collins, D. J., Neild, A., deMello, A., Liu, A. -. Q., Ai, Y. The Poisson distribution and beyond: methods for microfluidic droplet production and single cell encapsulation. Lab Chip. 15 (17), 3439-3459 (2015).
- Kemna, E. W. M., et al. High-yield cell ordering and deterministic cell-in-droplet encapsulation using Dean flow in a curved microchannel. Lab on a Chip. 12 (16), 2881 (2012).
- Köster, S., et al. Drop-based microfluidic devices for encapsulation of single cells. Lab on a Chip. 8 (7), 1110 (2008).
- Mazutis, L., et al. Single-cell analysis and sorting using droplet-based microfluidics. Nature Protocols. 8 (5), 870-891 (2013).
- Sun, P., et al. Functional characterization of ex vivo. blood myeloid and plasmacytoid dendritic cells after infection with dengue virus. Virology. 383 (2), 207-215 (2009).
- Tel, J., et al. The chemotherapeutic drug oxaliplatin differentially affects blood DC function dependent on environmental cues. Cancer Immunology, Immunotherapy. 61 (7), 1101-1111 (2012).
- Wimmers, F., et al. Single-cell analysis reveals that stochasticity and paracrine signaling control interferon-alpha production by plasmacytoid dendritic cells. Nature Communications. 9 (1), 3317 (2018).
- Gong, J., Kim, C. -. J. All-electronic droplet generation on-chip with real-time feedback control for EWOD digital microfluidics. Lab on a Chip. 8 (6), 898 (2008).
- Demirci, U., Montesano, G. Single cell epitaxy by acoustic picolitre droplets. Lab on a Chip. 7 (9), 1139 (2007).
- Rho, H. S., Yang, Y., Veltkamp, H. -. W., Gardeniers, H. Direct Delivery of Reagents from a Pipette Tip to a PDMS Microfluidic Device. Chips and Tips. , (2015).
- Paul, P. H., Garguilo, M. G., Rakestraw, D. J. Imaging of Pressure- And Electrokinetically Driven Flows through Open Capillaries. Analytical Chemistry. 70 (13), 2459-2467 (1998).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Physics Today. 54, 42 (2001).
- Mita, A., et al. Anti-proinflammatory Effects of Iodixanol (OptiPrep)-Based Density Gradient Purification on Human Islet Preparations. Cell Transplant. 19 (12), 1537-1546 (2013).
- Dura, B., et al. Profiling lymphocyte interactions at the single-cell level by microfluidic cell pairing. Nature Communications. 6 (1), 1-13 (2015).
- Dura, B., et al. Longitudinal multiparameter assay of lymphocyte interactions from onset by microfluidic cell pairing and culture. Proceedings of the National Academy of Sciences. 113 (26), 3599-3608 (2016).
- Yamanaka, Y. J., et al. Single-cell analysis of the dynamics and functional outcomes of interactions between human natural killer cells and target cells. Integrative Biology. 4 (10), 1175 (2012).
- Satija, R., Shalek, A. K. Heterogeneity in immune responses: From populations to single cells. Trends in Immunology. 35 (5), 219-229 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten