Method Article
Metodo basato su un puntale per semina cellule a goccia microfluidici piattaforme
In questo articolo
Riepilogo
Questo articolo presenta un protocollo per il seeding scarsa popolazione delle cellule usando puntali per dispositivi microfluidici gocciolina al fine di fornire una maggiore efficienza di incapsulamento di cellule in goccioline.
Abstract
Tra i vari disegni di piattaforma microfluidica frequentemente utilizzati per l'analisi cellulare, gocciolina-microfluidica fornisce uno strumento robusto per isolare e analizzare le cellule a livello di singola cellula eliminando l'influenza di fattori esterni sul cellulare microambiente. Incapsulamento delle cellule nelle goccioline è dettata dalla distribuzione di Poisson in funzione del numero di cellule presenti in ogni goccia e il numero medio di cellule per volume di goccia. Cellule primarie, soprattutto le cellule immuni, o i campioni clinici possono essere scarse e perdita di dati incapsulamento di cellule rimane impegnativo. In questa carta, presentiamo una nuova metodologia che utilizza puntali per celle per dispositivi microfluidici basati su goccia senza la perdita significativa di celle di carico. Con vari tipi di cellule, dimostriamo incapsulamento cella efficiente in goccioline che corrisponde strettamente all'efficienza di incapsulamento preveduto tramite la distribuzione di Poisson. Il nostro metodo assicura perdite carico di cellule a microfluidic piattaforme e può essere facilmente adattato per analisi unicellulare a valle, ad esempio, per decodificare interazioni cellulari tra diversi tipi di cellule.
Introduzione
Negli ultimi anni, l'uso della microfluidica come una piattaforma robusta e versatile per analisi cellulare a livello di singola cellula ha rapidamente aumentato1. Queste piattaforme forniscono high throughput screening di singole cellule e molecole biologiche con alta precisione e sensibilità utilizzando molto piccolo campione volume2,3,4. Tra diversi tipi di disegni di microfluidica, piattaforme basate su goccia consentono analisi di alto-rendimento delle singole cellule isolarli in una goccia di fase acquosa circondata da una fase immiscibile che consente un controllo preciso e accurato sul cellulare microambiente5,6. Basato su goccia microfluidica dà la flessibilità per isolare il singolo o multiplo-cellule in, entrambi, acquosa e goccioline di idrogel ed è prezioso nel sondaggio complesso comportamento cellulare, come proteina secrezione o cellular interazioni7, 8 , 9. segnalazione e cross-talk tra le cellule del sistema immunitario può essere influenzati dalle interazioni con altre cellule nel microambiente10. Isolamento di singole cellule in goccioline fornisce un efficace laboratorio analitico privo di rumore, libero dall'influenza di fattori ambientali esterni per più efficiente e accurato risultati11,12. Modificare la struttura di una piattaforma di goccia-microfluidica con ingressi multipli consente l'incapsulamento di più tipi di cellule per studiare le interazioni cellulari via cellulare-associazione12,13.
Il processo di incapsulamento di cellule nelle goccioline è casuale e il tasso di incapsulamento di cellule può essere statisticamente determinato utilizzando la formula per la distribuzione di Poisson14,15. Questo tasso di incapsulamento può essere valutato considerando il tasso medio dell'arrivo delle cellule allo svincolo della gocciolina e supponendo che l'arrivo di ogni cella è indipendente dall'arrivo di altre cellule16. Anche se arrivo cellula indipendente non può essere garantita, in caso di cellule scarsamente distribuite, può essere considerato l'ipotesi di indipendenza e la probabilità di una gocciolina contenente una o più celle può essere previsto in funzione del numero di cellule presente in ogni gocciolina e il numero medio di cellule per gocciolina16,17. Poiché questa stima di incapsulamento cellulare nelle goccioline è dipenda dal numero di cellule presenti in ogni goccia, uno può suggerire che l'aumento della concentrazione delle cellule all'ingresso aumenterà il numero medio di cellule presenti in ogni goccia 16. Pertanto, per garantire l'incapsulamento di singola cellula, le concentrazioni di cella devono essere ridotto ma questo spesso conduce a un gran numero di goccioline vuoto18.
Perdita di cellule durante il caricamento di attaccamento, sedimentazione, e/o agglutinamento nella siringa, tubi o dispositivo di produzione è un inconveniente comune responsabile per la deviazione dei valori effettivi incapsulamento dal predetto incapsulamento valori19 . Questo problema ottiene ulteriormente esagerato quando semina rare cellule immuni o campioni clinici come già sono scarsi nella popolazione e l'incapsulamento di solo poche cellule, molto più basse del previsto, non fornire dati sufficienti per l'analisi sperimentale. Le cellule dendritiche plasmacitoidi (PDC) sono un sottoinsieme raro delle cellule immuni che costituisce soltanto circa 0,2 - 0,6 per cento del bianco intero sangue cella popolazione20. Queste cellule secernono una quantità massiccia di interferoni al momento dell'attivazione di tipo I e quindi svolgono un ruolo critico in risposte immunitarie21. Quando si studia il comportamento cellulare di tali cellule rare nelle goccioline, è indispensabile per evitare la perdita delle cellule durante la semina cellulare e incapsulamento22. Ci sono vari progettazione evoluzioni che hanno garantito l'incapsulamento di singole cellule in goccioline utilizzando metodi di incapsulamento attivi che utilizzano diverse forze fisiche quali forze acustiche o elettriche per la generazione di goccioline contenenti singolo-cellule23,24. Tuttavia, questi metodi hanno i loro limiti in termini di produzione di gocciolina16.
In questo studio, abbiamo stabilito un metodo robusto e semplice che aggira le carenze dei metodi tradizionali per il caricamento di cellule singole o multiple per dispositivi microfluidici. Il nostro metodo, ispirato da Rho et al., utilizza i puntali delle pipette di diverse dimensioni per semina piccoli volumi di rare cellule immuni alle piattaforme di microfluidica gocciolina senza perdita di campione significativo ed ha dato i risultati che sono coerenti con la teorica previsioni25. Questa metodologia può essere facilmente e correttamente adattato per diverse applicazioni che coinvolgono basati su goccia microfluidica e applicato per un'ampia varietà di tipi cellulari o persino microparticelle.
Protocollo
1. 3-ingresso fabbricazione di dispositivi di polidimetilsilossano (PDMS)
- 40 g di base PDMS in un mixer condizionata di misurare una tazza e aggiungere 4 g di agente indurente PDMS alla base del reagente in Coppa, con attenzione, con un contagocce.
- Posizionare la tazza nel supporto del mixer condizionata e misurare il peso totale della tazza con il titolare. Impostare il valore del peso di equilibrio centrifuga sul mixer condizionata di conseguenza.
- Mescolare la base e induritore nel mixer condizionata a 2.000 giri/min per 2 min seguita da-schiumatura a 2.000 giri/min per 2 min.
- Preparare una barca di alluminio, con un diametro di circa le stesse dimensioni di quella di un wafer di silicio di 100 mm. Luogo il wafer di silicio, fabbricati per la replica processo di stampaggio, sulla barca di alluminio e mettere questa configurazione in una capsula Petri (diametro = 120 mm, altezza = 20 mm).
Nota: La dimensione del piatto Petri dipende dalle dimensioni dei wafer di silicio. - Rimuovere la Coppa dal supporto e versate il composto PDMS pre-curato (contenuto della tazza), con attenzione, sul wafer di silicio.
- Porre la capsula Petri, il wafer di silicio con la miscela PDMS pre-curato, in un essiccatore per circa 20 min per rimuovere tutte le bolle di aria.
- Rimuovere la capsula di Petri dopo 20 min e controllare per eventuali bolle d'aria rimanente che può essere rimosso.
- Posizionare la piastra di Petri in un forno, impostato a 65 ° C, per almeno 3 ore.
- Rimuovere la capsula di Petri dal forno dopo 3 h e rimuovere con cautela il PDMS curata da wafer di silicio.
- Dispositivi PDMS tagliati lungo le linee di taglio, utilizzando un coltello o un bisturi. Perforare le insenature e all'uscita di ogni dispositivo che utilizza un perforatore di 1,2 mm. Pulire ogni dispositivo PDMS con lo scotch per rimuovere eventuali pezzi di polvere o residui di PDMS.
- Facoltativamente, soffiare con azoto per rimuovere residui PDMS pezzi.
- Preparare vetrini di pulirli con acqua saponata, seguita da isopropanolo e asciutto con azoto.
- Legare un dispositivo PDMS pulito con un vetrino pulito in un plasma asher per chiudere le linee di flusso. Utilizzare le seguenti impostazioni: potenza: 50 W, tempo: 45 s, tempo di ritardo di sanguinare: 2 s, gas di processo: 1 Gas (aria), Vent: entrambe le valvole, Restricted sfogare tempo: 60 s, pompa con lo spin down tempo: 10 s, tempo di attesa di sfiato: 0 s, tempo di intercettazione del Gas: 1 s, Turbo abilitato di pompaggio : 0. Scollegare tutte le altre linee di gas.
Nota: Le impostazioni utilizzate per il plasma che Asher può variare secondo la marca del plasma asher utilizzato. - Preparare la soluzione di silano aggiungendo 50 µ l di silano (1h, 1h, 2H, 2h-Perfluorooctyltriethoxysilane) a 950 µ l di gas fluorurati ad olio.
Nota: Silano è tossico. Si prega di operare sotto cappa aspirante. - Aspirare la soluzione di silano preparato in una siringa, che è collegata a un tubo in Teflon.
- Steward il dispositivo sciacquando la soluzione preparata Silano attraverso l'uscita del dispositivo.
- Posizionare il dispositivo in un forno, fissato a 65 ° C, per 30 min.
- Rimuovere il dispositivo salinizzato dal forno e Silano in eccesso fuori del dispositivo a filo con olio fluorurati.
- Posizionare il dispositivo torna in un forno, impostato a 65 ° C, per almeno 1 h completare il processo di incollaggio.
Nota: Il protocollo può essere messo in pausa qui.
2. incapsulamento delle cellule loss-Less
-
Cella di raccolta
- Risospendere le cellule di T di Jurkat nel mezzo di Roswell Park Memorial Institute (RPMI) alle concentrazioni di 1.0x106 cellule/mL, 2.0x106 cellule/mL, 4.0 X106 cellule/mL e 8.0x106 cellule/mL; PDC in ematopoietici privo di siero terreni di coltura (per esempio, X-VIVO 15) alle concentrazioni di 1.3x106 cellule/mL, 3.0x106 cellule/mL e 13.0x106 cellule/mL; Cellule A549 dell'Aquila per volta di Dulbecco Medium (DMEM) ad una concentrazione di 1.0x106 cellule/mL.
Nota: Il tipo delle cellule e concentrazione di cellule può variare basato sull'esperimento. Etichettatura delle cellule può essere fatta anche basandosi sull'esperimento.
- Risospendere le cellule di T di Jurkat nel mezzo di Roswell Park Memorial Institute (RPMI) alle concentrazioni di 1.0x106 cellule/mL, 2.0x106 cellule/mL, 4.0 X106 cellule/mL e 8.0x106 cellule/mL; PDC in ematopoietici privo di siero terreni di coltura (per esempio, X-VIVO 15) alle concentrazioni di 1.3x106 cellule/mL, 3.0x106 cellule/mL e 13.0x106 cellule/mL; Cellule A549 dell'Aquila per volta di Dulbecco Medium (DMEM) ad una concentrazione di 1.0x106 cellule/mL.
-
Suggerimento-caricamento per generazione acquosa gocciolina
- Preparare olio fluorurati con miscela 3% biocompatibile tensioattivo aggiungere 3 mL di tensioattivo a 2 mL di olio di gas fluorurati.
Nota: La concentrazione del tensioattivo aggiunto all'olio fluorurati determina la stabilità dell'emulsione per periodi diversi di incubazione. La concentrazione del tensioattivo varia a seconda del supporto utilizzato per specifici tipi di cellule. - Disegnare la miscela di fase di olio in una siringa (1 mL). Rimuovere le bolle d'aria dalla siringa e collegarlo ad una tubazione del Teflon di lunghezza appropriata.
- Preparare una siringa di campione di disegno olio minerale biocompatibile in una siringa. Rimuovere le bolle d'aria e collegare la siringa a una tubazione del Teflon di lunghezza appropriata.
- Una spina PDMS con un diametro di 5 mm da una lastra PDMS curata del punzone.
Nota: La lastra PDMS polimerizzata può essere preparata utilizzando passaggi 1.1 a 1,9. Utilizzare un wafer di silicio normale invece di un wafer di silicio fabbricato. - Pugno un altro foro nel centro del tappo con un perforatore di 1 mm.
- Inserire la spina in una punta di pipetta µ l 200, dall'estremità più grande, tale che si adatta strettamente.
Nota: Utilizzare una punta 1.000 µ l per volume di campione più grandi e più grandi cellule. Per la punta della pipetta 1.000 µ l, spine di diametro compreso tra 5 mm e 7 mm possono essere utilizzate. Con una spina di diametro 5 mm, un volume di campione di circa 400 µ l può essere aspirato nella punta della pipetta. Se una spina di diametro maggiore è usato (7 mm), più volume del campione può essere aspirato (circa 900 µ l). - Inserire il tubo, che è collegato alla siringa, nella spina, PDMS, che è stata inserita nella punta della pipetta. Spingere lo stantuffo della siringa lentamente per riempire il puntale collegato con olio minerale. Spingere fuori tutta l'aria residua dalla punta della pipetta.
- Abbassare la punta della pipetta, collegata alla siringa, nella soluzione del campione e aspirare circa 150 µ l di campione nella punta.
- Ripetere i passaggi da 2.2.4 a 2.2.8 per preparare una seconda siringa campione.
- Posizionare con cura tutte le tre siringhe preparate su pompa a siringa.
- Inserire entrambi i puntali delle pipette, contenente il campione, nelle due insenature interne del chip PDMS. Inserire il tubo contenente la miscela di fase olio nell'ingresso esterno.
- Impostare il valore delle portate sulla pompa siringa come segue: soluzione fase continua: campioni di cellule µ l/h, 600: 100 µ l/h, ogni. Inserire e impostare le dimensioni della siringa.
Nota: Il diametro impostazioni variano in base al tipo di siringa. - Avviare la pompa per svuotare la soluzione campione attraverso i canali interni della fase olio e dispositivo attraverso il canale esterno del dispositivo.
- Collegare un tubo di lunghezza appropriata alla presa per iniziare a raccogliere le goccioline quando la formazione della gocciolina è stabile. Al momento della raccolta varia in base all'esperimento.
- Raccogliere le goccioline in un tubo di blocco. Aggiungere 200 µ l di terreno RPMI (senza siero) in cima le goccioline raccolte e incubare il campione.
Nota: Incubazione tempo delle goccioline raccolte varia basato sull'esperimento. Le goccioline vengono raccolti in un tubo di blocco quando viene eseguita l'analisi basata su citometria a flusso o isolamento dopo aver recuperato le cellule dalle goccioline rompendo l'emulsione. È possibile raccogliere le goccioline in una camera di vetro se l'esperimento richiede che l'analisi al microscopio a goccia.
- Preparare olio fluorurati con miscela 3% biocompatibile tensioattivo aggiungere 3 mL di tensioattivo a 2 mL di olio di gas fluorurati.
-
Emulsione di recupero delle cellule e rottura per analisi cytometric di flusso
- Preparare 20% 1h, 1h, 2h, soluzione di (PFO) 2H-Perfluoro-1-ottanolo (v/v) in olio di fluorurati con l'aggiunta di 2 mL di PFO in 10 mL di olio di fluorurati.
- Rimuovere l'olio in eccesso dalla parte inferiore del tubo di raccolta, contenente le goccioline, usando una siringa.
- Aggiungere 100 µ l di soluzione PFO del 20% per l'emulsione di rompere l'emulsione e rilasciare le cellule incapsulate nella fase acquosa. Toccare e mescolare brevemente. Fare a questo punto non vortice. Incubare per 1-2 min.
Nota: La quantità di PFO aggiunto dipende dalla quantità di gocce prodotte. Continuare ad aggiungere ulteriore PFO fino a quando il livello dell'olio sia completamente disciolta. Tenete a mente che il PFO è tossico per le cellule e che concentrazioni troppo elevate di PFO o troppo lunga incubazione in PFO potrebbe portare a morte aumentata delle cellule. - Girare la soluzione poco presso il più basso possibile rcf per 30 s.
- Preparare 100 mL di soluzione fredda Phosphate-Buffered salino (PBS) completata con 2% siero di vitello fetale (FCS) (2 mL di FCS in 98 mL di PBS).
- Pipettare 550 µ l della frazione acquosa, immediatamente dopo la centrifugazione e trasferirlo in un nuovo tubo di blocco contenente 500 µ l di soluzione di PBS freddo completati con 2% di FCS, come preparata al punto 2.3.5. Lasciate che qualsiasi olio residuo affondare fino in fondo il nuovo tubo di blocco.
- Aspirare 950 µ l della fase acquosa contenente le cellule da questo tubo di serratura, con attenzione, senza aspirare tutto l'olio residuo e trasferire la soluzione in un nuovo tubo di blocco.
- Rotazione verso il basso le cellule nel nuovo tubo serratura per 10 min.
- Risospendere le cellule in 300 µ l di soluzione di PBS freddo completati con 2% di FCS, come preparata al punto 2.3.5.
Nota: Le cellule possono essere anche ri-sospese in qualsiasi altra soluzione adatta come media a seconda dell'esperimento. Macchia le celle, basate sull'esperimento, per l'analisi mediante citometria a flusso.
3. cellula abbinamento
-
Raccolta delle cellule e la macchiatura
- Contare le cellule Jurkat T, dal matraccio di cultura e spin giù le cellule a 1.500 giri/min per 5 min.
- Rimuovere il supernatante e risospendere le cellule di 1.0x106 in 1 mL di PBS per ottenere una concentrazione di 1.0x106 cellule/mL. La quantità di PBS aggiunto dipende il numero di celle.
- Ripetere i passaggi da 3.1.1 a 3.1.2 per preparare un secondo campione di cellule T di Jurkat con la stessa concentrazione di cella.
- Lavare entrambi campioni due volte con 1 mL di PBS a 1.500 giri/min per 5 min.
- Risospendere un campione di cellule con tintura di 1,25 µM carboxyfluorescein succinimidyl ester (CFSE) e l'altro campione di cellule con 1,25 µM lontano rosso colorante o 1,25 della tintura di proliferazione delle cellule µM ad una concentrazione di cellule di 1.0x106 cellule/mL. Il totale soluzione di colorazione è di 1 mL per 1.0x106 celle.
Nota: Le cellule possono essere etichettate con tinture differenti a seconda dei filtri disponibili nel citometro a flusso o nel microscopio di fluorescenza. - Incubare i campioni di cellule con coloranti per 10 min a 37 ° C.
- Fermare la reazione di macchiatura aggiungendo 1 mL di ghiaccio freddo FCS dopo 10 min.
- Lavare i campioni delle cellule due volte con 1 mL di PBS a 1.500 giri/min per 5 min.
- Risospendere i campioni delle cellule nei media RPMI ad una concentrazione di 10.0x106 cellule/mL, per ogni colore.
-
Suggerimento-carico per la produzione di goccioline di idrogel di agarosio per l'accoppiamento delle cellule
Nota: Per cella associazione mediante le goccioline di idrogel di agarosio, mantenere la temperatura del sistema tra i 27 ° C e 37 ° C durante tutto il processo di generazione e raccolta della gocciolina per prevenire gelificante nel caso degli idrogeli e garantisce la vitalità cellulare9.- Sciogliere il gelificante temperatura ultrabassa agarosio riscaldandolo fino a 75 ° C in PBS ad una concentrazione di 4% (p/v) e mescolare il composto per 20 min.
- Miscelare la soluzione di agarosio con etichettati T di Jurkat cellule per produrre una concentrazione di agarosio del 2% (p/v). Ripetere questa operazione per l'altro campione con cellule marcate in modo diverso.
- Preparare olio fluorurati con miscela al 2% dell'agente tensioattivo aggiungendo 20 mL di tensioattivo a 30 mL di olio fluorurati (miscela di fase di olio).
- Seguire i passaggi 2.2.2 - 2.2.14.
Nota: A causa della natura viscosa di agarosio fusione basso e per garantire una produzione stabile gocciolina, impostare il valore delle portate delle pompe siringa come segue: olio miscela di fase: 2.000 campioni di cellule µ l/h,: 200 µ l/h. inserire e impostare le dimensioni della siringa. - Raccogliere le goccioline in un tubo di blocco e incubare le goccioline a 4 ° C per 60 min.
-
Emulsione di rottura e il recupero di perlina di agarosio per analisi al FACS
- Dopo l'incubazione di goccioline per 60 min, togliere l'olio in eccesso dal tubo di blocco, contenente le goccioline, usando una siringa.
- Aggiungere 200 µ l di PFO per rimuovere l'interfase olio da goccioline.
Nota: La quantità di PFO aggiunto al tubo dipende dalla quantità di gocce prodotte. Continuare ad aggiungere ulteriore PFO fino a quando il livello dell'olio sia completamente disciolta. - Lavare le perle dell'agarosi raccolti due volte con 1 mL di PBS freddo per rimuovere completamente l'olio mediante centrifugazione a 1.500 rpm per 10 min.
- Analizzare i raccolti dell'agarosi branelli mediante citometria a flusso.
Nota: È anche possibile osservare le perle sotto un microscopio a fluorescenza.
Risultati
Per i nostri esperimenti, abbiamo utilizzato un dispositivo di base microfluidici PDMS 3-ingresso con l'altezza di 25 micron (Figura 1). In questa configurazione dispositivo, abbiamo usato l'ingresso esterno per lo scarico dell'olio con surfattante e le due insenature interne per vampate di calore le fasi acquose con sospensioni cellulari o supporti. Dopo generazione e raccolta, le goccioline vengono incubate per un paio d'ore fuori chip prima dell'analisi a valle mediante citometria a flusso. Durante il periodo di incubazione, componenti del siero presente nei media possono interagire con il tensioattivo e causare goccioline di diventare instabile e si disintegrano. Pertanto è importante aggiungere una concentrazione ottimizzata di tensioattivo all'olio fluorurati. Abbiamo testato la stabilità delle goccioline monodispersed contenente ematopoietici terreni di coltura privo di siero completati con 2% di siero umano con differenti concentrazioni di tensioattivo in olio fluorurati. Si può dedurre dalla Figura 2 che queste goccioline di monodispersed sono altamente stabili fino a 24 ore se almeno 3% tensioattivo viene aggiunto alla fase di olio. Risultati simili sono stati ottenuti con media RPMI con e senza l'aggiunta di 10% FCS (dati non mostrati). Pertanto, stabilità della gocciolina è fortemente dipendente dalle concentrazioni di tensioattivo ottimale quando si lavora con diverse fonti di mezzi di coltura e le componenti del siero.
Per dimostrare l'efficienza di incapsulamento del nostro approccio abbiamo seminato in primo luogo le cellule utilizzano tubazioni collegate a siringhe, che è l'approccio più convenzionale per la semina di cellule (Figura 3A). Abbiamo raccolto le cellule di T di Jurkat a differenti concentrazioni di 1.0x106 cellule/mL, 2.0x106 cellule/mL e 4.0 X106 cellule/mL ed abbiamo ottenuto un'efficienza di incapsulamento che era più bassa di valori stimati (Figura 3B). 1.0x106 cellule/ml, la frazione di goccioline che conteneva una singola cella era 2,5%, che non ha aumentato anche su usando le più alte concentrazioni di cella. Per aumentare l'efficienza di cella-caricamento, abbiamo modificato il nostro approccio precedente e montate il tubo a metà della lunghezza di un treppiede elevato e caricato la sospensione cellulare nella metà che era collegata al dispositivo PDMS (Figura 4A). Utilizzando questo approccio, abbiamo incapsulato le cellule di T di Jurkat a differenti concentrazioni di 1.0x106 cellule/mL, 2.0x106 cellule/mL e 4.0 X106 cellule/mL e anche raro PDC a differenti concentrazioni di 1.0x106 cellule/mL, 2.0x106 cellule/mL e 12.0x106 cellule/mL. Ci aspettavamo una migliore incapsulamento tariffe impedendo la sedimentazione delle cellule con questo metodo. Tuttavia, tutte le concentrazioni testate, i risultati sperimentali erano molto più bassi che il predetto Poisson valori (Figura 4B e 4 di figuraC).
Utilizzando il nostro approccio di punta-caricamento abbiamo ottimizzato i nostri tassi di incapsulamento delle cellule per ottenere risultati sperimentali coerenti con i valori statisticamente stimati (Figura 5A). Per concentrazioni differenti di cellule di T di Jurkat, l'efficienza ottenuta incapsulamento abbinati i nostri valori calcolati a tutte le concentrazioni (Figura 5B). Notevolmente, anche con le cellule aderenti come le cellule del tumore delle cellule A549, che tendono ad aggregarsi, abbiamo osservato un rendimento leggermente migliore incapsulamento ad una concentrazione cellulare di 1.0x106 cellule/mL (Figura 5C). Abbiamo anche valutato l'efficacia del nostro sistema per incapsulare meno disponibile e scarsa PDC alle concentrazioni differenti delle cellule di 1.0x106 cellule/mL, 3.0x106 cellule/mL e 13.0x106 cellule/mL(Figura 5). Per facilitare il carico di possibilmente più grandi volumi superiori a 200 µ l, ad esempio, quando si lavora con linee cellulari o cellule immuni primarie più abbondante, inoltre abbiamo studiato l'efficacia di incapsulamento di cellule utilizzando 1000 µ l consigli (blu). Abbiamo dimostrato che questi suggerimenti µ l 1.000 ha dato una simile efficienza di incapsulamento in confronto le punte di 200 µ l (giallo) (Figura 5E).
Dipende il chip design e ricerca domanda a portata di mano, il nostro suggerimento tecnica di caricamento può essere utilizzato per caricare le celle tramite un ingresso, per sondare in eterogeneità cellulare, o più ingressi in parallelo, per la decodifica di interazioni cellulari. Abbiamo confrontato il caricamento delle cellule di T di Jurkat (ad una concentrazione di 10.0x106 cellule/mL) da un ingresso a etichettati in modo diverso due popolazioni delle cellule di T di Jurkat (ad una concentrazione combinata di 10.0 x106 cellule/mL) da due insenature (Figura 6 A e Figura 6B). Durante l'incapsulamento, le goccioline sono state generate utilizzando gelificante temperatura ultrabassa agarosio e gelificato dopo la produzione di perline di idrogel di agarosio forma che ha permesso l'analisi successiva a valle tramite microscopia e flusso cytometry (nella figura 6 C e Figura 6D). L'analisi al microscopio ha rivelato che cella abbinamento è stato raggiunto a diverse combinazioni che indica per cella di throughput elevato accoppiamento (Figura 6C). Inoltre, l'analisi della popolazione stessa di idrogel perle da citometria a flusso ha rivelato che perline senza cellule potrebbero essere separati dai branelli con cellule basate su Inoltra distinto (FSC, dimensioni) e lateralmente (SSC, granularità) modello di dispersione (Figura 6 D). Gating sulla popolazione di perline senza cellule ha confermato una mancanza di incapsulamento di cellule dall'assenza di segnali fluorescenti. Inoltre, gating sulla popolazione tallone con cellule ha rivelato l'esistenza di più indicativi di sub-popolazioni per l'incapsulamento delle cellule di T di Jurkat etichettate in modo diverso. I nostri risultati dimostrano che cella efficiente abbinamento può essere raggiunto, basato su entrambi al microscopio e analisi cytometric di flusso e ha mostrato un'efficienza di incapsulamento leggermente aumentata rispetto alla previsione di Poisson (Figura 6E).
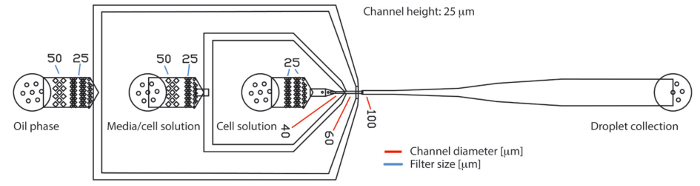
Figura 1 . PDMS basato gocciolina dispositivo microfluidico con tre ingressi e un'uscita. Il dispositivo consiste di tre insenature per fase olio continuo, terreni di coltura delle cellule e la sospensione cellulare, rispettivamente. Le goccioline generate sono raccolti presso l'outlet. I campioni di flusso laminarly fino al bivio di flusso-messa a fuoco dove vengono incapsulate in goccioline. Presso le insenature, filtro strutture contenere particelle di grandi dimensioni come le proteine o aggregati cellulari indietro. Il diametro delle lacune nella struttura del filtro sono indicate da linee blu. Il diametro dei canali all'ugello produzione sono indicati da linee rosse. L'altezza del canale sul chip intero era di 25 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 . Stabilità della gocciolina oltre 24 ore. I grafici mostrano l'area di goccioline contenenti ematopoietici terreni di coltura privo di siero + 2% di siero umano, nel corso del tempo per tre diverse concentrazioni di tensioattivo A) 0,5% B) 3% C) 5%. Clicca qui per visualizzare una versione più grande di questa figura.
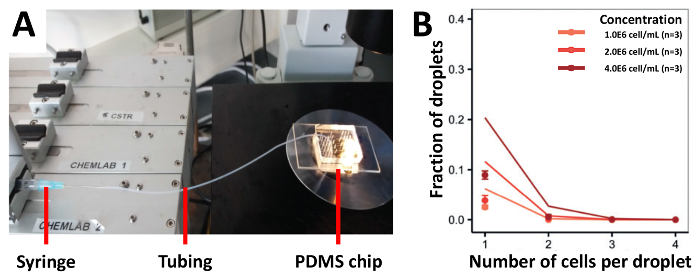
Figura 3 . Tubo base cella carico approccio. Cellule Jurkat-T vengono caricate a differenti concentrazioni al dispositivo utilizzando una siringa collegata alla tubazione. A) l'illustrazione mostra la messa a punto sperimentale B) il tasso di incapsulamento delle cellule come determinato da microscopia chiara. Punti: determinato sperimentalmente i valori; Chiuso linee: distribuzione di Poisson. Barra di errore rappresenta l'errore standard della media. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 . Incapsulamento di vari tipi di cellule a differenti concentrazioni di usando un tubo verticale caricamento approccio. Cellule di T di Jurkat e PDC (delle concentrazioni differenti) sono stati incapsulati per determinare l'efficienza di incapsulamento di cellule. A) l'illustrazione mostra la messa a punto sperimentale per il tubo verticale approccio di caricamento. B) il grafico mostra l'efficienza di incapsulamento di Jurkat T cellule. C) il grafico mostra l'efficienza di incapsulamento di PDC. Punti: determinato sperimentalmente i valori; Chiuso linee: distribuzione di Poisson. Barra di errore rappresenta l'errore standard della media. Clicca qui per visualizzare una versione più grande di questa figura.
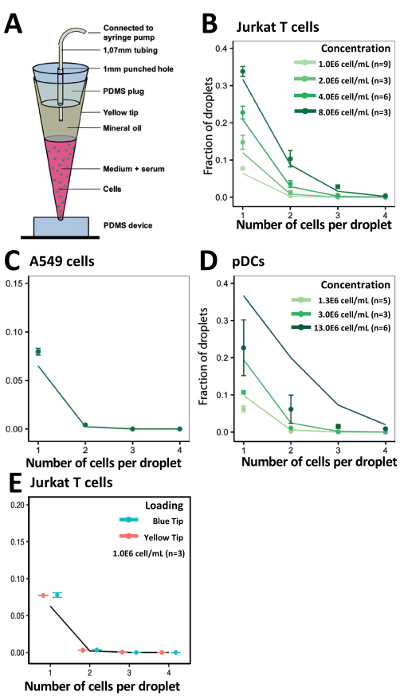
Figura 5 . Suggerimento per caricamento approccio per incapsulare i tipi di cellule diverse. A) illustrazione schematica della punta della tecnica di caricamento. B) il grafico mostra l'efficienza di incapsulamento di cellule Jurkat. C) il grafico mostra l'efficienza di incapsulamento di cellule A549. D) il grafico mostra l'efficienza di incapsulamento di PDC. E) il grafico mostra l'efficienza di incapsulamento di T di Jurkat celle utilizzando 200 µ l i puntali per pipette (gialli) e 1.000 µ l i puntali per pipette (blu). Punti: determinato sperimentalmente i valori; Chiuso linee: distribuzione di Poisson. Barra di errore rappresenta l'errore standard della media. Clicca qui per visualizzare una versione più grande di questa figura.
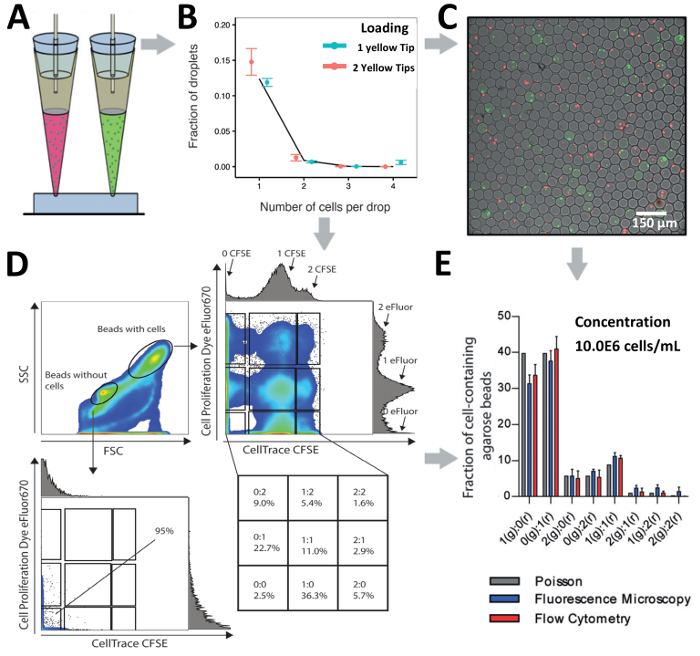
Figura 6 . Cella di abbinamento in gocce. A) illustrazione schematica della punta approccio per l'accoppiamento di cellule distinte da 2 ingressi nelle goccioline di caricamento. B) il grafico mostra l'incapsulamento di T di Jurkat celle utilizzando un ingresso o due ingressi in parallelo. La concentrazione di cellule per un suggerimento è 2.0x106 cellule/mL e la concentrazione di cellule per due suggerimenti entrambi 1.0x106 cellule/mL. Punti: determinato sperimentalmente i valori; Chiuso linee: distribuzione di Poisson. C) sovrapposizioni al microscopio la fluorescenza di idrogel perle e cellule di T di Jurkat identificate. D) Il grafico mostra l'analisi cytometric di flusso delle cellule accoppiate in agarosio idrogel perle. La trama viene illustrato sia forward scatter e dispersione laterale. E) confronto di numeri di cellulare in agarosio idrogel perle come rilevato da citometria a flusso e microscopia di fluorescenza. Bar: significa valore; Baffi: errore standard della media, n ≥ 4. Barra di errore rappresenta l'errore standard della media. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
In questo protocollo, abbiamo dimostrato una tecnica efficiente e semplice per caricare e incapsulare cellule nelle goccioline per analisi di alto-rendimento, cella singola e per eseguire l'associazione per gli studi di interazione cellulare cellulari e controllate. Inoltre, abbiamo confrontato diversi approcci convenzionali per caricare le cellule per dispositivi microfluidici e ha mostrato che il nostro Consiglio caricamento approccio è una tecnica più efficiente rispetto ad altri metodi.
Studi campioni clinici o tipi di cellule rare scarsi in numero di microfluidica basati su goccia possiedono alcune sfide inerenti. Come abbiamo anche dimostrato, le cellule tendono a sedimenti in siringhe e superficie del tubo, quindi, prevenire cellular incapsulamento per conformarsi ai valori stimati. Per eludere questo problema, alcuni gruppi utilizzano barre di agitazione nelle siringhe. Tuttavia, quando si utilizza popolazioni cellulari rara e limitata, il volume totale delle cellule è inoltre limitato, quindi, limitando l'uso di siringhe grandi e mescolando bar. Inoltre, abbiamo anche sostituito più comunemente utilizzati tubi con tubazione per evitare il collegamento delle cellule del Teflon rivestito, ma questo metodo non ha migliorato i risultati e se il tubo è troppo lungo, il problema del collegamento delle cellule aggrava (dati non mostrati). In alternativa, abbiamo usato un approccio di carico verticale del tubo dove le cellule sono state caricate nel tubo e non nella siringa per prevenire la perdita di cellule in volumi di grande siringa. Utilizzando questa tecnica, cellule con piccolo volume di campione possono essere caricati, ad es., PDC, che sono rari e limitati. Inoltre il campione dal tubo viene caricato al dispositivo in verticale per evitare la sedimentazione delle cellule. Il tubo utilizzato per semina cellulare ha piccole dimensioni e può essere paragonato a microcanali. Il flusso nella tubazione è pressione guidato e segue un profilo di velocità parabolico26. Questo implica che la velocità di flusso massima è al centro del tubo e velocità minima è ai bordi della tubazione27. Quando lo svuotamento di una popolazione di cellule attraverso il tubo, il gradiente di velocità induce le cellule a essere spinto verso i bordi dove si depositano giù perché la velocità al confine è vicino allo zero. La sedimentazione o agglomerato di celle nel tubo, quindi, riduce l'efficienza di incapsulamento come mostrato nei risultati rappresentativi dove i dati sperimentali non corrisponde con il modello previsto.
Un'altra soluzione adattata comunemente usata dagli scienziati, lavorando con gocciolina microfluidica, è quello di aumentare la densità del mezzo di coltura delle cellule tramite l'aggiunta di densità corrispondenti reagenti come Iodinaxol per evitare la sedimentazione delle cellule in siringhe19. Tuttavia, densità corrispondenti reagenti possono influenzare il comportamento cellulare e negativamente influenzare la secrezione di citochine da cellule (dati non mostrati)28.
Anche se parecchie piccole e grandi modifiche nella cella convenzionale tecniche di carico ha mostrato lievi miglioramenti nelle efficienze di incapsulamento, i risultati sperimentali ottenuti ancora non corrisponde i calcoli teorici. Tuttavia, con la punta di caricamento approccio potremmo il superare le limitazioni dei metodi precedenti ed efficienza di incapsulamento governate dalla statistica di Poisson. Questa tecnica non è solo vantaggiosa per sospensione celle di carico, ma può essere applicata anche per il caricamento di cellule aderenti, quali keratinocytes primari e A549 a chip microfluidici. Quando si utilizzano linee cellulari abbondanti, ad esempio A549, K562, ecc., può essere utilizzato più grande volume di campione. Pertanto, a seconda del volume del campione, diversi puntali dimensioni possono anche essere usati e questa semplice tecnica può essere adattata per incapsulamento cella singola e più fogli di plastica.
Mentre concentrazione bassa delle cellule è necessaria affinché l'incapsulamento di singole cellule in goccioline, le più alte concentrazioni di cellule sono desiderate per aumentare il numero medio di cellule incapsulate in ogni goccia per studi relazionati alla cella abbinamento. Ci sono diversi metodi di singola cellula che precedentemente sono stati descritti alle cellule immunitarie coppia su chip microfluidici o microfabbricati nanowells29,30,31. Nella gocciolina microfluidica, Poisson statistiche determina quella cella di 1:1 accoppiamento per due diversi tipi di cellule possa essere realizzato a concentrazioni di cellulare ottimale. Basato sulla previsione Poisson, c'è anche una probabilità che le goccioline potrebbero contenere altre combinazioni. Mentre abbinamento 1:1 delle cellule può essere desiderabile per studiare le interazioni cellulari a livello di singola cellula e risultati nella comprensione cellulare aumentata, più cellulare abbinamento ha anche importanti vantaggi. Permette di comprendere l'influenza di più celle di un tipo di cellula su altro tipo di cellula. Cross-talk tra diverse cellule immunitarie contribuiscono a generare una risposta immunitaria efficace contro varie infezioni e agenti patogeni e inoltre aggiunge robustezza al nostro sistema immunitario32. Come tale, la comunicazione cellulare possa essere interrogati con alta precisione in contesti distinti, ad esempio, 1:1, 2:1, 1:2, 2, 2, 3:1, ecc. rendimento maggiore comprensione su come singoli o coppie di celle controllano l'induzione delle risposte immunitarie. Ciò è particolarmente interessante per studiare ad esempio la capacità delle cellule natural killer o cellule di T citotossiche di uccidere in modo seriale loro cellule bersaglio rispettivi.
Come discusso, per incapsulamento multiple delle cellule in gocce, le più alte concentrazioni cellulari sono desiderate. Tuttavia, quando le celle di carico da un ingresso per l'incapsulamento di cellule, le più alte concentrazioni del campione di cellule possono causare le cellule da aggregare all'ingresso. Questo si traduce in tassi più bassi di incapsulamento e maggiore deviazione dai valori teorici. Per eludere questo problema, le cellule possono essere caricate da due ingressi separati pure. Teoricamente, sarebbe possibile sviluppare altri dispositivi microfluidici con entrate multiple per raggiungere livelli ancora più elevati di incapsulamento cella ove sia giustificata una media su x numero di celle. In questo studio abbiamo studiato l'efficacia di incapsulamento delle cellule di T di Jurkat quando caricato da un ingresso e due insenature usando la stessa concentrazione totale e ottenuto simile efficienza di incapsulamento. Questa modifica permette ai ricercatori di coppia differenti tipi cellulari su chip.
Mentre questo metodo aiuta nella celle per dispositivi microfluidici senza perdita significativa di celle di carico, ci sono alcune precauzioni che devono essere tenuti a mente. Quando si riempie le siringhe con olio minerale e aspirazione del campione di cellule in puntali per pipette, incorporazione di bolle d'aria dovrebbe essere evitato e l'intero sistema deve essere privo di aria. È anche importante tenere a mente che l'olio minerale non deve mescolare con il campione. Puntali per pipette, contenente campioni, devono essere inseriti saldamente nelle insenature del dispositivo microfluidico, con la massima precauzione, per evitare perdite e ulteriore incorporazione di bolle d'aria. Per riassumere, carico di punta è una tecnica semplice, ma robusta che permette analisi di alto-rendimento del comportamento cellulare tramite l'incapsulamento delle cellule senza perdita significativa di cellule in un modo economicamente vantaggioso. Quando utilizzato con concentrazioni di campione ottimale all'ingresso, questo approccio di celle con puntali per pipette di carico è molto flessibile e può essere adattato per diversi tipi di cellule, soprattutto per le cellule immuni primari rari, per ottenere maggiore efficienza di incapsulamento, vicino a modelli previsti.
Divulgazioni
Non abbiamo nulla di divulgare.
Riconoscimenti
Ringraziamo l'Eindhoven University of Technology per il generoso sostegno.
Materiali
| Name | Company | Catalog Number | Comments |
| 1H,1H,2H,2H-Perfluoro-1-octanol | Sigma-Aldrich | 171468-5G | |
| 1H,1H,2H,2H-Perfluorooctyltriethoxysilane | Fluorochem/UK | S13150 | Silane (toxic) |
| Agarose (Ultra-low Gelling Temperature) | Sigma-Aldrich | 9012-36-6 | |
| BD Wegwerpspuiten met Luer-Lok-punten | Fisher Scientific | 10630694 | Syringe |
| Biopsy Punch 1.2 mm | Harris Uni-Core | ||
| Cell Proliferation Dye eFluro 670 | eBioscience | 65-0840-85 | |
| CellTrace CFSE | Invitrogen | C34554 | |
| CellTrace Far Red Cell | Invitrogen | C34564 | |
| Eppendorf Tubes | Eppendrof Tubes | Safe-Lok tubes 1 mL and 2 mL | |
| Glass Slide | Sigma Aldrich | CLS294775X38-72EA | Corning microscope slides, plain L × W 75 mm × 38 mm |
| Harvard Pumps | Harvard Apparatus | C-400750; C-400727 | Syringe pumps |
| HFE-7500 3M Novec Engineered fluid | Fluorochem/UK | 51243 | Flourinated oil |
| Kai Biopsy Punch 5 mm | Amstel Medical | 1980130 | |
| Luer stub | Instechlabs/USA | LS20S | Luer stub, 20ga (pink) x 0.5in (12mm), non-sterile |
| Mineral oil (Light) | Sigma Aldrich | M8410-1L | |
| Phosphate buffered saline | Sigma-Aldrich | P4417-50TAB | Tablets |
| Pico-Surf 1 (5%in Novec 7500) | Sphere Fluidics | 020317-09 | Surfactant |
| Plasma Asher | Emitech | K1050X | Plasma asher |
| RPMI 1640 Medium | Gibco | 11875093 | |
| Silicone Elastomer Base 184 | Sylgard | 9355218 | PDMS base |
| Silicone Elastomer Curing Agent | Sylgard | 9355218 | Curing Agent |
| Stainless steel catheter coupler | Instechlab/USA | SC20/15 | 20ga x 15mm, non-sterile |
| TFE Teflon Tubing | Sigma-Aldrich | 58696-U | PTFE Tubing L × O.D. × I.D. 50 ft × 1/16 in. × 0.031 in. |
| Thinky mixer ARE-250 | EX-4025F | Conditioning mixture |
Riferimenti
- Yin, H., Marshall, D. Microfluidics for single cell analysis. Current Opinion in Biotechnology. 23 (1), 110-119 (2012).
- Meyvantsson, I., Beebe, D. J. Cell Culture Models in Microfluidic Systems. Annual Review of Analytical Chemistry. 1, 423-429 (2008).
- Yi, C., Li, C. W., Ji, S., Yang, M. Microfluidics technology for manipulation and analysis of biological cells. Analytica Chimica Acta. 560, 1-23 (2006).
- Wang, H. Y., Bao, N., Lu, C. A microfluidic cell array with individually addressable culture chambers. Biosensors and Bioelectronics. 24, 613-617 (2008).
- Zhang, Y., et al. A programmable microenvironment for cellular studies via. microfluidics-generated double emulsions. Biomaterials. 34 (19), 4564-4572 (2013).
- Teh, S. -. Y., Lin, R., Hung, L. -. H., Lee, A. P. Droplet microfluidics. Lab on a chip. 8 (2), 198-220 (2008).
- Hu, H., et al. Efficient cell pairing in droplets using dual-color sorting. Lab Chip. 15 (20), 3989-3993 (2015).
- Brouzes, E., et al. Droplet microfluidic technology for single-cell high-throughput screening. Proceedings of the National Academy of Sciences. 106 (34), 14195-14200 (2009).
- Chokkalingam, V., et al. Probing cellular heterogeneity in cytokine-secreting immune cells using droplet-based microfluidics. Lab on a Chip. 13 (42), 4740 (2013).
- den Haan, J. M. M., Arens, R., van Zelm, M. C. The activation of the adaptive immune system: Cross-talk between antigen-presenting cells, T cells and B cells. Immunology Letters. 162 (2), 103-112 (2014).
- Shah, G. J., Ohta, A. T., Chiou, E. P. -. Y., Wu, M. C., Kim, C. -. J. EWOD-driven droplet microfluidic device integrated with optoelectronic tweezers as an automated platform for cellular isolation and analysis. Lab on a Chip. 9 (12), 1732 (2009).
- Griffiths, A. D., Tawfik, D. S. Miniaturising the laboratory in emulsion droplets. Trends in Biotechnology. 24 (9), 395-402 (2006).
- Lagus, T. P., Edd, J. F. High-throughput co-encapsulation of self-ordered cell trains: cell pair interactions in microdroplets. RSC Advances. 3, 43 (2013).
- Moon, S., Ceyhan, E., Gurkan, U. A., Demirci, U. Statistical modeling of single target cell encapsulation. PLoS ONE. 6 (7), (2011).
- Abate, A. R., Chen, C. -. H., Agresti, J. J., Weitz, D. A. Beating Poisson encapsulation statistics using close-packed ordering. Lab on a Chip. 9 (18), 2628 (2009).
- Collins, D. J., Neild, A., deMello, A., Liu, A. -. Q., Ai, Y. The Poisson distribution and beyond: methods for microfluidic droplet production and single cell encapsulation. Lab Chip. 15 (17), 3439-3459 (2015).
- Kemna, E. W. M., et al. High-yield cell ordering and deterministic cell-in-droplet encapsulation using Dean flow in a curved microchannel. Lab on a Chip. 12 (16), 2881 (2012).
- Köster, S., et al. Drop-based microfluidic devices for encapsulation of single cells. Lab on a Chip. 8 (7), 1110 (2008).
- Mazutis, L., et al. Single-cell analysis and sorting using droplet-based microfluidics. Nature Protocols. 8 (5), 870-891 (2013).
- Sun, P., et al. Functional characterization of ex vivo. blood myeloid and plasmacytoid dendritic cells after infection with dengue virus. Virology. 383 (2), 207-215 (2009).
- Tel, J., et al. The chemotherapeutic drug oxaliplatin differentially affects blood DC function dependent on environmental cues. Cancer Immunology, Immunotherapy. 61 (7), 1101-1111 (2012).
- Wimmers, F., et al. Single-cell analysis reveals that stochasticity and paracrine signaling control interferon-alpha production by plasmacytoid dendritic cells. Nature Communications. 9 (1), 3317 (2018).
- Gong, J., Kim, C. -. J. All-electronic droplet generation on-chip with real-time feedback control for EWOD digital microfluidics. Lab on a Chip. 8 (6), 898 (2008).
- Demirci, U., Montesano, G. Single cell epitaxy by acoustic picolitre droplets. Lab on a Chip. 7 (9), 1139 (2007).
- Rho, H. S., Yang, Y., Veltkamp, H. -. W., Gardeniers, H. Direct Delivery of Reagents from a Pipette Tip to a PDMS Microfluidic Device. Chips and Tips. , (2015).
- Paul, P. H., Garguilo, M. G., Rakestraw, D. J. Imaging of Pressure- And Electrokinetically Driven Flows through Open Capillaries. Analytical Chemistry. 70 (13), 2459-2467 (1998).
- Whitesides, G. M., Stroock, A. D. Flexible methods for microfluidics. Physics Today. 54, 42 (2001).
- Mita, A., et al. Anti-proinflammatory Effects of Iodixanol (OptiPrep)-Based Density Gradient Purification on Human Islet Preparations. Cell Transplant. 19 (12), 1537-1546 (2013).
- Dura, B., et al. Profiling lymphocyte interactions at the single-cell level by microfluidic cell pairing. Nature Communications. 6 (1), 1-13 (2015).
- Dura, B., et al. Longitudinal multiparameter assay of lymphocyte interactions from onset by microfluidic cell pairing and culture. Proceedings of the National Academy of Sciences. 113 (26), 3599-3608 (2016).
- Yamanaka, Y. J., et al. Single-cell analysis of the dynamics and functional outcomes of interactions between human natural killer cells and target cells. Integrative Biology. 4 (10), 1175 (2012).
- Satija, R., Shalek, A. K. Heterogeneity in immune responses: From populations to single cells. Trends in Immunology. 35 (5), 219-229 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon