Method Article
Gewinnung von Lignin mit hohen Gehalt an β-O-4 durch milde Ethanol Extraktion und seine Wirkung auf die Depolymerisation Ausbeute
In diesem Artikel
Zusammenfassung
Hier präsentieren wir Ihnen ein Protokoll zur Ethanol-Gewinnung von Lignin aus verschiedenen Biomassequellen führen. Die Wirkung von der Extraktionsbedingungen auf Lignin-Ausbeute und β-O-4-Inhalte werden präsentiert. Selektive Depolymerisation erfolgt auf die erhaltenen Lignine, hoch aromatische Monomer-Produkte zu erhalten.
Zusammenfassung
Lignin Aufwertung Strategien sind ein wichtiger Faktor für die Erreichung wirtschaftlicher Wettbewerbsfähigkeit Bioraffinerien auf Basis von Lignocellulose Biomasse. Die meisten aufstrebenden elegante Verfahren bestimmte aromatische Produkte verlassen sich auf das Lignin-Substrat mit einem hohen Gehalt an leicht spaltbaren β-O-4-Verbindung als in der Heimat Lignin-Struktur. Dies bietet eine Miss-Match mit typischen technischen Lignine, die stark abgebaut und daher sind arm an β-O-4 Verbindungen. Daher sind die Gewinnung Erträge und die Qualität des erhaltenen Lignins von größter Bedeutung, um neue Wege der Lignin-Aufwertung zugreifen. In diesem Manuskript ist ein einfaches Protokoll vorgelegten erhalten Lignine mit hohen Gehalt an β-O-4 relativ milde Ethanol Extraktion, die verschiedene Lignozellulose-Quellen angewendet werden können. Ferner werden Analyseverfahren zur Bestimmung der Qualität der Lignine zusammen mit einer Depolymerisation Protokoll dargestellt, die spezifische phenolischen 2-Arylmethyl-1,3-Dioxolanes, die verwendet werden können ergibt, um die erhaltenen Lignine zu bewerten. Die vorgestellten Ergebnisse zeigen den Zusammenhang zwischen Lignin Qualität und Potenzial für die Lignine, in bestimmten Monomeren aromatische Chemikalien depolymerisiert. Insgesamt, die Extraktion und Depolymerisation zeigt ein Trade-off zwischen Lignin-Extraktion-Rendite und die Beibehaltung der native Aryl-Äther-Struktur und damit das Potenzial des Lignins als Substrat für die Produktion von Chemikalien für verwendet werden höherwertige Anwendungen.
Einleitung
Für die chemische Industrie nachhaltig zu sollten erneuerbare Rohstoffe wie Lignocellulose Biomasse als alternative zum aktuellen dominanten fossilen diejenigen1verwendet werden. Um solche Rohstoffe wirtschaftlich zu nutzen, sollte jedoch hochwertige Anwendungen für seinen Inhalt gesucht werden. Lignocellulose Biomasse kann etwa 30 Gew.-% des Lignins enthalten, eine aromatische Biopolymer ist für die derzeit nur wenige Anwendungen über seine Verwendung als geringwertige Kraftstoff2entwickelt wurden. Daher ist die Methodik zur potenziell erhöht Wert aromatischen Komponenten von großem Interesse für den Erfolg des zukünftigen Bioraffinerien.
Neuere Forschungen hat sich stark auf die Entwicklung neuartiger Methoden für die selektive Spaltung der am häufigsten vorkommende β-O-4-Verbindung (Abbildung 1a) in Lignin zu bestimmten aromatisch, in der Regel Phenol-, Monomere3,4 konzentriert ,5,6. Zum Beispiel der Einsatz von Säuren zwischen 80 ° C bis 180 ° C ist sehr effektiv bei der Spaltung der β-O-4-Verbindung bilden Aldehyd und Keton Fragmente7,8. Unsere Gruppen und andere haben vor kurzem gezeigt, dass Acidolysis in mit den Methoden zur Stabilisierung Kombination und Falle reaktive Fragmente ist extrem potent, phenolische Monomere mit bestimmten chemischen Motive9,10 zu erhalten , 11 , 12. davon, insbesondere Acetal Trapping von reaktiven Aldehyden mit Alkoholen zu phenolischen 2-Arylmethyl-1,3-Dioxolanes (POM) erwies sich mächtig durch seine relativ einfache Anwendung und die Beibehaltung der hoch funktionalisierten Natur Das Lignin Monomere (Abbildung 1 b)13,14. Diese POM stammen aus der Depolymerisation in ein Verhältnis, das bezieht sich auf die Verteilung des H, G und S Monomere in der übergeordneten Lignin Rohstoff zu präsentieren.
Säure katalysierte Depolymerisation, wie viele von den elegantesten Methoden entwickelt, sind relativ mild und Spalten nicht stärkere C-C-Bindungen, die in Lignin15auftreten. C-C-Bindungen werden jedoch besonders reichlich vorhanden, wenn harte Lignozellulose Fraktionierung Bedingungen durch die Kondensation von reaktiven Fragmente aus der Spaltung der schwächeren C-O-Bindungen16,17entlassen angewendet werden. Der Verlust der β-O-4-Inhalte aus der Biomasse Verarbeitungsmethode wird deutlich durch die Analyse einer Reihe von technischen Lignine, die gezeigt wurden, nur bis zu 6 β-O-4 Verbindungen pro 100 aromatischen Einheiten18behalten, während bei Lignozellulose diese Zahlen reichen von 45 bis 90 Verbindungen pro 100 aromatischen Einheiten je nach Quelle16. Was die mildere Extraktionsbedingungen, Lignine mit Gestänge-Distributionen erhalten Sie, die das natürliche Lignin besser Rechnung zu tragen. Allerdings erfordert dies ein Trade-off zwischen der Extraktionseffizienz und die Qualität der erhaltenen Lignin Material17. Dies hat auch Vorrang vor Organosolv-Gewinnung von Lignin, das ist eine beliebte Methode, um Lignin fraktionieren. Viele Variationen von diesem Prozess gibt, mit den Methoden mit unterschiedlichen Temperaturen, Säuregehalt, Extraktion Zeiten und Lösungsmittel. Hier hat die Extraktion schwere einen direkten Einfluss auf die erhaltenen Lignin-Struktur und damit ihre Eignung für die weitere Aufwertung19,20,21. Zum Beispiel hatte Organosolv-Lignin hergestellt durch Ethanol basierte Alcell Prozess, für 5 Jahre bei Demonstration Maßstab betrieben relativ geringe Menge an β-O-4 Verbindungen verlassen, da er bei relativ hohen Temperaturen zu gewährleisten effiziente Delignifizierung in betrieben wurde um qualitativ hochwertige Kohlenhydrate für Bioethanol-Produktion zu erhalten. Dennoch biobasierten Lösungsmittel mit wenig Auswirkungen auf die Umwelt wie Ethanol werden bevorzugt und somit die Extraktionsmethoden, die Lignine hochwertigere führen von Interesse sind. Alkoholische Lösungsmitteln sind von besonderem Interesse, denn neben den als Extraktionsmittel, die sie auch in der Lignin-Struktur z. B. integrieren β' - O - 4 (Abbildung 1a)22, die teilweise "" die Struktur von unerwünschten schützt Dekolleté. Eine geeignete Methode wäre möglicherweise zuerst Lignin mit hohem β-O-4 und in einem sequentiellen Schritt zu entfernen, den Rest des Lignins hochwertiger Zellulose Zugang zu erhalten.
In diesem Manuskript beschreiben wir ein geradlinig und hoch reproduzierbare Verfahren zur Gewinnung von hoher β-O-4 Lignin durch milde Ethanol Extraktion. Abhängig von der Biomasse-Quelle kann dies zu relativ hohe Extraktionseffizienz führen und Ertrag. Verfahren zur Charakterisierung der erhaltenen Lignin werden zur Verfügung gestellt, und wie Sie "deprotect" die etherified β' - O - 420. Darüber hinaus präsentiert ein Bewertungsverfahren für das Potenzial dieser Lignine in selektiven Depolymerisation Verfahren, die auf selektive Spaltung der β-O-4 Zusammenhänge beruhen. Diese Bewertung erfolgt mit Hilfe der Eisen(III)-triflate katalysierten Depolymerisation im Beisein von Ethylenglykol, um phenolische 2-Arylmethyl-1,3-Dioxolanes-23 die Verbindung zwischen β-O-4-Inhalte in das Lignin-Material zeigt zu erwirken und Das Monomer ergibt21. Die Ergebnisse zeigen die Balance zwischen hohen Lignin Absaugeffizienz und das Potenzial des erhaltenen Lignins, depolymerized, speziellen aromatischen Monomeren.
Protokoll
1. Vorbehandlung der Walnuss Rohstoffe vor der Lignin-Extraktion
- Herstellung von Schnitt-Walnuss-Schalen
- Füttern Sie die Walnuss-Schalen zu einem Hammer-Cutter, die Schalen brechen. Statten Sie des Hammer-Fräsers mit einem 5 mm Sieb am Ausgang. Sammeln Sie die gebrochenen Walnuss-Schalen in ein Becherglas 1 L.
- Füttern Sie die gebrochenen Schalen an ein Mikro Hammer Cutter Boden Muscheln zu erhalten. Statten Sie das Mikro Hammer-Messer mit einem 2 mm Sieb am Ausgang. Sammeln Sie die Boden Walnuss-Schalen in ein Becherglas 1 L.
- Gewinnung von Fettsäuren aus Boden Walnuss-Schalen
- Setzen Sie 150 g geschnittene Walnuss-Schalen in einem 500 mL Rundboden Kolben. Rundboden-Flasche 200 mL Toluol und einen Rührstab hinzufügen.
- Rundboden-Kolben einen Reflux-Kondensator zuordnen. Hitze die Mischung bei Reflux Temperatur (111 ˚C) mit einem Ölbad für 2 h mit kräftig rühren.
- Stoppen Sie die Heizung nach 2 h zu und lassen Sie die Mischung abkühlen auf Raumtemperatur durch Herausnahme aus dem Ölbad.
- Entfernen Sie das Toluol durch Filtration (185 mm Durchmesser, 10 µm Porengröße). Entsorgen Sie das Toluol Filtrat.
- Entfernen Sie das Toluol Rückstände durch Erhitzen der Walnuss-Schalen über Nacht in einem Vakuumofen bei 80 ° c und 50 Mbar.
- Fräsen von zuvor extrahierten Walnussschalen
- Platz 7 ZrO2 Kugeln mit einem Durchmesser von 20 mm in einem 250 mL Schüssel Schleifen Schleifen gemacht von ZrO2.
- Fülle die Schale mit 40 g Walnuss Partikel. Der Mahlschüssel 60 mL Isopropanol hinzufügen.
- Führen Sie das Schleifen von Walnuss-Schalen mit einer rotierenden Kugelmühle. In 4 Zyklen von 2 min 27 X g, gefolgt von einer 4 min Pause Schleifen Schleifen. Halten Sie die Temperatur des Behälters unter 80 ° c zu jeder Zeit. Führen Sie nicht mehr als 3 Chargen und die Schüssel abkühlen lassen danach runter.
- Sammeln Sie die fein gemahlenen Walnuss-Schalen in einem 500 mL Rundboden Kolben. Entfernen Sie das Isopropanol durch rotary verdunsten bei 40 ° c und 125 Mbar.
- Trockenen Übernachtung Walnuss-Schalen in einem Vakuum Ofen bei 50 ° c und 50 Mbar.
- Sieb fein gemahlenen Walnuss-Schalen durch ein Sieb 1 mm. Gemahlen Sie die Partikel, die zu groß sind wieder mit den rotierenden Ball-Mühle.
2. Vorbereitung des Holzes Rohstoffe
- Schneiden von der hölzernen Planken
- Legen Sie die Holzbohlen unter einer Bohrmaschine, die mit einem flachen Holz Geschwindigkeit Bohrer ausgestattet ist. Sammeln Sie die Holzspäne in ein Becherglas.
- Legen Sie die hölzerne Späne in einer Kaffeemühle zu in kleinere Stücke schneiden.
- Gewinnung von Fettsäuren aus Holz
- Führen Sie die Extraktion der Fettsäuren aus Holz in genau der gleichen Weise wie für Walnuss-Schalen in Schritt 1.2 beschrieben.
Hinweis: Keine Fräsen des Holzes erfolgt in der Kugelmühle, wie in Schritt 1.3 beschriebenen Bedingungen nicht zu einer Verringerung der Partikelgröße geführt hat.
- Führen Sie die Extraktion der Fettsäuren aus Holz in genau der gleichen Weise wie für Walnuss-Schalen in Schritt 1.2 beschrieben.
3. Gewinnung von hoher β-O-4 Ethanosolv Lignin
- Milde Ethanol Extraktion (Methode A)
- Setzen Sie 25 g des Ausgangsmaterials in einem 500 mL Rundboden Kolben. Fügen Sie eine 80: 20-Ethanol/Wasser-Gemisch (200 mL), 4 mL HCl-Lösung mit 37 % (0.24 M) und einen magnetischen Rührstab in den Rundboden-Kolben.
- Rundboden-Kolben einen Reflux-Kondensator zuordnen. Wärme Atreflux Mischungstemperatur mit einem Ölbad für 5 h mit kräftig rühren.
- Lassen Sie die Mischung auf Raumtemperatur abkühlen, indem es aus dem Ölbad. Filtern Sie das Gemisch (185 mm Durchmesser, 10 µm Porengröße) und waschen Sie die Reste mit 4 x 25 mL Ethanol.
- Aufarbeitung und Isolierung von lignin
- Den Likör in eine Flasche 500 mL Rundboden zu sammeln. Den Likör durch rotary verdunsten bei 40 ° c und 150 Mbar zu konzentrieren.
- Die gewonnenen Feststoff in 30 mL Aceton auflösen. Verwenden Sie ein Ultraschallbad, wenn der Feststoff nicht vollständig löst.
- Überstürzen Sie das Lignin von 600 mL Wasser der Mischung hinzufügen. Wenn kein Niederschlag auftritt, fügen Sie eine kleine Menge gesättigte wässrige Na2SO4 -Lösung für das Lignin ausflocken.
- Das Lignin durch Filtration (185 mm Durchmesser, 10 µm Porengröße) zu sammeln. Waschen Sie das Lignin mit 25 mL Wasser 4 Mal. Entsorgen Sie das Filtrat, wenn keine Analyse der Hemizellulose Fraktion erforderlich ist. Wenn das Filtrat sehr trübe ist, Hinzufügen einer Zentrifugation Röhre und sammeln den (festen) Boden Bruch durch Zentrifugation.
- Lassen Sie das Lignin an der Luft trocknen über Nacht. Trocknen Sie das Lignin weiter in einem Vakuumofen (über Nacht bei 50 ° c und 50 Mbar).
- Bestimmen Sie die Ausbeute, nachdem das Lignin in einem Vakuumofen über Nacht getrocknet ist.
- Bestimmen Sie das Lignin Extraktionseffizienz, indem man sie mit der gesamten Ligningehalt Klason Methode24bestimmt.
- Höhere Temperatur Ethanol Extraktion (Methode B)
- Setzen Sie 15 g des Ausgangsmaterials in eine 250 mL-Autoklaven. Fügen Sie eine 80: 20-Ethanol/Wasser-Gemisch (120 mL), 2,4 mL HCl (0.24 M) und einen magnetischen Rührstab.
- Hitze der Mischung bei 120 ° c für 5 h mit einer mitreißenden Geschwindigkeit von 5,2 x g. kühlen die Mischung anschließend in ein Eisbad.
- Filtern Sie das Gemisch (185 mm Durchmesser, 10 µm Porengröße) und waschen Sie die Reste 4 Mal mit 15 mL Ethanol.
- Führen Sie weitere Aufarbeitung und Isolierung genau wie in Schritt 3.2 beschrieben.
- Größeren Maßstab höhere Temperatur Ethanol Gewinnung von Walnuss-Schale (Methode C *)
- Setzen Sie 90 g fein Boden Nussbaum Schale in eine 1 L-Hochdruck-Autoklaven. Fügen Sie eine 80: 20-Ethanol/Wasser-Gemisch (750 mL) und 6,25 mL H2SO4 (0,12 M).
- Hitze der Mischung bei 120 ° c für 5 h mit einer mitreißenden Geschwindigkeit von 35,8 x g. Cool das Gemisch wieder auf Raumtemperatur durch Drehen auf die Reaktoren Kühlsystem nach der Einwirkzeit von 5 h.
- Filtern Sie das Gemisch (185 mm Durchmesser, 10 µm Porengröße) und waschen Sie die Reste 4 Mal mit 75 mL Ethanol.
Hinweis: Mit mehreren Filtern spart eine Menge Zeit. - Die Liköre in 2 gleichen Chargen zu sammeln. Führen Sie die Aufarbeitung und Isolierung wie beschrieben wie in Schritt 3.2 mit doppelter Menge Lösungsmittel für beide Serien.
- Experimente von Schritt 3.1. (Methode A *) und Schritt 3.3. (Methode B *) (optional)
- Legen Sie die genaue einige Materialien wie unter Punkt 3.1.1 aber ersetzen die HCl-Lösung mit 1,67 mL H2SO4 (0.12M) beschrieben. Der Rest der Schritt 3.1-3.2 ist identisch mit Methode A.
- Legen Sie die genaue einige Materialien wie unter Punkt 3.3.1 aber ersetzen die HCl-Lösung mit 1,0 mL der H2SO4 (0.12M) beschrieben. Der Rest der Schritt 3.3 ist identisch mit Methode B.
4. de-Veretherung des Lignins (optional)
- 1000 mg des Lignins in einem 24 mL 1:1-1,4-Dioxan/Wasser-Mischung in einem 100 mL Rundboden Kolben auflösen. Fügen Sie 1 mL eine 37 % ige HCl-Lösung auf die Mischung.
- Fügen Sie einen Rührstab und Rundboden-Kolben beimessen Sie einen Reflux-Kondensator. Hitze die Mischung auf 100 ° c mit einem Ölbad für 5 h mit kräftig rühren.
- Lassen Sie die Mischung auf Raumtemperatur abkühlen, indem es aus dem Ölbad. Fügen Sie die Mischung auf 160 mL Wasser das Lignin ausgefällt.
- Das Lignin durch Filtration (185 mm Durchmesser, 10 µm Porengröße) zu sammeln und das Lignin mit 25 mL Wasser 2 Mal waschen. Lassen Sie das Lignin an der Luft trocknen über Nacht. Trocknen Sie das Lignin weiter in einem Vakuumofen (über Nacht bei 50 ° c und 50 Mbar).
5. Analyse des Lignins
- Zweidimensionale NMR-(2D-NMR) Analyse
- Auflösen von 60 mg von getrockneten Lignin in 0,7 mL d6-Aceton. Fügen Sie ein paar Tropfen D2O, wenn das Lignin nicht vollständig zu lösen. Setzen Sie die Mischung in einem NMR-Rohr und nehmen ein 2D Proton Heteronuclear einzelnes Quantum Kohärenz Spektren (HSQC-) mit einem NMR-Spektrometer mit den folgenden Parametern: (11, -1), (160 -10), nt = 4, ni = 51220.
- Analysieren Sie die erhaltenen HSQC-Spektren. Passen Sie die Spektren durch manuelle Phase Korrekturen auf beiden Achsen, bis alle Signale positiv sind, da dies vor allem entlang der horizontalen (f2) Achse wichtig ist. Durchführen Sie keine grundlegende Korrekturen. Die Positionen der alle Verbindungen sind im Schritt 5.1.3 und 5.1.6 gegeben.
- Integrieren Sie die Signale der aromatischen Region, die die drei verschiedenen aromatischen Einheiten (Proton Nummerierung gemäß Abbildung 4) entsprechen. Diese Signale sind in der Region [(Proton range) (Carbon Bereich)]:
S2/6: [(6.48-6.90)(104-109)]
S'2/6: [(7.17-7.50)(105-109)]
Skondensierten: [(6.35-6.65)(106-109)]
G2: [(6.78-7.14)(111.5-116)]
G5: [(6.48-7.06)(115-120.5)]
G6: [(6.65-6.96)(120.5-124.5)]
H2/6: [(7.05-7.29)(128.5-133)]
Hinweis: H3/5 überschneidet sich mit dem G5 Signal, und es wird davon ausgegangen, dass H2/6 die gleiche Intensität wie H3/5 hat. Das Signal für kondensierte G überschneidet sich mit G-5. Wenn keine (oder kaum) G2 und G6 Signale vorhanden sind, bedeutet dies, dass vollständige Kondensation von G aufgetreten ist. - Berechnen Sie die Höhe der aromatischen Einheiten mit der Formel:
Total aromatisch = (((S2/6 + S "2/6) / 2) + Skondensierten) + ((G2 + G5 G6- H2/6) / 3) + (H2/6 / 2) - Berechnen Sie den Prozentsatz der G, H und S Einheiten mit den folgenden Formeln:
Ratio S = (((S2/6 + S "2/6) / 2) + Scondensed): insgesamt aromatischen x 100 %
Verhältnis G = ((G2+ G5G6- H2/6) / 3): insgesamt aromatischen x 100 %
Verhältnis H = (H2/6 / 2): insgesamt aromatischen x 100 % - Die Signale der aliphatischen Region Signale, die entsprechen, die β-O-4, β-β und β-5 Verbindungen und Hibbert Ketone zu integrieren. Diese sind in der Region [(proton range) (Kohlenstoff-Bereich)]:
Β-O-4α [(4.76-5.10)(73-77.5)]
Β ' - O - 4α [(4.44-4.84)(81.5-86)]
Β-O-4β und β' - O - 4β [(4.03-4.48)(85-90.5)]
Β-O-4γ und β' - O - 4γ [(3.10-4.00)(58.5-62)]
Β-5α [(5.42-5.63)(88-92)]
Β-5β [(3.36-3.56)(53-54.5)]
Β-5γ [(3.50-4.00)(62-64.5)]
Β-βα [(4.59-4.77)(86.5-89.5)]
Β-ββ [(2.98-3.20)(55.5-59)]
Β-βγ [(3.75-3.96)(72.5-76)] und [(4.10-4.31)(72.5-76)]
HKγ [(4.20-4.30)(66-68)]
Hinweis: Die β-Protonen der β-O-4 und β' - O - 4 Verbindungen überschneiden. Die strukturelle Motive dieser Verbindungen sind in Abbildung 1angegeben. - Die Anzahl der Verbindungen pro 100 C9 Einheiten basieren alle auf das Signal des Protons α der Zusammenhänge. Berechnen Sie die Gesamtzahl der Verbindungen mit den folgenden Formeln:
Β-O-4 Verbindungen = (β-O-4α + β' - O - 4-α) / total aromatisch X 100
# Β-5 Verbindungen = β-5α / total aromatisch X 100
Β-βVerbindungen = β-βα / total aromatisch X 100
- Gelanalyse Permeation Chromatographie (GPC)
- Lösen Sie 10 mg von getrockneten Lignin in 1 mL Tetrahydrofuran (THF) (mit einem Tropfen Toluol als interner Standard). Filtern Sie diese Mischung durch einen 0,45 µm-Spritze-Filter in einem Autosampler Fläschchen mit einer reduzierten Volumen Bucht von 0,3 mL. Schließen Sie den Autosampler Vials mit einer Kappe.
- Injizieren Sie 20 µL der Probe in einem THF GPC. Die gewonnenen Daten zu verarbeiten.
- Korrigieren Sie die erhaltenen Signal für das Referenzsignal (Toluol). Wählen Sie das Volume Elution für den richtigen Bereich (~ 200-10000 Da). Massenverteilung von der Software berechnet.
6. Depolymerisation von Lignine, phenolische 2-Arylmethyl-1,3-Dioxolanes (POM)
- Platz 50 mg von getrockneten Lignin in einer 20 mL Mikrowelle Durchstechflasche als das Reaktionsgefäß mit einem Magnetrührer ausgestattet. 0,85 mL 1,4-Dioxan, 50 µL von Ethylenglykol in 1,4-Dioxan (0,54 mL/mL) und 50 µL Octadecan (interner Standard) in 1,4-Dioxan (26 mg/mL) hinzugeben.
- Schließen Sie den Reaktionsbehälter und erhitzen Sie die Lösung auf 140 ° C unter Rühren bei 3,8 x g.
- Wenn das Reaktionsgefäß 140 ° C erreicht hat, fügen Sie 50 µL Fe (III) OTf3 in 1,4-Dioxan (0,1 g/mL).
- Rühren Sie den Reaktor für 15 min.
- Kühlen Sie den Reaktor auf Raumtemperatur ab und entfernen Sie die Depolymerisation Flüssigkeit, wie in Schritt 7.1 beschrieben.
7. Arbeit Up und Analyse der Depolymerisation Mischungen
- Filtern Sie die Flüssigkeit über Celite (Durchlässigkeit: 2,60-6-50 Darcy; Partikelgröße: 150 mesh Tyler; Sieb behalten (140 M U.S.): 2.0-25,0 %) und in ein 2 mL Zentrifugenröhrchen sammeln.
- Die Flüssigkeit über Nacht bei 35 ° C in eine Rotations-Vakuum-Konzentrator zu konzentrieren.
- Extrahieren Sie die endgültige Öl/fest mit dem folgenden Verfahren:
- Ausgesetzt und Anschwellen den Rückstand in 0,15 mL Dichlormethan (DCM) durch umfangreiche mischen (Vortex), 15 min von Beschallung und 30 min in automatische Rad.
- Zentrifugieren Sie Proben für bis zu 10 s mit einer Minispin Tabletop Zentrifuge um sicherzustellen, dass die Flüssigkeit an der Unterseite des Rohres (Zentrifugation Geschwindigkeit: 671 X g).
- Fügen Sie 0,75 mL Toluol und Mischung umfassend (durch Strudel und 10 min Ultraschallbehandlung).
- Zentrifugieren Sie Proben für bis zu 10 s mit einer Minispin Tabletop Zentrifuge (Zentrifugation Geschwindigkeit: 671 X g) um sicherzustellen, dass die Flüssigkeit an der Unterseite des Rohres ist.
- Die solide "oder" dick öligen Überrest der leichte organische Flüssigkeit trennen und filtern diese Flüssigkeit über einen Stecker der Celite und sammeln in einer Glasflasche.
Hinweis: Dieses Verfahren zur Aussetzung/waschen wird drei Mal wiederholt, und in der letzten Extraktion 0,5 mL Toluol dient.
- Die kombinierten organischen Phasen durch rotary Verdampfung (40 ° c, 20 Mbar) zu konzentrieren.
- Auflösen der öligen Rückstände in 1 mL der DCM für die Gaschromatographie Flamme Ionisation Detektor (GC-FID) Analyse.
- Durchführen Sie GC-FID mit einem GC, ausgestattet mit einem FID-Detektor und Nutzung Helium als Trägergas. Standard-Einstellungen: 1 µL Spritze, ein Split-Verhältnis von 50: 1, ein Helium-Flow von 0,95 mL/min Equip GC Apparat mit einem HP5 Spalte (30 m x 0.25 mm x 0,25 µm) und laufen mit ein Temperaturprofil beginnt mit einer 5 min 60 ° C-Isotherme. Follow-up durch eine Rampe 10 ° C/min, 20 min bis 260 ° C. Halten Sie diese Temperatur für 20 Minuten.
- Die Gipfel in den Spektren manuell zu integrieren. Die Retentionszeiten der Gipfel sind als folgende: Octadecan (21,4 min), H-Acetal (19,5 min), G-Acetal (20,8 min), S-Acetal (23,4 min). Verwenden Sie die erhaltenen Werte in Schritt 7.8 um die Quantifizierung durchzuführen.
- Durchführen Sie die Quantifizierung der G Acetal, basiert auf einer Eichkurve mit einem standard Verbindung isoliert Mitführen eines internen Standards (Octadecan).
Hinweis: Eichkurve: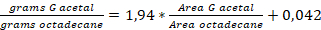 (R2= 0,9991)
(R2= 0,9991)
Ergeben Sie G-Acetal: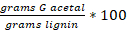
Basierend auf früheren Ergebnisse9,21,23 , die eine Responsefaktor für H und S Acetal 2.19 sowie 1,82 veranschlagt wurde.
Ergebnisse
In Abbildung 2werden die gewonnenen Rohstoffe nach der Vorbehandlung (linke Spalte) angezeigt. Alle Rohstoffe erhielt als kleine Chips vorhanden, abgesehen von Buchenholz, die als Späne aus geeigneten Partikelgröße für die Extraktion erworben wurde. Die Lignine erhalten nach der Extraktion-Show eine breite Palette von Farben und Korngrößen. Die Lignine gewonnenen milden Behandlungen (Methode A und zweiten Spalte Abbildung 2) sind in der Regel rot/rosa in der Farbe und erworbenen als kleine Flocken. Bei härtere Bedingungen angewendet (Methoden B und C *) sind, die erhaltenen Lignine haben eine braun/bräunlich gelb Farbe (dritte und vierte Spalte Abbildung 2). Für alle die Extraktionen durchgeführt unter schwierigeren Bedingungen (Methoden B und C*) im Vergleich zu milderen Bedingungen (Reaktionsschema in Abbildung 1, Ergebnisse in Tabelle 1) den Ertrag zu steigern. Dieser Effekt war viel tiefer für Nussbaum (10,2 Prozent), Buche (8,5 Prozent) und Zedernholz (5,1 Prozent) im Vergleich zu Kiefernholz (nur 0,5 % Steigerung). Basierend auf den Ligningehalt der Biomasse vor der Extraktion (40,3 % für Nussbaum, 28,6 % Kiefer25, 18,8 % Buche25 und 35,1 % Zeder25), das Lignin Extraktionseffizienz Buchenholz ist besonders hoch (73,9 %), während für die andere Quellen, die unteren Extraktionseffizienz erworben wurde. Methoden A * und B *, Experimente mit Schwefelsäure für Methoden A und B, zeigte einige deutliche Unterschiede in der Extraktion-Rendite. Milde Extraktion von Walnuss-Schalen mit Schwefelsäure (Methode A *) hat nur eine sehr geringe Ausbeute von 2,6 %, die ist deutlich niedriger als die Extraktion mit Salzsäure (Methode A) (2,6 % und 5,0 %). Mit härteren Extraktionsbedingungen die Extraktion mit Schwefelsäure (Methode B *) zeigt eine höhere Ausbeute im Vergleich zu Salzsäure (Methode B) (19,3 % und 15,2 %), allerdings ist anzumerken, dass Zucker Spuren in das Produkt durch Extraktion gewonnen werden mit Schwefelsäure.
Aus der NMR-Analyse der verschiedenen Lignine (Beispiel siehe Abbildung 4), die H/D/S-Verhältnis und die Höhe des Gestänges ermittelt wurden (Tabelle 1). Aufgrund der Überlappung der β und γ-Protonen des β-O-4 und die β' - O - 4 Gestänge, die Menge des Gestänges wird quantifiziert mit α-Protonen. Darüber hinaus können die G-5/6 und H3/5 Signale überlappen, aber diese korrigiert werden, durch Anpassung der Verhältnisse entsprechend mit der H-2/6 -Signale. Auch ein Signal entspricht der γ-Protonen Hibbert Ketone und ein Signal für oxidierte S-Einheiten, die wahrscheinlich durch Lignin Endgruppen verursacht sind, werden identifiziert.
Die Verhältnisse von NMR erhalten zeigen, dass in der Regel bietet Extraktionen mit Methode B Lignin mit höheren S-Gehalt im Vergleich zu denen mit Methode A in dem Fall, dass die Einheimischen Material S Einheiten enthält. Darüber hinaus bieten die Extraktionen mit Methode B Lignin mit einer geringeren Menge an insgesamt β-O-4 Verbindungen im Vergleich zu Methode A, zeigt erhöhte Abbau bei Erhöhung der Temperatur. Eine Ausnahme bildet die Walnuss-Lignin gewonnenen Methoden A und B für die die Höhe der gesamten β-O-4 Verbindungen sehr ähnlich war. Die Anzahl der β-β und β-5 Verbindungen verringert bei härtere Bedingungen angewendet werden, wenn auch in geringerem Maße. Darüber hinaus zufolge NMR die Lignine nach Ethanol Extraktion eine gewisse bauliche Veränderung der β-O-4-Verbindung zeigte erhalten. Diese müssen mindestens ca. 50 % Substitution am α-OH-Gruppe, wodurch die α-Ethoxylated β' - O - 4 Gestänge. Die Lignin-Extraktion zeigt hohen Reproduzierbarkeit, nachweislich durch die milde Extraktion von Walnuss-Schalen (Methode A) 4 Mal ausführen. Vor allem, ist die Abweichung in der Gesamtzahl der β-O-4 Verbindungen bemerkenswert klein. Wenn die Extraktion unter schwierigeren Bedingungen (Methoden B und C *), der Anteil der α-Ethoxylierung durchgeführt wurde erhöht. In der HSQC gewonnen, Spektren von Buche Lignin bei härteren Zustand (Methode B), ein Signal für S kondensiert sichtbar, ist die passt perfekt mit der bedeutenden in Höhe von β-O-4 Verbindungen zu verringern. Die Walnuss-Extraktion durchgeführt im großen Maßstab (Methode C *) zeigt eine signifikante Abnahme für alle Verbindungen und ein Signal für S kondensiert ist sichtbar in den HSQC--Spektren. Die relativ hohe Rendite für die Gewinnung von Zeder bei milden Bedingungen (Methode A) wird durch die Anwesenheit von eine erhebliche Menge an Fettsäuren verursacht. Experimente mit Schwefelsäure gab guten Einblick in die Wirkung der Säure auf die Zusammensetzung des Lignins erhalten. Mit milden Extraktionsbedingungen (MethodA *) war ein sehr reines Lignin erhalten die Zusammensetzung im Vergleich zu den anderen milden Extraktionen (MethodA) sehr ähnlich war. Die etwas geringere Menge an β-O-4 Verbindungen kann zugeschrieben werden, zu einer weniger effizienten Einbindung von Ethanol in das Lignin-Framework, was zu einer geringeren Anzahl von β' - O - 4 Verbindungen. Bei härteren Extraktionsbedingungen (Methode B *) die Unterschiede zu den gewonnenen Lignin ist viel tiefer im Vergleich des Lignins aus Walnussschalen extrahiert in Gegenwart von Salzsäure (Methode B) gewonnen. Die Gesamtzahl der β-O-4 Verbindungen zeigt eine scharfe Abnahme (35 und 74, beziehungsweise) und das Lignin gewonnen mit Schwefelsäure zeigt eine hohe Menge an Kondensat in der aromatischen Region (48 %), bestimmt durch die Integration der die Signale entsprechend der S verdichtet und Gkondensierte (Schritt 5.1.3). Dieser hohe Betrag der Kondensation kann voll Schwefelsäure, als das Produkt aus der gleichen Extraktion mit Salzsäure zeigte keine Kondensation in der aromatischen Region zugeschrieben werden. Die Zusammensetzung des Produkts bezogen auf rauen größeren Maßstab Extraktion (Methode C *) zeigt keinen großen Unterschied mit dem Erzeugnis in einem kleineren Maßstab (Methode B *). Der einzige große Unterschied ist der niedrigere Betrag von Kondenswasser in der aromatischen Region in der groß angelegten Extraktion (9 %) und anschließend einen höheren Anteil an β-O-4 Verbindungen. Dieser Unterschied kann durch die Differenz in der Heizprofil der verschiedenen Autoklaven verursacht werden.
Die Lignine wurden auch von GPC (Abbildung 5) bieten Einblick in das Molekulargewicht (Tabelle 2) analysiert. Diese zeigen, dass wenn härtere Extraktionsbedingungen (Methode B) angewendet werden, das Gewicht mittlere Molekulargewicht (Mw) und die Polydispersität für alle Quellen steigen. Die Zahl mittlere Molmasse (Mn) zwischen den Extraktionsbedingungen sind für jede Quelle vergleichbar. Insgesamt zeigen diese Ergebnisse, dass härtere Extraktionsbedingungen eine zweifache Wirkung haben, und größere Fragmente werden zusätzlich weitere Aufschlüsselung der solcher Fragmente extrahiert.
Für einige Anwendungen, die Bildung von β' - O - 4 Gestänge ist unerwünscht, z. B. beim Depolymerisation Methoden anwenden, die auf die Oxidation der benzylic (α) Hydroxyl Gruppe26,27,28verlassen. Die Transformation der β' - O - 4 Verknüpfung der Ethanosolv Lignin zu regelmäßigen β-O-4 Verbindungen war zuvor gemeldeten20 und erfolgte mit einem Lignin Batch aus Walnuss-Schalen gewonnen, die das Lignin gewonnen aus Walnussschalen berichtet in diesem vergleichbar ist Papier (Abbildung 6). Das Lignin bestand aus 30 native β-O-4 Verbindungen und 39 α-Ethoxylated β' - O - 4 Verbindungen (34 und 38 Verbindungen, bzw. für das Lignin in diesem Papier). De-Veretherung umgewandelt fast alle α-Ethoxylated Verbindungen die native Struktur der erhaltenen Lignin bestand aus 57 β-O-4 Verbindungen und nur 3 α-Ethoxylated β' - O - 4 Verbindungen, zeigt einen kleinen Verlust in die Gesamtzahl der β-O-4 Einheiten. Die Masse des Lignins lag bei 72 % des ursprünglichen Lignins, die in erster Linie durch den Verlust der Ethyl-Gruppe verursacht wird.
Um das Potenzial des Lignins für die Herstellung von aromatischen Monomere durch milde Depolymerisation zu demonstrieren, durchgeführt Acidolysis Reaktionen mit Fe(OTf)3 in Anwesenheit von Ethylenglykol wurden (Abbildung 7). Diese Reaktion führt zu drei verschiedenen phenolischen 2-Arylmethyl-1,3-Dioxolanes (POM), die beziehen sich auf die H, G und S-Einheiten in das Lignin zu präsentieren. Tabelle 3 zeigt den Ertrag von S, G und H Acetale und die gesamten Erträge sind in Abbildung 8dargestellt. Es ist sichtbar, dass die Lignin-Extraktions-Verfahren wird die Ausbeute an Acetale wesentlichen Einfluss hat. Geringere Erträge ergeben sich für Lignin extrahiert mit schwierigeren Bedingungen (Methode B). Dies ist wahrscheinlich auf ein mehr veränderte (höherer Prozentsatz von α-Ethoxylierung) Struktur verdichtet, wie im vorherigen Absatz beschrieben.
Die Bedeutung der β-O-4 Einheiten spiegelt sich durch die Bereitstellung von Korrelationen Monomer Rendite in Depolymerisation wie im Protokoll (Abbildung 9). Ein klarer Trend ist sichtbar, wenn man bedenkt das Gesamtgehalt β-O-4 und nicht etherified β-O-4-Verbindungen, wo eine höhere β-O-4-Inhalte in der Regel höhere Ausbeute an phenolischen 2-Arylmethyl-1,3-Dioxolanes (POM) ergibt sich die im Einklang mit früheren Ergebnissen21 . Bei der Betrachtung der etherified β' - O - 4 Verbindungen, der Trend ist auch klar, zeigen, dass die Depolymerisation Ausbeute nicht mit der Anzahl der β zusammenhängt ' - O - 4 Verbindungen. Unter Reaktionsbedingungen können die etherified β-O-4 Verbindungen de-etherified aber dieser zusätzliche Schritt führt zum Verlust des Materials, wie oben beschrieben.
Alles in allem Korrektur den Monomer Depolymerisation Ertrag für die Lignin-Extraktion-Rendite, die folgenden Ergebnisse (Tabelle 4) erhalten. Diese zeigen, dass Methoden A und Bzu vergleichen, in der Regel höhere Mengen an Acetal durch härtere Extraktion bietet insgesamt Lignin Mehrertrag, gefolgt von einem (weniger selektiv) Depolymerisation gewonnen werden können. Dennoch zeigen die Ergebnisse für Pinienwald auch, dass dies abhängig von Biomasse Quelle, ist da der Anstieg der Extraktion Schweregrad keine deutliche Ertragssteigerung bieten. Aufbewahrung der β-O-4 Struktur wird bevorzugt für diese Holzart, insgesamt phenolischen 2-Phenylmethyl-1,3-Dioxolan (POM) Mehrertrag zu geben.
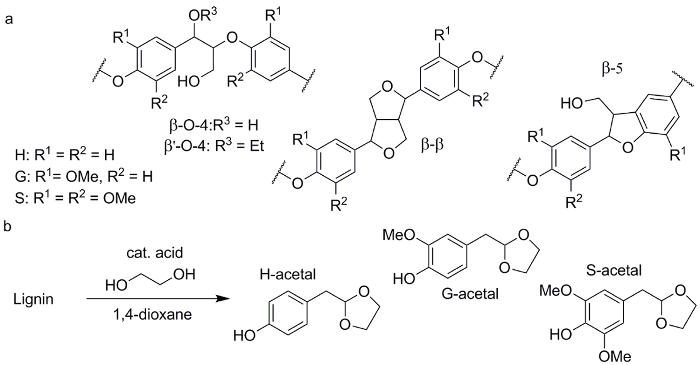
Abbildung 1 . Chemische Strukturen der erhaltenen Produkte. (a) allgemeine strukturelle Motive wie in der Lignin-Struktur. (b) Säure katalysiert Lignin Depolymerisation kombiniert mit Acetal-Trapping phenolischen 2-Arylmethyl-1,3-Dioxolanes (POM) zu erhalten. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2 . Lignin aus verschiedenen Ausgangsstoffen gewonnen. Bild von vier verschiedenen Lignozellulose-Rohstoffe nach der Vorbehandlung (Schritte 1 und 2) und den erhaltenen Lignine nach Organosolv-Extraktion bei unterschiedlichen Bedingungen (Methode ein-Schritt 3.1, Methode B-Schritt 3.3 und Methode C *-Schritt 3.4). Bitte klicken Sie hier für eine größere Version dieser Figur.
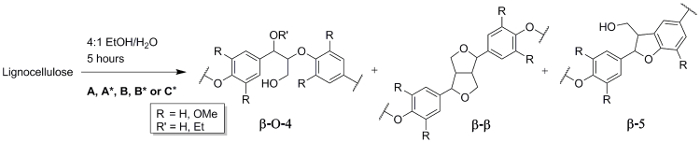
Abbildung 3 . Reaktionsschema für die Extraktion von Ethanosolv. Überblick über die erhaltenen Verbindungen: β-O-4 (R' = H), β' - O - 4 (R' = Et), β-β und β-5. Bedingungen: (A) 80 ˚C, 0,24 M HCl (Schritt 3.1), (B) 120 ° c, 0.24 M HCl (Schritt 3.3), (C *) 120 ° c, 0,12 M H2SO4 (Schritt 3.4) und die Kontrolle experimentieren, A * und B * (Schritt 3.5). Bitte klicken Sie hier für eine größere Version dieser Figur.
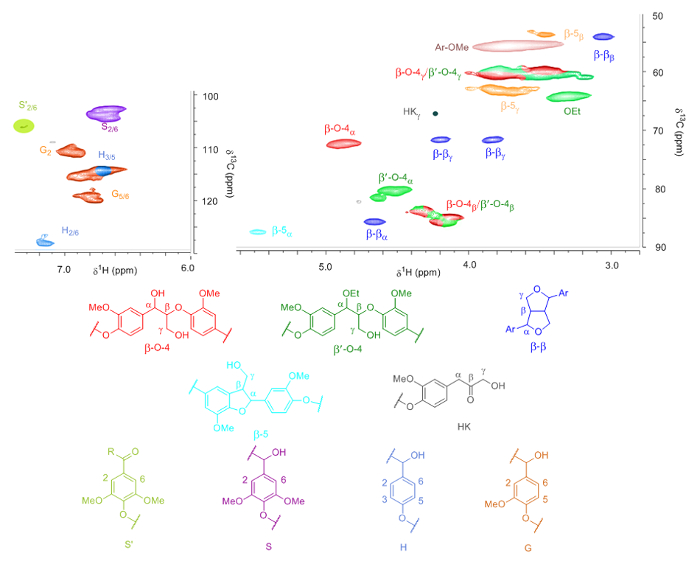
Abbildung 4 . HSQC-Analyse des Lignins. Identifizierung von allen Lignin Verbindungen gemessen mit 2D-HSQC-des Lignins aus Walnussschalen mit milden Behandlung (Schritt 3.1) gewonnen. Die Signale für HKγ und S "2/6 sind vergrößert, um sie sichtbar zu machen. Bitte klicken Sie hier für eine größere Version dieser Figur.
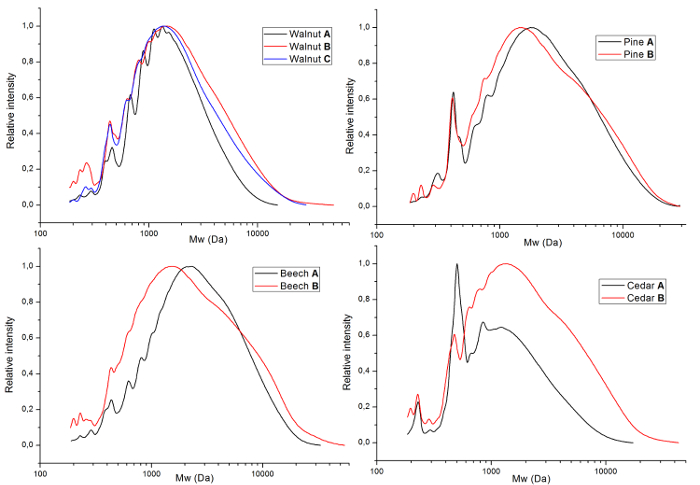
Abbildung 5 . Molekulargewicht des Lignins. GPC-Graphen der erhaltenen Lignine geteilt durch Quelle (ein = Nussbaum, b = Kiefer Holz, c = Buchenholz und d = Zedernholz). Die Zeilen entsprechen verschiedenen Proben wie von Tabelle 2gegeben. Bitte klicken Sie hier für eine größere Version dieser Figur.
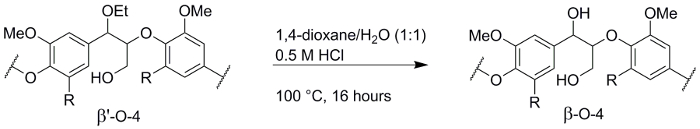
Abbildung 6 . De Veretherung des Lignins. Reaktionsschema der de-Veretherung von der erhaltenen Ethanosolv Lignin aus Walnussschalen (Schritt 4). Bitte klicken Sie hier für eine größere Version dieser Figur.
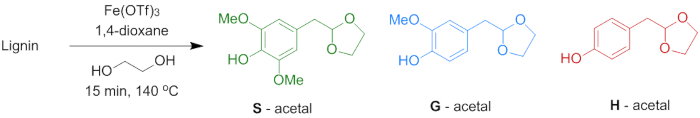
Abbildung 7 . Lignin Depolymerisation, Acetale. Reaktionsschema für die Depolymerisation von Lignin, phenolische 2-Arylmethyl-1,3-Dioxolanes (POM). H-Einheit: R1 = R2 = H; G-Unit: R1 = OMe, R2 = H; S-Einheit: R1 = R2 = OMe (Schritt 6). Bitte klicken Sie hier für eine größere Version dieser Figur.
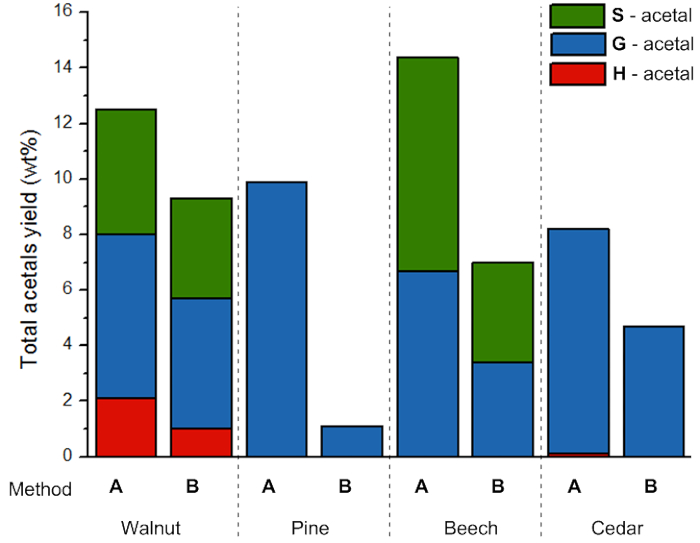
Abbildung 8 . Acetal Ertrag pro Quelle. Erträge der phenolischen 2-Arylmethyl-1,3-Dioxolanes (POM) Depolymerisation von Lignin aus verschiedenen Quellen entnommen. Bitte klicken Sie hier für eine größere Version dieser Figur.
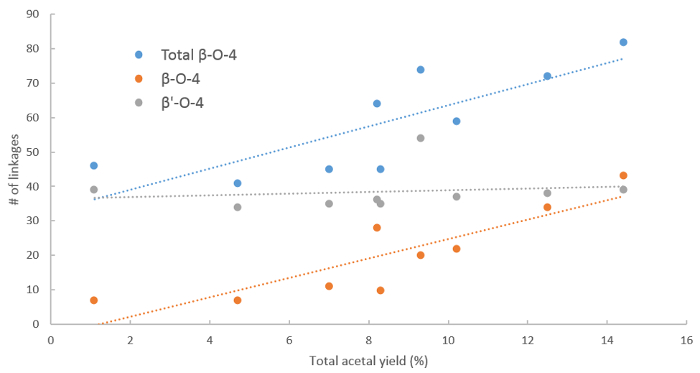
Abbildung 9 . Einfluss der β-O-4 Verbindungen auf den Ertrag Acetal. Erträge der phenolischen 2-Arylmethyl-1,3-Dioxolanes (POM) gewonnenen Lignin Depolymerisation im Vergleich zu den gesamten β-O-4 (blau), nicht etherified β-O-4 (Orange) und etherified β-O-4 (grau) Inhalte in das Lignin-Ausgangsmaterial. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Quelle | Bedingungen | Rendite (%) | Extraktion Wirkungsgrad (%)1 | S/G/H-Verhältnis | Insgesamt β-O-4 | Β-O-4 | Β ' - O - 4 | Β-Β | Β-5 |
| Walnuss | A | 5,0 ± 0,7 | 12.4 | 45/46/9 | 75 ± 2,5 | 36 ± 2,6 | 39 ± 3,1 | 11 ± 0,7 | 5 ± 1,5 |
| Walnuss | A * | 2.6 | 6.5 | 47/45/8 | 53 | 32 | 21 | 9 | 4 |
| Walnuss | B | 15.2 | 37,7 | 59/37/4 | 74 | 20 | 54 | 9 | 6 |
| Walnuss2 | B * | 19.3 | 47,9 | 75/25/0 | 35 | 5 | 30 | 7 | 3 |
| Walnuss2 | C * | 16.2 | 40,2 | 65/33/2 | 45 | 10 | 35 | 8 | 3 |
| Kiefer | A | 3.5 | 12.2 | 0 / > 99 / < 1 | 59 | 22 | 37 | 0 | 14 |
| Kiefer | B | 4.0 | 14.0 | 0 / > 99 / < 1 | 46 | 7 | 39 | 0 | 8 |
| Buche | A | 5.4 | 28,7 | 63/37/0 | 82 | 43 | 39 | 12 | 5 |
| Buche3 | B | 13.9 | 73,9 | 83/17/0 | 45 | 11 | 35 | 9 | 2 |
| Zeder | A | 6.4 | 18.2 | 0 / > 99 / < 1 | 64 | 28 | 36 | 0 | 6 |
| Zeder | B | 11.5 | 32,8 | 0 / > 99 / < 1 | 41 | 7 | 34 | 0 | 7 |
Tabelle 1. Ethanosolv Extraktion Ergebnisse. Erhaltenen Erträge, aromatische Verteilung und Verbindungen für die verschiedenen Extraktionen auf Biomasse durchgeführt. * Schwefelsäure dient als Säure. 1 Ertrag des Lignins (wt%)/Lignin Inhalte in das Ausgangsmaterial Klason Lignin Entschlossenheit bestimmt. 2 Hemizellulose und S kondensiert in das Produkt. 332 % der S-Einheiten werden verdichtet.
| Quelle | Bedingungen | Mn (g/Mol) | Mw (g/Mol) | Ð |
| Walnuss | A | 1096 | 1805 | 1.65 |
| Walnuss | B | 1174 | 2934 | 2.50 |
| Walnuss | C * | 1248 | 2930 | 2.35 |
| Kiefer | A | 1331 | 3071 | 2.31 |
| Kiefer | B | 1319 | 3596 | 2.73 |
| Buche | A | 1645 | 3743 | 2.28 |
| Buche | B | 1368 | 4303 | 3.14 |
| Zeder | A | 860 | 1626 | 1,89 |
| Zeder | B | 1188 | 3292 | 2,77 |
Tabelle 2: Molekulargewichte der erhaltenen Lignine.
| Quelle | Bedingungen | Rendite (%) | S/G/H-Verhältnis | Insgesamt β-O-4 | S Acetal (Gew.-%) | G-Acetal (Gew.-%) | H Acetal (Gew.-%) | Insgesamt Acetal Ertrag (Gew.-%) |
| Walnuss | A | 5.0 | 45/46/9 | 72 | 4.5 | 5.9 | 2.1 | 12.5 |
| Walnuss | B | 15.2 | 59/37/4 | 74 | 3.6 | 4.7 | 1.0 | 9.3 |
| Walnuss | C * | 16.2 | 65/33/2 | 45 | 3.8 | 3.9 | 0,6 | 8.3 |
| Kiefer | A | 3.5 | 0 / > 99 / < 1 | 59 | 0 | 9.9 | 0,3 | 10.2 |
| Kiefer | B | 4.0 | 0 / > 99 / < 1 | 46 | 0 | 1.1 | 0 | 1.1 |
| Buche | A | 5.4 | 63/37/0 | 82 | 7.7 | 6.7 | 0 | 14.4 |
| Buche | B | 13.9 | 83/17/0 | 45 | 3.6 | 3.4 | 0 | 7.0 |
| Zeder | A | 6.4 | 0 / > 99 / < 1 | 64 | 0 | 8.1 | 0.1 | 8.2 |
| Zeder | B | 11.5 | 0 / > 99 / < 1 | 41 | 0 | 4.7 | 0 | 4.7 |
Tabelle 3: Acetal Erträge von Lignin Depolymerisation. Erträge der phenolischen 2-Arylmethyl-1,3-Dioxolones (POM) Depolymerisation von Lignin aus verschiedenen Quellen entnommen. Bedingungen: 50 mg Lignin, 60 wt % Ethylenglykol, 10 Gew.-% Fe(OTf)3, Lösungsmittel: 1,4-Dioxan, 140 ° C (1 mL Gesamtvolumen), 15 Minuten (Schritt 7).
| Quelle | Bedingungen | Lignin-Extraktion-Rendite (%) | Β-O-4 | Β ' - O - 4 | Insgesamt β-O-4 | Insgesamt Acetal Ertrag (Gew.-%) | Insgesamt Acetal Ausbeute für Lignin Extraktion Ertrag (Gew.-%)1 korrigiert |
| Walnuss | A | 5.0 | 34 | 38 | 72 | 12.5 | 0,63 |
| Walnuss | B | 15.2 | 20 | 54 | 74 | 9.3 | 1.41 |
| Walnuss | C * | 16.2 | 10 | 35 | 45 | 8.2 | 1.33 |
| Kiefer | A | 3.5 | 22 | 37 | 59 | 10.2 | 0,36 |
| Kiefer | B | 4.0 | 7 | 39 | 46 | 1.1 | 0,04 |
| Buche | A | 5.4 | 43 | 39 | 82 | 14.4 | 0.78 |
| Buche | B | 13.9 | 11 | 35 | 45 | 6.9 | 0,96 |
| Zeder | A | 6.4 | 28 | 36 | 64 | 8.2 | 0,52 |
| Zeder | B | 11.5 | 7 | 34 | 41 | 4.7 | 0,54 |
Tabelle 4: insgesamt Acetal Ertrag mit Extraktion-Rendite korrigiert. Erträge der phenolischen 2-Arylmethyl-1,3-Dioxolanes (POM) gewonnenen Depolymerisation von Lignin aus verschiedenen Quellen für Lignin-Extraktion-Rendite korrigiert. 1 Berechnung: 100 *(lignin yield/100) * (total Acetal Ertrag/100). Bedingungen: 50 mg Lignin, 60 wt % Ethylenglykol, 10 Gew.-% Fe(OTf)3, Lösungsmittel: 1,4-Dioxan, 140 ° C, 15 min (Reaktion über Schritt 6) & Aufarbeitung über Schritt 7.
Diskussion
Die Ergebnisse aus der Extraktionen bei unterschiedlichen Bedingungen und verschiedenen Biomasse-Quellen zeigen wie die optimalen Bedingungen für Lignin Extraktion mit einem relativ hohen Gehalt an β-O-4 Verbindungen je nach Quelle variieren können. Zum Beispiel Walnuss Extraktion unter schwierigeren Bedingungen (Methode B) bietet eine Verdreifachung der Ertrag mit einer in der Nähe von Aufbewahrung von der Menge der β-O-4 Einheiten, während für Buche und Zeder die Ausbeute erhöht aber ist begleitet von einem beträchtlichen Rückgang der Menge an β-O-4 Einheiten. Auf der anderen Seite für Kiefer, härteren Extraktionsbedingungen bieten sehr wenig Nutzen in Ertrag und führen auch zu einer Lignin mit einer sehr geringen Menge an β-O-4 Einheiten. Dies bedeutet, dass in der Regel irgendeine Form der Optimierung zu beteiligen, das richtige Gleichgewicht zwischen Lignin Ertrag und Qualität in Form eines Zurückbehaltungsrechts des Betrags der β-O-4 Einheiten in der erhaltenen Lignin-Material bekommen.
Der starke Anstieg der Mw das Lignin Material aus härteren Extraktionsbedingungen zeigt, dass unter diesen Bedingungen größere Fragmente extrahiert werden können, bietet höhere Erträge. Allerdings tritt bei diesen Bedingungen zusätzliche Fragmentierung, Bereitstellung von zusätzlichen unteren Molekulargewicht Material und erhöht so die Polydispersität, wie in den GPC-Grafiken von Nussbaum (Abb. 5a) und Zeder (Abb. 5D) in deutlich zu erkennen die Form des Signals bei ~ 500 Da.
HSQC-NMR ist ein wichtiges informatives Tool vergleichende Daten über die Qualität der verschiedenen Lignine vorzulegen. Es sei darauf hingewiesen, dass bei diesem Verfahren wird eine standard HSQC--Experiment durchgeführt, dies eignet sich hervorragend für vergleichende Daten zu erhalten, aber nicht unbedingt quantitativ aufgrund von Unterschieden in Relaxationszeiten ist. Die hohe Anzahl der Verbindungen für einige Lignine in Tabelle 1 angezeigt werden überschätzt. Quantitative HSQC-Experimente bessere Ergebnisse liefern, aber deutlich mehr NMR Zeit gekostet, obwohl29 Alternativen. Nach unserer Erfahrung sollte die Zahlen in Tabelle 1 um den Faktor 1.3 besser widerspiegelt die tatsächliche Höhe der β-O-4 Einheiten pro 100 aromatischen Einheiten unterteilt werden.
Wie bereits erwähnt die berichteten Ergebnisse hinweisen wie finden optimale Bedingungen je nach Quelle variieren kann um die maximale Monomer Erträge zu erzielen. Beispielsweise wenn Walnuss als Ausgangsmaterial verwendet wird, führen, die allgemeine Gesamtanzahl Acetale erhöht etwa zwei Mal wenn Lignin Extraktion rauheren Bedingungen (Methode B) tätig sind. Dies ist jedoch vor allem aufgrund der großen Unterschiede bei Lignin-Extraktion-Rendite, ohne Auswirkungen auf die β-O-4-Inhalte. Anders sind, wenn Kiefer verwendet wird mildere Extraktionsbedingungen (Methode A) vorzuziehen. In der Tat Lignin Extraktion zu Ergebnissen führen in sehr ähnliche Erträge in zwei Fällen aber schwierigeren Bedingungen einen Tropfen in β-O-4 Einheiten (vor allem nicht etherified β-O-4 Verbindungen), die der Grund für solch einen niedrigen Monomer Ertrag sein können wie in der vorstehenden Randnummer angegeben. Ein erheblicher Verlust von nicht etherified β-O-4 Verbindungen kann auch in den Fällen von Buche und Zeder beobachtet werden, wenn Bedingungen (Methode B) für die Extraktion angewendet werden, führt möglicherweise zu einer niedrigeren Monomere Ausbeute. Allerdings unterscheidet sich die Gesamtausbeute Acetal nicht so viel je nach Extraktion. In der Tat wird eine ungefähre Verdoppelung in Lignin-Extraktion-Rendite beobachtet, für beide Biomassequellen Umschalten von Methoden A, B, für den etwa zweifach Rückgang Monomer Rendite kompensiert.
Offenlegungen
Die Autoren berichten keine Interessenskonflikte
Danksagungen
Die Arbeit wurde von der Europäischen Union (Marie Curie ITN 'SuBiCat' PITN-GA-2013-607044, PJD, KB und JGdV), neben finanzieller Unterstützung des European Research Council, ERC starten Grant 2015 (CatASus) 638076 (AdS und KB) und das Forschungsprogramm Talent gefördert. Schema (Vidi) mit Projektnummer 723.015.005 (KB), die teilweise von der niederländischen Organisation für wissenschaftliche Forschung (NWO) finanziert wird.
Materialien
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Iron (III) triflate | Sigma Aldrich | 708801-1G | purity: 90% |
| Octadecane | Sigma Aldrich | 0652-100G | purity: 99% |
| Celite | Alfa Aesar | H33152.0B | |
| Silica Gel | SiliCycle | R12030B-1KG | P60 40-63 μm |
| Dichloromethane | Macron Fine Chemicals | 6779-25 | |
| Walnut shells | |||
| Pine wood | |||
| Cedar wood | |||
| Beech wood | |||
| Ethanol | JT Baker Chemicals | 00832000001 | Ethanol absolute |
| Isopropanol | Acros Organics | 149320025 | 99.5+% extra pure |
| Acetone | Macron Fine Chemicals | 2440-06 | |
| Tetrahydrofuran | Boom B.V. | 164240025 | stabilized with BHT |
| Toluene | Macron Fine Chemicals | 8608-02 | |
| Water | Demi water from the internal supply | ||
| 1,4-Dioxane | Acros Organics | 408820010 | 99+% extra pure |
| Hydrochloric acid | Acros Organics | 124620026 | 37% solution in water |
| Sulfuric acid | Boom B.V. | 760519081000 | 95-97% |
| Acetone-d6 | Acros Organics | 325320500 | 99.8 atom% D |
| Deuterium oxide | Sigma Aldrich | 151882-100G | 99.9 atom% D |
| Filters | Munktell | 400303185 | 185 mm diameter, 10 μm pore size |
| Magnetic stirring bars | VWR | 442-4525 | |
| Syringe filter | Sartorius | 17559-Q | 0.45 μm filter |
| Autosampler vial (2 mL) | Brown | 151123 | |
| Reduced volume inlet (0.3 mL) | Brown | 150820 | |
| Autosampler caps (11 mm) | Brown | 151216 | |
| Autosampler vial crimper | |||
| Oil bath | |||
| Syringes (1 mL) | Henke Sass Wolf | 4010-200V0 | |
| Heating block-4 positions | IKA | ||
| Micro tubes 2 ml | Sarstedt | 72691 | |
| Crimp seals-20 mm | Brown Chromatography Supplies | 151287 | with Silicone/PTFE septa |
| Equipment | |||
| Rotary Ball Mill | Fritsch | 06.2000.00 | Laboratory Planetary Mono Mill PULVERISETTE 6 |
| Hammer mill | Brabender | ||
| Micro Hammer mill | Brabender | ||
| Vacuum oven | Heraeus | Heraeus Vacutherm | |
| Reflux setup and other glassware | CBN Suppliers B.V. | Reflux condensor, Roundbottom flask, Beaker glass and funnels | |
| Rotary evaporator | IKA | ||
| 250 mL high pressure autoclave | Berghof | ||
| 1 L high pressure autoclave | Medimex | ||
| Ultrasonic bath | Emerson | type Branson 3210 | |
| NMR instrument | Bruker | Ascend 600 | |
| THF-GPC | Hewlett Packard | 1100 series | |
| Magnetic stirring plate | SalmenKipp | SK861492220263 | type x-1250 |
| Coffee grinder | Profi Cook | PC-KSW1021 | |
| Drilling machine | Solid | type TB 13 S | |
| GC-FID | Shimadzu | ||
| BUCHI Reveleris PREP purification system | Buchi | ||
| BUCHI C18 column | Buchi | 150 mm × 21.2 mm × 10 μm | |
| 20 ml microwave vials | ??? | ||
| Univapo 150 ECH rotational vacuum concentrator | UniEquip | ||
| Eppendorf minispin tabletop centrifuge | Eppendorf | ||
| SB2 rotator | Stuart | ||
| Vortex | Wilten | ||
| Processing Software | |||
| WinGPC Unichrom | |||
| MestReNova |
Referenzen
- Tuck, C. O., Pérez, E., Horváth, I. T., Sheldon, R. A., Poliakoff, M. Valorization of Biomass: Deriving More Value from Waste. Science. 337, 695-699 (2012).
- Ragauskas, A. J., et al. Lignin Valorization: Improving Lignin Processing in the Biorefinery. Science. 344, 709-719 (2014).
- Sun, Z., Fridrich, B., de Santi, A., Elangovan, S., Barta, K. Bright Side of Lignin Depolymerization: Toward New Platform Chemicals. Chemical Reviews. 118 (2), 614-678 (2018).
- Schutyser, W., Renders, T., Van den Bosch, S., Koelewijn, S. F., Beckham, G. T., Sels, B. F. Chemicals from lignin: an interplay of lignocellulose fractionation, depolymerization, and upgrading. Chemical Society Reviews. 47 (3), 852-908 (2018).
- Kärkäs, M. D., Matsuura, B. S., Monos, T. M., Magallanes, G., Stephenson, C. R. J. Transition-metal catalyzed valorization of lignin: the key to a sustainable carbon-neutral future. Organic & Biomolecular Chemistry. 14 (6), 1853-1914 (2016).
- Deuss, P. J., Barta, K. From models to lignin: Transition metal catalysis for selective bond cleavage reactions. Coordination Chemistry Review. 306, 510-532 (2016).
- Yokoyama, T. Revisiting the Mechanism of β-O-4 Bond Cleavage During Acidolysis of Lignin. Part 6: A Review. Journal of Wood Chemistry and Technology. 35 (1), 27-42 (2014).
- Sturgeon, M. R., et al. A Mechanistic Investigation of Acid-Catalyzed Cleavage of Aryl-Ether Linkages: Implications for Lignin Depolymerization in Acidic Environments. ACS Sustainable Chemistry and Engineering. 2 (3), 472-485 (2014).
- Deuss, P. J., Scott, M., Tran, F., Westwood, N. J., de Vries, J. G., Barta, K. Aromatic monomers by in situ conversion of reactive intermediates in the acid-catalyzed depolymerization of lignin. Journal of the American Chemical Society. 137 (23), 7456-7467 (2015).
- Jastrzebski, R., Constant, S., Lancefield, C. S., Westwood, N. J., Weckhuysen, B. M., Bruijnincx, P. C. A. Tandem Catalytic Depolymerization of Lignin by Water-Tolerant Lewis Acids and Rhodium Complexes. ChemSusChem. 9 (16), 2074-2079 (2016).
- Kaiho, A., Kogo, M., Sakai, R., Saito, K., Watanabe, T. In situ trapping of enol intermediates with alcohol during acid-catalysed de-polymerization of lignin in a nonpolar solvent. Green Chemistry. 17 (5), 2780-2783 (2015).
- Huang, X., Zhu, J., Korányi, T. I., Boot, D. B., Hensen, E. J. M. Effective Release of Lignin Fragments from Lignocellulose by Lewis Acid Metal Triflates in the Lignin-First Approach. ChemSusChem. 9 (23), 3262-3267 (2016).
- Kaiho, A., Mazzarella, D., Satake, M., Kogo, M., Sakai, R., Watanabe, T. Construction of di(trimethylolpropane) cross linkage and phenylnaphthalene structure coupled with selective β-O-4 bond cleavage for synthesizing lignin-based epoxy resins with controlled glass transition temperature. Green Chemistry. 18 (24), 6526-6535 (2016).
- Lahive, C. W., et al. Advanced model compounds for understanding acid-catalyzed lignin depolymerization: Identification of renewable aromatics and a lignin-derived solvent. Journal of the American Chemical Society. 138 (28), 8900-8911 (2016).
- Shuai, L., Saha, B. Towards high-yield lignin monomer production. Green Chemistry. 19 (16), 3752-3758 (2017).
- Rinaldi, R., et al. Paving the Way for Lignin Valorisation: Recent Advances in Bioengineering, Biorefining and Catalysis. Angewandte Chemie International Edition. 55 (29), 8167-8215 (2016).
- Schutyser, W., Renders, T., van den Bosch, S., Koelewijn, S. F., Beckham, G. T., Sels, B. F. Chemicals from lignin: an interplay of lignocellulose fractionation, depolymerization, and upgrading. Chemical Society Reviews. 47 (3), 852-908 (2018).
- Constant, S., et al. New insights into the structure and composition of technical lignins: a comparative characterization study. Green Chemistry. 18 (9), 2651-2665 (2016).
- Smit, A., Huijgen, W. Effective fractionation of lignocellulose in herbaceous biomass and hardwood using a mild acetone organosolv process. Green Chemistry. 19 (22), 5505-5514 (2017).
- Lancefield, C. S., Panovic, I., Deuss, P. J., Barta, K., Westwood, N. J. Pre-treatment of lignocellulosic feedstocks using biorenewable alcohols: towards complete biomass valorization. Green Chemistry. 19 (1), 202-214 (2017).
- Deuss, P. J., Lancefield, C. S., Narani, A., de Vries, J. G., Westwood, N. J., Barta, K. Phenolic acetals from lignins of varying compositions via iron (III) triflate catalysed depolymerization. Green Chemistry. 19 (12), 2774-2782 (2017).
- Bauer, S., Sorek, H., Mitchell, V. D., Ibáñez, A. B., Wemmber, D. E. Characterization of Miscanthus giganteus Lignin Isolated by Ethanol Organosolv Process under Reflux Condition. Journal of Agricultural and Food Chemistry. 60 (33), 8203-8212 (2012).
- Deuss, P. J., et al. Metal triflates for the production of aromatics from lignin. ChemSusChem. 9 (2), 2974-2981 (2016).
- Nicholson, D. J., Leavit, A. T., Francis, R. C. A three-stage Klason method for more accurate determinations of hardwood lignin content. Cellulose Chemistry and Technology. 48 (1-2), 53-59 (2014).
- Sun, Z., et al. Complete lignocellulose conversion with integrated catalyst recycling yielding valuable aromatics and fuels. Nature catalysis. 1, 82-92 (2018).
- Lancefield, C. S., Ojo, O. S., Tran, F., Westwood, N. J. Isolation of Functionalized Phenolic Monomers through Selective Oxidation and C-O Bond Cleavage of the β-O-4 Linkages in Lignin. Angewandte Chemie International Edition. 54 (1), 258-262 (2015).
- Rahimi, A., Ulbrich, A., Coon, J. J., Stahl, S. S. Formic-acid-induced depolymerization of oxidized lignin to aromatics. Nature. 515, 249-252 (2014).
- Bosque, I., Magallanes, G., Rigoulet, M., Kärkäs, M. D., Stephenson, C. R. J. Redox Catalysis Facilitates Lignin Depolymerization. ACS Central Science. 3 (6), 621-628 (2017).
- Sette, M., Wechselberger, R., Crestini, C. Elucidation of Lignin Structure by Quantitative 2D NMR. Chemistry - A European Journal. 17 (34), 9529-9535 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten