Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Echtzeit-Video-Projektion in einem MRI zur Charakterisierung der neuronalen Korrelate im Zusammenhang mit Spiegel-Therapie für Phantomschmerzen
In diesem Artikel
Zusammenfassung
Wir präsentieren einen Roman kombiniert Verhaltens- und Neuroimaging Protokoll mit Echtzeit-video-Projektion zur Charakterisierung der neuronalen Korrelate mit Spiegel-Therapie innerhalb der Magnet-Resonanz-Tomographie Scanner Umgebung im Bein verbunden amputierte Patienten mit Phantomschmerzen.
Zusammenfassung
Spiegel-Therapie (MT) ist als eine effektive rehabilitative Strategie zur Linderung der Schmerzsymptome in Amputierte mit Phantomschmerzen (PLP) vorgeschlagen worden. Jedoch zur Gründung der neuronalen Korrelate MT Therapie zugeordnet haben schon schwierig angesichts der Tatsache, dass es schwierig ist, die Therapie innerhalb einer Magnetresonanztomographie (MRT) Scanner-Umgebung effektiv verwalten. Um die funktionelle Organisation des kortikalen Regionen verbunden mit dieser rehabilitative Strategie zu charakterisieren, haben wir eine kombinierte Verhaltens- und funktionelle Neuroimaging-Protokoll entwickelt, die bei den Teilnehmern mit einer Beinamputation angewendet werden können. Dieser neuartige Ansatz ermöglicht es Teilnehmern MT innerhalb der MRI-Scanner-Umgebung zu unterziehen, indem Sie anzeigen in Echtzeit video-Bilder von einer Kamera erfasst. Die Bilder sind durch den Teilnehmer durch ein System von Spiegeln und einem Monitor, dass der Teilnehmer beim liegen auf dem Scannerglas sieht angesehen. Auf diese Weise können funktionelle Veränderungen im kortikalen Bereiche von Interesse (z. B. sensomotorischen Kortex) charakterisiert werden als Reaktion auf die direkte Anwendung des Mt.
Einleitung
PLP bezieht sich auf die Schmerzempfindung im Bereich entspricht das fehlende Glied postamputation1,2wahrgenommen. Dieser Zustand ist eine erhebliche chronische Gesundheitswesen Belastung und kann einen dramatischen Einfluss auf eine individuelle Lebensqualität3,4haben. Es wurde vermutet, dass Veränderungen in der Hirnstruktur und Funktion eine grundlegende Rolle in der Entwicklung und Neuropathophysiology von PLP5,6 spielen. Unbekannt bleiben jedoch die zugrunde liegende neuronale Korrelate wie Schmerzsymptome entwickeln und wie sie in Reaktion auf die Behandlung gelindert werden können. Dieser Mangel an Informationen ist vor allem aufgrund technischen Herausforderungen und Einschränkungen verbunden mit der Durchführung eines bestimmten therapeutischen Ansatzes innerhalb der Grenzen einer Neuroimaging-Umgebung wie MRI5,7,8 .
Ergebnisse aus einer Reihe von Studien führen die Entwicklung von PLP maladaptive neuroplastischen Reorganisation innerhalb der sensomotorischen Cortex, sowie in anderen Bereichen des Gehirns auftreten. Zum Beispiel hat sich gezeigt, dass nach der Amputation einer Extremität, es eine Verschiebung in der entsprechenden sensomotorischen kortikale Repräsentation gibt der angrenzenden Gebiete. Infolgedessen beginnen benachbarte Gebieten offenbar Invasion der Zonen, die verwendet, um den amputierten Gliedmaßen9,10entsprechen. Um Schmerzsymptome im Zusammenhang mit PLP zu lindern, können Behandlungen wie MT oder Bewegungsvorstellung effektiv9,11,12sein. Es wird vorgeschlagen, dass die Linderung von Symptomen vermeintlich durch die Kreuz-modalen Wiedereinsetzung in den vorigen afferenten Inputs, bereitgestellt durch die Beobachtung der Spiegel reflektiert Bilder von Nichtbetroffenen Glied12,13auftritt, 14,15,16,17. Durch diese Bilder können alle Teilnehmer in der Lage, die Reflexion der gegenüberliegenden Gliedmaßen anstelle des zu visualisieren, die amputiert worden, wodurch es eine Illusion, die beide Gliedmaßen bleiben. Die Illusion und immersive Effekte wurden zuvor von Diers Et Al. bei gesunden Probanden untersucht in denen ein Vergleich der funktionalen Aktivierung durch funktionelle MRT (fMRT) ausgewertet wurde, nach Durchlaufen einer Aufgabe entweder mit einem gemeinsamen Spiegelkasten oder virtual-Reality- 18. die neuronale Korrelate der Umkehrung der maladaptive neuroplastischen Veränderungen und die Linderung von Symptomen zugeordnet bleiben jedoch schlecht verstanden. Darüber hinaus bleibt der zugrunde liegenden Mechanismus der PLP ein Thema der Forschung, wie die deutliche zugrunde liegenden physiopathologic Veränderung hinter der Entwicklung von PLP noch unvollständig aufgeklärt ist, während umstrittene Ergebnisse ergab5wurden, 19. Wie bereits erwähnt, führen mehrere Autoren die Entwicklung des Schmerzes auf Deafferentation und kortikale Reorganisation der betroffenen Gehirn-Bereich (Bereich der Amputierten Gliedmaße)6,7,8; jedoch wurden gegenüber Ergebnisse beschrieben von Makin und Mitarbeitern, in denen das Vorhandensein von Schmerzen ist verbunden mit dem Erhalt der Gehirnstruktur und Schmerz ist eine Reduzierung der interregionalen funktionelle Verknüpfung19zugeschrieben. Im Hinblick auf diese umstrittene und gegenüber Erkenntnisse glauben wir, dass die neuartige Ansatz, der hier vorgestellten zusätzliche relevante Informationen zu der Studie von PLP bringt und es Wissenschaftlern ermöglicht, die Auswirkungen der MT in einer live-Umgebung mit dem Grad des Gehirns zu bewerten Aktivierung und vergleicht sie mit den Ebenen des Schmerzes in unsere vollständige Protokoll19bewertet.
Frühere Literatur zu diesem Thema hat gezeigt, dass MT eine der am besten geeigneten Behavioral Therapien für die Behandlung von PLP durch einfache Implementierung und niedrige Kosten12 ist. In der Tat haben frühere Studien dieser Technik Beweise für eine Umkehr der maladaptive Veränderungen innerhalb der primären sensomotorischen Cortex in Amputierte mit PLP8,20,21gezeigt. Obwohl MT vielleicht einer der günstigste und effektivste Ansatz zur Behandlung von PLP12,22,23,24, sind weitere Studien notwendig, um diese Effekte zu bestätigen, da einige Patienten nicht reagieren auf diese Art von Behandlung8 und es gibt ein Mangel an größeren randomisierten klinischen Studien, die Evidenz-basierten Ergebnisse25bieten.
Eine der Hypothesen, mit denen MT PLP reduzieren kann, bezieht sich auf die Tatsache, die das Spiegelbild des Körperteils nicht amputiert hilft zu reorganisieren und die Diskrepanz zwischen Propriozeption und visuelles Feedback26zu integrieren. Die zugrunde liegenden Mechanismen der MT konnte mit der Umkehrung der maladaptive Zuordnung von somatosensorischen8,27,28verknüpft werden.
Für MT sind Themen erforderlich, um mehrere motorischen und sensorischen mit ihrer intakten Gliedmaßen (z. B. Beugung und Streckung) Aufgaben unter Beachtung dieser Effekt in einem Spiegel befindet sich in der Mittellinie des Körpers des Teilnehmers, wodurch eine anschauliche und präzise Darstellung von Bewegung im Bereich der Amputierten Gliedmaße29.
An der Weiterentwicklung der wissenschaftlichen Verständnis der Pathophysiologie Aspekte unbedingt beteiligt PLP, besser den zugrunde liegenden neuroplastischen Veränderungen aufgrund von Amputationen von Gliedmaßen, sowie die Verbesserung der Schmerzsymptome, die bereitgestellten Mt charakterisieren In diesem Zusammenhang bildgebende Verfahren wie fMRT, entstanden als leistungsfähige Werkzeuge zu helfen, die pathophysiologische Mechanismen zugeordneten kortikalen Reorganisation zu erläutern und Hinweise zur Optimierung der Rehabilitation von Personen mit PLP in die klinischen Kontext30,31. Darüber hinaus gewährt die hohe räumliche Auflösung von fMRI (verglichen mit Elektroenzephalographie, zum Beispiel) ermöglicht eine genauere Zuordnung von Gehirn Antworten, z. B. Finger und Ziffer Darstellungen im sensomotorischen Kortex zusammen mit anderen Regionen der die Gehirn-32.
Bis heute bleibt der Neurophysiologie MT zugeordneten schwer wegen einem großen Teil auf die Herausforderungen der Durchführung des Verfahrens in der Scanner-Umgebung (d.h., es ist schwierig für eine individuelle Therapie durchzuführen, liegend im Scanner). Hier beschreiben wir eine Methode, die für eine individuelle, eigene Beinbewegung beobachten ermöglicht in Echtzeit während liegenden Rückenlage innerhalb der engen Grenzen des Scanners trug. Eine genaue Nachbildung der das lebendige und immersive Gefühl, ausgelöst durch die Therapie kann wiederhergestellt werden, mit einer Videokamera, die erfasst in Echtzeit Bilder von der beweglichen Bein und ein System von Spiegeln und ein Monitor, der direkt von der Studie Teilnehmer eingesehen werden kann.
Frühere Studien haben versucht, integrieren Techniken wie video-Aufzeichnung, virtual Reality und aufgezeichnete Animationen als Mittel, um die visuelle Reize zu präsentieren und zu umgehen diesen technischen Herausforderungen9,16,33 ,34. Jedoch haben diese Techniken in ihrer Wirksamkeit35,36,37,38,39beschränkt. Im Einzelfall eine aufgezeichnete Video zu verwenden, ist eine oft schlechte Synchronisation zwischen TeilnehmerInnen Bewegungen und die zur Verfügung gestellt durch das Video, sowie ein Mangel an Timing-Genauigkeit, führt zu einer schlechten realistischen Eindruck, dass die Person selbst Bein ist in Bewegung. Um dieses Gefühl der sensomotorischen eintauchen zu verbessern, haben andere Techniken, wie virtual Reality und digitalisierten Animationen versucht worden. Jedoch nicht gelungen, visuell überzeugende Empfindungen durch eine niedrige Bildauflösung, eine eingeschränkte Sichtfeld, unrealistisch oder gestörten menschenähnliche Bewegungen und Präsenz der Bewegung Verzögerung zu erzeugen (z. B. desynchronization der Bewegung). Darüber hinaus verhindert der Mangel an eine präzise Modellierung kombiniert mit den Armen Kontrolle über andere Funktionen, wie die Auswirkungen der Schwerkraft, Reibung und Dynamik die Wahrnehmung eines lebendigen und immersive Atmosphäre40. Für Amputierte, es lohnt sich deshalb zu Strategien, um sicherzustellen, dass Themen uns die kognitive Aufgabe (Beobachtung beschäftigen) und auf die Illusion von immersiven amputiert limb Bewegung. Zu guter Letzt die erforderlichen Ressourcen für die Entwicklung und Umsetzung dieser komplexen Strategien können sehr zeitaufwändig sein und/oder kostenintensiv.
Wir beschreiben einen neuen Ansatz, den wir glauben, eine realistische und lebendige Gefühl der Immersion erstellt, wobei die Teilnehmer eine live und in Echtzeit Video ein projiziertes Bild der eigenen Gliedmaßen sehen können, während sie eine Sitzung der MT31durchführen. Dieser Ansatz wird durchgeführt, während der einzelne in der Scanner-Bohrung liegt und ohne hohe Kosten oder umfangreiche technische Entwicklung ist.
Dieses Protokoll ist Bestandteil einer National Institute of Health (NIH) Research Project Grant (RO1)-geförderten klinischen Studie, die die Wirkung der Kombination einer neuromodulatorische Technik, nämlich die transkranielle Gleichstrom Stimulation (tDCS), wertet mit einer Verhaltenstherapie (Spiegel-Therapie) um Phantomschmerzen31zu entlasten. Wir bewerten Änderungen in der visuellen analog-Skala (VAS) für Schmerzen an der Basislinie, vor, und nach jeder Sitzung eingreifen. fMRI dient als neurophysiologische Werkzeug um strukturelle Veränderungen in der Funktion des Gehirns und ihre Korrelation mit der Entlastung der PLP bewerten. Daher ergibt sich eine erste fMRT um eine Grundlinie Karte die strukturelle Organisation des Gehirns des Teilnehmers, die entweder zeigen wird, dass es kortikale Reorganisation maladaptive5,6,8 , 11 , 13 , 14 , 18 , 28 oder nicht gibt es19; auf die gleiche Weise kann die Wissenschaftler beobachten welche Bereiche zu Studienbeginn mit der Aufgabe der MT aktiviert werden, um die Bereiche Aktivierung als Reaktion auf die MT zu verstehen; zu guter Letzt ist es möglich, eine zweite fMRI Postintervention zu sehen, ob Änderungen (Modulation) in die kortikale Reorganisation nach der kombinierten Therapie mit tDCS und MT generiert wurden und zu analysieren, wenn diese Änderungen sind korreliert oder in mit den Grad Verbindung der Schmerz Veränderung. Daher dieses Protokoll ermöglicht es Wissenschaftlern, Umstrukturierung Änderungen bei Patienten mit PLPs während MT zu bewerten und auch hilft ihnen zu verstehen, wenn diese Veränderungen im fMRT Änderungen im PLP, daher zusätzliche Angaben auf zugeordnet sind Wie wirkt sich die MT strukturelle und funktionelle Aktivität des Gehirns, Phantomschmerzen zu ändern.
Protokoll
1. Vorbereitung des Themas
- Vor der Teilnahme haben die Teilnehmer eine Einverständniserklärung abzuschließen und eine MRT-Sicherheit screening-Bewertung, Letzteres durchgeführte Neuroimaging-Techniker bei der Scanstraße, um sicherzustellen, dass der Teilnehmer keinen bekannten Gegenanzeigen gescannt (z.B. Metall in ihrem Körper, eine Geschichte von Klaustrophobie oder Schwangerschaft).
- Geben Sie die Teilnehmer mit detaillierten Anweisungen in Bezug auf die Versuchsdurchführung.
- Haben Sie den Betreff ein Lehr aufgezeichneten Audio um sicherzustellen, dass sie in der Lage zu verstehen und befolgen die Anweisungen während der Messung zu hören.
- Führen Sie eine Praxis führen in einem mock-Scanner, der Einarbeitung der Aufgabenanweisungen innerhalb der Scanner-Umgebung zu erleichtern.
Hinweis: Der mock Scanner ist in jeder Hinsicht an den realen Daten erfasst MRI-Scanner, aber ohne die aktive Magnet ähnlich. - Geben Sie klare Anweisungen an die Teilnehmer zu vermeiden alle Bewegungen der Rest- und phantom Extremität Kontraktionen der Muskulatur stumpf zu vermeiden, die das Gehirn-Signal stören können.
2. Vorbereitung des Experiments
Hinweis: Das experimentelle Protokoll ist ähnlich wie zuvor für die Zwecke der Untersuchung die neuronalen Korrelate, verbunden mit den mentalen Bildern der Bewegung der oberen Gliedmaßen beschrieben wurde. Hier haben wir das Konzept für die Bewegung der unteren Gliedmaßen angepasst. Insbesondere bestehen die Verhaltensstörungen Aufgaben aus folgenden Teilen.
- Bitten Sie vor Betreten des Zimmers Scanner die Teilnehmer ihrer Prothese und keine Metallgegenstände entfernen.
- Haben die MRI-Techniker stellen sicher, dass der Teilnehmer hat kein Metall an ihrem Körper, die in Gefahr bringen könnte.
- Transport der Teilnehmer in den MRT-Raum in einem Rollstuhl MRT-kompatibel; Danach bitten Sie die Teilnehmer, sich auf das MRI-Scanner-Bett zu übertragen.
- Bequem Platz für MT einteilig, MRI-kompatible, horizontale Spiegel (10.000 x 255 x 3 mm) mit einem dreieckigen Stand zwischen den Beinen des Teilnehmers während sie auf dem Scannerglas Rückenlage liegen unterstützt. Verwenden Sie Sandsäcke, um Stabilität und eine bessere Positionierung des Spiegels zu ermöglichen. Bringen Sie den Spiegel-Standfuß mit einem verstellbaren Arm, so dass es im Einklang mit dem Thema Höhe positioniert und Positionierung sein kann, ohne Kontakt mit irgendeinem Teil des Körpers ( Abbildung 1).
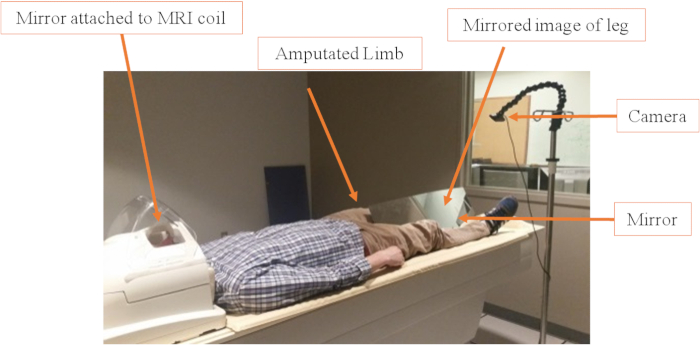
Abbildung 1 : Video-Kamera und Spiegel einrichten Der Spiegel befindet sich zwischen die Beine in einem Winkel von etwa 45°, je nach Höhe des Teilnehmers und Amputation. Das Ziel ist es, stumpfes zu decken und für die Videosysteme unsichtbar zu machen. Sandsäcke werden verwendet, um den Spiegel in der richtigen Position zu halten. Die Kamerapositionierung ist auch anpassbar und kann leicht mit dem Stativ oder anpassungsfähige Hock (ändert sich der Winkel der Kamera) geändert werden. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Montieren Sie für das visuelle Feedback eine MRI-kompatiblen Digitalkamera auf einem verstellbaren Stativ Stand in der Nähe der intakten Bein des Teilnehmers ( Abbildung 1).
Hinweis: Die verwendete Kamera ist in der Tabelle der Werkstoffe und kostet ca. 217 USD aufgeführt. Die Kamera erfasst Bilder in 1.080 Pixel Bildauflösung. Da die Kamera selbst nicht platziert wurde innen des MRT langweilen, gibt es keine Notwendigkeit teurer MRI-kompatible Systeme. Die Kamera ist eine MRI-Safe Infusionsständer über einen Schwanenhals modulare Schlauch Positionierung Änderungen ermöglichen beigefügt. - Befestigen Sie die Kamera auf einem Stativ, so dass die entsprechende Anpassung der Betrachtungswinkel und Sichtfeld.
- Setzen Sie einen zweiten Spiegel auf die MRT Kopf Spule, so dass der Teilnehmers an das Bild auf dem Monitor direkt während liegen vollständig innerhalb des Scanners ( Abbildung 2) trug.
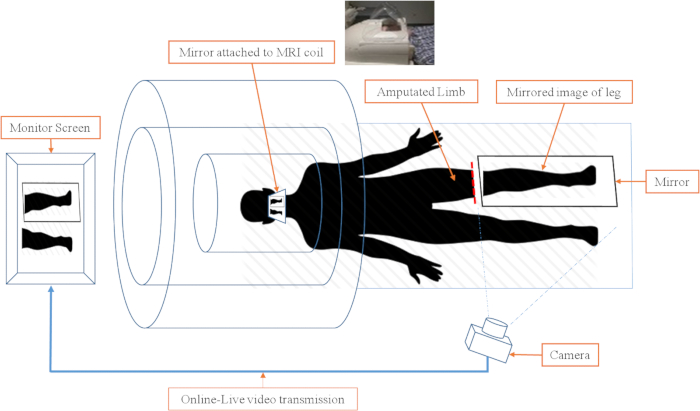
Abbildung 2 : Schematische Videokamera und Bildprojektion in der Scanner-Umgebung. Die Echtzeit-video-Projektion der Spiegel-Therapie-System besteht aus drei Subsystemen. (1) Kamera und Monitor-Subsystem. Das Video wird an den Monitor übertragen, so dass das Thema der Bein- und Spiegel Beinbewegungen in Echtzeit beobachten kann. (2) der Leiter Spule mit dem Spiegel befestigt. Der Spiegel in der Kopf Spule erlaubt die Teilnehmer auf den Monitor zu sehen, ohne den Kopf zu bewegen. Der Spiegel ist in einem 45°-Winkel auf Augenhöhe. (3) den Spiegel und Sandsäcke. Die MRI-kompatiblen Spiegel ist sorgfältig platziert, zwischen den Beinen und stumpf in einer Weise, dass es stumpf deckt und das beste ermöglicht Bild angezeigt wird. Bitte klicken Sie hier für eine größere Version dieser Figur.
- Richten Sie die Echtzeit-Videobild-Übertragung gesendet werden, durch ein computergesteuertes System und Projekt, die es auf einen Monitor auf der Rückseite des Scanners gelegt (in der Nähe des Kopfes des Teilnehmers) trug.
Hinweis: Es gibt keine wahrnehmbare Zeitverzögerung zwischen der Projektion und der erfassten tatsächlichen Bewegung. Die tatsächliche Bewegung und das visuelle Feedback getrennt von weniger als einer Sekunde in das Echtzeit-Gefühl nicht stört, vom Teilnehmer angegebene.
3. Scannen und Datenerhebung
- FMRT-Daten mit einem 3 T-Scanner mit einer 8-Kanal phased Array Kopf Spule zu erwerben.
- Image-Sequenzen, die eine hochauflösende T1-gewichteten strukturelle Abbildung enthalten erhalten (TE: 3,1 ms, TR: 6,8 ms, Flipwinkel: 9°, 1 mm isotrope Voxel Größe) (anatomische Scan), und Blut-Sauerstoff-Niveau-abhängigen (BOLD) fMRT Signal-Messungen mit einem Protokoll basierend auf Multizeilen Farbverlauf (schnell-Feld) Echo planar Imaging (EPI) und standard-Parameter (TE: 28 ms, TR: 2 s, Flipwinkel: 90°, isotrope 3 mm Voxel Größe, axial ausgerichtet und deckt das ganze Gehirn).
Hinweis: Der gesamte Scanvorgang dauert ca. 30 min. Dazu gehören eine anfängliche 4 min strukturelle (anatomischen) Scan und vier Aufgabe (funktionale) übernahmen dauert 6 Minuten. Für jede Aufgabe (funktionelle Erwerb) soll der Patient den Fuß mit einer Geschwindigkeit von 1 Tippen Sie auf tippen Sie auf jede Sekunde. - Während der Scans haben Sie die Teilnehmer Klang-Isolierung MRI kompatibel (z. B. Westone) während der Scan Sitzung der Ermittler akustische Befehle hören Kopfhörer.
- Während der Patient im Scanner liegt, spielen Sie die auditive, so dass die Teilnehmer eine Reihe von auditive Signale für die bestimmten Verhaltens Aufgabe hört.
- Verwenden Sie die folgenden Befehle: 1) "Bein" für die Bewegung von der amputierten Bein (siehe Hinweis nach Schritt 3.11); (2) "Spiegel" für die Bewegung des intakten Beins beim Betrachten einer Echtzeit-video-Aufzeichnung (so beobachten die Bewegung der Beine in der Position des amputierten Bein mit dem Spiegel); (3) "Rest", in dem der Teilnehmer hält jeder Beinbewegung und liegt bewegungslos mit ihren Augen, geschlossen. Darüber hinaus haben die Ermittler sagt "start" und "beenden", um den Anfang und das Ende des experimentellen Laufs bzw. bedeuten ( Abbildung 3).
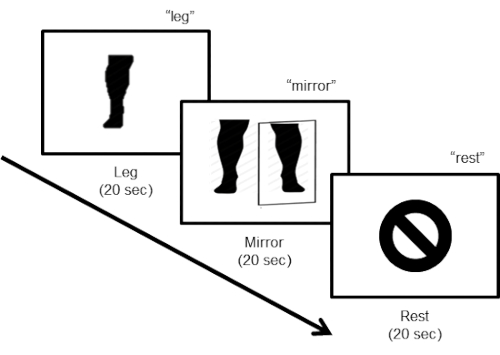
Abbildung 3 : Task-Design. Die Aufgabe besteht aus drei Schritten. Während des ersten Schritts "Bein", das Thema wird angewiesen, dem Bein (beugen, Fuß) mit einer Geschwindigkeit von etwa einer Bewegung verschieben alle 2 s (10 Bewegungen in 20 s), mit geschlossenen Augen. Für den zweiten Schritt der "Spiegel", der Teilnehmer muss das Bein in Bewegung bleiben (10 Bewegungen in 20 s) beim Betrachten der Videomonitor anzeigen Online-Echtzeit-Spiegelbild der Beine. Im letzte Schritt wird das Thema Ruhelagerung angewiesen.
- Haben Sie die Teilnehmer eine Bewegung mit der nonamputated Unterschenkel mit geschlossenen Augen (d. h. wiederholte plantar Flexion und dorsal Flexion des Fußes in einem Tempo von etwa einem Tap pro 2-3 s) durchführen.
- Haben die Teilnehmer die gleichen Beinbewegung auszuführen, aber jetzt der Teilnehmer beobachtet ein Spiegelbild von seinem Bein bewegen an die Stelle der Amputierten Beins mit Echtzeit-video-Capture der Bewegung des Beines intakt.
- Haben Sie die Teilnehmer eine Rest-Bedingung durchzuführen, in der er/Sie immer noch mit keine Bewegung der Beine legt.
Hinweis: Jede Bedingung beträgt 20 s (d. h. einen experimentellen Block = 60 s) eine Zeitlang Lauflänge von 6 min (sechs Wiederholungen des experimentellen Laufs pro Block). - Sammeln Sie Daten in einer einzigen Sitzung für jeden Teilnehmer.
- Weisen Sie den Prüfer zu beachten unerwünschten Bewegungen und zwischen den Läufen, anweisen die Teilnehmer das richtige Tempo und die Bewegungen zu halten.
- Stellen Sie sicher, dass nachdem die Verfahren durchgeführt werden, dem Prüfer die Daten in einem verschlüsselten Flash-Laufwerk überträgt und diese an einem sicheren Ort in der Anlage speichert.
Hinweis: In diesem Protokoll wird das Wort "Bein" anstelle des Wortes "Fuß" verwendet. Obwohl die Teilnehmer nur Bewegungen (aufgrund der Zwänge von der MRT-Gerät) zu Fuß machen, die meisten von ihnen haben einen größeren Teil der unteren Gliedmaßen amputiert werden und werden als beinamputierte, nicht Fuß bezeichnet.
4. Analyse
- Die funktionelle Neuroimaging Datenanalyse mit Standardtechniken30,41, mit Hilfe der Längsschnittanalyse Design (Grundlinie und überdecken) und Verarbeitung Strom in der FMRIB-Software-Bibliothek (FSL)-Software-Paket42 ,43.
- Durchführen Sie für jede funktionale Überprüfung 3D-Bewegung Korrektur mit der Ausrichtung der ersten Volumen, Hochpass-Filter zur zeitliche linearen Trends zu entfernen, und führen Sie eine Korrektur für Slice Erwerb und räumliche Glättung (Gaußsche Kernel, 5,0 mm volle Breite am halben Max. [FWHM]).
- Markieren Sie Mengen mit einer Bewegung über 0,9 mm in jede Richtung mit FSL Bewegung Ausreißer Erkennung Verarbeitung Stream und mathematisch "Schrubben Sie" sie aus der letzten Endes44.
Hinweis: Wenn mehr als 25 % der Bände für Beseitigung bestimmt sind, sollte die gesamte Übernahme aus dem gesamten Dataset ausgeschlossen werden.
- Markieren Sie Mengen mit einer Bewegung über 0,9 mm in jede Richtung mit FSL Bewegung Ausreißer Erkennung Verarbeitung Stream und mathematisch "Schrubben Sie" sie aus der letzten Endes44.
- Jedes der vorverarbeiteten funktionelle Bilder zu den hochauflösenden anatomischen coregister und bringen sie dann in den standard Talairach Raum.
- Passen Sie ein allgemeines lineares Modell (GLM) zu einem Voxel-Zeit-Kurs wo ist jede experimentelle Bedingung durch ein Boxcar Regressor modelliert, die mit Doppel-Gammakorrektur hämodynamische Funktion geglättet werden soll.
- Verwenden Sie die hochauflösende anatomische T1-gewichteten anatomischen Volumen zu konstruieren eine aufgeblasene kortikalen Flächennetz zu sehen die sulcal Aktivierung, projizieren individuellen Subjekt Karten für jeden Kontrast von Interesse zum Thema rekonstruiert ist Masche.
Hinweis: Die Projektionen sollten die wesentlichen Werte von GLM zeigen. Das standard Kriterium p < 0,001 für multiple Vergleiche mit einer Cluster-Größe Schwelle Anpassung korrigiert die statistische Signifikanz Schwellenwert festgesetzt.
- Durchführen Sie für jede funktionale Überprüfung 3D-Bewegung Korrektur mit der Ausrichtung der ersten Volumen, Hochpass-Filter zur zeitliche linearen Trends zu entfernen, und führen Sie eine Korrektur für Slice Erwerb und räumliche Glättung (Gaußsche Kernel, 5,0 mm volle Breite am halben Max. [FWHM]).
- Durchzuführen Sie eine Region of Interest (ROI) Analyse.
- Den primäre ROI im großen und ganzen mit FreeSurfers Desikan Atlas45 des primären sensomotorischen Kortex zu definieren, und dann für jedes Fach mithilfe der fachspezifischen funktionelle Aktivierungs während der Etappe vs. Rest Zustand an der Grundlinie-Scan verfeinern.
- Reflektieren Sie die raffinierte primäre ROI auf den homologen Bereich der gegenüberliegenden Hemisphäre (d.h. ipsilateral primäre sensomotorischen Darstellung der intakten unteren Gliedmaßen).
- Verwenden Sie die standard FreeSurfer anatomische Desikan Atlas45 um die gesamte (bilateral) okzipitalen Sehrinde für den sekundären ROI definieren.
Ergebnisse
Erzeugen das Gefühl verbunden mit MT mit Echtzeit-video-Projektion ist machbar. Teilnehmer haben subjektiv berichtet, dass das Videobild wahrgenommen lebensecht ist und die Sensation immersive ist.
Darüber hinaus sind die Muster der kortikale Aktivierung verbunden mit MT (d. h. Bewegung des Beines und Anzeigen des Projektionsbildes Spiegel) in der Scanner-Umgebung robust. In einer Pilotstudie wurden die kortikalen Antworten au...
Diskussion
Dieses Protokoll beschreibt eine neuartige, machbaren Verfahren, Ermittler, die neuronalen Korrelate zugeordnete MT bei Personen mit PLP genau zu charakterisieren.
Wie zuvor erwähnt, vorbei an Studien haben versucht, die neuronalen Korrelate zugeordnete MT Behandlung durch die Einbeziehung verschiedener Techniken wie z. B. video-Aufzeichnung, virtual Reality und aufgezeichnete Animationen9,33 untersuchen ,
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Studie wurde unterstützt durch einen NIH RO1 Grant (1R01HD082302).
Materialien
| Name | Company | Catalog Number | Comments |
| Scanner | Phillips | NA | 3 Tesla Philips Acheiva MRI scanner |
| Camera | Logitech | NA | HD Pro Webcam C910 |
| Monitor | Cambridge Research Systems | NA | 3D BOLD screen for MRI |
| Mirror | TAP Plastics | 99999 | Mirrored Acrylic Sheets (CuttoSize) Clear 1/8 (.118)" Thick, 10" Wide, 40" Long |
| Mirror stand | NA | Mirror stand was built by the co-investigators from a rectangular piece of wood | |
| Headphones | Westone Sensimetrics | PN 79245 | Replacement comply foam tips for universal-fit earphones. Canal size: Standard 6 pieces/ 3 pair MR compatible in ear headphones |
| MRI Scanner | Phillips | 3.0 T Philips Achieva System |
Referenzen
- Louis, E. D., York, G. K. Weir Mitchell’s observations on sensory localization and their influence on Jacksonian neurology. Neurology. 66 (8), 1241-1244 (2006).
- Weinstein, S. M. Phantom Limb Pain and Related Disorders. Neurologic Clinics. 16 (4), 919-935 (1998).
- Rudy, T. E., Lieber, S. J., Boston, J. R., Gourley, L. M., Baysal, E. Psychosocial Predictors of Physical Performance in Disabled Individuals With Chronic Pain. The Clinical Journal of Pain. 19 (1), 18-30 (2003).
- Whyte, A. S., Carroll, L. J. A preliminary examination of the relationship between employment, pain and disability in an amputee population. Disability and Rehabilitation. 24 (9), 462-470 (2002).
- Flor, H., Diers, M., Andoh, J. The neural basis of phantom limb pain. Trends in Cognitive Sciences. 17 (7), 307-308 (2013).
- Flor, H., Nikolajsen, L., Staehelin Jensen, T. Phantom limb pain: a case of maladaptive CNS plasticity?. Nature Reviews. Neuroscience. 7 (11), 873-881 (2006).
- Lotze, M., Flor, H., Grodd, W., Larbig, W., Birbaumer, N. Phantom movements and pain. An fMRI study in upper limb amputees. Brain: A Journal of Neurology. 124 (Pt 11), 2268-2277 (2001).
- Foell, J., Bekrater-Bodmann, R., Diers, M., Flor, H. Mirror therapy for phantom limb pain: Brain changes and the role of body representation. European Journal of Pain (United Kingdom). 18 (5), 729-739 (2014).
- Subedi, B., Grossberg, G. T. Phantom limb pain: Mechanisms and treatment approaches. Pain Research and Treatment. 2011, (2011).
- Elbert, T., et al. Extensive reorganization of the somatosensory cortex in adult humans after nervous system injury. NeuroReport. 5 (18), 2593-2597 (1994).
- Diers, M., Christmann, C., Koeppe, C., Ruf, M., Flor, H. Mirrored, imagined and executed movements differentially activate sensorimotor cortex in amputees with and without phantom limb. Pain. 149 (2), 296-304 (2010).
- Chan, B. L., et al. Mirror therapy for phantom limb pain. The New England Journal of Medicine. 357 (21), 2206-2207 (2007).
- Flor, H., Knost, B., Birbaumer, N. Processing of pain- and body-related verbal material in chronic pain patients: central and peripheral correlates. Pain. 73 (3), 413-421 (1997).
- Flor, H., Braun, C., Elbert, T., Birbaumer, N. Extensive reorganization of primary somatosensory cortex in chronic back pain patients. Neuroscience Letters. 224 (1), 5-8 (1997).
- Bolognini, N., Russo, C., Vallar, G. Crossmodal illusions in neurorehabilitation. Frontiers in Behavioral Neuroscience. 9 (August), (2015).
- Senna, I., Russo, C., Parise, C. V., Ferrario, I., Bolognini, N. Altered visual feedback modulates cortical excitability in a mirror-box-like paradigm. Experimental Brain Research. 233 (6), 1921-1929 (2015).
- Ambron, E., Miller, A., Kuchenbecker, K. J., Buxbaum, L. J., Coslett, H. B. Immersive low-cost virtual reality treatment for phantom limb pain: Evidence from two cases. Frontiers in Neurology. , (2018).
- Diers, M., et al. Illusion-related brain activations: A new virtual reality mirror box system for use during functional magnetic resonance imaging. Brain Research. 1594, 173-182 (2015).
- Makin, T. R., et al. Phantom pain is associated with preserved structure and function in the former hand area. Nature Communications. 4, 1570 (2013).
- Darnall, B. D., Li, H. Home-based self-delivered mirror therapy for phantom pain: A pilot study. Journal of Rehabilitation Medicine. 44 (3), 254-260 (2012).
- Rothgangel, A. S., Braun, S. M., Beurskens, A. J., Seitz, R. J., Wade, D. T. The clinical aspects of mirror therapy in rehabilitation: a systematic review of the literature. International Journal of Rehabilitation Research. 34 (1), 1-13 (2011).
- Griffin, S. C., et al. Trajectory of phantom limb pain relief using mirror therapy: Retrospective analysis of two studies. Scandinavian Journal of Pain. 15, 98 (2017).
- Tsao, J. W., Finn, S. B., Miller, M. E. Reversal of phantom pain and hand-to-face remapping after brachial plexus avulsion. Annals of Clinical and Translational Neurology. 3 (6), 463-464 (2016).
- Tung, M. L., et al. Observation of limb movements reduces phantom limb pain in bilateral amputees. Annals of Clinical and Translational Neurology. 1 (9), 633-638 (2014).
- Datta, R., Dhar, M. Mirror therapy: An adjunct to conventional pharmacotherapy in phantom limb pain. Journal of Anaesthesiology, Clinical Pharmacology. 31 (4), 575-578 (2015).
- Kim, S. Y., Kim, Y. Y. Mirror therapy for phantom limb pain. The Korean Journal of Pain. 25 (4), 272-274 (2012).
- Halligan, P. W., Zeman, A., Berger, A. Phantoms in the brain. Question the assumption that the adult brain is “hard wired“. BMJ (Clinical Research ed.). 319 (7210), 587-588 (1999).
- Flor, H., et al. Phantom-limb pain as a perceptual correlate of cortical reorganization following arm amputation. Nature. 375 (6531), 482-484 (1995).
- Genius, J., et al. Mirror Therapy:Practical Protocol for Stroke Rehabilitation. Pain Practice. 16 (4), 422-434 (2013).
- Forman, S. D., et al. Improved assessment of significant activation in functional magnetic resonance imaging (fMRI): use of a cluster-size threshold. Magnetic Resonance in Medicine. 33 (5), 636-647 (1995).
- Pinto, C. B., et al. Optimizing Rehabilitation for Phantom Limb Pain Using Mirror Therapy and Transcranial Direct Current Stimulation: A Randomized, Double-Blind Clinical Trial Study Protocol. JMIR Research Protocols. 5 (3), e138 (2016).
- Goense, J., Bohraus, Y., Logothetis, N. K. fMRI at High Spatial Resolution: Implications for BOLD-Models. Frontiers in Computational Neuroscience. 10, 66 (2016).
- Khor, W. S., et al. Augmented and virtual reality in surgery—the digital surgical environment: applications, limitations and legal pitfalls. Annals of Translational Medicine. 4 (23), 454 (2016).
- Nosek, M. A., Robinson-Whelen, S., Hughes, R. B., Nosek, T. M. An Internet-based virtual reality intervention for enhancing self-esteem in women with disabilities: Results of a feasibility study. Rehabilitation Psychology. 61 (4), 358-370 (2016).
- Henry, J. Virtual Reality in 2016: Its Power and Limitations. Medium. , (2016).
- Renner, R. S., Velichkovsky, B. M., Helmert, J. R. The perception of egocentric distances in virtual environments - A review. ACM Computing Surveys. 46 (2), 1-40 (2013).
- Huang, M. P., Alessi, N. E. Current limitations into the application of virtual reality to mental health research. Studies in Health Technology and Informatics. , (1998).
- Ballester, B. R., et al. Domiciliary VR-Based Therapy for Functional Recovery and Cortical Reorganization: Randomized Controlled Trial in Participants at the Chronic Stage Post Stroke. JMIR Serious Games. 5 (3), e15-e15 (2017).
- Bower, K. J., et al. Clinical feasibility of interactive motion-controlled games for stroke rehabilitation. Journal of Neuroengineering and Rehabilitation. 12, 63 (2015).
- Reed, S. K. Structural descriptions and the limitations of visual images. Memory & Cognition. 2 (2), 329-336 (1974).
- Boynton, G. M., Engel, S. A., Glover, G. H., Heeger, D. J. Linear Systems Analysis of Functional Magnetic Resonance Imaging in Human V1. The Journal of Neuroscience. 16 (13), 4207-4221 (1996).
- Jenkinson, M., Beckmann, C. F., Behrens, T. E. J., Woolrich, M. W., Smith, S. M. FSL. NeuroImage. 62 (2), 782-790 (2012).
- Smith, S. M., et al. Advances in functional and structural MR image analysis and implementation as FSL. NeuroImage. 23 (Supple), S208-S219 (2004).
- Siegel, J. S., et al. Statistical Improvements in Functional Magnetic Resonance Imaging Analyses Produced by Censoring High-Motion Data Points. Human Brain Mapping. 35 (5), 1981-1996 (2014).
- Desikan, R. S., et al. An automated labeling system for subdividing the human cerebral cortex on MRI scans into gyral based regions of interest. NeuroImage. 31 (3), 968-980 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten