Method Article
Visualisierung von Candida albicans im Murine Gastrointestinal Tract mit fluoreszierender In-Situ-Hybridisierung
In diesem Artikel
Zusammenfassung
Der Zweck dieses Protokolls ist es, Candida albicans Zellform und Lokalisation im Magen-Darm-Trakt des Säugetiers zu visualisieren.
Zusammenfassung
Candida albicans ist ein Pilzbestandteil der Darmmikrobiota beim Menschen und vielen anderen Säugetieren. Obwohl C. albicans keine Symptome bei den meisten kolonisierten Wirten verursacht, dient das Vorkommensbecken für Infektionskrankheiten, und das Vorhandensein von hohen Pilztittern im Darm ist mit entzündlichen Darmerkrankungen verbunden. Hier beschreiben wir eine Methode zur Visualisierung der Zellmorphologie und Lokalisation von C. albicans in einem Mausmodell der stabilen gastrointestinalen Kolonisation. Die Kolonisation wird mit einer Einzeldosis von C. albicans bei Tieren, die mit oralen Antibiotika behandelt wurden, festgestellt. Segmente des Darmgewebes werden so fixiert, dass die Architektur der luminalen Inhalte (Mikroorganismen und Schleim) sowie der Wirtsschleimhaut erhalten bleibt. Schließlich wird die fluoreszierende In-situ-Hybridisierung mit Sonden gegen Pilz-rRNA durchgeführt, um C. Albicans und Hyphen zu färben. Ein wesentlicher Vorteil dieses Protokolls ist, dass es die gleichzeitige Beobachtung der C. albicans Zellmorphologie und deren räumliche Assoziation mit Wirtsstrukturen während der gastrointestinalen Kolonisation ermöglicht.
Einleitung
Candida albicans ist ein Pilzkommensal sowie ein opportunistischer menschlicher Erreger. Diese Hefe fehlt eine definierte Umweltnische und stattdessen vermehrt sich innerhalb der Magen-Darm -(GI) Trakt, Haut, und Genitourinary Trakt von Menschen und anderen Säugetieren1. Während sich die frühe Forschung an C. albicans in erster Linie auf sein Virulenzpotenzial konzentrierte, deuten mehrere aktuelle Berichte darauf hin, dass die commensal vermehrende Organismen im Darm eine wichtige Rolle bei der normalen Gesundheit spielen können, einschließlich der Immunentwicklung der Host2,3,4. Um Untersuchungen des C. albicans-Commensalismus innerhalb des Säugetierdarms zu erleichtern, entwickelten wir ein Mausmodell der stabilen GI-Kolonisation und eine Fluoreszenz-in-situ-Hybridisierung (FISH)-basierte Methode zur Visualisierung von Pilzhefezellen und Hyphen innerhalb der Darmlumen.
Mit einigen Ausnahmen5zeigen im Labor gezüchtete Mäuse in der Regel Resistenzen gegen Pilzbesiedlung des Verdauungstraktes. Es wird angenommen, dass die Kolonisationsresistenz durch bestimmte Bakterienarten vermittelt wird; dies kann jedoch durch die Behandlung der Tiere mit Antibiotika6,7 oder die Verwendung einer chemisch definierten Ernährung überwunden werden, die vermutlich dieZusammensetzungder Bakterienarten 8,9verändert. In ähnlicher Weise wurde beim Menschen die Verwendung von Breitspektrum-Antibiotika mit C. albicans Überwucherung und Verbreitung10in Verbindung gebracht. Unser murines Kolonisationsmodell verwendet Breitspektrum-Antibiotika, um C. albicans Kolonisierung von immunkompetenten, konventionell aufgezogenen Mäusen zu etablieren. Penicillin und Streptomycin werden im Trinkwasser der Tiere eine Woche vor dem Gavage mit 108 koloniebildenden Einheiten (KBE) von C. albicans zur Verfügung gestellt. Solange das mit Antibiotika infundierteWasser fortgesetzt wird, werden sich C. Albicans durch den GI-Trakt ausbreiten und Fäkalientiter von 106x 108 KBE/g erreichen. Trotz der hohen Pilzbesiedlung bleiben die Tiere gesund und gewinnen mit der gleichen Geschwindigkeit an Gewicht wie nicht infizierte Kontrollen. Dieses Modell wurde erfolgreich verwendet, um mehrere C. albicans Commensalism Faktoren11,12zu überprüfen und zu charakterisieren.
Wie andere Mitglieder des Pilzreichs ist C. albicans in der Lage, enorme morphologische Plastizität13. Unter In-vitro-Bedingungen hat sich gezeigt, dass es zwischen mindestens sechs einzelligen Hefezelltypen sowie multizellulären Hyphen und Pseudohyphae übergeht. Der Hefe-zu-Hyphen-Übergang ist eines seiner am besten charakterisierten Virulenz-Attribute, und Hyphase und Pseudohyphae überwiegen in den meisten Säugetier-Krankheitsmodellen sowie in infizierten menschlichen Geweben. Um die Lokalisation und Zellmorphologie von C. albicans innerhalb des murinen Verdauungstraktes zu bestimmen, haben wir eine FISH-Technik zur Färbung von Hefen und Hyphen in festen histologischen Abschnitten entwickelt. Die Sonden bestehen aus fluoreszierend gekennzeichneten DNA-Oligonukleotiden, die zu pilzgaler 23S-ribosomaler RNA (rRNA) hybridisieren, die über das Pilzzytoplasma verteilt ist. Da Wirtsgewebe so fixiert sind, dass die dreidimensionale Architektur des Darms, einschließlich der Wirtsschleimhaut, des Verdauungsmaterials, der bakteriellen Mikrobiota und des Schleims im Darmlumen, erhalten bleibt, ermöglicht diese Technik die Lokalisierung von Pilzen Zellen in Bezug auf diese Landmarken, wenn sie befleckt werden. Die FISH-Technik vergleicht sich günstig mit traditionellen histologischen Flecken für Pilze, wie Periodische Säureschiff (PAS) oder Gomoris Methenamin-Silber (GMS), sowie kommerziell erhältliche Antimykotika, da diese Reagenzien nicht spezifisch für C. albicans. Darüber hinaus entfernen Standardfixative die Schleimschicht und stören andere Inhalte des Darmlumens14,15.
In diesem Artikel enthalten wir detaillierte Anweisungen für die Etablierung von hochgradigen C. albicans Kolonisation der Maus GI-Trakt, für die Zerlegung des Verdauungstraktes von eingeschläferten Tieren, für Gewebefixierung in einer Weise, die Luminal und zum Nachweis von C. albicans in Wirtgeweben mit FISH. Neben wilden Typen und mutierten Stämmen von C. albicans kann die Gavage-Technik verwendet werden, um andere Mikroorganismen zu liefern. Die Fixierungstechnik wäre nützlich für jede Studie, in der die Erhaltung des Darminhalts gewünscht ist. Das FISH-Verfahren kann innerhalb eines Tages abgeschlossen werden und kann verwendet werden, um mehrere Pilzarten mithilfe mehrerer, differenziell gekennzeichneter Sonden zu lokalisieren.
Protokoll
Die nachstehend beschriebenen Schritte wurden vom UCSF Institutional Animal Care and Use Committee (IACUC) genehmigt.
1. Gastrointestinale Kolonisation von Mäusen mit C. albicans mit Oral Gavage
- Bereitstellung von Wohnraum für 18-21 g männliche oder weibliche Mäuse (8 bis 10 Wochen alt), wie von der lokalen IACUC genehmigt. Verwenden Sie autoklavierte Nahrung und Wasser ab dem ersten Tag.
HINWEIS: Die Verwendung von sterilisierten Käfigen, Bettwäsche, Lebensmitteln und Wasser reduziert das Risiko einer Kontamination mit antibiotikaresistenten Umweltbakterien, die C. Albicans potenziell aus dem Darm verdrängen können. Darüber hinaus sollte je nach Versuchsfrage die individuelle Unterbringung von Tieren in Betracht gezogen werden, da Mäuse koprophage sind und Darminhalte unter den Tieren geteilt werden. - Ersetzen Sie am nächsten Tag das autoklavierte Trinkwasser durch autoklaviertes Wasser, das 5 % Glukose, 1.500 U/ml Penicillin G und 2 mg/ml Streptomycin enthält.
- Bereiten Sie im Voraus 200x Antibiotika-Lagerlösungen (Tabelle 1) vor, filtern Sie sie und frieren Sie bei -20 °C ein.
- Halten Sie Tiere auf Antibiotika für eine Woche.
- Bewerten Sie an den Tagen 3 und 6 nach dem Start von Antibiotika den Kot jedes Tieres auf Kontamination mit antibiotikaresistenten aeroben Bakterien. Halten Sie ein Tier mit einer Hand, legen Sie ein ungekapseltes Mikrofugerohr in die Nähe des Anus und sammeln Sie mindestens ein Fäkalienpellet.
- Setzen Sie jedes Fäkalpellet in 1 ml sterilem Wasser und Platte 100 l auf Luria-Brühe (LB), Hefeextrakt Pepton-Dextrose (YEPD) oder Hirnherzinfusion (BHI) plus Blut-Agar-Platten. Inkubieren Sie die Platten über Nacht in einem Standard-Inkubator (nicht anaerobe) bei 37 °C und bewerten Sie das Bakterienwachstum.
HINWEIS: Die Platten sollten ein minimales Wachstum aufweisen (0 bis 20 Kolonien). Wenn >20 Kolonien von Bakterien von Tieren mit Penicillin und Streptomycin behandelt werden, dann ist es unwahrscheinlich, dass high-level Besiedlung mit C. albicans etabliert werden und das Experiment abgebrochen werden sollte.
- Drei Tage vor dem Gavage Streifen C. albicans von gefrorenen Glycerinvorräten zu YEPD + 2% Agarplatten und inkubieren bei 30 °C für 2 Tage.
- Einen Tag vor der Gavage impfen Sie eine Kolonie jedes C. albicans-Stamms, der in 5 ml flüssiges YEPD getestet werden soll. Bei 30 °C über Nacht mit Schütteln bebrüten.
- Am Morgen der Gavage, verdünnen Sie die gesättigte Kultur von C. albicans auf eine optische Dichte bei 600 nm (OD600) von 0,1 in 100 ml YEPD auf 30 °C vorgewärmt. Schütteln Sie in einem Orbital-Shaker bei 200 Rpm bei 30 °C zwischen 4 h und 5 h, bis OD600 1 erreicht (Mitte-Log-Wachstum).
- Jede 100 ml Kultur auf zwei 50 ml konische Rohre und Zentrifuge bei 3.000 x g für 5 min bei Raumtemperatur (RT) übertragen.
HINWEIS: C. albicans propagiert sich relativ langsam bei RT. Wenn dieses Protokoll für eine andere Art angepasst wird, muss die Impfung möglicherweise auf Eis gehalten werden, um ein anhaltendes Wachstum zu verhindern. - Entsorgen Sie den Überstand, setzen Sie die pelletierten Zellen in 20 ml steriler Saline pro 50 ml Kultur wieder auf und bündeln Sie die doppelten resuspendierten Pellets in einzelne konische Rohre. Zentrifuge bei 3.000 x g für 5 min.
- Entsorgen Sie den Überstand und setzen Sie ihn in 20 ml steriler Saline wieder auf. Wirbel kurz und entfernen Sie 20 l für OD600 Messung. 1:50 in steriler normaler Saline verdünnen. Zentrifugieren Sie die verbleibenden resuspendierten Zellen bei 3.000 x g für 5 min.
- Entsorgen Sie den Überstand. Bei einer Inokulumgröße von 1 x 108 KBE setzen Sie die pelletierten Zellen auf ca. 5 x 108 KBE/ml in steriler normaler Salin auf der Grundlage der geschätzten Konzentration aus der OD600-Messung aus.
HINWEIS: In der Regel entspricht ein OD600 von 1 1 1 x 107 Hefezellen/ml. Dieser Wert kann je nach Spektralphotometer variieren und sollte überprüft werden. Wenn eine Änderung der Konzentration für Infektionen mit einem anderen Mikroorganismus gewünscht wird, planen Sie ein Inokulumvolumen von 10 L/g Maus, um Beschwerden für das Tier zu minimieren. - Überprüfen Sie die Konzentration des Inokulums, indem Sie eine Verdünnung von 1:1.000 mit einem Hämozytometer zählen. Passen Sie das Volumen der zellen, die mit Hilfe des Hämozytometers bestimmt werden, auf der Grundlage der mit dem Hämozytometer ermittelten Konzentration.
- Mit einer Fütterungsnadel(Abbildung 1A) wird jedes Tier mit dem berechneten Volumen eines gegebenen Inokulums gegavtieren. Siehe Schritte 1.13.1-1.13.8 für das Gavage-Verfahren.
HINWEIS: Die Ausbildung für Gavage sollte von einem erfahrenen Praktiker erhalten werden, und das Verfahren sollte im Voraus gemeistert werden. Ein erfolgreiches Verfahren für ein einzelnes Tier dauert in der Regel nicht länger als 1 min.- Befestigen Sie eine autoklavierte Tierfütterungsnadel an einer 1 ml Spritze und füllen Sie die Spritze mit einem Gavage-Volumen, wodurch Luftblasen entfernt werden, um eine ungenaue Dosis zu vermeiden. Auf eine sterile Oberfläche legen.
- Sichern Sie das Tier für gavage. Halten Sie das Tier mit der dominanten Hand an der Basis des Schwanzes und gleiten Sie die nicht dominante Hand auf den Rücken des Tieres zur lockeren Haut direkt hinter den Ohren.
- Mit dem Zeigefinger und Daumen der nicht dominanten Hand, sammeln Sie die lose Haut fest zusammen; dies ist die "Scruff". Nehmen Sie das Tier durch seine Schuppundung und Schleife kleinen Finger der gleichen (nicht dominanten) Hand um den Schwanz, um Das Tier gegen die Handfläche zu immobilisieren. Dehnen Sie den Kopf des Tieres sanft aus, so dass Kopf und Körper (und damit Hals und Speiseröhre) in einer geraden Linie sind.
HINWEIS: Der Versuch einer Gavage, während der Körper des Tieres gebogen oder verdreht ist, kann zu Komplikationen wie Ösophagenerationsperforation und Tod des Tieres führen. - Nehmen Sie die Spritze mit der dominanten Hand und halten Sie senkrecht zum Tier, mit der gekrümmten Nadel nach unten zeigen(Abbildung 1B). Mit der Kugel der Nadel, sanft eine innen Ecke des Mundes, sanft die Nadel entlang der Seite des Mundes auf die Rückseite des Halses zu bewegen, und schließlich bewegen Sie die Nadel in die Mitte.
HINWEIS: Die Einführung der Nadel auf einem seitlichen Weg hilft, Resistenzen von den Zähnen und der Zunge des Tieres zu vermeiden. - Sobald sich die Kugel der Nadel an der Rückseite des Rachens befindet, kippen Sie die Nadel nach oben, so dass sie parallel zur Körperlinie des Tieres ist (Abbildung 1C).
HINWEIS: An dieser Stelle zeigt das Tier einen Knebelreflex. Dies ist ein gutes Zeichen, das darauf hinweist, dass die Nadel richtig positioniert ist, und die Knebelbewegung hilft, die Nadel die Speiseröhre hinunter zu führen. Wenn es keinen Knebelreflex gibt, kann sich die Nadel eher in der Luftröhre als in der Speiseröhre befinden. Ziehen Sie die Nadel vorsichtig zurück und fahren Sie mit Schritt 1.13.1 fort. - Lassen Sie das Tier das Inokulum schlucken, bis nur wenige Millimeter sichtbar bleiben (Abbildung 1D). Fördern Sie die Nadel sanft.
HINWEIS: Wenn die Nadel nicht vorrückt, vermeiden Sie die Anwendung von Gewalt, die die Speiseröhre beschädigen kann. Manchmal erfordert das Vorrücken des letzten halben Zentimeters einen extra großen Gag des Tieres. Wenn die Nadel festzustecken scheint, ziehen Sie sie langsam zurück und versuchen Sie es erneut von Schritt 1.13.4. - Testen Sie, ob sich die Nadelkugel an der richtigen Position (Magen) befindet, indem Sie den Kolben sanft voranbringen. Wenn es keinen Widerstand gibt, setzen Sie die Lieferung des Inokulums fort. Sobald das Inokulum verabreicht wurde, ziehen Sie die Nadel langsam zurück.
- Ersetzen Sie das Tier in seinem Käfig und überwachen Sie das Tier weiterhin für 5 bis 10 min auf Anzeichen von mühsamer Atmung oder Not. Vergewissern Sie sich, dass das Tier kurz nach der Vermehrung wieder normal tätig wird.
- Wenn das gleiche Inoculum mit dem nächsten Tier verwendet wird, reinigen Sie die Nadel mit einem Alkoholtücher. Fahren Sie mit Schritt 1.13.1 fort. Wenn ein anderes Inokulum verwendet wird, verwenden Sie eine neue Nadel und fahren Sie mit Schritt 1.13.1 fort.
HINWEIS: Es ist wichtig, die Tiere am Tag nach der Vermehrung zu inspizieren. Tiere, die Anzeichen von Bedrängnis aufweisen (z. B. geknickte Körperhaltung, mühsame Atmung), sollten menschlich eingeschläfert werden, da sie wahrscheinlich einen Ösopharienbruch, eine Schädigung der Lunge oder eine andere innere Verletzung erlitten haben, von der eine Genesung unwahrscheinlich ist.
- Nach der Verdünnung der Tiere werden die Ozinluden des Inokulas zur Dosisüberprüfung verdünnt.
- Bereiten Sie 10-fache serielle Verdünnungen bis 1:105vor. Platte ein GavageVolumen der 1:105 Verdünnung auf eine 100 mm Platte von Sabouraud dextrose Agar.
- Inkubieren Sie die Platte für 2 Tage bei 30 °C. Zählen Sie KBE, um die Inokulumdosis zu bestätigen.
2. Herstellung von Magen-Darm-Geweben für die Histologie
HINWEIS: Dieser Abschnitt des Protokolls ist von Johansson und Hansson16adaptiert.
- Bereiten Sie 500 ml Methacarnlösung (60% Methanol, 30% Chloroform, 10% Eisessig) in einem großen Schraubverschluss-Kunststoffglas für je 2 sezierte Tiere vor.
ACHTUNG: Methanol und Chloroform sind beim Einatmen schädlich und sollten in einer chemischen Haube manipuliert werden. Eisessigsäure kann ätzend sein und sollte mit der richtigen persönlichen Schutzausrüstung behandelt werden. Methanol, Chloroform und Eisessig sollten als gefährliche Abfälle entsorgt werden. - Am experimentellen Endpunkt, euthanisieren Tiere human nach einem Protokoll von der lokalen IACUC genehmigt.
HINWEIS: Bei mit Antibiotika behandelten Tieren reicht die Besiedlung von C. albicans in der Regel von 106 KBE/g an Tag 5 bis zu 5 x 107 KBE/g pro Tag 25. - Sterilisieren Sie Sezierwerkzeuge mit 10% Bleichmittel und spülen Sie mit 70% Ethanol.
- Befestigen Sie jedes Tier an einer Sezierfläche, wobei die ventrale Seite nach oben gerichtet ist. Verwenden Sie 30 G Nadeln, um die Gliedmaßen an der Sezierfläche zu befestizieren (Abbildung 2A). Sprühen Sie das Tier mit 70% Ethanol, um das Fell zu reinigen und das Kleben an den Werkzeugen zu minimieren.
- Mit stumpfen Zangen, kneifen Sie einen Abschnitt der Bauchhaut mit nicht dominanter Hand. Mit einer Schere mit dominanter Hand, Incise die Haut und die darunter liegende Faszien in der Nähe der Basis des Beckens. Erweitern Sie den Schnitt in einer U-Form entlang jeder Seite der Peritonealhöhle bis zum Rippenkäfig. Heben Sie die Haut aus dem Weg.
- Mit einem Bleistift, voretikettieren Histologie-Kassetten für die GI-Segmente bewertet werden. Zum Beispiel, für jedes Tier, kennzeichnen Sie separate Kassetten als "Magen", "proximale Dünndarm", "mittlerer Dünndarm", "distalen Dünndarm", "Cecum" und "großer Darm". Legen Sie ein Schaumstoffpad auf die Unterseite jeder Kassette (Abbildung 2A).
ANMERKUNG: Abbildung 2B zeigt die vorgeschlagenen Abschnitte, die in Kassetten platziert werden sollen. - Mit stumpfen Zangen, vorsichtig extrahieren Sie das Cecum aus der Peritonealhöhle. Verwenden Sie eine Schere, um Verbindungen zwischen dem Cecum und dem kleinen und großen Darm zu trennen.
HINWEIS: Cecal Gewebe ist sehr empfindlich und leicht zu brechen. Achten Sie beim Manipulieren. - Legen Sie das gesamte Cecum in eine Histologiekassette, so dass es ungedreht ist und flach liegt (Abbildung 2C). Legen Sie ein zweites Schaumstoffpad oben und schließen Sie die Kassette. Legen Sie die Kassette in ein Schraubverschlussglas mit Methacarn.
- Verbrauchen Sie einen Abschnitt des Dickdarms, der 1-2 Fäkalienpellets enthält, mit einer Länge, die kleiner als die der Kassette ist.
- Legen Sie den Gewebeabschnitt in die Kassette und halten Sie das Gewebe flach und ungedreht. Overlay mit einem zweiten Schaumstoffpad und schließen Sie die Kassette. Legen Sie die Kassette in Methacarn.
- Für jeden Abschnitt des Dünndarms, der beprobt werden soll, wird ein Segment von 1 x 2 cm ausgeschnitten, das etwas Verdauungsmaterial enthält.
- Legen Sie das Segment in eine Histologiekassette, so dass das Gewebe flach und ungedreht bleibt. Overlay mit einem zweiten Schaumstoffpad und schließen Sie die Kassette. Legen Sie die Kassette in Methacarn.
- Für den Magen, trennen Sie die Verbindungen zur Speiseröhre und Dünndarm. Legen Sie in eine Kassette, halten Sie das Gewebe flach und ungedreht. Overlay mit einem zweiten Schaumstoffpad und schließen Sie die Kassette. Legen Sie die Kassette in Methacarn.
- Lassen Sie die Kassetten in Methacarn-Lösung bei RT für mindestens 3 h und weniger als 2 Wochen.
HINWEIS: Es gibt mehrere Punkte, in denen die festen GI-Segmente an einen kommerziellen Histologiedienst übertragen werden können. Diese Gewebe können schwierig zu abschnitten sein, ohne Unterbrechung des luminalen Inhalts, und optimale Ergebnisse werden von einem erfahrenen Techniker erhalten. Wenn der kommerzielle Dienst bereit ist, Vorarbeiten vor dem Einbetten des Gewebes in Paraffin durchzuführen, können die Kassetten in dieser Phase zusammen mit Anweisungen für Schritt 2.16 gesendet werden. - Beginnen Sie mit dem Schmelzen von genügend Paraffinwachs, um alle Gewebekassetten in einem großen Becher in einem vorgeheizten 70 °C Hybridisierungsofen zu bedecken.
- Entfernen Sie nach der Fixierung die Schaumstoffpads und geben Sie jeden intakten Gewebeabschnitt wieder in seine Kassette zurück. Waschen Sie das Gewebe mit den folgenden Lösungen bei RT mit Schütteln: zweimal für 35 min in 100% Methanol, zweimal für 25 min in 100% Ethanol, zweimal für 20 min in Xylol.
ACHTUNG: Xylol ist entzündlich, giftig und kann beim Einatmen Schäden verursachen. Verwenden Sie in einer chemischen Haube mit ordnungsgemäßem Schutz. Xylol über gefährliche Abfallverfahren entsorgen. - Die Kassetten trocken auf ein Papiertuch zerlegen und in vorgeschmolzenem Paraffinwachs für 2 h bei 70 °C in einem Hybridisierungsofen abstellen. Stellen Sie sicher, dass die Kassetten mit Paraffin gefüllt sind und keine Blasen mehr übrig bleiben.
HINWEIS: Dieser Schritt ermöglicht es dem Wachs, das GI-Segment zu infiltrieren und gewebe und den Inhalt zu stabilisieren. - Entfernen Sie die Kassetten aus Wachs, lassen Sie das überschüssige Wachs abtropfen und lagern Sie bei RT, bis sie in Wachsblöcke eingebettet sind. Entsorgen Sie das Wachs, das Spuren von Xylolen enthält, als gefährlichen Abfall.
HINWEIS: Das Noble Lab nutzt einen kommerziellen Histologie-Service zum Einbetten und Verschnitt enzierens von Geweben. Für die Standardvisualisierung von C. albicans Hefen und Hyphen werden 4 m Abschnitte verwendet. Zur Bewertung der Konnektivität von Hyphensegmenten, die sich in der Regel über mehrere Ebenen erstrecken, können 8 m Abschnitte verwendet werden. Je nach der Fähigkeit von FISH-Sonden, in die Probe einzudringen, kann es möglich sein, noch dickere Abschnitte zu verwenden.
3. Validierung neu entwickelter Sonden
HINWEIS: Das folgende Protokoll zur Validierung von C. albicans Sonden wurde von Swidsinski et al.17adaptiert.
- Streak C. albicans SC5314 und eng verwandte Vergleichsarten (z.B. Candida dubliniensis, Candida tropicalis) zu YEPD + 2% Agarplatten. 1-2 Tage bei 30 °C inkubieren.
- Impfen Sie 5 ml flüssiges YEPD-Medium mit einer einzigen Kolonie.
- Pipette 1 ml der suspendierten Zellen zu einem Mikrozentrifugenrohr und Zentrifuge bei 3.000 x g für 5 min. Überstand entsorgen.
- Setzen Sie das Pellet in 100 l Phosphat-gepufferter Saline (PBS) wieder auf.
- Pipette 5 x 10 L von resuspendierten Zellen und Punkt auf einem Glasschlitten. In einen größeren Kreis verteilen und trocknen lassen.
HINWEIS: Wenn Zellen nicht haften, verwenden Sie Poly-L-Lysin-beschichtete Dias. - Kreisen Sie den Zellfleck mit einem PAP-Stift ein und decken Sie mit 50 l 2,5% Paraformaldehyd (PFA) in PBS ab. Bei RT für 10 min inkubieren.
ACHTUNG: PFA ist entzündlich und kann bei Einatmen oder Hautkontakt zu gesundheitlichen Problemen führen. Mit PFA kontaminierte Gegenstände sollten als sonderstoffsgefährdender Abfall entsorgt werden. - Waschen Sie 3x mit PBS. Tippen Sie auf Flüssigkeit auf Daspapiertuch und decken Sie sie mit 100 l PBS ab. Wiederholen Sie dies zweimal. Letzte Wäsche entsorgen.
-
Bereiten Sie Folien für den mehrtägigen Speicher vor. Wenn Sie FISH am selben Tag ausführen, fahren Sie mit Schritt 3.9 ohne die Schritte in diesem Abschnitt fort.
HINWEIS: Es ist vorzuziehen, die Hybridisierung sofort durchzuführen, aber wenn es zu kurzer Zeit ist, folgen Sie Schritt 3.8 vor der Lagerung. Dias können mehrere Tage bei 4 °C gelagert werden.- Bedecken Sie den Spot mit 60% Ethanol. Inkubieren Sie bei RT für 3 min. Entsorgen Sie die Lösung.
- Bedecken Sie den Spot mit 80% Ethanol. Inkubieren Sie bei RT für 3 min. Entsorgen Sie die Lösung.
- Bedecken Sie den Spot mit 100% Ethanol. Inkubieren Sie bei RT für 3 min. Entsorgen Sie die Lösung. Fahren Sie mit Schritt 3.9 fort.
- Legen Sie die diabedeckenden Dias in einem Hybridisierungsofen bei 50 °C für 1 h. Wenn Schritt 3.8 befolgt wurde, lagern Sie die Dias bei 4 °C. Wenn dies nicht der Fall ist, fahren Sie mit Schritt 4.2 fort, um das Hybridisierungsprotokoll auszuführen.
4. FISH Sstaining in GI Tract Gewebe
- Entwachsung sparobin-eingebettete histologische Abschnitte.
- In einem Hybridisierungsofen ein mit Xylol auf 60 °C gefülltes Coplin-Glas vorwärmen.
- Legen Sie die Dias in das mit Xylol gefüllte Glas ein. Bei 60 °C für 10 min. Die Xylolwäsche entsorgen. Bewahren Sie die Dias im Glas auf und gießen Sie das Xylol in einen Abfallbehälter.
- Frisches RT-Xylol in das Glas geben und bei 60 °C 10 min inkubieren. Die zweite Xylolwäsche entsorgen.
- Füllen Sie das Glas mit 100% Ethanol und inkubieren bei RT für 5 min. Entfernen Sie die Dias aus dem Glas und Luft trocken.
- Stellen Sie den Hybridisierungsofen für Schritte in Abschnitt 4.2 auf 50 °C.
- Stain C. albicans mit der FISH-Sonde.
- Bereiten Sie 1 ml frische Hybridisierungslösung (20 mM Tris-HCl, pH 7,4, 0,9 M NaCl, 0,1% Natriumdodecylsulfat [SDS], 1% Formamid in RNase-freiem Wasser) vor. Siehe Tabelle 1 für Beispielberechnungen.
- Mischen Sie 50 l Hybridisierungslösung mit 1 l C. albicans Sonde (5' Cy3- ACAGGAGAAGCCGTGCC 3'; 50 g/ml in RNase-freiem Wasser) für eine Endsonde Menge von 0,5 g pro Schlitten.
HINWEIS: Viele im Labor gezüchtete Mäuse enthalten keine Pilze unter ihrer Mikrobiota. In diesem Fall ist es möglich, eine Pan-Pilz-Sonde (5' Cy3-CTCTCTCTTCACCCTATTC 3') zu ersetzen, die 23S rRNA der meisten Pilzarten erkennt, nicht nur C. albicans. Nach den Erfahrungen der Autoren liefert die Panmykogalsonde eine hellere Färbung als die C. albicans-spezifischeSonde. - Schützen Sie die Lösung vor Licht und Vorwärme bis 50 °C.
- Zeichnen Sie mit einem PAP-Stift einen Kreis um den Gewebeabschnitt aus Abschnitt 4.1.
- Pipette 50 l sondenhaltige Hybridisierungslösung auf das feste Gewebe und sanft über den Gewebebereich mit einer Pipettenspitze verteilen. Überlagern Sie die Flüssigkeit mit einem Hybridisierungs-Abdeckungsslip, der dafür sorgt, Dassblasen zu vermeiden sind.
- Versiegeln Sie in einer wasserdichten Hybridisierungskammer und inkubieren Sie die Abschnitte für 3 h bei 50 °C im Dunkeln in einem Hybridisierungsofen.
- In der Zwischenzeit 50 ml FISH-Waschlösung (20 mM Tris-HCl, pH 7,4, 0,9 M NaCl in RNase-freiem Wasser) vorbereiten. Siehe Tabelle 1 für Beispielberechnungen.
- Die Waschlösung auf 50 °C in den Vorwarm bewegen.
- Nach 3 h die Waschlösung in ein Coplin-Glas geben. Entfernen Sie dann vorsichtig den Deckelrutsch mit Zangen von der Rutsche und legen Sie die Rutsche in die Waschlösung.
- Das Glas mit Aluminiumfolie bedecken und bei 50 °C 20 min bebrüten.
- Bereiten Sie während dieser Inkubation eine Mucin-Nuklei-Färbungslösung vor (20 ng/mL 4,6-Diamidino-2-Phenylindole [DAPI], 1,6 g/ml Fluorescein-Isothiocyanat [FITC]-Lectin in PBS). Siehe Tabelle 1 für Beispielberechnungen. Für Magen und Dickdarm verwenden Sie FITC-Ulex europaeus agglutinin 1 (UEA-1). Verwenden Sie für Dünndarm und Cecum eine Kombination aus FITC-UEA-1 und FITC-Weizenkeim Agglutinin (WGA).
HINWEIS: Lektine verschiedener Arten erkennen unterschiedliche Zuckermodifikationen von Glykoproteinen wie Mucin. Die hier empfohlenen Lektinkombinationen wurden empirisch für eine optimale Färbung des Schleims in verschiedenen GI-Fächern bestimmt. - Waschen Sie die Dias, indem Sie die FISH-Waschlösung ausgießen und das Glas mit RT PBS nachfüllen. Die PBS sofort abgießen und mit PBS auffüllen. Gießen Sie die PBS für insgesamt 2 Wärer.
- Wick weg die PBS mit einem empfindlichen Aufgabe Wischer Gewebe und kreisen Sie die Darmgewebe Abschnitt mit einem PAP-Stift. Legen Sie die Dias in einen undurchsichtigen Kunststoffbehälter und fügen Sie dem Gewebeabschnitt 50 L Mucin-Nuklei-Färbungslösung hinzu. Bedecken Sie den Behälter mit Aluminiumfolie, um vor Licht zu schützen. Bei 4 °C für 45 min inkubieren.
- Legen Sie die Dias in ein Coplin-Glas und waschen Sie sie schnell zweimal in PBS bei RT.
- Tippen Sie auf die überschüssige PBS auf einem Papiertuch und leiten Sie dann die letzten Tropfen PBS mit einem Gewebe ab.
- Legen Sie einen Tropfen Montagemedium auf jedem Abschnitt und überlagern Sie mit einem Glasdeckel, um Blasen zu verhindern. Lassen Sie das Montagemedium unter dem gesamten Deckschein verteilen. Zur sofortigen Bildgebung verankern Sie den Deckelrutsch mit Nagellack an den Ecken. Für die Langzeitlagerung, versiegeln Sie den Deckelrutsch mit Nagellack.
- Bildn istoren Sie die Dias mit einem Fluoreszenzmikroskop.
Ergebnisse
Nach den Anweisungen wird das Ergebnis dieser Technik eine fluoreszierende Kennzeichnung von Kernen im Wirtsepithel, Schleim und C. Albicans in abschnitten GI-Geweben sein. Wildtyp Candida albicans Zellen sollten entweder als runde, einzellige Hefezellen oder hochlängsige, manchmal verzweigte, multizelluläre Hyphen erscheinen (Zellzellteilungen werden im Hyphen nicht sichtbar sein). Mutanten von C. albicans können zusätzlich als kleinere, leicht längliche "graue" Hefen oder als größere, leicht längliche "GUT" (gastrointestinal-induzierter Übergang) oder "undurchsichtige" Hefen auftreten.
Abbildung 1 zeigt die Fütterungsnadel, die für die Oral-Gavage verwendet wird, sowie Schlüsselpositionen der Nadel während des Gavage-Verfahrens. Abbildung 2 enthält ein typisches Setup für die Organsektion und das Aussehen von GI-Segmenten der Maus.
Abbildung 3 zeigt die FISH-Färbung verschiedener C. albicans-Zelltypen nach der Vermehrung in vitro und innerhalb des Mausmodells. Abbildung 3A zeigt Fluoreszenz- und Phasenbilder von festen, permeabilisierten, in vitro vermehrten Hyphen. Hypha-Bildung wurde mit flüssigem Lees Medium18 mit 2% N-Acetylglucosamin, pH 6,8 bei 37 °C induziert. Abbildung 3B zeigt Fluoreszenz- und Phasenbilder von festen, permeabilisierten, in vitro vermehrten Hefezellen. Abbildung 3C,D zeigt feste, permeabilisierte, in vitro vermehrte GUT-Zellen bzw. undurchsichtige Zellen. GUT- und opake Zelltypen sind morphologisch nicht unterscheidbar, außer wenn sie durch Rasterelektronenmikroskopie visualisiert werden. Bitte beachten Sie, dass die FISCHfärbung von in vitro vermehrten Zellen suboptimal ist, wenn die Zellen nicht gut durchmeabilisiert sind. Ein Beispiel für schwache und diffuse Färbung ist in Abbildung 3Cdargestellt. Um optimale Ergebnisse zu erzielen, sollten die Bedingungen für die Zellfixierung und Permeabilisierung empirisch für jeden zu untersuchenden Zelltyp und jede zu untersuchende Art bestimmt werden. Glücklicherweise führt das empfohlene Protokoll zur Visualisierung von C. albicans in geschnittenen Geweben zu einer konsistenteren Permeabilisierung.
Abbildung 3E-G zeigt C. Albikane im Maus-Dickdarm, gefärbt mit der C. albicans-spezifischenSonde (Abbildung 3E) oder der Panfungalsonde (Abbildung 3F,G). C. albicans erscheint rot in diesen Bildern, Wirtszellenkerne sind blau, und die Schleimschicht ist grün. Sowohl runde Hefen als auch hochlänglich ierte Hyphen (weiße Pfeilspitzen) kommen im Dickdarm vor. Bitte beachten Sie, dass die Färbung mit der Panfungalsonde heller ist. Abbildung 3G zeigt eine Ume6-Mutation im selben Fach, gefärbt mit der Panfungalsonde. Ume6 kodiert einen Transkriptionsfaktor, der für die Hypha-Bildung unter In-vitro-Bedingungen erforderlich ist19 . Interessanterweise wird der Hefe-gesperrte Phänotyp, der von diesem Mutanten unter In-vitro-Bedingungen angezeigt wird, nicht innerhalb des Darms rekapituliert, was darauf hindeutet, dass ein redundanter Faktor innerhalb des Hosts aktiviert werden muss12. Abbildung 4 zeigt das Auftreten von wilden Typ C. Albicans in verschiedenen Segmenten des murinen GI-Traktes, einschließlich der Regionen, die unmittelbar an die Wirtsschleimhaut angrenzen, und zentraleren Regionen des Darmlumens.
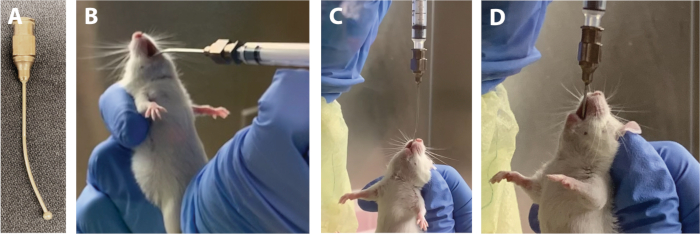
Abbildung 1: Wichtige Zuführnadelpositionen während der Gavage. (A) Fütterungsnadel. (B) Nadelkugel an der Seite der Zunge einstecken. (C) Fütterungsnadel in aufrechter Position mit Einsetzen in die Speiseröhre. (D) Fütterungsnadel in den Magen mit ein paar Millimetern sichtbar über der Nase eingesetzt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Beispiel-Sezierlayout. (A) Abschnittspad und Werkzeuge. (B) Verbrauchsteuer-Trakt. Proximale (Ösophagus) zu distalen (Anus) Abschnitten: I. Magen. II. Proximaler Dünndarm. III. Medialer Dünndarm. IV. Distaler Dünndarm. V. Cecum. VI. Dickdarm. Rosa gestrichelte Rahmenkästen zeigen das zu fixierende Gewebe an. (C) Gewebe, die in Kassetten angeordnet sind. Römische Ziffern sind die gleichen wie in Panel B. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
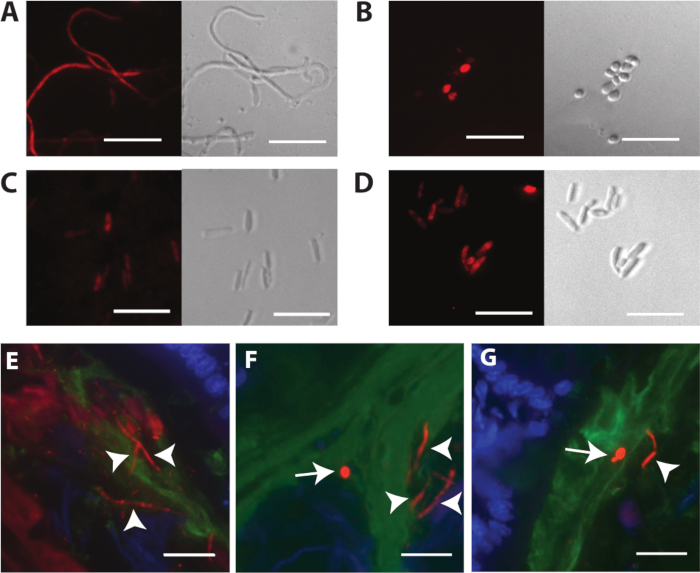
Abbildung 3: Repräsentative Bilder von FISH-befleckten C. albicans. (A) FISH of C. albicans hyphae grown in liquid Lee es media18 with 2% N-acetylglucosamine, pH 6.8. (B) FISH von C. Albicans runden Hefezellen, die auf YEPD angebaut werden + 2% Agarplatten. (C) FISH von C. albicans GUT-Zellen (ySN1045), die auf YEPD angebaut werden + 2% Agarplatten. (D) FISH von C. albicans opaken Zellen, die auf YEPD angebaut werden + 2% Agarplatten. (E) Wilde Typ C. Albikane (ySN250) im Dickdarm, mit der C. albicans-spezifischenSonde gefärbt. (F) Wilde Typ C. Albikane im Dickdarm, mit der Panfungalsonde gefärbt. (G) Ume6 Mutant (ySN1479) im Dickdarm, mit der Panfungalsonde gefärbt: rot ist C. albicans, blau ist Wirt epitheliale Kerne, und grün ist Mucin. Pfeilspitzen zeigen Hyphen an. Pfeile zeigen Hefe an. Maßstabsbalken = 20 m. Die Bilder F und G sind von Witchley et al.12adaptiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
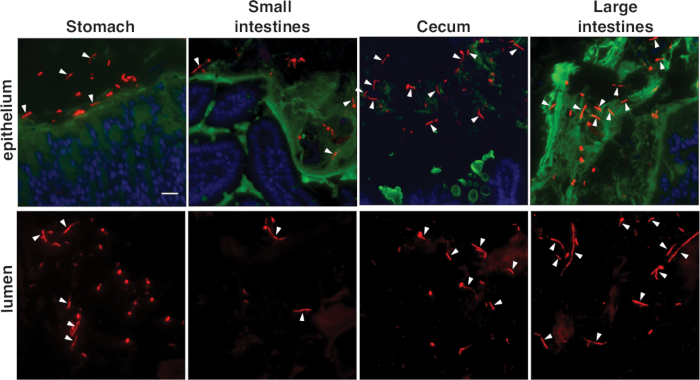
Abbildung 4: Aussehen von FISH-befleckten C. Albicans in verschiedenen Darmfächern. Wildtyp C. albicans wird in den angegebenen Segmenten des Maus-GI-Trakts angezeigt. In jedem Fach zeigen Bilder den Bereich neben der Wirtsschleimhaut und den zentralen Bereich des Darmlumens. Die Färbung wurde mit der Panfungalsonde durchgeführt. Skala bar = 20 'm. Bilder sind von Witchley et al.12adaptiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Antibiotika-Bestände (200x) | |||
| Penicillin G | 181 mg/ml | ||
| Streptomycin | 400 mg/L | ||
| Methacarn | |||
| vorrat | Endgültige Konzentration | Volumen | Einheiten |
| Methanol | 60% | 300 | ml |
| chloroform | 30% | 150 | ml |
| Eissäureessig | 10% | 50 | ml |
| Hybridisierungslösung | |||
| vorrat | Endgültige Konzentration | Volumen | Einheiten |
| 1 M Tris-HCl, pH 7,4 | 20 mM | 20 | Μl |
| 5 M NaCl | 0,9 M | 180 | Μl |
| 10% SDS | 0.10% | 10 | Μl |
| 100% Formamid | 1.00% | 10 | L (in kleinen Aliquots bei -20 °C zwischen den Verwendungen gehalten) |
| RNasefreies Wasser | 780 | Μl | |
| FISH Waschlösung | |||
| 1 M Tris-HCl, pH 7,4 | 20 mM | 1 | ml |
| 5 M NaCl | 0,9 M | 9 | ml |
| RNasefreies Wasser | 40 | ml | |
| Mucin-nuclei Färbelösung | |||
| DAPI, 10 g/ml | 20 ng/ml | 2 | Μl |
| Lektin, 40 g/ml | 1,6 g/ml | 40 | Μl |
| PBS, pH 7,4 | 958 | Μl | |
Tabelle 1: Typische Mengen und Konzentrationen von Lösungen, die in diesem Protokoll verwendet werden.
Diskussion
Die hier beschriebene Methode ermöglicht die Visualisierung von C. Albicans Hefen und Hyphen in den GI-Trakten von commensally kolonisierten Mäusen jeden Geschlechts oder Stammes. Die FISH-Sonde hybridisiert zu 23S rRNA, die über das Pilzzytoplasma verteilt ist. Unsere Methode wurde von einem zuvor berichteten Protokoll zur Visualisierung von Darmbakterien20angepasst. Da C. albicans seine Morphologie innerhalb des Hosts ändert, ist die Methode nützlich, um die Pilzzellform sowie die Lokalisierung zu überwachen. Zum Beispiel haben wir diese Methode verwendet, um die Hypothese zu widerlegen, dass Hefen im gesamten Verdauungstrakt vorherrschen, und Um Diskrepanzen zwischen den In-vivo- und In-vitro-Phänotypen bestimmter "filamentationsdefekter" Mutantenaufzudecken 12.
Für die C. albicans commensal Colonization gibt es mehrere Mausmodelle. Die Mikrobiota von Labormäusen und Menschen sind unterschiedlich und bei Mäusen ist der Einsatz von Antibiotika oder einer spezialisierten Ernährung erforderlich, um eine stabile Besiedlung zu etablieren. Die Behandlung mit Antibiotika verbessert auch die Besiedlung von C. albicans beim Menschen und ist ein wichtiger Risikofaktor für die disseminierte Krankheit10. Die in dieser Studie verwendeten Antibiotika sind relativ kostengünstig und führen zu zuverlässigen Abnahmen der bakteriellen Mikrobiota. Beachten Sie, dass Antibiotika verwendet werden, um die Belastung von antagonistischen Bakterienarten zu verringern, nicht um alle Bakterien von den Tieren zu beseitigen. Wenn Forscher C. albicans-Wirt-Wechselwirkungenin Abwesenheit von Bakterien untersuchen oder den Einsatz von Antibiotika oder einer speziellen Ernährung vermeiden wollen, können keimfreie Tiere durch konventionell aufgezogene Tiere ersetzt werden; gnotobiotische Mäuse weisen jedoch bestimmte immun- und anatomische Anomalien auf und sind daher möglicherweise nicht für alle Zwecke geeignet.
Mehrere Schritte sind wichtig für eine erfolgreiche FISH-Färbung: Die empfohlene Fixierungsmethode ist entscheidend, um die strukturelle Integrität von GI-Geweben zu erhalten, insbesondere den zerbrechlichen Inhalt des Darmlumens, wie z. B. die Schleimschicht und die dreidimensionale Organisation von Pilzen und Bakterien16. Bitte beachten Sie, dass viele häufig verwendete Fixierungslösungen, die Wasser enthalten, die Luminalarchitektur stark schädigen. Die in diesem Protokoll empfohlenen Fixierungs- und Lösungslösungen für Nachfixierungswashen enthalten kein Wasser, und es ist wichtig, eine Kontamination mit Wasser zu vermeiden. Ein weiterer kritischer Schritt ist der Hybridisierungsschritt, bei dem es wichtig ist, die Verdunstung der Hybridisierungslösung während der Inkubation von Dias im Hybridisierungsofen zu vermeiden. Wir empfehlen, die Dias in einen wasserdichten Behälter zu legen, um dieses Problem zu vermeiden. Alternativ kann man wasserdichte Hybridisierungskammern verwenden, wie sie ursprünglich für die Hybridisierung von Mikroarrays verwendet wurden.
Eine C. albicans-spezifische FISH-Sonde wird in diesem Protokollbeschrieben. Da jedoch viele im Labor gezüchtete Mäuse keine C. Albicans oder andere Pilze als Teil ihrer natürlichen Darmmikrobiota enthalten, kann eine Panfungalsonde c. albicans bei experimentell besiedelten Tieren spezifisch färben. Die Substitution einer Panfungalsonde kann aufgrund ihrer überlegenen Hybridisierungseigenschaften und eines höheren Signal-Rausch-Verhältnisses wünschenswert sein. Wenn die Panmykogalsonde als pseudospezifische Sonde für C. albicansverwendet wird, ist es wichtig, einen Mangel an Färbung bei nicht infizierten Tieren zu dokumentieren (d.h. mit Antibiotika behandelt, aber nicht Mit C. albicans). Die Färbung eines nicht kolonisierten Kontrolltiers ist auch nützlich, um Hintergrundfärbungen zu bewerten, die sich aus der Einhaltung von FISH-Sonden an Lebensmittelpartikeln ergeben können. Insgesamt bietet die Verwendung von FISH-Sonden eine verbesserte Spezifität gegenüber den meisten anderen Methoden der Färbung von Pilzen, wie Calcofluor weiß (die Chitin färbt, eine Zellwandkomponente, die zwischen Zelltypen variieren kann), GMS oder kommerziell erhältliche antimykotische Antikörper. Darüber hinaus ermöglicht die FISCHfärbung die Costainierung mehrerer Organismen mit differenziell gekennzeichneten FISH-Sonden zu artspezifischen rRNAs.
Eine Einschränkung dieser Technik ist, dass bestimmte C. albicans Hefezellentypen durch FISH sehr ähnlich erscheinen (z. B. die opaken und GUT-Zelltypen). Um zwischen diesen Zelltypen zu unterscheiden, wäre es sinnvoll, Hybridisierungssonden zu zelltypspezifischen Pilz-mRNAs zu entwickeln. Dennoch hat die FISH-Technik in ihrer aktuellen Form bereits überraschende Diskrepanzen zwischen dem In-vivo- und in-vitro-Verhalten von C. Albicans-Mutanten, die unter beiden Bedingungen12bewertet wurden, aufgedeckt, was auf komplexe Wechselwirkungen in der natürliche komonsale Umgebung, die durch bestehende In-vitro-Assays nicht ausreichend nachgeahmt werden. Weitere Studien mit verschiedenen C. Albicans Flecken in zusätzlichen wildEn Typ und mutierten Wirten werden wahrscheinlich zusätzliche Einblicke in Pilz-Wirt-Wechselwirkungen liefern. Insbesondere wird es lehrreich sein, C. albicans in Modellen von entzündlichen Darmerkrankungen zu profilieren, die mit hohen Titern von C. albicans beim Menschen verbunden sind21, und andere Modelle von C. albicans Überwucherung und Krankheit. Die FISH-Technik kann auch mit Immunhistochemie kombiniert werden, um bestimmte Wirtszellen zu färben. Insgesamt bietet die hier vorgestellte Methode ein relativ schnelles und zuverlässiges Mittel, um die Lokalisation und Morphologie von C. albicans innerhalb des Gi-Trakts der Säugetiere zu bestimmen.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren danken Carolina Tropini, Katharine Ng, Justin Sonnenburg und KC Huang für die Anleitung bei der Entwicklung der FISH-Technik. Teresa O'Meara gab hilfreiche Kommentare zum Manuskript, und Miriam Levy half bei der Fotografie. Diese Arbeit wurde durch Die NIH-Stipendien R01AI108992, R01DK113788 und einen Burroughs Welcome Award in der Pathogenese der Infektionskrankheit unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD | 309659 | can be substituted from any vendor |
| BHI blood agar | can be substituted from any vendor | ||
| C. albicans FISH probe | IDT DNA Technologies | custom order | |
| Chamber for hybridization incubation | watertight chamber meant to reduce evaporation | ||
| Chloroform | Sigma | C2432 | >=99.5% |
| DAPI | Roche | 10236276001 | can be substituted from any vendor |
| Delicate task wiper tissues | Kimberley-Clark | 34256CT | Kimwipes |
| D-glucose | Sigma | G7021-5KG | can be substituted from any vendor |
| Ethanol | Sigma | E7023 | molecular biology grade |
| Feeding needles | Cadence, Inc. | 7910 | metal; 20 X1-1/2" W/2-1/4; can be autoclaved to sterilize |
| FITC-UEA-1 | Sigma | L9006-1MG | other fluorophores available |
| FITC-WGA | Sigma | L4895-2MG | other fluorophores available |
| Foam pads | Fisher | 22038221 | Order foam pads that will fit within cassettes |
| Formamide | Sigma | 47671 | molecular biology grade |
| Glacial acetic acid | Macron Fine Chemicals | MK881746 | ACS reagent, >=99.5% |
| Glass Coplin jar | Fisher | 08-815 | hold up to 10 slides back to back |
| Histology cassettes | Simport | M512 | Deep cassettes so cecum is not squished |
| Hybridization coverslips | Sigma | GBL712222 | RNase-free |
| Hybridization oven | can be substituted from any vendor | ||
| LB | can be substituted from any vendor | ||
| Lee's media | prepared as described in Lee et al. 1975 | ||
| Methanol | Sigma | 179337 | ACS reagent, >=99.8% |
| Mice | Charles River Laboratories | 028 | adult BALB/c; 18-21 grams (8-10 weeks) |
| Paraformaldehyde | Fisher | 50-980-487 | 16% solution |
| Parrafin wax | Sigma | P3558-1KG | Paraplast for tissue embedding |
| PBS, pH 7.4 | UCSF Cell Culture Facility Media Production Unit | CCFAL003 | calcium, magnesium-free; can be substituted from any vendor |
| Penicillin G | Sigma | PENNA-100MU | |
| Sabouraud dextrose agar | can be substituted from any vendor | ||
| Saline | Baxter | 2F7123 | sterile, can be substituted from any vendor |
| Sodium chloride (NaCl) | Sigma | S3014 | can be substituted from any vendor; maintain RNase-free |
| Sodium dodecyl sulfate (SDS) | Sigma | L3771 | can be substituted from any vendor; maintain RNase-free |
| Streptomycin | Sigma | S9137-100G | |
| Super PAP pen | Life Technologies | 8899 | can be substituted from any vendor |
| Tris-HCl | Sigma | T3253 | can be substituted from any vendor; maintain RNase-free |
| Vectashield | Vector Laboratories | H-1000 | does not contain DAPI |
| Xylenes | Sigma | 214736 | reagent grade |
| YEPD | can be substituted from any vendor |
Referenzen
- Noble, S. M., Gianetti, B. A., Witchley, J. N. Candida Albicans Cell-Type Switching and Functional Plasticity in the Mammalian Host. Nature Reviews in Microbiology. 15 (2), 96-108 (2017).
- Bacher, P., et al. Human Anti-fungal Th17 Immunity and Pathology Rely on Cross-Reactivity against Candida albicans. Cell. 176 (6), 1340-1355 (2019).
- Shao, T. Y., et al. Commensal Candida albicans Positively Calibrates Systemic Th17 Immunological Responses. Cell Host and Microbe. 25 (3), 404-417 (2019).
- Jiang, T. T., et al. Commensal Fungi Recapitulate the Protective Benefits of Intestinal Bacteria. Cell Host and Microbe. 22 (6), 809-816 (2017).
- Iliev, I. D., et al. Interactions Between Commensal Fungi and the C-Type Lectin Receptor Dectin-1 Influence Colitis. Science. 336 (6086), 1314-1317 (2012).
- Fan, D., et al. Activation of HIF-1 alpha and LL-37 by Commensal Bacteria Inhibits Candida Albicans Colonization. Nature Medicine. 21 (7), 808-814 (2015).
- Koh, A. Y., Kohler, J. R., Coggshall, K. T., Van Rooijen, N., Pier, G. B. Mucosal Damage and Neutropenia Are Required for Candida Albicans Dissemination. PLoS Pathogens. 4 (2), e35(2008).
- Yamaguchi, N., et al. Gastric Colonization of Candida Albicans Differs in Mice Fed Commercial and Purified Diets. Journal of Nutrition. 135 (1), 109-115 (2005).
- Kadosh, D., et al. Effect of Antifungal Treatment in a Diet-Based Murine Model of Disseminated Candidiasis Acquired via the Gastrointestinal Tract. Antimicrobial Agents and Chemotherapy. 60 (11), 6703-6708 (2016).
- Perlroth, J., Choi, B., Spellberg, B. Nosocomial Fungal Infections: Epidemiology, Diagnosis, and Treatment. Medical Mycology. 45 (4), 321-346 (2007).
- Pande, K., Chen, C., Noble, S. M. Passage Through the Mammalian Gut Triggers a Phenotypic Switch That Promotes Candida Albicans Commensalism. Nature Genetics. 45 (9), 1088-1091 (2013).
- Witchley, J. N., et al. Candida Albicans Morphogenesis Programs Control the Balance between Gut Commensalism and Invasive Infection. Cell Host and Microbe. 25 (3), 432-443 (2019).
- Noble, S. M., Gianetti, B. A., Witchley, J. N. Candida Albicans Cell-Type Switching and Functional Plasticity in the Mammalian Host. Nature Reviews in Microbiology. 15 (2), 96-108 (2017).
- Balish, E., Filutowicz, H., Oberley, T. D. Correlates of Cell-Mediated Immunity in Candida Albicans-Colonized Gnotobiotic Mice. Infection and Immunity. 58 (1), 107-113 (1990).
- Guarner, J., Brandt, M. E. Histopathologic Diagnosis of Fungal Infections in the 21st Century. Clinical Microbiology Reviews. 24 (2), (2011).
- Johansson, M. E., Hansson, G. C. Preservation of Mucus in Histological Sections, Immunostaining of Mucins in Fixed Tissue, and Localization of Bacteria with FISH. Methods in Molecular Biology. 842, 229-235 (2012).
- Swidsinski, A., Weber, J., Loening-Baucke, V., Hale, L. P., Lochs, H. Spatial Organization and Composition of the Mucosal Flora in Patients with Inflammatory Bowel Disease. Journal of Clinical Microbiology. 43 (7), 3380-3389 (2005).
- Lee, K. L., Buckley, H. R., Campbell, C. C. An Amino Acid Liquid Synthetic Medium for the Development of Mycelial and Yeast Forms of Candida Albicans. Sabouraudia. 13 (2), 148-153 (1975).
- Banerjee, M., et al. UME6, a Novel Filament-Specific Regulator of Candida Albicans Hyphal Extension and Virulence. Molecular Biology of the Cell. 19 (4), 1354-1365 (2008).
- Earle, K. A., et al. Quantitative Imaging of Gut Microbiota Spatial Organization. Cell Host and Microbe. 18 (4), 478-488 (2015).
- Sokol, H., et al. Fungal Microbiota Dysbiosis in IBD. Gut. 66 (6), 1039-1048 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten