Method Article
Visualisation de Candida albicans dans le tractus gastro-intestinal murine utilisant l'hybridation fluorescente in Situ
Dans cet article
Résumé
Le but de ce protocole est de visualiser la forme et la localisation des cellules de Candida albicans dans le tractus gastro-intestinal des mammifères.
Résumé
Candida albicans est une composante fongique du microbiote intestinal chez l'homme et de nombreux autres mammifères. Bien que C. albicans ne cause pas de symptômes chez la plupart des hôtes colonisés, le réservoir commensal ne servent de dépôt pour les maladies infectieuses, et la présence de seins fongiques élevés dans l'intestin est associée à une maladie inflammatoire de l'intestin. Ici, nous décrivons une méthode pour visualiser la morphologie et la localisation de cellules de C. albicans dans un modèle de souris de colonisation gastro-intestinale stable. La colonisation est établie à l'aide d'une seule dose de C. albicans chez les animaux qui ont été traités avec des antibiotiques oraux. Des segments de tissu intestinal sont fixés d'une manière qui préserve l'architecture du contenu luminal (micro-organismes et mucus) ainsi que la muqueuse hôte. Enfin, l'hybridation in situ fluorescente est effectuée à l'aide de sondes contre l'ARNr fongique pour tacher les C. albicans et les hyphes. Un avantage clé de ce protocole est qu'il permet l'observation simultanée de la morphologie cellulaire de C. albicans et de son association spatiale avec les structures hôtes pendant la colonisation gastro-intestinale.
Introduction
Candida albicans est un commensal fongique ainsi qu'un agent pathogène humain opportuniste. Cette levure n'a pas de niche environnementale définie et se propage plutôt dans le tractus gastro-intestinal (GI), la peau et le tractus génito-urinaire des humains et d'autres mammifères1. Alors que les premières recherches sur C. albicans se sont concentrées principalement sur son potentiel de virulence, plusieurs rapports récents suggèrent que la propagation des organismes dans l'intestin peut jouer un rôle important dans la santé normale, y compris le développement immunitaire de la hôte2,3,4. Pour faciliter les investigations du commensalisme de C. albicans dans l'intestin des mammifères, nous avons développé un modèle de souris de colonisation stable de GI et une méthode d'hybridation in situ de fluorescence (FISH) pour visualiser des cellules de levure fongique et des hyphes dans le lumen intestinal.
À quelques exceptions près5, les souris de élevage en laboratoire présentent généralement une résistance à la colonisation fongique du tube digestif. On pense que la résistance à la colonisation est médiée par des espèces bactériennes spécifiques; cependant, ceci peut être surmonté par le traitement des animaux avec des antibiotiques6,7 ou l'utilisation d'un régime chimiquement défini qui modifie vraisemblablement la composition bactérienned'espèces 8,9. De même, chez l'homme, l'utilisation d'antibiotiques à large spectre a été associée à la surcroissance et à la diffusion de C. albicans 10. Notre modèle de colonisation murine utilise des antibiotiques à large spectre pour établir la colonisation de C. albicans de souris immunocompétentes et traditionnellement élevés. La pénicilline et la streptomycine sont fournies dans l'eau potable des animaux pendant une semaine avant le gavage avec 108 unités de formation de colonies (CUS) de C. albicans. Tant que l'eau infusée d'antibiotiques est continue, C. albicans se propagera à travers le tractus gastro-intestinal, atteignant les titers fécaux de 106à 108 CfU/g. Malgré le niveau élevé de colonisation fongique, les animaux restent en bonne santé et prennent du poids au même rythme que les témoins non infectés. Ce modèle a été utilisé avec succès pour dépister et caractériser plusieurs c. albicans commensalism facteurs11,12.
Comme d'autres membres du royaume fongique, C. albicans est capable d'une énorme plasticité morphologique13. Dans des conditions in vitro, il a été montré à la transition entre au moins six types de cellules de levure unicellulaires, ainsi que des hyphes multicellulaires et des pseudohyphes. La transition levure-hypha est l'un de ses attributs de virulence les mieux caractérisés, et les hyphes et les pseudohyphes prédominent dans la plupart des modèles de maladies des mammifères, ainsi que dans les tissus humains infectés. Pour déterminer la localisation et la morphologie de cellules de C. albicans dans le tube digestif murine, nous avons développé une technique de FISH pour colorer des levures et des hyphes dans les sections histologiques fixes. Les sondes se composent d'oligonucléotides d'ADN étiquetés fluorescents qui s'hybrident à l'ARN ribosomal fongique 23S (rRNA), qui est distribué dans tout le cytoplasme fongique. Parce que les tissus hôtes sont fixés d'une manière qui préserve l'architecture tridimensionnelle de l'intestin, y compris la muqueuse hôte, le matériel digestif, le microbiote bactérien, et le mucus dans le lumen intestinal, cette technique permet la localisation des champignons cellules par rapport à ces repères lorsqu'ils sont tachés. La technique FISH se compare favorablement aux taches histologiques traditionnelles pour les champignons, telles que le Schiff acide périodique (PAS) ou la méthénamine-Argent (GMS) de Gomori, ainsi que les anticorps antifongiques disponibles dans le commerce, parce que ces réactifs ne sont pas spécifiques pour C. albicans. En outre, les fixatifs standard enlèvent la couche de mucus et perturbent d'autres contenus de l'intestin lumen14,15.
Dans cet article, nous fournissons des instructions détaillées pour établir la colonisation de haute qualité de C. albicans du tractus gastro-intestinal de souris, pour la dissection du tube digestif des animaux euthanasiés, pour la fixation de tissu d'une manière qui préserve luminal pour la détection de C. albicans dans les tissus hôtes à l'aide de FISH. En plus des souches sauvages de type et mutant de C. albicans, la technique du gavage peut être utilisée pour fournir d'autres micro-organismes. La technique de fixation serait utile pour toute étude dans laquelle la préservation du contenu de l'intestin est souhaitée. La procédure FISH peut être complétée en un jour et peut être utilisée pour localiser plusieurs espèces fongiques à l'aide de multiples sondes étiquetées différemment.
Protocole
Les étapes décrites ci-dessous ont été approuvées par le Comité institutionnel de soins et d'utilisation des animaux de l'UCSF (IACUC).
1. Colonisation gastro-intestinale des souris avec C. albicans utilisant le gavage oral
- Fournir un logement à 18 à 21 g de souris mâles ou femelles (8 à 10 semaines) tel qu'approuvé par l'IACUC locale. Utilisez de la nourriture et de l'eau autoclaved à partir du premier jour.
REMARQUE: L'utilisation de cages stérilisées, de literie, de nourriture et d'eau réduit le risque de contamination par des bactéries environnementales résistantes aux antibiotiques qui peuvent potentiellement déplacer C. albicans de l'intestin. En outre, selon la question expérimentale, le logement individuel des animaux devrait être considéré parce que les souris sont copropagiques et le contenu de l'intestin sera partagé entre les animaux cologés. - Le jour suivant, remplacez l'eau potable autoclaved par de l'eau autoclaved contenant 5% de glucose, 1500 U/mL de pénicilline G, et 2 mg/mL de streptomycine.
- Pour plus de commodité, préparer à l'avance les solutions de stock d'antibiotiques 200x(tableau 1),filtrer la stérilisation et congeler à -20 oC.
- Maintenir les animaux sous antibiotiques pendant une semaine.
- Les jours 3 et 6 après le début des antibiotiques, évaluez les excréments de chaque animal pour la contamination par des bactéries aérobies résistantes aux antibiotiques. Tenir un animal d'une main, placer un tube de microfuge non plafonné près de l'anus et recueillir au moins une boulette fécale.
- Resuspendre chaque granule fécale dans 1 ml d'eau stérile et une assiette de 100 l sur le bouillon de Luria (LB), l'extrait de levure peptone dextrose (YEPD), ou l'infusion cardiaque cérébrale (BHI) plus les plaques d'agar de sang. Incuber les plaques toute la nuit dans un incubateur standard (non anaérobie) à 37 oC et évaluer la croissance bactérienne.
REMARQUE: Les plaques devraient afficher une croissance minimale (0 à 20 colonies). Si des colonies de bactéries sont récupérées à partir d'animaux traités à la pénicilline et à la streptomycine, il est peu probable que la colonisation de haut niveau avec C. albicans soit établie et que l'expérience soit avortée.
- Trois jours avant le gavage, stries C. albicans des stocks congelés de glycérol à YEPD - 2% plaques d'agar et incuber à 30 oC pendant 2 jours.
- Un jour avant le gavage, inoculer une colonie de chaque souche de C. albicans à tester dans 5 ml de YEPD liquide. Incuber à 30 oC pendant la nuit en secouant.
- Le matin du gavage, diluer la culture saturée de C. albicans à une densité optique à 600 nm (OD600) de 0,1 sur 100 mL de YEPD préchauffé à 30 oC. Secouer dans un shaker orbital à 200 tr/min à 30 oC pendant entre 4 h et 5 h jusqu'à ce que l'OD600 atteigne 1 (croissance moyenne du journal).
- Transférer chaque culture de 100 ml dans deux tubes coniques de 50 ml et une centrifugeuse à 3 000 x g pendant 5 min à température ambiante (RT).
REMARQUE : C. albicans se propage relativement lentement à RT. Si l'adaptation de ce protocole pour une autre espèce, l'inocula peut devoir être maintenue sur la glace pour empêcher la croissance continue. - Jeter le supernatant, resuspendre les cellules granulées dans 20 ml de saline stérile par 50 ml de culture, et mettre en commun les granulés en double en tubes coniques simples. Centrifugeuse à 3 000 x g pendant 5 min.
- Jeter le supernatant et le suspendre dans 20 ml de salin stérile. Vortex brièvement et retirer 20 l pour la mesure OD600. Diluer 1:50 dans la saline normale stérile. Centrifuger les cellules resuspension restantes à 3 000 x g pendant 5 min.
- Jetez le supernatant. Pour une taille d'inoculum de 1 x 108 CFU, resuspendre les cellules granulées à environ 5 x 108 CFUs/mL en saline normale stérile basée sur la concentration estimée déterminée à partir de la mesure OD600.
REMARQUE: Typiquement, un OD600 de 1 correspond à 1 x 107 cellules de levure/mL. Cette valeur peut varier selon le spectrophotomètre et doit être vérifiée. Si un changement de concentration est souhaité pour les infections avec un micro-organisme différent, prévoyez un volume d'inoculum de 10 l/g de souris pour minimiser l'inconfort de l'animal. - Vérifier la concentration de l'inoculum en comptant une dilution de 1:1 000 avec un hémocytomètre. Ajuster le volume des cellules à gavaged en fonction de la concentration déterminée à l'aide de l'hémocytomètre.
- À l'aide d'une aiguille d'alimentation animale(figure 1A), gavage chaque animal avec le volume calculé d'un inoculum donné. Voir les étapes 1.13.1-1.13.8 pour la procédure de gavage.
REMARQUE : La formation pour le gavage doit être obtenue d'un praticien expérimenté, et la procédure doit être maîtrisée à l'avance. Une procédure réussie pour un seul animal ne prend généralement pas plus de 1 min.- Fixez une aiguille d'alimentation animale autoclaved à une seringue de 1 ml et remplissez la seringue d'un volume de gavage, en enlevant les bulles d'air pour éviter une dose inexacte. Placer sur une surface stérile.
- Sécurisez l'animal pour le gavage. Tenez l'animal à la base de la queue avec la main dominante et faites glisser la main non dominante vers le haut du dos de l'animal jusqu'à la peau lâche juste derrière les oreilles.
- À l'aide de l'index et du pouce de la main non dominante, rassembler la peau lâche ensemble étroitement; c'est le "scruff". Ramassez l'animal par sa éraflure et bouclez petit doigt de la même main (non dominante) autour de la queue pour immobiliser l'animal contre la paume de la main. Étendre doucement la tête de l'animal de sorte que sa tête et son corps (et donc le cou et l'œsophage) sont en ligne droite.
REMARQUE: Tenter un gavage pendant que le corps de l'animal est plié ou tordu peut entraîner des complications telles que la perforation oesophagée et la mort de l'animal. - Ramassez la seringue avec la main dominante et tenez perpendiculairement à l'animal, l'aiguille courbée pointant vers le bas (Figure 1B). À l'aide de la boule de l'aiguille, accrochez doucement un coin intérieur de la bouche, avancez doucement l'aiguille le long du côté de la bouche à l'arrière de la gorge, et enfin déplacez l'aiguille vers le centre.
REMARQUE: L'introduction de l'aiguille le long d'un chemin latéral permet d'éviter la résistance des dents et de la langue de l'animal. - Une fois que la boule de l'aiguille est à l'arrière de la gorge, inclinez l'aiguille vers le haut de sorte qu'elle soit parallèle à la ligne de corps de l'animal (figure 1C).
REMARQUE: À ce stade, l'animal montrera un réflexe de bâillon. C'est un bon signe qui indique que l'aiguille est positionnée correctement, et le mouvement de bâillonnement aide à guider l'aiguille vers le bas de l'œsophage. S'il n'y a pas de réflexe de bâillon, l'aiguille peut être dans la trachée plutôt que dans l'œsophage. Retirez délicatement l'aiguille et revenez à l'étape 1.13.1. - Laisser l'animal avaler l'inoculum jusqu'à ce que seulement quelques millimètres restent visibles (figure 1D). Avancez l'aiguille en douceur.
REMARQUE: Si l'aiguille n'avance pas, évitez d'utiliser la force, ce qui peut endommager l'œsophage. Parfois, l'avancement du dernier demi-centimètre nécessitera un bâillon extra-large de l'animal. Si l'aiguille semble bloquée, retirez-la lentement et réessayez à partir de l'étape 1.13.4. - Testez que la boule d'aiguille est au bon endroit (estomac) en avançant doucement le piston. S'il n'y a pas de résistance, continuez à livrer l'inoculum. Une fois l'inoculum administré, retirez lentement l'aiguille.
- Remplacez l'animal dans sa cage et continuez à surveiller l'animal pendant 5 à 10 min pour déceler des signes de respiration laborieuse ou de détresse. Vérifier que l'animal reprend son activité normale peu de temps après le gavage.
- Si le même inoculum sera utilisé avec le prochain animal, nettoyez l'aiguille avec une lingette d'alcool. Revenez à l'étape 1.13.1. Si un inoculum différent est utilisé, utilisez une nouvelle aiguille et revenez à l'étape 1.13.1.
REMARQUE: Il est important d'inspecter les animaux le lendemain du gavage. Les animaux présentant des signes de détresse (p. ex., posture voûtée, respiration laborieuse) doivent être euthanasiés sans cesse, car ils ont probablement subi une rupture oesophagiste, des dommages aux poumons ou une autre blessure interne dont la guérison est peu probable.
- Après le gavage des animaux, les dilutions de plaque de l'inocula pour la vérification de dose.
- Préparer des dilutions en série 10 fois jusqu'à 1:105. Plaque un volume de gavage de la dilution 1:105 sur une plaque de 100 mm d'agar de sabouraud dextrose.
- Incuber l'assiette pendant 2 jours à 30 oC. Comptez les UFC pour confirmer la dose d'inoculum.
2. Préparation des tissus gastro-intestinaux pour l'histologie
REMARQUE: Cette section du protocole est adaptée de Johansson et Hansson16.
- Préparer 500 ml de solution de méthacarn (60 % de méthanol, 30 % de chloroforme, 10 % d'acide acétique glaciaire) dans un grand pot en plastique à capuchon à vis pour chaque 2 animaux disséqués.
MISE EN GARDE: Le méthanol et le chloroforme sont nocifs s'ils sont inhalés et doivent être manipulés dans une hotte chimique. L'acide acétique glaciaire peut être corrosif et doit être manipulé avec l'équipement de protection individuelle approprié. Le méthanol, le chloroforme et l'acide acétique glaciaire doivent être rejetés en tant que déchets dangereux. - Au point d'terminaison expérimental, euthanasiez les animaux sans humains selon un protocole approuvé par l'IACUC locale.
REMARQUE: Chez les animaux traités aux antibiotiques, la colonisation de C. albicans varie généralement de 106 UFC/g le jour 5 jusqu'à 5 x 107 UFC/g au jour 25. - Stériliser les outils de dissection avec 10 % d'eau de Javel et rincer à 70 % d'éthanol.
- Fixer chaque animal à une surface de dissection, avec le côté ventral tourné vers le haut. Utilisez des aiguilles de 30 G pour fixer les membres à la surface de dissection (figure 2A). Vaporiser l'animal avec 70% d'éthanol pour nettoyer la fourrure et minimiser coller aux outils.
- À l'aide de forceps émoussés, pincez une section de peau abdominale avec la main non dominante. À l'aide de ciseaux à la main dominante, inciser la peau et le fascia sous-jacent près de la base du bassin. Étendre l'incision en forme de U le long de chaque côté de la cavité péritonéale et jusqu'à la cage thoracique. Soulevez la peau de la route.
- À l'aide d'un crayon, préétiquetez les cassettes d'histologie pour les segments GASTRO à évaluer. Par exemple, pour chaque animal, étiquetez les cassettes séparées comme « estomac », « intestins grêles proximaux », « intestins grêles intermédiaires », « intestins grêles distal », « cecum » et « gros intestins ». Placez un tampon en mousse sur le fond de chaque cassette (Figure 2A).
REMARQUE : La figure 2B décrit les sections suggérées à placer dans les cassettes. - À l'aide de forceps émoussés, extraire délicatement le cecum de la cavité péritonéale. Utilisez des ciseaux pour couper les connexions entre le cecum et les petits et grands intestins.
REMARQUE: Le tissu cécal est très délicat et facile à rompre. Faites attention lorsque vous manipulez. - Placer le cecum entier dans une cassette d'histologie de sorte qu'il soit détordu et pose à plat (Figure 2C). Placer un deuxième tampon en mousse sur le dessus et fermer la cassette. Placez la cassette dans un bocal à vis contenant du methacarn.
- Accises une section des gros intestins qui contient 1/2 granules fécales, avec une longueur inférieure à celle de la cassette.
- Placer la section tissulaire dans la cassette, en gardant le tissu plat et non tordu. Recassez-le d'un deuxième tampon en mousse et fermez la cassette. Placez la cassette dans methacarn.
- Pour que chaque section de l'intestin grêle soit échantillonnée, accise un segment de 1 à 2 cm qui contient du matériel digestif.
- Placez le segment dans une cassette d'histologie, en gardant le tissu plat et non tordu. Recassez-le d'un deuxième tampon en mousse et fermez la cassette. Placez la cassette dans methacarn.
- Pour l'estomac, couper les connexions à l'œsophage et l'intestin grêle. Placer dans une cassette, en gardant le tissu plat et non tordu. Recassez-le d'un deuxième tampon en mousse et fermez la cassette. Placez la cassette dans methacarn.
- Laissez les cassettes dans la solution methacarn à RT pendant au moins 3 h et moins de 2 semaines.
REMARQUE: Il y a plusieurs points au cours desquels les segments d'IG fixes peuvent être transférés à un service d'histologie commerciale. Ces tissus peuvent être difficiles à sectionsans la perturbation du contenu luminal, et des résultats optimaux seront obtenus par un technicien expérimenté. Si le service commercial est prêt à effectuer des lavages avant d'incorporer les tissus dans la paraffine, les cassettes peuvent être envoyées à ce stade avec des instructions pour l'étape 2.16. - Commencer à faire fondre suffisamment de cire de paraffine pour couvrir toutes les cassettes de tissus dans un grand bécher dans un four d'hybridation préchauffé à 70 oC.
- Après fixation, retirer les tampons en mousse et retourner chaque section de tissu intact dans sa cassette. Laver les tissus avec les solutions suivantes à RT avec des secousses: deux fois pour 35 min de méthanol 100%, deux fois pour 25 min dans 100% d'éthanol, deux fois pour 20 min en xylène.
MISE EN GARDE: Le xylène est inflammable, toxique et peut causer des dommages s'il est inhalé. Utiliser dans une hotte chimique avec une protection appropriée. Éliminer le xylène par des procédures de déchets dangereux. - Pat les cassettes sèchent sur un essuie-tout et placez-les dans de la cire de paraffine préfondue pendant 2 h à 70 oC dans un four à hybridation. Assurez-vous que les cassettes sont remplies de paraffine et qu'il ne reste plus de bulles.
REMARQUE: Cette étape permet à la cire d'infiltrer le segment DES IG et de stabiliser le tissu et le contenu. - Retirez les cassettes de la cire, laissez l'excès de cire s'écouler et entreposez-les à RT jusqu'à ce qu'elles soient incorporées dans des blocs de cire. Jetez la cire contenant des traces de xylènes comme déchets dangereux.
REMARQUE: Le Noble Lab utilise un service d'histologie commerciale pour l'encastrage et la section des tissus. Pour la visualisation standard des levures et des hyphes de C. albicans, des sections de 4 m sont utilisées. Pour évaluer la connectivité des segments d'hyphe, qui s'étendent généralement à travers plusieurs plans, des sections de 8 m peuvent être utilisées. Selon la capacité des sondes FISH à pénétrer dans le spécimen, il peut être possible d'utiliser des sections encore plus épaisses.
3. Validation des sondes nouvellement conçues
REMARQUE: Le protocole suivant pour la validation des sondes C. albicans a été adapté de Swidsinski et coll.17.
- Streak C. albicans SC5314 et des espèces de comparaison étroitement apparentées (p. ex. Candida dubliniensis, Candida tropicalis) à YEPD - 2 % de plaques d'agar. Incuber pendant 1/2 jours à 30 oC.
- Inoculer 5 ml de milieu yEPD liquide avec une seule colonie.
- Pipette 1 ml des cellules suspendues à un tube de microcentrifuge et centrifugeuse à 3 000 x g pendant 5 min. Jeter le supernatant.
- Resuspendre le granule dans 100 l de saline tamponnée de phosphate (PBS).
- Pipette 5-10 l de cellules resuspendues et place sur une lame de verre. Étendre dans un plus grand cercle et laisser sécher.
REMARQUE: Si les cellules ne sont pas adhérentes, utilisez des lames enduites de poly-L-lysine. - Encerclez la tache cellulaire avec un stylo PAP et couvrez-la de 50 l de paraformaldéhyde (PFA) en PBS. Incuber à RT pendant 10 min.
MISE EN GARDE: La PFA est inflammable et peut causer des problèmes de santé en cas d'inhalation ou en contact avec la peau. Les articles contaminés par l'APF doivent être jetés comme déchets dangereux. - Laver 3x avec PBS. Appuyez sur le liquide sur du papier absorbant et recouvrez-le de 100 l de PBS. Répétez deux fois. Jeter le lavage final.
-
Préparer des diapositives pour le stockage de plusieurs jours. Si vous effectuez FISH le même jour, passez à l'étape 3.9 sans les étapes de cette section.
REMARQUE: Il est préférable d'effectuer l'hybridation immédiatement, mais si court dans le temps suivre l'étape 3.8 avant de stocker. Les glissières peuvent être stockées pendant plusieurs jours à 4 oC.- Couvrir la tache avec 60% d'éthanol. Incuber à RT pendant 3 min. Jetez la solution.
- Couvrez la tache avec 80% d'éthanol. Incuber à RT pendant 3 min. Jetez la solution.
- Couvrir la tache avec 100% d'éthanol. Incuber à RT pendant 3 min. Jetez la solution. Passez à l'étape 3.9.
- Placer les toboggans à découvert dans un four d'hybridation à 50 oC pendant 1 h. Si l'étape 3.8 a été suivie, entreposez les glissières à 4 oC. Si ce n'est pas le cas, passez à l'étape 4.2 pour exécuter le protocole d'hybridation.
4. FISH Sstaining in GI Tract Tissues
- Sections histologiques paraffines de cire.
- Dans un four d'hybridation, préchauffer un pot de Coplin rempli de xylène à 60 oC.
- Insérez les diapositives dans le bocal rempli de xylène. Déposer à 60 oC pendant 10 min. Jeter le lavage xylène. Gardez les glissières dans le bocal et versez le xylène dans un contenant à déchets.
- Verser le xylène RT frais dans le bocal et couver à 60 oC pendant 10 min. Jeter le deuxième lavage de xylène.
- Remplissez le pot avec 100 % d'éthanol et incubez-le à RT pendant 5 min. Retirez les lames du bocal et séchez l'air.
- Placez le four d'hybridation à 50 oC pour les étapes de la section 4.2.
- Tache C. albicans avec la sonde FISH.
- Préparer 1 mL de solution d'hybridation fraîche (20 mM Tris-HCl, pH 7,4, 0,9 M NaCl, 0,1 % de sulfate de dodecyl de sodium [SDS], 1 % de formamide dans de l'eau sans RNase). Voir tableau 1 pour les calculs de l'échantillon.
- Mélanger 50 l de solution d'hybridation avec 1 l de sonde C. albicans (5' Cy3- ACAGCAGAAGCCGTCGT 3'; 50 'g/mL dans de l'eau sans RNase) pour une quantité finale de sonde de 0,5 g par diapositive.
REMARQUE: De nombreuses souris de laboratoire ne contiennent pas de champignons parmi leur microbiote. Dans ce cas, il est possible de remplacer une sonde pan-fongique (5' Cy3-CTCTGGCTTCACCCTTC 3') qui reconnaît 23S rRNA de la plupart des espèces fongiques, pas seulement C. albicans. Selon l'expérience des auteurs, la sonde panfongique donne une coloration plus brillante que la sonde spécifique à C. albicans. - Protégez la solution de la lumière et préchauffez à 50 oC.
- À l'aide d'un stylo PAP, dessinez un cercle autour de la section tissulaire de la section 4.1.
- Pipette 50 L de solution d'hybridation contenant des sondes sur le tissu fixe et répartie doucement sur la section tissuavecnel avec une pointe de pipette. Recouvrir le liquide d'un bordereau d'hybridation en veillant à prévenir les bulles.
- Scellez les glissières dans une chambre d'hybridation étanche et incubez les sections pendant 3 h à 50 oC dans l'obscurité dans un four d'hybridation.
- Pendant ce temps, préparer 50 ml de solution de lavage FISH (20 mM Tris-HCl, pH 7,4, 0,9 M NaCl dans de l'eau sans RNase). Voir tableau 1 pour les calculs de l'échantillon.
- Déplacer la solution de lavage à 50 oC pour préréchauffer.
- Après 3 h, ajouter la solution de lavage dans un bocal Coplin. Ensuite, retirez soigneusement la glissière de couverture de la glissière avec des forceps et placez la glissière dans la solution de lavage.
- Couvrir le pot de papier d'aluminium et couver à 50 oC pendant 20 min.
- Au cours de cette incubation, préparer la solution de coloration mucin-nucléi (20 ng/mL 4,6-diamidino-2-phenylindole [DAPI], 1,6 g/mL fluorescein isothiocyanate [FITC]-lectine in PBS). Voir tableau 1 pour les calculs de l'échantillon. Pour l'estomac et les gros intestins, utilisez FITC-Ulex europa agglutinin 1 (UEA-1). Pour les intestins grêles et le cecum, utilisez une combinaison d'agglutinine du germe du FITC-UEA-1 et du fitC-blé (WGA).
REMARQUE: Les lectines de différentes espèces reconnaissent différentes modifications de sucre des glycoprotéines telles que la mucine. Les combinaisons de lectine recommandées ici ont été déterminées empiriquement pour la coloration optimale du mucus dans différents compartiments de GI. - Laver les toboggans en versant la solution de lavage FISH et en remplissant le pot avec RT PBS. Versez immédiatement le PBS et remplissez avec PBS. Verser le PBS pour un total de 2 lavages.
- Wick loin le PBS avec un tissu d'essuie-glace tâche délicate et encerclez la section de tissu intestinal avec un stylo PAP. Placer les lames dans un récipient en plastique opaque et ajouter 50 l de solution de coloration mucin-nucléi à la section tissulaire. Couvrir le contenant de papier d'aluminium pour se protéger de la lumière. Incuber à 4 oC pendant 45 min.
- Placez les toboggans dans un bocal Coplin et lavez-les rapidement deux fois en PBS à RT.
- Appuyez sur l'excès de PBS sur un essuie-tout, puis évacuer les gouttes finales de PBS avec un tissu.
- Placer une goutte de support de montage sur chaque section et recouvrir d'un bordereau en verre, empêchant les bulles. Laisser le milieu de montage se propager sous l'ensemble du bordereau. Pour une imagerie immédiate, ancrez le bordereau en place avec du vernis à ongles dans les coins. Pour le stockage à long terme, sceller autour de la couverture avec du vernis à ongles.
- Imagez les diapositives à l'aide d'un microscope fluorescent.
Résultats
Suivant les instructions fournies, le résultat de cette technique sera l'étiquetage fluorescent des noyaux dans l'épithélium hôte, le mucus, et C. albicans dans les tissus gi sectionnés. Les cellules sauvages de type Candida albicans devraient apparaître comme des cellules de levure rondes et unicellulaires ou des hyphes multicellulaires très allongés, parfois ramifiés (les divisions cellulaires ne seront pas apparentes dans les hyphes). Les mutants de C. albicans peuvent en outre apparaître comme des levures « grises » plus petites et légèrement allongées ou comme des levures « GUT » plus grandes et légèrement allongées (transition induite par les gastro-intestinaux) ou « opaques ».
La figure 1 représente l'aiguille d'alimentation utilisée pour le gavage oral, ainsi que les positions clés de l'aiguille pendant la procédure de gavage. La figure 2 fournit une configuration typique utilisée pour la dissection d'organe et l'apparition de segments gastro-intestinaux de la souris.
Figure 3 affiche la coloration FISH de différents types de cellules C. albicans suite à la propagation in vitro et dans le modèle de la souris. La figure 3A montre des images de fluorescence et de phase d'hyphes fixes, perméabilisés et propagés in vitro. La formation d'hypha a été induite avec le milieu de Lee liquide18 avec 2% N-acetylglucosamine, pH 6.8 à 37 oC. La figure 3B montre des images de fluorescence et de phase de cellules de levure fixes, perméabilisées et propagées in vitro. La figure 3C,D montre des cellules GUT fixes, perméabilisées et propagées in vitro et des cellules opaques, respectivement. Les types de cellules GUT et opaques sont morphologiquement indiscernables, sauf lorsqu'ils sont visualisés par microscopie électronique à balayage. Veuillez noter que la coloration FISH des cellules prophétisées in vitro sera sous-optimale si les cellules ne sont pas bien perméabilisées. Un exemple de coloration faible et diffuse est illustré dans la figure 3C. Pour de meilleurs résultats, les conditions de fixation et de perméabilisation cellulaires doivent être déterminées empiriquement pour chaque type de cellule et espèce à étudier. Heureusement, le protocole recommandé pour visualiser C. albicans dans les tissus sectionnés produit une perméabilisation plus cohérente.
Figure 3E-G dépeignent C. albicans dans de grands intestins de souris, tachés de la sonde spécifique C. albicans(Figure 3E) ou de la sonde panfunonale (Figure 3F,G). C. albicans apparaît rouge dans ces images, les noyaux de cellules hôtes sont bleus, et la couche de mucus est verte. Les deux levures rondes et hyphes très allongés (pointes de flèche sailles blanches) se produisent dans les gros intestins. Veuillez noter que la coloration est plus brillante avec la sonde panfungique. Figure 3G représente un mutant ume6 dans le même compartiment, taché de la sonde panfunonique. Ume6 code un facteur de transcription qui est nécessaire pour la formation d'hyphe dans des conditions in vitro19 . Fait intéressant, le phénotype à levures verrouillé s'affiche par ce mutant dans des conditions in vitro n'est pas récapitulé dans l'intestin, ce qui suggère qu'un facteur redondant doit être activé dans l'hôte12. La figure 4 représente l'apparition de types sauvages De C. albicans dans différents segments du tractus gastro-intestinal murine, y compris les régions adjacentes à la muqueuse hôte et aux régions plus centrales du lumen intestinal.
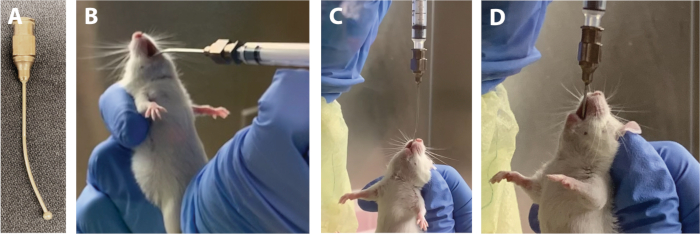
Figure 1 : Positions principales de l'aiguille d'alimentation pendant le gavage. (A) Aiguille d'alimentation. (B) Boule d'aiguille d'alimentation insérée sur le côté de la langue. (C) Aiguille d'alimentation en position verticale avec insertion dans l'œsophage. (D) Aiguille d'alimentation insérée dans l'estomac avec quelques millimètres visibles au-dessus du nez. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Exemple de disposition de dissection. (A) Dissection pad et outils. (B) Tract gastro-intestinal excisé. Proximal (œsophage) aux sections distales (anus) : I. Estomac. II. Intestins grêles proximal. III. Intestins grêles médiaux. IV. Intestins grêles distal. V. Cecum. VI. Gros intestin. Les boîtes de bordure pointillées roses indiquent que les tissus doivent être fixés. (C) Tissus positionnés dans des cassettes. Les chiffres romains sont les mêmes que dans le panneau B. S'il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
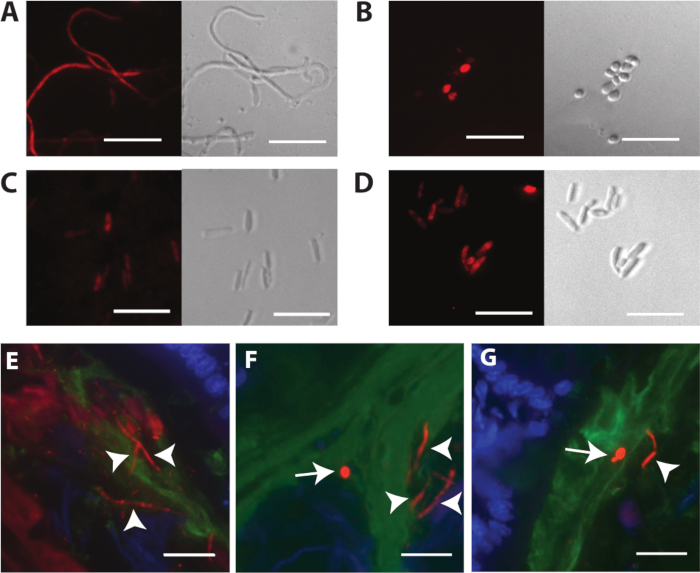
Figure 3 : Images représentatives de C. albicans tachésfish. (A) FISH de C. albicans hyphes cultivés dans les médias liquides de Lee18 avec 2% N-acetylglucosamine, pH 6.8. (B) FISH de C. albicans cellules de levure rondes cultivées sur YEPD - 2% plaques d'agar. (C) FISH des cellules GUT de C. albicans (ySN1045) cultivées sur des plaques de YEPD - 2% d'agar. (D) FISH de C. albicans cellules opaques cultivées sur YEPD - 2% plaques d'agar. (E) Type sauvage C. albicans (ySN250) dans les gros intestins, tachés de la sonde c. albicans-spécifique. (F) Sauvage de type C. albicans dans les gros intestins, tachés de la sonde panifgique. (G) Ume6 mutant (ySN1479) dans les gros intestins, taché de la sonde panfunonique: rouge est C. albicans, bleu est l'hôte des noyaux épithéliales, et le vert est mucine. Les pointes de flèche indiquent des hyphes. Les flèches indiquent la levure. Les barres d'échelle de 20 m. Les images F et G sont adaptées de Witchley et coll.12. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
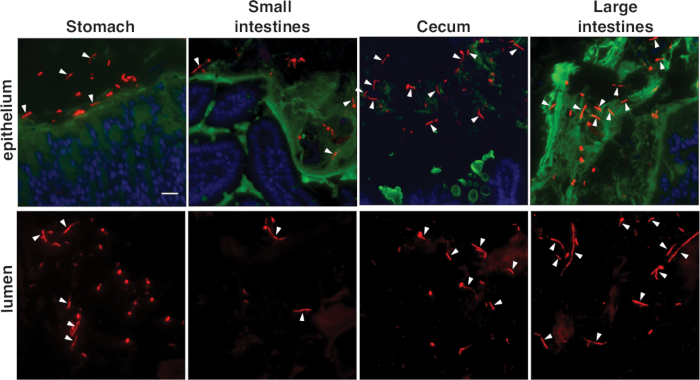
Figure 4 : Apparition de C. albicans tachés fish dans différents compartiments intestinaux. Le type sauvage C. albicans est indiqué dans les segments indiqués du tractus gastro-intestinal de la souris. Dans chaque compartiment, des images représentent la zone adjacente à la muqueuse hôte et la région centrale du lumen intestinal. La coloration a été réalisée avec la sonde panfongique. Barre à l'échelle de 20 m. Les images sont adaptées de Witchley et coll.12. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Stocks d'antibiotiques (200x) | |||
| Pénicilline G | 181 mg/mL | ||
| Streptomycine | 400 mg/L | ||
| Methacarn Methacarn | |||
| stock | Concentration finale | volume | Unités |
| Méthanol | 60% | 300 | ml |
| chloroforme | 30% | 150 | ml |
| Acide acétique glaciaire | 10% | 50 | ml |
| Solution d'hybridation | |||
| stock | Concentration finale | volume | Unités |
| 1 M Tris-HCl, pH 7,4 | 20 mM | 20 | Μl |
| 5 M NaCl | 0,9 M | 180 | Μl |
| 10% SDS | 0.10% | 10 | Μl |
| 100% formamide | 1.00% | 10 | L (conservé dans de petits aliquots à -20 oC entre les utilisations) |
| Eau sans RNase | 780 | Μl | |
| Solution de lavage FISH | |||
| 1 M Tris-HCl, pH 7,4 | 20 mM | 1 | ml |
| 5 M NaCl | 0,9 M | 9 | ml |
| Eau sans RNase | 40 | ml | |
| Solution de coloration Mucin-nuclei | |||
| DAPI, 10 g/mL | 20 ng/mL | 2 | Μl |
| lectine, 40 g/mL | 1,6 g/mL | 40 | Μl |
| PBS, pH 7,4 | 958 | Μl | |
Tableau 1 : Volumes et concentrations typiques de solutions utilisées dans ce protocole.
Discussion
La méthode décrite ici permet la visualisation des levures et des hyphes de C. albicans dans les voies gastro-intestinales des souris colonisées de n'importe quel sexe ou souche. La sonde FISH s'hybride à 23S rRNA, qui est distribué dans tout le cytoplasme fongique. Notre méthode a été adaptée d'un protocole précédemment rapporté pour visualiser des bactéries d'intestin20. Parce que C. albicans change sa morphologie au sein de l'hôte, la méthode est utile pour surveiller la forme des cellules fongiques ainsi que la localisation. Par exemple, nous avons utilisé cette méthode pour réfuter l'hypothèse selon laquelle les levures prédominent dans tout le tube digestif, et pour exposer les écarts entre les phénotypes in vivo et in vitro de certains mutants « défectueux de filamentation »12.
Plusieurs modèles de souris existent pour C. albicans commensal colonization. Le microbiote des souris de laboratoire et des humains est distinct et, chez la souris, l'utilisation d'antibiotiques ou d'un régime spécialisé est nécessaire pour établir une colonisation stable. Le traitement aux antibiotiques améliore également la colonisation de C. albicans de l'homme et est un facteur de risque majeur pour la maladie disséminée10. Les antibiotiques utilisés dans cette étude sont relativement peu coûteux et produisent des diminutions fiables du microbiote bactérien. Notez que les antibiotiques sont utilisés pour diminuer le fardeau des espèces bactériennes antagonistes, pas pour éliminer toutes les bactéries des animaux. Si les chercheurs souhaitent étudier les interactions C. albicans-hôteen l'absence de bactéries ou pour éviter l'utilisation d'antibiotiques ou d'un régime alimentaire spécial, les animaux exempts de germes peuvent être remplacés par des animaux élevés de façon conventionnelle; cependant, les souris gnotobiotiques présentent certaines anomalies immunitaires et anatomiques et peuvent donc ne pas convenir à toutes les fins.
Plusieurs étapes sont importantes pour la coloration FISH réussie: La méthode de fixation recommandée est essentielle pour préserver l'intégrité structurelle des tissus gastro-intestinaux, en particulier le contenu fragile de l'intestin lumen, tels que la couche de mucus et la tridimensionnelle l'organisation des champignons et des bactéries16. Veuillez noter que de nombreuses solutions de fixation couramment utilisées qui contiennent de l'eau sont très dommageables pour l'architecture lumineuse. Les fixatifs et les solutions pour les lavages post-fixation recommandés dans ce protocole ne contiennent pas d'eau, et il est important d'éviter la contamination par l'eau. Une autre étape critique est l'étape d'hybridation, où il est important d'éviter l'évaporation de la solution d'hybridation lors de l'incubation des toboggans dans le four d'hybridation. Nous vous suggérons de placer les diapositives dans un contenant étanche pour éviter ce problème. Alternativement, on peut utiliser des chambres d'hybridation étanches comme celles utilisées à l'origine pour l'hybridation des microréseaux.
Une sonde C. albicans-spécifique FISH est décrite dans ce protocole. Cependant, parce que beaucoup de souris d'élevage en laboratoire ne contiennent pas de C. albicans ou d'autres champignons dans le cadre de leur microbiote intestinal naturel, une sonde panfongique peut spécifiquement tacher C. albicans chez des animaux colonisés expérimentalement. La substitution d'une sonde panfunonique peut être souhaitable en raison de ses caractéristiques d'hybridation supérieures et de son rapport signal-bruit plus élevé. Si la sonde panfunonale est utilisée comme sonde pseudospécifique pour C. albicans, il est important de documenter un manque de coloration chez les animaux non infectés (c.-à-d., traités avec des antibiotiques, mais pas C. albicans). La coloration d'un animal témoin non colonisé est également utile pour évaluer la coloration de fond qui peut résulter de l'adhérence des sondes FISH aux particules alimentaires. Dans l'ensemble, l'utilisation de sondes FISH offre une spécificité accrue par rapport à la plupart des autres méthodes de coloration des champignons, comme le blanc Calcofluor (qui tache la chitin, un composant de la paroi cellulaire qui peut varier d'un type de cellule à l'autre), le GMS ou les anticorps antifongiques disponibles dans le commerce. En outre, la coloration FISH permet la costaining de plusieurs organismes à l'aide de sondes FISH étiquetées différemment pour les rARN spécifiques aux espèces.
Une mise en garde de cette technique est que certains types de cellules de levure C. albicans semblent très similaires par FISH (par exemple, les types de cellules opaques et GUT). Pour distinguer entre ces types de cellules, il serait utile de développer des sondes d'hybridation aux ARNm fongiques spécifiques au type cellulaire. Néanmoins, dans sa forme actuelle, la technique FISH a déjà révélé des écarts surprenants entre les comportements in vivo et in vitro des mutants de C. albicans évalués dans les deux conditions12, indiquant des interactions complexes dans le environnement commensal naturel qui ne sont pas suffisamment imités par les essais in vitro existants. D'autres études de différentes taches de C. albicans dans d'autres hôtes de type sauvage et mutants sont susceptibles de donner des informations supplémentaires sur les interactions fongiques-hôtes. En particulier, il sera instructif de profiler C. albicans dans les modèles de maladie sexiste inflammatoire, qui est associée à des seins élevés de C. albicans chez l'homme21, et d'autres modèles de C. albicans surcroissance et la maladie. La technique FISH peut également être combinée avec l'immunohistochimie pour tacher les cellules hôtes spécifiques. Dans l'ensemble, la méthode présentée ici fournit un moyen raisonnablement rapide et fiable pour déterminer la localisation et la morphologie de C. albicans dans le tractus gastro-intestinal des mammifères.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs tient à remercier Carolina Tropini, Katharine Ng, Justin Sonnenburg et KC Huang pour leur orientation dans le développement de la technique FISH. Teresa O'Meara a fourni des commentaires utiles sur le manuscrit, et Miriam Levy a aidé à la photographie. Ce travail a été soutenu par des subventions des NIH R01AI108992, R01DK113788, et un Burroughs Welcome Award dans la pathogenèse des maladies infectieuses.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD | 309659 | can be substituted from any vendor |
| BHI blood agar | can be substituted from any vendor | ||
| C. albicans FISH probe | IDT DNA Technologies | custom order | |
| Chamber for hybridization incubation | watertight chamber meant to reduce evaporation | ||
| Chloroform | Sigma | C2432 | >=99.5% |
| DAPI | Roche | 10236276001 | can be substituted from any vendor |
| Delicate task wiper tissues | Kimberley-Clark | 34256CT | Kimwipes |
| D-glucose | Sigma | G7021-5KG | can be substituted from any vendor |
| Ethanol | Sigma | E7023 | molecular biology grade |
| Feeding needles | Cadence, Inc. | 7910 | metal; 20 X1-1/2" W/2-1/4; can be autoclaved to sterilize |
| FITC-UEA-1 | Sigma | L9006-1MG | other fluorophores available |
| FITC-WGA | Sigma | L4895-2MG | other fluorophores available |
| Foam pads | Fisher | 22038221 | Order foam pads that will fit within cassettes |
| Formamide | Sigma | 47671 | molecular biology grade |
| Glacial acetic acid | Macron Fine Chemicals | MK881746 | ACS reagent, >=99.5% |
| Glass Coplin jar | Fisher | 08-815 | hold up to 10 slides back to back |
| Histology cassettes | Simport | M512 | Deep cassettes so cecum is not squished |
| Hybridization coverslips | Sigma | GBL712222 | RNase-free |
| Hybridization oven | can be substituted from any vendor | ||
| LB | can be substituted from any vendor | ||
| Lee's media | prepared as described in Lee et al. 1975 | ||
| Methanol | Sigma | 179337 | ACS reagent, >=99.8% |
| Mice | Charles River Laboratories | 028 | adult BALB/c; 18-21 grams (8-10 weeks) |
| Paraformaldehyde | Fisher | 50-980-487 | 16% solution |
| Parrafin wax | Sigma | P3558-1KG | Paraplast for tissue embedding |
| PBS, pH 7.4 | UCSF Cell Culture Facility Media Production Unit | CCFAL003 | calcium, magnesium-free; can be substituted from any vendor |
| Penicillin G | Sigma | PENNA-100MU | |
| Sabouraud dextrose agar | can be substituted from any vendor | ||
| Saline | Baxter | 2F7123 | sterile, can be substituted from any vendor |
| Sodium chloride (NaCl) | Sigma | S3014 | can be substituted from any vendor; maintain RNase-free |
| Sodium dodecyl sulfate (SDS) | Sigma | L3771 | can be substituted from any vendor; maintain RNase-free |
| Streptomycin | Sigma | S9137-100G | |
| Super PAP pen | Life Technologies | 8899 | can be substituted from any vendor |
| Tris-HCl | Sigma | T3253 | can be substituted from any vendor; maintain RNase-free |
| Vectashield | Vector Laboratories | H-1000 | does not contain DAPI |
| Xylenes | Sigma | 214736 | reagent grade |
| YEPD | can be substituted from any vendor |
Références
- Noble, S. M., Gianetti, B. A., Witchley, J. N. Candida Albicans Cell-Type Switching and Functional Plasticity in the Mammalian Host. Nature Reviews in Microbiology. 15 (2), 96-108 (2017).
- Bacher, P., et al. Human Anti-fungal Th17 Immunity and Pathology Rely on Cross-Reactivity against Candida albicans. Cell. 176 (6), 1340-1355 (2019).
- Shao, T. Y., et al. Commensal Candida albicans Positively Calibrates Systemic Th17 Immunological Responses. Cell Host and Microbe. 25 (3), 404-417 (2019).
- Jiang, T. T., et al. Commensal Fungi Recapitulate the Protective Benefits of Intestinal Bacteria. Cell Host and Microbe. 22 (6), 809-816 (2017).
- Iliev, I. D., et al. Interactions Between Commensal Fungi and the C-Type Lectin Receptor Dectin-1 Influence Colitis. Science. 336 (6086), 1314-1317 (2012).
- Fan, D., et al. Activation of HIF-1 alpha and LL-37 by Commensal Bacteria Inhibits Candida Albicans Colonization. Nature Medicine. 21 (7), 808-814 (2015).
- Koh, A. Y., Kohler, J. R., Coggshall, K. T., Van Rooijen, N., Pier, G. B. Mucosal Damage and Neutropenia Are Required for Candida Albicans Dissemination. PLoS Pathogens. 4 (2), e35 (2008).
- Yamaguchi, N., et al. Gastric Colonization of Candida Albicans Differs in Mice Fed Commercial and Purified Diets. Journal of Nutrition. 135 (1), 109-115 (2005).
- Kadosh, D., et al. Effect of Antifungal Treatment in a Diet-Based Murine Model of Disseminated Candidiasis Acquired via the Gastrointestinal Tract. Antimicrobial Agents and Chemotherapy. 60 (11), 6703-6708 (2016).
- Perlroth, J., Choi, B., Spellberg, B. Nosocomial Fungal Infections: Epidemiology, Diagnosis, and Treatment. Medical Mycology. 45 (4), 321-346 (2007).
- Pande, K., Chen, C., Noble, S. M. Passage Through the Mammalian Gut Triggers a Phenotypic Switch That Promotes Candida Albicans Commensalism. Nature Genetics. 45 (9), 1088-1091 (2013).
- Witchley, J. N., et al. Candida Albicans Morphogenesis Programs Control the Balance between Gut Commensalism and Invasive Infection. Cell Host and Microbe. 25 (3), 432-443 (2019).
- Noble, S. M., Gianetti, B. A., Witchley, J. N. Candida Albicans Cell-Type Switching and Functional Plasticity in the Mammalian Host. Nature Reviews in Microbiology. 15 (2), 96-108 (2017).
- Balish, E., Filutowicz, H., Oberley, T. D. Correlates of Cell-Mediated Immunity in Candida Albicans-Colonized Gnotobiotic Mice. Infection and Immunity. 58 (1), 107-113 (1990).
- Guarner, J., Brandt, M. E. Histopathologic Diagnosis of Fungal Infections in the 21st Century. Clinical Microbiology Reviews. 24 (2), (2011).
- Johansson, M. E., Hansson, G. C. Preservation of Mucus in Histological Sections, Immunostaining of Mucins in Fixed Tissue, and Localization of Bacteria with FISH. Methods in Molecular Biology. 842, 229-235 (2012).
- Swidsinski, A., Weber, J., Loening-Baucke, V., Hale, L. P., Lochs, H. Spatial Organization and Composition of the Mucosal Flora in Patients with Inflammatory Bowel Disease. Journal of Clinical Microbiology. 43 (7), 3380-3389 (2005).
- Lee, K. L., Buckley, H. R., Campbell, C. C. An Amino Acid Liquid Synthetic Medium for the Development of Mycelial and Yeast Forms of Candida Albicans. Sabouraudia. 13 (2), 148-153 (1975).
- Banerjee, M., et al. UME6, a Novel Filament-Specific Regulator of Candida Albicans Hyphal Extension and Virulence. Molecular Biology of the Cell. 19 (4), 1354-1365 (2008).
- Earle, K. A., et al. Quantitative Imaging of Gut Microbiota Spatial Organization. Cell Host and Microbe. 18 (4), 478-488 (2015).
- Sokol, H., et al. Fungal Microbiota Dysbiosis in IBD. Gut. 66 (6), 1039-1048 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon