Method Article
Kernisolierung aus ganzem Gewebe mit einer Waschmittel- und enzymfreien Methode
In diesem Artikel
Zusammenfassung
Die Isolierung einzelner Kerne beruht auf der Dissoziation und der Waschmittel-basierten Permeabilisierung der Zellmembran, Schritte, die optimiert werden müssen und anfällig für die Einführung technischer Artefakte sind. Wir zeigen ein Waschmittel- und enzymfreies Protokoll zur schnellen Isolierung intakter Kerne direkt aus dem gesamten Gewebe, das Kerne liefert, die für Single-Nucleus RNA-seq (snRNA-Seq) oder ATAC-seq geeignet sind.
Zusammenfassung
Hochdurchsatz-Transkriptom und Epigenom-Profilierung erfordert die Vorbereitung einer Einzelzell- oder Einzelkernsuspension. Die Vorbereitung der Suspension mit intakten Zellen oder Kernen beinhaltet Dissoziation und Permeabilisierung, Schritte, die unerwünschte Geräusche und unerwünschte Schäden verursachen können. Insbesondere bestimmte Zelltypen wie Neuronen sind schwierig, sich in einzelne Zellen zu dissoziieren. Darüber hinaus erfordert die Permeabilisierung der Zellmembran zur Freisetzung von Kernen eine Optimierung durch Versuch und Irrtum, die zeitaufwändig, arbeitsintensiv und finanziell nicht lebensfähig sein kann. Um die Robustheit und Reproduzierbarkeit der Probenvorbereitung für die Hochdurchsatzsequenzierung zu verbessern, beschreiben wir eine schnelle enzym- und waschmittelfreie säulenbasierte Kernisolationsmethode. Das Protokoll ermöglicht eine effiziente Isolierung der Kerne aus dem gesamten Zebrafischhirn innerhalb von 20 Minuten. Die isolierten Kerne zeigen eine intakte Kernmorphologie und eine geringe Neigung zur Aggregation. Darüber hinaus ermöglicht die Durchflusszytometrie die Anreicherung und Clearance von Zellablagerungen für die nachgeschaltete Anwendung. Das Protokoll, das an Weichteilen und kultivierten Zellen arbeiten soll, bietet eine einfache und zugängliche Methode zur Probenvorbereitung, die für die Profilerstellung mit hohem Durchsatz verwendet werden kann, wodurch die Schritte vereinfacht werden, die für erfolgreiche Single-Nuklei-RNA-Seq- und ATAC-seq-Experimente erforderlich sind.
Einleitung
Single-Cell RNA-seq (scRNA-Seq) und ATAC-seq sind vielseitige Werkzeuge, um komplexe biologische Systeme mit einzelliger Auflösung zu untersuchen. Sie werden häufig genutzt, um Zellsubtypen und -zue), Gennetzwerke und zelluläre Heterogenität zu definieren. Voraussetzung für die Durchführung von scRNA-seq ist die Herstellung einer einzelzelligen Suspension durch Gewebedissoziation. Aufgrund der Variation der extrazellulären Matrixzusammensetzung und der mechanischen Eigenschaften erfordern einzelne Gewebe eine Optimierung des Dissoziationsprotokolls zur Herstellung einer einzelzelligen Suspension.
Die Dissoziation von Geweben in einzelne Zellen beinhaltet in der Regel die Behandlung mit Verdauungsenzymen, einschließlich Kollagennase, Dispase oder Trypsin, bei 37 °C1,2,3,4. Da die Transkriptionsmaschinerie bei 37 °C aktiv bleibt, kann die enzymatische Dissoziation mRNA-Expressionsartefakte und Rauschen5,6einführen. Insbesondere kann eine längere Inkubation stressempfindliche Gene und Hitzeschockreaktionen auf ungleichmäßige Weise auslösen – was zu technischen Variabilitätimexperimenten führt7.
Ein weiterer Nachteil der Erzeugung einer Einzelzellsuspension ist die Schwierigkeit, lebensfähige und intakte Zelltypen mit komplexen Morphologien zu erhalten. Insbesondere Neuronen, Adipozyten und Podozyten sind eine Herausforderung,8,9,10,11zu isolieren. Zum Beispiel demonstrierten Wu und Kollegen das Fehlen von glomerulären Podozyten in scRNA-Profilen einer erwachsenen Mausniere12. Ähnliche nicht optimale Beobachtungen wurden in Bezug auf die Wiederherstellung von miteinander verbundenen Neuronen aus Hirngewebe8,13,14gemacht. Zusammenfassend kann die Dissoziation, dass Dissoziationsprotokolle eine Erkennungsverzerrung in Richtung einer leichter zu dissoziierenden Zelltypen einführen können, was zu einer falschen Darstellung der zellulären Architektur des Organs führt.
Um das technische Rauschen und die Verzerrung zu überwinden, die während der Probenvorbereitung in scRNA-Seq. eingeführt werden, bietet die Isolierung und Profilierung des Kerns eine attraktive Alternative. Da die kerntechnische Morphologie zwischen verschiedenen Zelltypen ähnlich ist, umgeht die Isolierung der Kerne das Problem der Isolierung intakter und lebensfähiger Zellen mit komplexen Morphologien. So zeigten Wu und Kollegen eine erfolgreiche Profilierung von glomerulären Podozyten mit dem Single-Nucleus RNA-Seq. (snRNA-Seq.) einer erwachsenen Mausniere, die in scRNA-Seq12fehlte. Faszinierenderweise haben vergleichende Studien zwischen einzelliger und singlenucleus RNA-seq eine Abnahme der Induktion von Stress- und Hitzeschock-Antwort-Genen mit snRNA-Seq12nahegelegt. Die Studien deuten ferner auf eine hohe Korrelation zwischen den genenden Genen hin, die durch die beiden Methoden nachgewiesen wurden. Eine aktuelle Studie über menschliche Mikroglia konnte jedoch keine genetische Aktivierung bei der Alzheimer-Krankheit erkennen15. Somit ist snRNA-Seq in bestimmten Kontexten eine geeignete Alternative für scRNA-Seq16,17. Darüber hinaus kann die nukleare Isolierung für einzellige ATAC-Seq. genutzt werden, die Informationen über die Regionen von Offenem Chromatin in einzelnen Zellen liefert.
Das Protokoll zur Kernisolierung umfasst drei Hauptschritte: i) Lyse der Zellmembran auf Detergenzienbasis, um den Zellkern freizusetzen; ii) Gewebehomogenisierung mit einem Dounce Homogenisator; und iii) Anreicherung von Kernen und Entfernung von Zellablagerungen mittels Gradientenzentrifugation oder Durchflusszytometrie18,19,20,21,22. Dabei hängen die ersten beiden Schritte vom Gewebetyp ab und müssen empirisch optimiert werden. Mildes Reinigungsmittel führt zu einem partiellen Bruch der Zellmembran und ineffizientem Abruf von Kernen aus dem Gewebe23. Auf der anderen Seite führt ein hohes Waschmittelniveau und harte Homogenisierung zum Bruch der Kernmembran und deren Verlust24,25. Ruptured-Kerne neigen weiter dazu, sich zu verklumpen und Aggregate zu bilden, die, wenn sie nicht entfernt werden, zu Artefakten im nachgeschalteten Profilierungsexperiment führen können.
Um die Probleme im Zusammenhang mit der Reinigungsmitteloptimierung für die Kernisolierung zu umgehen, führen wir ein Protokoll ein, um intakte Kerne von frischen Proben mit einer waschmittelfreien und spinspaltenbasierten Methode zu isolieren. Das Protokoll liefert Kerne aus dem ganzen Organ innerhalb von 20 Minuten, was die Induktion der artefaktischen Transkription begrenzt. Die isolierten Kerne können mit FACS für Single-Nuclei RNA-Seq. und ATAC-seq angereichert werden, was eine einfache und universelle Methode bietet, die eine robuste und reproduzierbare Hochdurchsatzprofilierung ermöglicht.
Protokoll
Alle nachstehend dargestellten Verfahren wurden in Übereinstimmung mit der institutionellen (Université Libre de Bruxelles (ULB)) und den nationalen ethischen und Tierschutzrichtlinien und -vorschriften durchgeführt, die von der Ethikkommission für Tierschutz (CEBEA) der Université Libre de Bruxelles (Protokolle 578N-579N) gebilligt wurden.
1. Vorbereitung vor Gewebesektion
- Bereiten Sie 0,2% Tricain-Lösung in PBS für die Einschläfung des Zebrafisches vor. Kühlen Sie die Lösung auf Eis.
- Bereiten Sie eine 30 mm Petrischale für das Zerlegen des Gewebes vor.
- Bereiten Sie eiskalte 1x PBS (10 ml pro Gewebeprobe) vor.
- Die Zentrifuge auf 4 °C abkühlen.
- Für die Isolierung von Kernen verwenden Sie ein waschmittelfreies Kernisolationskit (Tabelle der Materialien).
- Vor dem Start des Protokolls werden die Pre-Chill-Puffer A und B im Kit bereitgestellt, indem sie mindestens 30 min vor der Kernisolierung auf Eis gestellt werden.
- Für den Umgang mit den isolierten Kernen sollten die Kunststoffreagenzien wie Rohre und Pipettenspitzen mit 5% BSA-Lösung beschichtet werden. Bereiten Sie die Lösung dafür vor, indem Sie 2 g BSA in 40 ml PBS auflösen. Die Beschichtung von Kunststoffartikeln mit 5% BSA reduziert das Kleben von Kernen an Kunststoff. Dieser Schritt verbessert die Wiederherstellung isolierter Kerne.
- Beschichten Sie die Pipettenspitzen, indem Sie 5% BSA-Lösung 2-3 mal pipetieren. Die Spitzen 2 Stunden lang lufttrocknen. Bereiten Sie 10 Kunststoffspitzen pro Probe vor.
- Beschichten Sie die Rohre für die Sammlung von Kernen, indem Sie sie mit 5% BSA füllen. Invertieren Sie die Rohre 3 Mal, um eine effiziente Beschichtung zu gewährleisten. Entfernen Sie die Lösung und trocknen Sie die Rohre 2 Stunden lang auf einem sauberen Tissuepapier auf den Kopf. Pro Probe, Schicht ein Sammelrohr im Kit zur Verfügung gestellt. Zusätzlich bereiten Beschichtete 1,5 ml Rohre für die Kernsammlung nach FACS vor.
HINWEIS: Glasspitzen sind eine sehr empfehlenswerte Alternative zu den Kunststoffpipettenspitzen, um das Kleben zu minimieren.
2. Zerlegung des Zebrafischhirns
- Für die Einschläfung des Zebrafisches eine 90 mm Petrischale mit 25 ml eiskalter Tricain-Lösung zubereiten.
- Nehmen Sie den Zebrafisch vorsichtig mit einem Fischernetz aus dem Becken und legen Sie ihn in die Petrischale.
- Euthanisieren Sie den Fisch, indem Sie ihn 5 min in Tricaine lassen.
- Enthaupten Sie das Tier mit einer scharfen Rasierklinge.
- Mit Zangen, brechen Sie den Schädel sanft auf und entfernen Sie Weichgewebe, Haut und Knochen von der ventralen und dorsalen Seite des Schädels.
- Übertragen Sie das Gehirn vorsichtig in eine frische 30-mm-Schale mit eiskaltem PBS.
- Schneiden Sie das Gehirn in kleine Stücke mit einer Rasierklinge, um die Belastung der Probe auf der Spin-Säule zu erleichtern.
3. Single-Kern-Isolierung
- Übertragen Sie das gehackte Gewebe auf die im Kernisolationskit vorgesehene Filterpatrone und fügen Sie 200 L Kaltpuffer A hinzu, um das Gewebe zu sensibilisieren. Schleifen Sie das Gewebe mit der Kunststoffstange, die vom Kit für 2 min zur Verfügung gestellt wird.
- Fügen Sie 300 l Kaltpuffer A hinzu und inkubieren Sie die Filterpatrone auf Eis mit einer Kappe, die für 10 min geöffnet ist.
- Kappen Sie die Patrone und setzen Sie das Gewebe wieder auf, indem Sie das Rohr 5 Mal invertieren.
- Zentrifuge bei 16.000 x g für 30 s. In diesem Schritt werden Zellen beim Durchlaufen des Filters gebrochen und Hochgeschwindigkeitszentrifugalkraft angewendet. Der Durchfluss enthält intakte Kerne, die an der Unterseite des Rohres pellet.
- Entsorgen Sie den Filter und setzen Sie das Pellet wieder auf, indem Sie 10 s kräftig wirbeln.
- Pellet die Kerne durch Zentrifugieren der Lösung bei 500 x g für 3 min. Entsorgen Sie den Überstand sorgfältig, da das Kernpellet farblos ist.
- Das Pellet in 0,8 ml Kaltpuffer B und Zentrifuge bei 600 x g 10 min wieder aufsetzen. In diesem Schritt werden Kerne von Membranablagerungen getrennt. Das erhaltene farblose Pellet enthält isolierte Kerne.
- Setzen Sie die isolierten Kerne in 500 l PBS mit 5% BSA aus. Halten Sie die Kerne Suspension auf Eis, um FACS nach der Quantifizierung durchzuführen.
4. Visualisierung der Kernmorphologie
- Bestätigen Sie die kerntechnische Morphologie von Hoechst Färbung. Entfernen Sie dazu mit BSA-beschichteten Spitzen 100 l Einzelkernaufhängung in einem neuen Rohr. Um die Kerne zu färben, fügen Sie 0,1 l Von Hoechst (1 mg/ml) hinzu. Sanft wirbeln die Röhre.
- Übertragen Sie die Kernaufhängung zur Bildgebung auf die Glasbodenschale.
- Stellen Sie die Kerne mit einem Fluoreszenzmikroskop mit Laseranregungseinstellungen von einer Wellenlänge von 405 nm (Violett) auf.
5. FACS-basierte Anreicherung von Kernen
- Vor der Durchführung von FACS filtern Sie die Kerne mit einem 40-m-Zellsieb in ein BSA-beschichtetes Rohr.
- Verdünnen Sie die gefilterte Suspension, indem Sie PBS mit 5% BSA zu einem Endvolumen von 1.000 l hinzufügen.
- Beschriften Sie zwei runde FACS-Rohre als "Kontrolle" und "befleckt". Das "Kontrollrohr" enthält ungefärbte Kerne, während das "gefärbte" Rohr Mithoechst-gebeizte Kerne hat.
- Übertragen Sie 250 l der Kernaufhängung mit BSA-beschichteter Pipettenspitze in das "Steuerrohr".
- Übertragen Sie die verbleibende 750-L-Lösung in das als "gefleckt" gekennzeichnete FACS-Rohr und fügen Sie 1 L Hoechst-Farbstoff hinzu, um die Kerne zu färben. Mix durch langsames Wirbeln.
- Laden Sie die unbefleckte Kontrollprobe in den Zellsortierer. Rekord5000 Ereignisse.
- Laden Sie die gebeizten Proben, und zeichnen Sie 5000 Ereignisse auf.
- Zeichnen Sie FACS-Gates, die die Identifizierung einzelner Kerne ermöglichen. Kerne können durch den Vergleich des Hoechst-Fluoreszenzsignals zwischen Kontroll- und Gebeizprobe ausgewählt werden.
- Hoechst-positive Kerne aus dem gebeizten Rohr in ein neues 1,5 ml-Rohr mit 50 l PBS mit 5% BSA sortieren.
HINWEIS: Isolierte Kerne können je nach den Anforderungen der nachgeschalteten Anwendung in einem gewünschten Medium gesammelt werden.
Ergebnisse
--Das oben beschriebene Protokoll wurde verwendet, um einzelne Kernsuspension direkt aus Zebrafisch-Gehirngewebe zu erzeugen. Die Isolierung dauert in der Regel 20 Minuten und vermeidet die Verwendung von Waschmittel oder Verdauungsenzym. Eine schematische Zusammenfassung der einzelnen Schritte des Protokolls ist in Abbildung 1aufgeführt, die gedruckt werden kann, um sie als Anleitung zu verwenden.
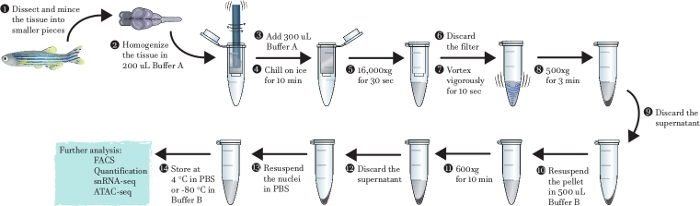
Abbildung 1: Schematische serniterfreie Spinspalten-basierte Methode zur Kernisolierung.
Grafische Darstellung der einzelnen Schritte, die bei der Extraktion von Kernen aus frischem Zebrafisch-Hirngewebe durchgeführt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Visualisierung der nuklearen Morphologie
Zur qualitativen Bestätigung der Kernmorphologie wurden die isolierten Kerne mit Hoechst befleckt und mittels Fluoreszenzmikroskopie visualisiert. Die Kerne erschienen intakt, rund und gut getrennt (Abbildung 2). Wichtig ist, dass die kernnukleare Aggregation, ein Zeichen für einen nuklearen Membranbruch, fehlte.
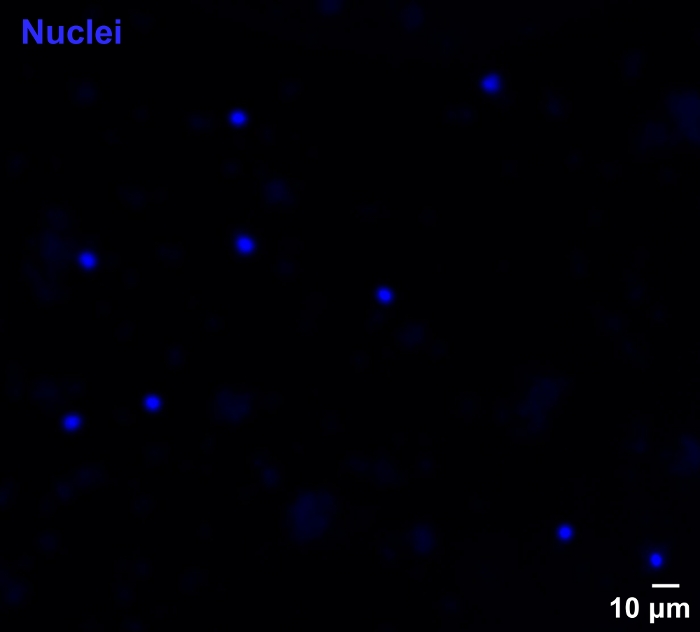
Abbildung 2: Isolation einzelner Kerne vom Zebrafischhirn.
Fluoreszenzmikroskopie Bild von Hoechst-gefärbten Kernen, die ihre intakte Morphologie demonstrieren. Maßstabsleiste: 10 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
FACS-basierte Anreicherung der intakten Kerne
Die Anreicherung isolierter Kerne und die Entfernung von Zellablagerungen wurde durch Durchflusszytometrie durch Gating auf das Vorhandensein eines Hoechst-Fluoreszenzsignals durchgeführt. Das Hoechst-Signal wurde bei Anregung mit Violett, 405 nm, Laser (Brilliant Violet 421 – BV421) erkannt. Ungefärbte Kerne zeigten Hintergrundfluoreszenz (Abbildung 3A, Zusatzabbildung 1A), während gefärbte Kerne ein starkes fluoreszierendes Signal zeigten (Abbildung 3B, Ergänzende Abbildung 1B). Wie in Abbildung 3Cdargestellt, waren die ungefleckten und Hoechst-Gebeikerne im violetten Kanal gut getrennt.
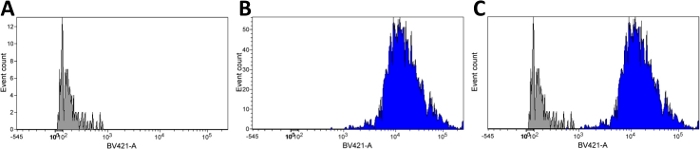
Abbildung 3: Isolierte Kerne zeigen starkes und spezifisches Hoechst-Fluoreszenzsignal in der Durchflusszytometrie.
Histogrammplots für einzelne Kerne Suspension mit der Verteilung der Hoechst Färbung. Hoechst begeistert von Violett, 405 nm, Laser (Brilliant Violet 421 – BV421). Die unbefleckte Probe (A) zeigt Signal im Bereich von 100-103an, während Hoechst gebeizte Kerne (B) Signal im Bereich von 103-105 aussenden. Eine Überlagerung der Fluoreszenzintensität, die von ungefärbten (grauen) und gebeizten (blauen) Proben (C) emittiert wird, zeigt eine klare Trennung zwischen den beiden Populationen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
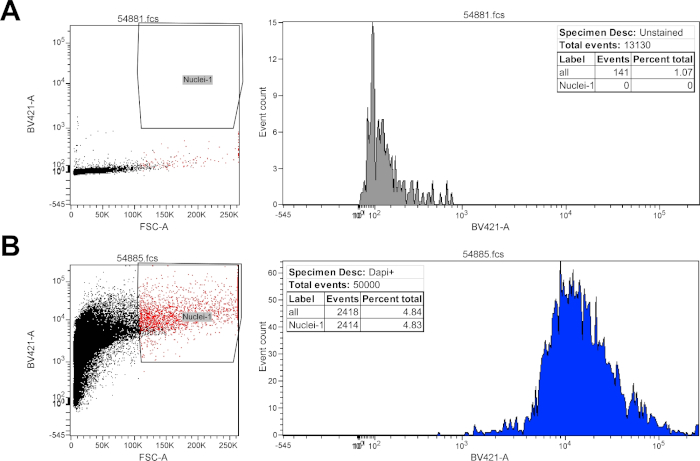
Ergänzende Abbildung 1: Flusszytometrie-Gating-Strategie für isolierte Kerne. Repräsentative Strömungsflächen für isolierte Kernaufhängung. Isolierte Kerne wurden mit Vorwärtsstreuung und Violettlaser BV421 analysiert, der Hoechst bei 405 nm anregt. Die unbefleckte Probe (A) zeigte das BV421-Signal im Bereich 100-103 an. Von 13130 Ereignissen wurden 141 Ereignisse als einzelne Kerne auf der Grundlage von FSC-A (1,07% der Gesamtsumme) und 0 Ereignisse für nicht befleckte Kerne auf der Grundlage des BV421-Signals (0% des Gesamtsignals) nachgewiesen. Die Hoechst-Buntkerne (B) zeigten das BV421-Signal im Bereich 103-105 an. Von 50000 Ereignissen wurden 2418 Ereignisse als Einzelkerne auf der Grundlage von FSC-A (4,84 % der Gesamtanzahl) und 2414 Ereignisse für Hoechst-positive Kerne auf Basis des BV421-Signals (4,83 % des Gesamtsignals) nachgewiesen. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Diskussion
Die Profilierung des Transkriptoms und des Epigenoms in einer einzelzelligen Auflösung hat die Untersuchung biologischer Systeme revolutioniert. Studien zur Auflösung einer einzelnen Zelle für ein festes Gewebe hängen von der Dissoziation des Organs in einzelne Zellen oder Kerne ab. Dissoziation ist ein destruktives Verfahren, das technische Artefakte einführen kann, die die Entwicklung einer genauen Darstellung des Systems5,6verhindern können. Zum Beispiel kann enzymatische Dissoziation Zellen mit komplexen Morphologien, wie Neuronen oder Podozyten, schädigen und die Expression von Stress und Hitzeschock-Antwort-Genen7,12induzieren. Zusätzlich kann die Verwendung von Reinigungsmittel während der Dissoziation die Kernmembran brechen und zur Aggregation23,25führen. Daher ist die Optimierung der Dissoziation, um eine Einzelzell- oder Kernsuspension von höchster Qualität zu erhalten, von größter Bedeutung für den Erfolg von Hochdurchsatz-Profiling-Experimenten.
Hier zeigen wir eine waschmittel- und enzymfreie Kernisolationsmethode, die die Extraktion intakter Kerne aus dem Zebrafischhirn in weniger als 20 Minuten ermöglicht. Das Protokoll liefert Kerne mit typischer Morphologie und robuster Integrität (Abbildung 2). Aus einem einzelnen Zebrafisch-Gehirn mit einem Gewicht von 6 mg ergibt das Protokoll insgesamt 60.000 Kerne, die durch eine Hämozytometerzahl bestimmt werden. Die isolierten Kerne können für mehrere nachgeschaltete Anwendungen verwendet werden, einschließlich snRNA-seq, ATAC-seq und Immunostaining. Die isolierten Kerne können Kreuzkontaminationen aus zytoplasmatischen Fraktionen umfassen, insbesondere aus Komponenten von endoplasmatischem Retikulum und Mitochondrien. Für Hochdurchsatz-Profiling-Experimente wird dringend die Clearance von Zellablagerungen, insbesondere Mitochondrien, empfohlen. Die Durchflusszytometrie (Abbildung 3) bietet eine praktikable Option für die Reinigung von Kernen. Alternativ kann der Saccharosegradient auch zur Beseitigung von Schmutz verwendet werden.
Das Protokoll wurde an der Schilddrüse der Maus getestet (Daten nicht gezeigt) und liefert Ähnliche Ergebnisse wie Zebrafisch-Gehirngewebe. Insgesamt bietet das Protokoll eine robuste, reproduzierbare und universelle Methode zur Herstellung einer Einzelkernsuspension, die dazu beiträgt, die Logistik für Profiling-Experimente mit hohem Durchsatz zu vereinfachen.
Offenlegungen
Die Autoren haben keinen Interessenkonflikt. Die Zahlung für den offenen Zugang des Artikels wurde von Invent Biotechnologies Inc., USA, geleistet.
Danksagungen
Wir danken den Mitgliedern des Labors von Dr. Sabine Costagliola und Singh für die Kommentare zum Manuskript. Diese Arbeit wurde vom Fonds de la Recherche Scientifique-FNRS unter der Grant-Nummer 34772792 – MISU an S.P.S. unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Bovine serum albumin (BSA) | Carl Roth | 90604-29-8 | Albumin fraction V |
| Cell sorter | BD Biosciences | FACSAria III | |
| Centrifuge | Sartorius | A-14C | |
| Eppendorf tubes (1.5 mL) | Eppendorf | 22363204 | |
| Falcon (15 mL) | Corning | 352096 | Polypropylene centrifuge tubes |
| Falcon (5 mL ) | Corning | 352052 | Polystyrene round bottom test tubes |
| Fine forceps | Fine Science Tools | 11295-10 | |
| Flowmi cell strainer (40 μm) | Sigma | BAH136800040 | |
| Fluorescence microscope | Leica | DMI6000 B | |
| Glass bottle (250 mL) | VWR | 215-1593 | |
| Glass bottomed dish | World Precision Instruments | FD3510-100 | Fluorodish 35 mm |
| Glass Pasteur pipettes | VWR | 612-1701 | |
| Glass pipette socket | Carl Roth | 388.1 | Pipetting aid pi-pump 2500 |
| Hoechst staining dye solution | Abcam | ab228551 | Hoechst 33342 |
| Minute Detergent-Free Nuclei Isolation Kit | Invent Biotechnologies | NI-024 | |
| PBS (10X) | ThermoFisher | 70011069 | |
| Petri dish (30 mm) | FisherScientific | 11333704 | Pyrex |
| Petri dish (90 mm) | Corning | 758-10178-CS | Gosselin |
| Pipette tips | VWR | 89079 | 10 μL, 200 μL, 1000 μL |
| Pipettes | Gilson | F167380 | Pipetman |
| Razor blade | Swann-Morton | 7981809 | |
| Tricaine methane sulfonate | Sigma | E10521 | |
| Vortex machine | Scientific Industries | SI-0236 | Vortex-Genie 2 |
Referenzen
- Ebrahimi Dastgurdi, M., Ejeian, F., Nematollahi, M., Motaghi, A., Nasr-Esfahani, M. H. Comparison of two digestion strategies on characteristics and differentiation potential of human dental pulp stem cells. Archives of Oral Biology. 93, 74-79 (2018).
- Stenn, K. S., Link, R., Moellmann, G., Madri, J., Kuklinska, E. Dispase, a neutral protease from Bacillus polymyxa, is a powerful fibronectinase and type IV collagenase. Journal of Investigative Dermatology. 93 (2), 287-290 (1989).
- Khan, M. R., Chandrashekran, A., Smith, R. K. W., Dudhia, J. Immunophenotypic characterization of ovine mesenchymal stem cells. Cytometry Part A. 89 (5), 443-450 (2016).
- Cavanagh, T. J., Lakey, J. R. T., Wright, M. J., Fetterhoff, T., Wile, K. Crude collagenase loses islet-isolating efficacy regardless of storage conditions. Transplantation Proceedings. 29 (4), 1942-1944 (1997).
- Massoni-Badosa, R., et al. Sampling artifacts in single-cell genomics cohort studies. bioRxiv. , (2020).
- Van Den Brink, S. C., et al. Single-cell sequencing reveals dissociation-induced gene expression in tissue subpopulations. Nature Methods. 14 (10), 935-936 (2017).
- O'Flanagan, C. H., et al. Dissociation of solid tumour tissues with cold active protease for single-cell RNA-seq minimizes conserved collagenase-associated stress responses. Bioarxiv. 683227, (2019).
- Bakken, T. E., et al. Single-nucleus and single-cell transcriptomes compared in matched cortical cell types. Plos One. 13 (12), 0209648(2018).
- Lake, B. B., et al. A single-nucleus RNA-sequencing pipeline to decipher the molecular anatomy and pathophysiology of human kidneys. Nature Communications. 10 (1), (2019).
- Rajbhandari, P., et al. Single cell analysis reveals immune cell-adipocyte crosstalk regulating the transcription of thermogenic adipocytes. eLife. 8, (2019).
- Hagberg, C. E., et al. Flow Cytometry of Mouse and Human Adipocytes for the Analysis of Browning and Cellular Heterogeneity. Cell Reports. 24 (10), 2746-2756 (2018).
- Wu, H., Kirita, Y., Donnelly, E. L., Humphreys, B. D. Advantages of single-nucleus over single-cell RNA sequencing of adult kidney: Rare cell types and novel cell states revealed in fibrosis. Journal of the American Society of Nephrology. 30 (1), 23-32 (2019).
- Lacar, B., et al. Nuclear RNA-seq of single neurons reveals molecular signatures of activation. Nature Communications. 7 (1), 1-13 (2016).
- Habib, N., et al. Div-Seq: Single-nucleus RNA-Seq reveals dynamics of rare adult newborn neurons. Science. 353 (6302), 925-928 (2016).
- Thrupp, N., et al. Single nucleus sequencing fails to detect microglial activation in human tissue. bioRxiv. , (2020).
- Selewa, A., et al. Systematic Comparison of High-throughput Single-Cell and Single-Nucleus Transcriptomes during Cardiomyocyte Differentiation. Scientific Reports. 10 (1), 1-13 (2020).
- Lake, B. B., et al. A comparative strategy for single-nucleus and single-cell transcriptomes confirms accuracy in predicted cell-type expression from nuclear RNA. Scientific Reports. 7 (1), 1-8 (2017).
- Jiang, Y., Matevossian, A., Huang, H. S., Straubhaar, J., Akbarian, S. Isolation of neuronal chromatin from brain tissue. BMC Neuroscience. 9, 42(2008).
- Krishnaswami, S. R., et al. Using single nuclei for RNA-seq to capture the transcriptome of postmortem neurons. Nature Protocols. 11 (3), 499-524 (2016).
- Birnie, G. D. Isolation of Nuclei from Animal Cells in Culture. Methods in Cell Biology. 17, 13-26 (1978).
- Dounce, A. L., Witter, R. F., Monty, K. J., Pate, S., Cottone, M. A. A method for isolating intact mitochondria and nuclei from the same homogenate, and the influence of mitochondrial destruction on the properties of cell nuclei. The Journal of Biophysical and Biochemical Cytology. 1 (2), 139-153 (1955).
- Hymer, W. C., Kuff, E. L. Isolation of Nuclei From Mammalian Tissues Through the Use of Triton X-100. The journal of Histochemistry and Cytochemistry. 12, 359-363 (1964).
- Johnson, M. Detergents: Triton X-100, Tween-20, and More. Materials and Methods. 3, (2013).
- Sikorskaite, S., Rajamäki, M. L., Baniulis, D., Stanys, V., Valkonen, J. P. T. Protocol: Optimised methodology for isolation of nuclei from leaves of species in the Solanaceae and Rosaceae families. Plant Methods. 9 (1), 31(2013).
- Graham, J., Rickwood, D. Subcellular fractionation: a practical approach. , IRL Press. (1997).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten