Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Etablierung eines Octopus-Ökosystems für die biomedizinische und biotechnologische Forschung
In diesem Artikel
Zusammenfassung
Das Verständnis der einzigartigen physiologischen und anatomischen Strukturen von Kraken kann die biomedizinische Forschung stark beeinflussen. Dieser Leitfaden zeigt, wie eine Meeresumwelt eingerichtet und erhalten werden kann, um diese Art unterzubringen, und enthält modernste Bildgebungs- und Analyseansätze, um die Anatomie und Funktion des Nervensystems des Oktopus zu visualisieren.
Zusammenfassung
Viele Entwicklungen in der biomedizinischen Forschung wurden durch die Entdeckung anatomischer und zellulärer Mechanismen inspiriert, die bestimmte Funktionen bei verschiedenen Arten unterstützen. Der Oktopus ist eines dieser außergewöhnlichen Tiere, das Wissenschaftlern neue Einblicke in die Bereiche Neurowissenschaften, Robotik, regenerative Medizin und Prothetik gegeben hat. Die Forschung mit dieser Kopffüßerart erfordert die Einrichtung komplexer Einrichtungen und eine intensive Pflege sowohl für den Oktopus als auch für sein Ökosystem, die für den Erfolg des Projekts entscheidend ist. Dieses System erfordert mehrere mechanische und biologische Filtersysteme, um dem Tier eine sichere und saubere Umgebung zu bieten. Zusammen mit dem Steuerungssystem sind spezielle routinemäßige Wartungs- und Reinigungsarbeiten erforderlich, um die Anlage langfristig effektiv in Betrieb zu halten. Es wird empfohlen, diesen intelligenten Tieren eine bereicherte Umgebung zu bieten, indem die Landschaft des Tanks verändert, eine Vielzahl von Beutetieren einbezogen und herausfordernde Aufgaben für sie eingeführt werden. Unsere Ergebnisse umfassen MRT und eine Ganzkörper-Autofluoreszenz-Bildgebung sowie Verhaltensstudien, um ihr Nervensystem besser zu verstehen. Kraken besitzen eine einzigartige Physiologie, die viele Bereiche der biomedizinischen Forschung beeinflussen kann. Ihnen ein nachhaltiges Ökosystem zur Verfügung zu stellen, ist der erste entscheidende Schritt, um ihre unterschiedlichen Fähigkeiten aufzudecken.
Einleitung
Neue Konzepte in der biomedizinischen Forschung und der biomedizinischen Technik werden oft durch die Identifizierung spezifischer Strategien inspiriert, die biologische Arten besitzen, um umweltbedingte und physiologische Bedingungen und Herausforderungen anzugehen. Zum Beispiel hat das Verständnis der Fluoreszenzeigenschaften in Glühwürmchen zur Entwicklung neuer Fluoreszenzsensoren geführt, die die zelluläre Aktivität in anderen Modellorganismen melden können1; Die Identifizierung von Ionenkanälen, die durch Licht in Algen aktiviert werden, hat zur Entwicklung einer zellulären und zeitspezifischen lichtbasierten Neuromodulation geführt2,3,4,5; Die Entdeckung von Proteinen in Glaswelsen, die entsprechend dem Erdmagnetfeld navigieren, hat zur Entwicklung der magnetbasierten Neuromodulation geführt6,7,8,9,10,11; Das Verständnis des Siphonreflexes in Aplysia war entscheidend für das Verständnis der zellulären Grundlage des Verhaltens12,13,14.
Die Forscher erweitern weiterhin die aktuelle biotechnische und phylogenetische Toolbox, indem sie die einzigartigen Stärken und neuen Perspektiven auf physiologische Funktionen nutzen, die nicht-konventionelle Laborspezies haben. Bundesbehörden beginnen, diese Studienlinien zu unterstützen, indem sie neuartige Arbeiten an verschiedenen Arten finanzieren.
Eine Tiergattung mit einzigartigen Anatomie- und Regenerationsfähigkeiten sowie der adaptiven Kontrolle jedes ihrer Arme, faszinierenden Biologen und Ingenieuren und einem faszinierenden Publikum aus allen Teilen der Gesellschaft ist der Octopus17. Tatsächlich wurden in den letzten Jahrzehnten viele Aspekte der Physiologie und des Verhaltens des Oktopus untersucht15,16,17,18,19,20,21,22,23,24,25,26 . Jüngste Entwicklungen in den Bereichen Molekular- und Evolutionsbiologie, Robotik, Bewegungsaufzeichnung, Bildgebung, maschinelles Lernen und Elektrophysiologie beschleunigen jedoch Entdeckungen im Zusammenhang mit der Physiologie und dem Verhalten von Tintenfischen und übersetzen sie in innovative biotechnologische Strategien27,28,29,30,31,32,33,34,35 ,36,37,38,39.
Hier beschreiben wir, wie die Oktopushaltung eingerichtet und gepflegt wird, die für Wissenschaftler und Ingenieure mit unterschiedlichen Hintergründen, wissenschaftlichen Interessen und Zielen von Interesse und Relevanz ist. Nichtsdestotrotz konzentrieren sich unsere Ergebnisse auf die Anwendung von Kraken in den Neurowissenschaften und der neuroengineering Forschung. Der Oktopus hat ein hoch entwickeltes Nervensystem mit 45 Millionen Neuronen im zentralen Gehirn, 180 Millionen Neuronen in den Optischen Lappen und zusätzlichen 350 Millionen Neuronen in den acht axialen Schnüren und peripheren Ganglien; Im Vergleich dazu hat ein Hund eine ähnliche Anzahl von Neuronen und eine Katze nur die Hälfte davon40. Im Gegensatz zum Nervensystem der Wirbeltiere gibt es nur 32K efferente und 140K afferente Fasern, die die Millionen von Neuronen im Gehirn des Oktopus mit den Millionen von Neuronen in jedem der axialen Schnüre ihres Arms verbinden40,41,42. Diese relativ wenigen miteinander verbundenen Fasern deuten darauf hin, dass die meisten Details für die Ausführung der motorischen Programme in der axialen Schnur selbst ausgeführt werden, was die einzigartig verteilte neuronale Kontrolle der Kraken betont. Die Arme des Oktopus verfügen über eine außergewöhnliche feinmotorische Kontrolle, die es ihnen ermöglicht, Manipulationsfähigkeiten wie das Öffnen von Glasdeckeln zu erlernen, selbst wenn sie sich im Behälter befinden. Diese hochentwickelte Greifmotorik ist einzigartig in der Klasse der Kopffüßer (Oktopus, Tintenfisch und Tintenfisch)43.
Tatsächlich hat der Oktopus in Hunderten von Millionen Jahren der Evolution ein bemerkenswertes und ausgeklügeltes Genom und physiologisches System entwickelt43,44, das neue Entwicklungen und Fortschritte in wissenschaftlichen und technischen Bereichen inspiriert hat. Beispielsweise kann ein wasserabweisendes Klebepflaster, das auf der anatomischen Struktur der Saugnäpfe des Oktopus basiert, an nassen und trockenen Oberflächen haften bleiben45; Ein synthetisches Tarnmaterial, das von der Tarnhaut des Oktopus inspiriert ist, kann eine flache 2D-Oberfläche in eine dreidimensionale oberfläche mit Unebenheiten und Gruben verwandeln46. Miniatur-Soft- und autonome Roboter (z. B. Octobots), die in Zukunft als chirurgische Werkzeuge im Inneren des Körpers dienen könnten47; und ein Arm (z.B. OctoArm), der an einem panzerartigen Roboter48 befestigt ist, wurden ebenfalls entwickelt. Viele Arten von Kraken werden in der biomedizinischen Forschung verwendet, z. B. Octopus vulgaris, Octopus sinensis, Octopus variabilis und Octopus bimaculoides (O. bimaculoides); die O. vulgaris und O. bimaculoides sind die häufigsten34,49,50. Die jüngste Sequenzierung verschiedener Oktopus-Genome macht diese Gattung von besonderem Interesse und eröffnet neue Grenzen in der Tintenfischforschung34,43,51,52.
O. bimaculoides, das in unserem Setup verwendet wird, ist eine mittelgroße Tintenfischart, die erstmals 1949 entdeckt wurde und in flachen Gewässern vor der Nordostpazifikküste von Zentralkalifornien bis südlich der Halbinsel Baja California gefunden werden kann17. Es kann an den falschen Augenflecken auf seinem Mantel unter seinen Augen erkannt werden. Im Vergleich zu Giant Pacific Octopus (Enteroctopus dofleini) und Common Octopus (O. vulgaris) ist der California Two-Spot Octopus (O. bimaculoides) relativ klein, beginnt kleiner als ein paar Zentimeter und wächst schnell als Jungtier. Wenn sie in einem Labor aufgezogen wird, kann die größe des erwachsenen Mantels auf eine durchschnittliche Größe von 100 cm anwachsen und bis zu 800 g wiegen53,54. Kraken haben eine schnelle Wachstumsphase innerhalb ihrer ersten 200 Tage; Bis dahin gelten sie als Erwachsene und wachsen für den Rest ihres Lebens weiter55,56,57. Kraken können kannibalistisch sein, besonders wenn beide Geschlechter zusammen in einem Tank untergebracht sind; Daher müssen sie einzeln in separaten Tanks untergebracht werden58.
Protokoll
Alle Tierversuche wurden vom Institutional Animal Care and Use Committee (IACUC) der Michigan State University genehmigt.
1. Einrichtung der Octopus-Tankausrüstung
- Erhalten Sie zunächst alle nicht-biologischen Materialien für ein Aquarium, die in das Meeresumweltsystem integriert werden, wie in der Materialtabelle gezeigt. Die Größen sind in Zoll angegeben.
- Waschen Sie alle Teile des Schlauch-, Rohrleitungs- und Filtersystems vor der Installation mit 70% Ethanol und entionisiertem (DI) Wasser. Verwenden Sie beim Reinigen keine Seife oder andere Chemikalien.
- Platzieren Sie einen Fiberglastisch 13 Zoll x 49 Zoll x 1/2 Zoll (Teil #71) mit vier Tischbeinen aus Kohlefaser und mit den Abmessungen 2 Zoll x 2 Zoll x 23 Zoll (Teil #72). Befestigen Sie die Beine direkt unter den Ecken der Tischplatte.
- Platzieren Sie unter der Oberseite, zwischen jedem der Tischbeine, 2 Zoll x 2 Zoll lange (Teil Nr. 72) Kohlefaser-Stabilisierungsstreben, die an der Unterseite des Tisches und direkt am Rand des oberen Regals befestigt sind. Befestigen Sie mit Schrauben ein weiteres Regal mit den gleichen Abmessungen direkt auf dem Boden unter dem Tisch. Lassen Sie die Pumpe (siehe Materialtabelle) direkt auf der unteren Regalfläche sitzen, während der Tank auf der Oberseite sitzt. Dieses System ist in Abbildung 1 dargestellt.
HINWEIS: Die Wasserabgabe aus dem Tank wird schwerkraftgefüttert und alle Schläuche, mit Ausnahme derjenigen, die in den Tank ein- und aussteigen, müssen niedriger sein als der Boden des Tanks, um einen maximalen Entwässerungskopfdruck zu gewährleisten.

Abbildung 1: Aufbau des Octopus-Panzers. Wasserein- und -auslass (a). Drei Oktopustanks mit einer Fläche von jeweils 1,22 m x 0,3 m (b). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Bohren Sie ein einzelnes 13/4-Zoll-Loch, 2 Zoll von einer der Seiten des Tanks, mit Glasschneidebohrern. Die Unterseite des Absaugsiebs für den Wasserausgang bestimmt die Höhe der Ausgangsbohrung, wie auf der rechten Seite von Abbildung 2a dargestellt. Der Wasserstand wird durch das Saugsieb bestimmt und muss mindestens 6 Zoll von der Oberseite des Tanks entfernt sein, um eine Wasserspritzzone zu ermöglichen.
- Verwenden Sie eine PVC-Grundierung und Zement, um die Abschnitte dauerhaft zu verbinden. Um dies zu tun, schieben Sie zunächst das Ende des vorgesehenen männlichen PVC-Rohrs in das Ende des weiblichen Rohrs. Legen Sie ein Stück Malerband auf die Außenseite des männlichen Teils, das noch sichtbar ist, um zu verhindern, dass die Grundierung und der Zement auf der Außenseite des Rohres sichtbar werden. Trennen Sie die Teile nach dem Kleben und legen Sie nach dem Auftragen des Zements im selben Bereich eine leichte Grundierung auf die Außenseite des Rohres.
- Passen Sie das Männliche Rohr so schnell wie möglich nach dem Auftragen von Zement in das weibliche Rohr um und entfernen Sie das Klebeband. 24 h nach dem Auftragen der Grundierung und des Zements die neu verbundenen Teile mit DI-Wasser auswaschen. Für die Aushärtungszeit schauen Sie sich das Zementprodukt für weitere Richtungen an.
HINWEIS: Stellen Sie sicher, dass die Einrichtung aller Schläuche und Geräte ordnungsgemäß platziert ist, bevor PVC-Primer und Zement verwendet werden. Die Anforderungen an die Rohrlänge können variieren. - Verbinden Sie als Nächstes das 1-Zoll-Außendurchmesser (OD) -Ende des Saugsiebs dauerhaft mit dem 1-Zoll-Innendurchmesser (ID) -Ende des Ellenbogengelenks. Verbinden Sie das Ende des Ellenbogengelenks mit einem geraden PVC-Schlauch (1 Zoll OD). Verbinden Sie die andere Seite des geraden Schlauches dann mit der 1-Zoll-ID der durchgehenden geraden Adapterbuchse verbinden.
HINWEIS: ID bezieht sich auf den größten Abstand zwischen den Innenwänden des Rohrs. OD bezieht sich auf die Außenseite der Rohrbreite. - Verbinden Sie den durchgehenden geraden Adapter dauerhaft mit einem geraden 4 Zoll langen PVC-Rohr mit einem 1 Zoll AUßEN (ab Schritt 1.8). Dieses Rohr zeigt aus dem Tank.
- Verbinden Sie das gerade Rohr dauerhaft mit der Mitte des PVC-Verbinders (1 Zoll ID Tee-Form; ab Schritt 1.9). Verbinden Sie als Nächstes permanent zwei 6 Zoll lange (Teil Nr. 69) Rohre (1 Zoll OD) mit den beiden gegenüberliegenden Enden des T-Shirts - eines zeigt direkt nach oben für die Luftabgabe und das andere direkt nach unten für den Wasserfluss.
- Verbinden Sie das nach unten verlängerte gerade Rohr (ab Schritt 1.10) dauerhaft mit einem geraden Adapter mit Widerhakenbuchse (1-Zoll-ID). Befestigen Sie einen 36 Zoll langen Gummischlauch (3/4 Zoll ID) am Stachelrohradapter.
- Platzieren Sie das Kühlsystem zwischen dem Wasserausgangsschlauch und dem Sumpfsystem.
- Befestigen Sie die mit dem System gelieferten 3/4-Zoll-Widerhaken an den Ein- und Ausgangsanschlüssen der Kältemaschine. Legen Sie den Gummischlauch (ab Schritt 1.11) auf die Einlassarmatur des Kühlers.
- Schließen Sie ein neues Stück 3/4-Zoll-ID-Rohr (aus Schritt 1.13) vom Kältemaschinenausgang (ab Schritt 1.12) an den Einlass des Sumpfsystems an, wie in Abbildung 2b dargestellt.
- Platzieren Sie als Nächstes den 4 Zoll x 12 Zoll großen Sockenfilter mit einer Porengröße von 200 μm in seinem vorgesehenen Bereich, wie in Abbildung 2 dargestellt. Platzieren Sie außerdem, wie in Abbildung 2 dargestellt, den Proteinabschäumer und die Rücklaufpumpe in den entsprechenden Bereichen. Befestigen Sie zusammen mit der Rücklaufpumpe das automatische Top-Off-Schwimmerventil an der Innenwand des Pumpenbereichs, 2 Zoll über der Oberseite des Wassereinlasses der Pumpe. Blockieren Sie nicht, dass die Pumpe bei Bedarf aus dem Tank entfernt wird.
- Schließen Sie ein gerades 12 Zoll langes Rohr (3/4 Zoll AUßEN) dauerhaft an den Auslass der Pumpe an (ab Schritt 1.15). Verbinden Sie am anderen Ende des geraden 3/4-Zoll-OD-Rohrs den OD des Rohrs dauerhaft mit einem 3/4-Zoll-ID-45 °-Ellenbogengelenk. Verbinden Sie am anderen Ende des Gelenks dauerhaft einen 3/4-Zoll-OD-Schlauch.
- Befestigen Sie das andere Ende des geraden Rohres (ab Schritt 1.16) an der 3/4-Zoll-ID eines geraden Reduzieradapters. Verbinden Sie das größere Adapterende (2-Zoll-AUßEN) dauerhaft mit dem Eingang des UV-Lichts.
HINWEIS: Gerade Schlauchlängen können variieren. - Passen Sie als Nächstes die Platzierung des UV-Lichteinlasses mit dem Ausgangsrohr der Pumpe (ab Schritt 1.17) ab, damit sich das Rohr nicht zwischen Licht und Pumpe verbiegt (ab Schritt 1.15). Bohren Sie Löcher in die Stabilisierungsstrebe, um sie an die Befestigungslöcher für UV-Licht anzupassen. Passen Sie die Größe der Schrauben mit dem Bohrer an und befestigen Sie das UV-Licht mit den angegebenen Schrauben am Tisch.
- Schließen Sie die 2-Zoll-Seite eines anderen Reduzieradapters dauerhaft an die Ausgabe des UV-Lichts an (ab Schritt 1.18). Befestigen Sie eine 1-Zoll-AUßENseite eines 5 Zoll langen geraden Rohrs an der 1-Zoll-ID des Adapters. Als nächstes verbinden Sie ein 90 ° -Eckstück mit der 1-Zoll-ID mit dem 1-Zoll-OD-Rohr. das unbefestigte Ende des Eckstücks zeigt auf die Seite des Tanks, auf die der Wassereintrag gehen soll (gleiche Seite wie in Schritt 1.5).
- Verbinden Sie das andere Ende der Ecke (ab Schritt 1.19) dauerhaft mit einem 6 Zoll langen Rohr (Teil Nr. 69) mit 1 Zoll AUßEN mit dem Eingang der Durchflusskontrolleinheit (Teil Nr. 2). Schließen Sie ein weiteres 1-Zoll-OD-Rohr (Teil Nr. 69) dauerhaft an den Ausgang der Durchflussüberwachungseinheit an; Die Länge muss mindestens 3 Zoll über die Seite des Tanks hinausgehen.
- Schneiden Sie mit einem 13/4-Zoll-Glasschneidbohrer (Teil Nr. 1) ein neues Loch 3 Zoll über der vorgesehenen Wasserlinie und 2 Zoll von der Seite des Tanks entfernt (Abbildung 1a) auf der Seite gegenüber der Mitwasseraustrittsbohrung. Befestigen Sie eine weitere Durchgangswandverschraubung mit einem 1-Zoll-Schlupf (Teil Nr. 77), der aus dem Tank heraus zeigt.
- An den Schottenschlupf ein gerades Rohr mit dem 1-Zoll-Außendurchmesser und der 4 Zoll Länge (Teil #69) dauerhaft anschließen. Schneiden Sie den Schlauch ab dem letzten Teil von Schritt 1.21 ab, um den Abstand anzupassen, über den sich dieser Schlauch vom Tank erstreckt. Verbinden Sie dauerhaft ein 90 °-Rohr (Teil Nr. 65) mit jedem der offenen Rohre und schneiden Sie ein abschließendes 1-Zoll-OD-Geraderohr (Teil Nr. 69), das beide Eckstücke dauerhaft verbindet.
HINWEIS: Abbildung 3 zeigt eine einfache Darstellung des Aquariensystems. - Richten Sie den Rest des Steuerungssystems ein (Teil Nr. 34) und montieren Sie zuerst die Steckdosenleiste (Teil Nr. 53) am Tisch selbst oder an einer nahe gelegenen Wand. Montieren Sie daneben das Fluidüberwachungsmodul (Teil #2).
- Schließen Sie den Durchflusssensor, die Steckdosenleiste und die Lecksuchsensoren an das Modul an. Stellen Sie das Wachstumslicht (Teil Nr. 26) auf, das an der Algentonne befestigt ist (Abbildung 2).
- Schließen Sie den Durchflusssensor, das UV-Licht, das Wachstumslicht, die Pumpe und den Proteinskimmer an den Energiebalken an. Richten Sie die Programmierung der Wassersteuerung gemäß der Bedienungsanleitung des Herstellers ein.
- Bereiten Sie Salzwasser vor, indem Sie eine halbe Tasse handelsübliche Salzmischung mit 1 Gallone Umkehrosmose (RO) oder deionisiertem (DI) Wasser mischen. Machen Sie 45 Gallonen, um einen Tank und ein Sumpfsystem vollständig zu füllen.
- Schalten Sie die Pumpe im Durchflussregler des Sumpfsystems ein und fügen Sie Salzwasser hinzu, bis sich das automatische Abdeckventil in der Aus-Position befindet, sodass kein zusätzliches Frischwasser erforderlich ist.
- Sobald das Wasser voll ist, stoppen Sie das Befüllen und schalten Sie die Wasserkühleinheit ein, um die Temperatur zwischen 18 ° C und 22 ° C einzustellen, da dies der bevorzugte Temperaturbereich ist53. Schalten Sie den Proteinskimmer ein.
- Fügen Sie 30 kg zerkleinerte Korallen auf den Boden des Tanks sowie eine Schicht zerkleinerter Korallen auf den Boden des Algenbehälters hinzu. Fügen Sie der Oktopus-Umgebung mehrere lebende Felsen und andere Ergänzungen hinzu. Legen Sie eine Oberseite auf, um die Öffnung des Tanks abzudecken.
HINWEIS: Lebende Felsen sind tote Korallen, die von makroskopischen Meereslebewesen wie Bakterien und Algen bewohnt werden. - Fügen Sie nitrifizierende Bakterien hinzu, die in den Meerwasseraquarien verwendet werden, wie auf der Verpackung angegeben. Fügen Sie dies wie angewiesen hinzu und überprüfen Sie Temperatur, Salzgehalt, pH-Wert, Ammoniak, Nitrit und Nitrat täglich mit Wassertestkits, pH-Sensor und Temperatursensor. Sichere Werte für Ammoniak-, Nitrit- und Nitratwerte liegen unter 0,5 ppm, 0,25 ppm bzw. 10 ppm58.
- Stellen Sie sicher, dass uv-Licht für die Tage ausgeschaltet ist, an denen nitrifizierende Bakterien hinzugefügt werden, damit die Salzwassermikroorganismen wachsen können. Nachdem sich die Parameter im sicheren Bereich befinden, kann das UV-Licht reaktiviert werden.
- Nachdem das System eingerichtet ist, überprüfen Sie auch, ob der pH-Wert und die Sauerstoffversorgung bei 8,0-8,4
 bzw. 59 liegen. Bevor Sie Tiere in das Aquarium geben, überprüfen Sie mit einem Kupferwasser-Testkit das Vorhandensein von Kupfer- und Sauerstoffgehalten im System.
bzw. 59 liegen. Bevor Sie Tiere in das Aquarium geben, überprüfen Sie mit einem Kupferwasser-Testkit das Vorhandensein von Kupfer- und Sauerstoffgehalten im System.
HINWEIS: Kupfer verursacht Schäden an Wirbellosen und stört die Osmoregulation in Fischkiemen60,61. - Wenn Kupfer im Wasser gefunden wird, testen Sie die DI / RO-Wasserquelle. Nachdem Sie festgestellt haben, dass die Wasserquelle kein Kupfer enthält, führen Sie einen Wasserwechsel von 30% durch und legen Sie den Aktivkohleblock (Teil Nr. 46) in Wasser. Wenn das Problem weiterhin besteht, führen Sie einen vollständigen Wasserwechsel durch und reinigen Sie alle Teile.
- Nachdem alle Wasserparameter als sicher eingestuft wurden, fügen Sie mindestens eine Woche vor dem Hinzufügen der Oktopusse 10 Geistergarnelen in das System ein. Dies wird dazu beitragen, Biomasse für Bakterien einzuführen und die Gesamtwasserqualität anzuzeigen.
- Fügen Sie dem Algenbehälter zusätzliche Bewohner des Aquarienökosystems hinzu. Dazu gehören Chaetomorpha spp. (Spaghettialge), Trochus Sp. (gebänderte Trochusschnecke) und Mercenaria mercenaria (Kirschkernmuscheln).

Abbildung 2: Sumpfsystem. Seitenansicht des Sumpfsystems (a). Draufsicht auf das Sumpfsystem (b). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
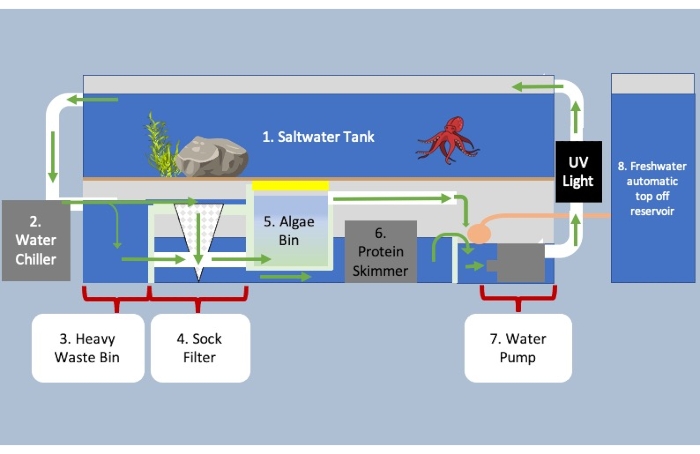
Abbildung 3: Aquarium mit Sumpffiltersystem unter dem Tank und Umweltkontrolleinheiten. Grüne Pfeile zeigen die Richtung des Wasserflusses durch das System an. Wasser, das von Abschnitt eins bis zwei zum Kühlen und auf drei fließt, um schwere biologische Stoffe von leichteren Stoffen zu trennen. Schwere Abfälle schwimmen nach unten und nach außen zu Abschnitt fünf, während die kleinere biologische Substanz innerhalb von Abschnitt vier in den Sockenfilter fließt. Wasser fließt von vier unter Abschnitt fünf und gelangt in den Proteinskimmer in sechs, um den verbleibenden Abfall im Wasser zu entfernen. Der Algenbehälter enthält Mikroorganismen, um Abfälle, Ammoniak und Nitrate abzubauen und das Wasser mit Sauerstoff zu versorgen. Im letzten Teil des Systems wird mehr Wasser hinzugefügt, um die Verdunstung zu berücksichtigen, bevor es zurück in den Tank gepumpt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Lagertanks
- Richten Sie zwei hohe 60-Gallonen-Wasserspeichertanks ein, einen für das Salzwasser und den anderen für RO-Wasser. Stellen Sie sicher, dass die maximale Fülllinie des Frischwassertanks höher ist als der Tisch. Befestigen Sie einen 1/4-Zoll-Schlauch an der automatischen Oberseite des Schwimmerventils im Sumpfsystem und befestigen Sie das andere Ende des Schlauches am Boden des Frischwassertanks.
HINWEIS: Dies ist zum Nachfüllen, wenn Wasser verdunstet. Salz bleibt im Wasser. - Füllen Sie den Salzwassertank mit Wasser und geben Sie die proportionale Menge Salz in den Tank. Belüften Sie den Salzwasserspeicher kontinuierlich für das Mischen und die richtige Sauerstoffversorgung. Warten Sie eine Stunde vor dem Gebrauch, um eine vollständige Vermischung des Salzes sicherzustellen.
HINWEIS: Der Salzwassertank ist nützlich, um die Tanks nach der Reinigung wieder aufzufüllen.
3. Einrichtung des Lebensmitteltanks
- Um Garnelen länger als eine Woche am Leben zu erhalten, lagern Sie sie in einem separaten Tank vom Oktopus mit einem Salzgehalt unter 30 ppt und einer Temperatur von fast 25 ° C.
- Um dies zu tun, eine Woche nachdem die Oktopustanks gereift sind, geben Sie 8 Gallonen gereiftes Salzwasser in den Garnelentank. Fügen Sie 15 kg zerkleinerte Korallen auf den Boden des Tanks hinzu. Fügen Sie dem Tank ein paar lebende Steine hinzu, um Verstecke für die Häutung zu finden (Abbildung 4).
HINWEIS: Gereiftes Meerwasser bezieht sich auf den Prozess, bei dem Meeresbakterien im Salzwasser wachsen können, wie in Schritt 1.30 gezeigt. - Befestigen Sie einen Kanisterfilter am Rand des Tanks. Richten Sie den Kanisterfilter nach Anweisung des Herstellers ein. Fügen Sie eine Luftpumpe neben dem Tank hinzu, der mit einem Rohr verbunden ist, in dem ein luftbefestigter Stein in den Tank eingelegt ist.
- Reinigen Sie den Filter und wechseln Sie die Filterpads jede Woche. Außerdem müssen 25% des Wassers gleichzeitig gewechselt werden. Überprüfen Sie stickstoff-, pH- und Temperaturparameter täglich in den Lebensmitteltanks mit Wassertestkits, wie in Schritt 1.30 beschrieben. Wenn die Wasserstickstoffparameter hoch bleiben, führen Sie zusätzliche Wasserwechsel durch und fügen Sie dem Wasser einen stickstoffabsorbierenden Beutel hinzu. oder wenn die Probleme länger als einen Monat anhalten, müssen die Garnelen in ein größeres Becken gebracht werden.
- Fügen Sie Garnelen hinzu, sobald zerkleinertes Korallensediment zerstreut ist. Um zuerst Garnelen hinzuzufügen, bewegen Sie die Garnelen bei der Ankunft, ohne Wasser für 5 Minuten in den kleinen Salzwassertank zu verschiffen, um Bioabfälle zu entfernen. Dann können die Garnelen direkt in den Tank gegeben werden. Moskitofische können bei der Ankunft direkt in das Garnelenbecken gegeben werden.
HINWEIS: Garnelen und Mückenfische können von jedem auf dem Materialblatt aufgeführten kommerziellen Lieferanten für lebende Tiere oder anderen Lebensmittellieferanten erworben werden. Es ist auch möglich, Oktopusse aufgetaute Garnelen anzubieten. - Füttern Sie Garnelen und Fische mit Fischflocken, abgestorbener Vegetation oder Algen62 gemäß den Anweisungen in der Nahrung.
- Für den Krabbentank fügen Sie 1 Gallone Salzwasser und 10 kg Kieselsteine hinzu. Stapeln Sie die Kieselsteine auf der einen Seite und lassen Sie trockenes Land auf der einen Seite und 2 cm Salzwasser auf der anderen Seite (wie in Abbildung 4 dargestellt). Die optimalen Umweltwasserparameter für diese Wirbellosen sollten 30-35 ppt bzw. 22-25 °C für Salzgehalt und Temperatur11,63 betragen.
- Fügen Sie Fiddler-Krabben direkt in den Tank hinzu (Abbildung 4). Krabben verbringen den größten Teil ihres Lebens an Land, können aber einige Tage am Stück unter Wasser sein, was den Tank, der teilweise unter Wasser steht, für ihr langfristiges Überleben entscheidend macht.
- Füttern Sie Fiddler-Krabben einmal täglich, indem Sie Fischflocken in die Schüssel auf dem trockenen Bereich des Tanks geben. Reinigen Sie wöchentlich, indem Sie Krabben entfernen und 100% des Salzwassers wechseln. Reinigen Sie die Kieselsteine.
- Lagern Sie Meeresmuscheln (Muscheln und Muscheln) in den Salzwassertanks, damit sich die Kraken öffnen und einen weiteren Wasserfiltermechanismus bereitstellen können64.
- Legen Sie die Muscheln in der ersten Woche in einen separaten, unbesetzten Tank, um eine unnötige Abfallladung auf das Filtersystem des Oktopustanks zu vermeiden.
HINWEIS: Während die Muscheln das Nahrungsmittel der Wahl des Oktopus waren, ist es wahrscheinlicher, dass sie bald nach der Ankunft sterben und den biologischen Abfall im Tank erheblich erhöhen, wenn sie in großen Mengen vorhanden sind.
4. Einbringen von Oktopus in den Tank
- Stellen Sie sicher, dass die Ammoniak-, Nitrit- und Nitratwerte unter 0,5 ppm, 0,25 ppm bzw. 10 ppm liegen. Halten Sie eine Wasserhandpumpe bereit, um Oktopus-Tinte aus dem Tank zu entfernen. Es wird auch empfohlen, zwei Personen für dieses Verfahren zu haben.
- Legen Sie den Beutel bei der Ankunft auf die Waage und ziehen Sie das Gewicht des Beutels ab, nachdem der Oktopus entfernt wurde. Fügen Sie dem Beutel einen Luftstein hinzu, um die Sauerstoffversorgung des Wassers zu erhöhen, während Sie das Tier in seinen Tank geben. Messen Sie die Temperatur und den Salzgehalt des Versandwassers. Erfassen Sie Fälle von längerer Krankheit nach dem Versand.
- Ohne Wasser aus dem Beutel in den Tank zu leiten, hängen Sie den Transportbeutel über die Ecke des Tanks, wobei der Beutel teilweise in das Tankwasser eingetaucht ist, um die Temperatur des Transportbeutels zu ändern. Entfernen Sie 10% des Wassers aus dem Beutel und kippen Sie die Spüle ab. Fügen Sie die gleiche Menge Wasser aus dem Tank in den Beutel hinzu. Wiederholen Sie dies alle 10 Minuten, bis sich die Wassertemperatur im Beutel nicht mehr als 1° von der Wassertemperatur im Tank unterscheidet.
- Sobald die Temperaturdifferenz des Beutels und des Tanks innerhalb von 1 ° liegt, stellen Sie sicher, dass Handschuhe getragen werden, um die Oktopusse zu ihrem individuellen Tank zu bewegen. Um sich zu bewegen, legen Sie beide Hände unter den Oktopus, um während des Transfers Unterstützung zu bieten; Die zweite Person muss die abgesaugten Arme vorsichtig von der Seite der Tasche ziehen.
- Sobald der Oktopus aus der Tasche ist, bewegen Sie ihn schnell in das Wasser seines neuen Lebensraums und übertragen Sie so wenig Wasser wie möglich aus dem Versandsack. Verwenden Sie die Handpumpe, um die Tinte zu entfernen, die der Oktopus im Tank freisetzt. Wiegen Sie nun den Beutel mit Wasser, um das ungefähre Gewicht des Tieres zu erhalten.
- Überwachen Sie in den ersten 2 Wochen nach der Ankunft den täglichen Verzehr des Oktopus, der etwa 4% bis 8% seines Gewichts betragen sollte58,65,66. Der Oktopus sollte viermal täglich überprüft werden; Dies kann nach 2 Wochen auf zweimal täglich reduziert werden. Wiegen Sie alle zwei Wochen, um ihren Nahrungsverbrauch nach Bedarf anzupassen.
HINWEIS: Es ist bekannt, dass einige Tintenfischarten aus ihrem Tank entweichen, daher ist es ratsam, ein Gewicht von 2,5 kg auf den Deckel ihres Tanks zu legen.
5. Tägliche Pflege
- Geben Sie mit einem handelsüblichen Salzwasser-Testkit für pH-Wert, Ammoniak, Nitrit und Nitrat die kit-gerichtete Menge Antankwasser zu den vier mit dem Kit gelieferten Reagenzgläsern hinzu. Wie auf dem Testkit angegeben, fügen Sie die Menge des kolorimetrischen Reaktanten in das entsprechende Röhrchen hinzu.
- Wenn die Ammoniak-, Nitrit- und Nitratwerte über 0,5 ppm, 0,25 ppm bzw. 10 ppm liegen, waschen Sie die Biomasse aus dem Sockenfilter oder wechseln Sie zu einem neuen Sockenfilter. Reinigen Sie zusätzlich Biomasse von der Oberseite des Skimmers mit einer Bürste und fügen Sie dem Tank zusätzliche denitrifizierende Bakterien hinzu. Wenn die Probleme weiterhin bestehen, ersetzen Sie 25% des frischen Salzwassers.
HINWEIS: Die oben genannten Schritte reduzieren Stickstoffverbindungen innerhalb des Ökosystems. - Entfernen Sie alle toten Krabben- und Garnelenkadaver aus dem Tank sowie alle Tintenfischfäkalien mit einer Handpumpe. Entfernen Sie alle verbleibenden lebenden Krabben aus dem Tank und bringen Sie sie zurück in den Lagertank. Als nächstes ordnen Sie große Objekte im Tank neu an.
- Geben Sie die Hälfte der Krabben, die der Oktopus täglich essen würde, in den Tank mit einem Gewicht von 1,25 +/- 0,25 g. Füttern Sie aufgetaute Garnelen oder kleine männliche Fiedlerkrabben an junge Kraken. Je nach Experiment können Krabben und Garnelen überall im Tank oder direkt in den Oktopus eingeführt werden.
HINWEIS: Der tägliche Nahrungsverbrauch der Kraken beträgt 4% -8% ihres Gewichts67. Gefrorene Garnelen können auch als Nahrungsquelle basierend auf dem Gewicht des Oktopus bereitgestellt werden. - Bieten Sie täglich fünf Geistergarnelen an. Im Durchschnitt wurden in diesem Experiment drei verbraucht. Um dem Oktopus eine Vielzahl von Nahrung zu geben, geben Sie einmal pro Woche eine lebende Muschel oder Muschel und halten Sie immer drei Mückenfische im Tank.
HINWEIS: Es ist nicht erforderlich, den Tieren eine Vielzahl von Lebensmitteln zu geben, und kann verhindern, dass Tiere während der Versuche durch Futter angelockt werden. Der Fütterungsplan, der hier verwendet wird, um die Fütterung und das Verhalten von Tintenfischen am besten zu überwachen, besteht darin, die Hälfte der Anzahl der Krabben basierend auf dem Gewicht einzuführen und die Anzahl der Garnelen auf fünf Uhr morgens zu erhöhen. Am Abend die zweite Hälfte der Krabben in den Tank einführen.
6. Wöchentliche Hygiene
- Schalten Sie die Lichter für Skimmer, Pumpe und Algenbehälter aus, bevor Sie das Sumpfsystem reinigen. Schalten Sie dann das automatische Ventil des Systems aus, bevor Sie Wasser entfernen. Schließlich entfernen Sie den Skimmer und das gesamte Wasser nur aus dem Sumpfsystem.
- Schrubben Sie den Algenbehälter leicht, um den größten Teil der Biomasse von den Wänden zu entfernen. Reinigen Sie den Rest des Sumpfbereichs mit einer Bürste. Entfernen Sie den Sockenfilter, reinigen Sie ihn mit Essig und lassen Sie ihn trocknen. drehen Sie sich jede Woche mit einem anderen Sockenfilter und ersetzen Sie alle drei Monate durch neue. Entfernen und reinigen Sie die Biomasse wöchentlich von der Oberseite des Skimmers.
HINWEIS: Vermeiden Sie die Verwendung von Metall zum Reinigen des Kunststoffs, da dadurch Kratzer entstehen, die anfällig für mikrobielles Wachstum sein könnten. - Setzen Sie den Skimmer wieder in das System ein und beginnen Sie mit dem Nachfüllen mit Salzwasser. Wenn sich der Pumpenbereich zu füllen beginnt, können alle Systeme wieder eingeschaltet werden. Hören Sie auf, Wasser hinzuzufügen, wenn sich die automatische Oberseite des Schwimmerventils in der Aus-Position befindet.

Abbildung 4: Tank für Fiedlerkrabben (Minuca pugnax). Der Boden des Tanks ist zur Hälfte für trockenes Bett und die andere Hälfte für 2 cm flaches Salzwasser bestimmt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Tank für Geistergarnelen (Palaemonetes paludosus). Felsen im Garnelenbecken bieten Platz für die Garnelen zum Verstecken und Häuten sowie für das Wachstum von Mikroorganismen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
7. Pflege kranker Tiere
- Befolgen Sie die Anleitung reference66 , um das Wohlbefinden von Oktopus zu beurteilen.
HINWEIS: Bei weiblichen Kraken beginnt das Ende des Lebenszyklus normalerweise nach dem Legen von Eiern. Das Tier wird beginnen, den Nahrungskonsum zu verringern und wird ganz aufhören zu essen und wird lethargischer. Die Lebensdauer nach dem End-of-Life-Prozess variiert. Es können keine weiteren Maßnahmen ergriffen werden, außer das Tier zu füttern und zu überwachen. Seneszente Männchen verringern den Nahrungskonsum und werden lethargisch68.
8. Oktopus-Anästhesie
- Führen Sie eine Oktopusanästhesie durch, wie in Butler-Struben et al.69 beschrieben.
- Besorgen Sie sich einen 6 L Behälter mit Deckel, der mindestens 15 cm hoch ist. Geben Sie 4 l Wasser direkt aus dem Tank des Oktopus in den Behälter und belüften Sie 4 l Salzwasser mit einer kleinen Luftpumpe mit Luftstein, um Sauerstoff in die Wasserumgebung zu verteilen58.
- Vor der Einführung des Oktopus 1% EtOH in den Behälter geben. Bevor Sie mit dem Oktopus umgehen, notieren Sie die Anzahl der Atemzüge pro Minute, indem Sie die Ausatmung von Wasser aus dem Siphon zählen.
HINWEIS: Für Oktopusse im Labor des Forschers beträgt die Grundatmung 16 - 24 Atemzüge pro Minute. - Bevor Sie den Oktopus bewegen, zeichnen Sie die Hautpigmentierung und die Grundatmungsrate des Oktopus auf. Nehmen Sie den Oktopus mit einem sauberen 4-Liter-Behälter mit offenem Mund aus dem Tank, indem Sie ihn mit dem umgebenden Wasser schöpfen.
HINWEIS: Während der Anästhesie weisen die Atemfrequenzen nicht unbedingt auf eine vollständige Anästhesie hin. - Wiegen Sie den Oktopus im Behälter und bewegen Sie ihn dann, indem Sie beide Hände um den Körper des Oktopus legen und ihn anheben. Eine zweite Person kann benötigt werden, um die abgesaugten Gliedmaßen von den Behälterwänden zu entfernen.
- Bewegen Sie den Oktopus schnell in den vorbereiteten Behälter mit 1% EtOH. Schließen Sie den Deckel, um eine mögliche Flucht zu verhindern.
- Zeichnen Sie die Atmung des Oktopus pro Minute auf, indem Sie die Ausatmung von Wasser aus dem Siphon am Ende der ersten 5 Minuten zählen. Wenn die Atmung über dem Ausgangswert bleibt und das Tier weiterhin auf einen leichten Druck reagiert, fügen Sie dem Wasser zusätzliche 0,25% EtOH hinzu. Die Zugabe von Ethanol zu Wasser kann bis zu einem Maximum von 3% EtOH fortgesetzt werden.
HINWEIS: Ein Hinweis darauf, dass der Oktopus bewusstlos ist, ist der Verlust der Kontrolle über seine Chromatophoren. In diesem Fall erscheint die Haut blasser als normal. Eine weitere Indikation ist, die Arme leicht einzuklemmen und zu testen, ob es eine motorische Reaktion gibt. Wenn es zu diesem Zeitpunkt immer noch keine Reaktion gibt, ist der Oktopus bewusstlos und es können Experimente durchgeführt werden. - Überwachen Sie während der Narkose die Atmung und Farbe des Oktopus, um sicherzustellen, dass er für die Dauer des Eingriffs bewusstlos bleibt. Wenn der Oktopus während des Eingriffs zu erwachen beginnt, fügen Sie zusätzliche 0,25% EtOH hinzu.
- Um die Auswirkungen der Ethanolanästhesie umzukehren, geben Sie den Oktopus aus seinem permanenten Fäkalientank in einen neuen Tank mit sauerstoffreichem Wasser mit 4 l oder mehr. Sobald sich die Atmung wieder normalisiert, wird der Oktopus aktiv und seine Haut kehrt zu normalen Pigmenten zurück; es kann zurück in seinen Tank bewegt werden.
9. Oktopus-Euthanasie
- Befolgen Sie die internationalen Standards für Oktopus-Euthanasie, wie in Fiorito et al., Moltschaniwskyj et al. und Butler-Struben et al57,58,69 beschrieben.
- Bereiten Sie einen neuen 6-Liter-Behälter mit 4 l Wasser aus dem Fäkalientank des Oktopus vor. Mischen Sie MgCl2 bis zu einer Konzentration von 4% in den Euthanasietank. Führen Sie Schritte von 8.1 bis 8.9 aus, um den Oktopus zu betäuben.
- Bewegen Sie den Oktopus nach Schritt 8.8 in den Euthanasietank. Nachdem die Atmung aufgehört hat, warten Sie 5 Minuten und führen Sie eine Dezerebration des Oktopus durch oder bewahren Sie sie 5 weitere Minuten im Euthanasietank auf.
10. Verhalten von O. bimaculoides
- Füttern Sie den Oktopus nicht morgens, wenn er für die Verwendung eines Schraubverschlussbehälters trainiert wird. Richten Sie ein Kameraaufzeichnungsgerät ein, das auf den für die Fütterung vorgesehenen Bereich zeigt.
- Erhalten Sie ein 50 ml Schraubverschlussrohr mit Löchern mit einem Durchmesser von 1 mm auf der gesamten Oberfläche und die Kappe für den Wasserfluss im gesamten Behälter. Legen Sie eine Fiddler-Krabbe in den Behälter. Legen Sie ein Gewicht in den Behälter oder befestigen Sie es an der Außenseite, damit es am Boden des Tanks verbleibt.
- Platzieren Sie den Behälter am Boden des Tanks im offenen Bereich und in Sichtweite des Oktopus und der Kamera. Wenn die Krabbe nach 4 h nicht gegessen wurde, entfernen Sie sie aus der Sonde und setzen Sie den Fütterungsplan für den Tag fort. Führen Sie diese Übung täglich durch.
HINWEIS: Dies ist in Abbildung 6 dargestellt und wird im Abschnitt "Repräsentatives Ergebnis" erläutert.
11. Oktopus-MRT
HINWEIS: Bisher wurden evozierte funktionelle MRT-Reaktionen in der Netzhaut des Oktopus bei anästhesierten Tieren gemessen70. Hier erhielten wir eine ultrahohe räumliche Auflösung MRT des Nervensystems des Oktopus, die stundenlanges Scannen erforderte. So wurde dies in einem eingeschläferten O. bimaculoides durchgeführt.
- Erhalten Sie MRT-Bilder mit einem 7T-System. Wickeln Sie den Oktopus in eine Polyvinylchlorid-Plastikfolie in Küchenqualität, um die Hydratation des Gewebes aufrechtzuerhalten. Legen Sie den Oktopus auf die Packung, stecken Sie die Enden ein und rollen Sie dann zum Versiegeln.
- Verwenden Sie eine Volumen-Sende-/Empfangsspule mit einem Durchmesser von 4 cm, um Bilder des Gehirns und mehrerer Arme aufzunehmen. Verwenden Sie die T1-gewichtete RARE-Sequenz mit den folgenden Parametern: Wiederholungszeit (TR) von 1500 ms, Echozeit (TE) von 20 ms, 117 x 117 x 500 μm Auflösung, 100 Mittelwerte, RARE-Faktor 8. Dies sind typische MRT-Parameter für die Bildgebung von Nagetiergehirnen. Die Verwendung eines RARE-Faktors beschleunigt die Bildgebung, während 100 Bilder zusammen gemittelt werden, um das Signal-Rausch-Verhältnis zu erhöhen71.
- Stellen Sie sich den Oktopusarm mit einer 86-mm-Volumenübertragungsspule und einer 4 x 4 cm großen 4-Kanal-Array-Empfangsspule vor. Schneiden Sie einen Arm mit einer chirurgischen Schere ab und legen Sie ihn in ein 15 ml konisches Röhrchen, das mit phosphatgepufferter Kochsalzlösung gefüllt ist.
HINWEIS: Die Sequenz war eine T1_weighted Inversion Recovery Sequence (MP-RAGE) mit parametern: TR/TE = 4000/2,17 ms, Inversionsverzögerung 1050 ms, 100 x 100 x 500 μm Auflösung, 9 Mittelwerte, Scanzeit 1,5 h (Abbildung 7). Eine Inversions-Wiederherstellungssequenz nullt das Signal von Wasser und erhöht den Kontrast innerhalb des Bildes; Diese Sequenz wurde gewählt, weil sie die Visualisierung der inneren Anatomie des Arms72 ermöglicht.
12. Kryofluoreszenztomographie (CFT) Bildgebung
- Flash-Freeze den Oktopus: Arbeiten Sie in einer Abzugshaube. Bedecke den Boden eines Dewar mit Trockeneis und fülle ihn dann mit Hexanen. Senken Sie den Oktopus in etwa 10 Minuten langsam in die Hexane ab und fügen Sie bei Bedarf frische Hexane und Trockeneis hinzu, um den Oktopus vollständig mit kalten Hexanen zu bedecken. Bewahren Sie den Oktopus bei -20 °C eingefroren auf, bis er eingebettet ist.
- Einbetten und Schneiden des Oktopus: Erstellen Sie mit den vom CFT-Hersteller bereitgestellten Werkzeugen eine rechteckige Form der entsprechenden Größe, um den Oktopus zu halten. Bedecken Sie den Boden der Form mit OCT-Medien (optimale Schnitttemperatur) (Standardmaterial, das in Histologielabors verwendet wird) und lassen Sie es zu einem halbfesten Gel einfrieren.
- Legen Sie den gefrorenen Oktopus in die Gelschicht des OCT und bedecken Sie ihn dann langsam mit OCT in 2-3 Schichten. Frieren Sie zwischen den Gießschritten die Blockschritte ein, bis sich das OCT im Gelstadium befindet. Nachdem der Oktopus vollständig bedeckt ist, frieren Sie den Block für mindestens 12 h bei -20 °C ein.
- Laden Sie die Probe in das Kryofluoreszenztomographie-System73.
- Schneiden und bilden Sie das gesamte eingeschläferte O. bimaculoides in mesoskopischer Auflösung mit 3 Emissions-/Anregungsfiltern ab, wodurch mehrere isotrope 3D-Datensätze erzeugt werden.
- Wenn die Schnitte den Arm und das Verdauungssystem erreichen, übertragen Sie die Abschnitte zur weiteren Histologie auf die Objektträger.
- Laden Sie den Rohdatensatz in die Rekonstruktionssoftware des CFT-Anbieters, die speziell für eine schnelle Verarbeitung entwickelt wurde.
- Rekonstruieren Sie einen 3-dimensionalen Stapel unter Verwendung von Landmarkenausrichtung, Histogrammausgleich sowie Fluoreszenzkorrekturen und -normalisierung, einschließlich der Entfernung von fluoreszierenden Fluoreszenzeffekten unter der Oberfläche für jede Wellenlänge.
- Sobald der endgültige 3D-Stapel vom Rekonstruktionstool erstellt wurde, visualisieren Sie die Daten mit dem Imaging-Software-Tool und erstellen Sie Fly-Throughs mit Weißlicht- und Fluoreszenzüberlagerungen zusammen mit 3D-Maximum Intensity Projections (3D-MIPS), z. B. Abbildung 873.
Ergebnisse
Alle Tiere in unseren Studien wurden aus der Wildnis gewonnen, und daher konnte ihr genaues Alter nicht bestimmt werden und ihr Aufenthalt im Labor war variabel. Der Oktopuszustand wurde täglich beobachtet. Wir haben keine Parasiten, Bakterien, Hautschäden oder abnormales Verhalten gesehen. Das Durchschnittsgewicht der Tiere betrug 170,38 +/- 77,25 g. Jedes Tier bewohnte seinen eigenen 40-Gallonen-Tank. Die mittlere ± Standardabweichung für die Parameter, die für einen Tank über eine Woche aufgezeichnet wurden, war...
Diskussion
System-Setup:
Das Aquarienökosystem wurde so entwickelt, dass sowohl mechanische als auch biologische Methoden zur Filterung und Sauerstoffversorgung des Wassers eingesetzt werden. Die Filterelemente des Systems verwenden Sockenfilter, Proteinskimmer und regelmäßige Reinigung, um den Stickstoff- und Sauerstoffgehalt aufrechtzuerhalten. Noch wichtiger ist, dass wir uns auch auf marine Mikroorganismen verlassen, um die gefährlichen stickstoffhaltigen Verbindungen und andere biologische Abfälle zu v...
Offenlegungen
Alle Autoren erklären keine Interessenkonflikte.
Danksagungen
Diese Arbeit wurde von NIH UF1NS115817 (G.P.) unterstützt. G.P. wird teilweise durch die NIH-Zuschüsse R01NS072171 und R01NS098231 unterstützt. Wir danken Patrick Zakrzewki und Mohammed Farhoud von Emit Imaging für die Hilfe und Unterstützung bei der Erfassung und Visualisierung der Daten auf der Xerra Imaging Platform. Die MSU hat eine Forschungsvereinbarung mit Bruker Biospin.
Materialien
| Name | Company | Catalog Number | Comments |
| 1-3/4 in. Drill Bit | Home Depot | 204074205 | Glass cutting tool Part number:1 |
| 1" flow sensors | Neptune Systems | Local Dealer | Pipe with sensor to measure water flow Part number:2 |
| 1" Slip Bulkhead Strainer | Bulk Reef Supply | 207113 | Strainer for water leaving tank Part number:3 |
| 10 gallon tank | Preuss Pets | Local Dealer | Fiddler crab holding tank Part number:4 |
| 4 inch X 12 inch 200 Micron Nylon Monofiliment Mesh Filter Sock w/ Plastic Ring | AQUAMAXX | UJ41171 | Filter for large organic matter in sump Part number:5 |
| 40 gallon aquarium | Preuss Pets | Local Dealer | 4 Food aquarium tanks Part number:6 |
| 60g poly tanks - rectangle | Preuss Pets | Local Dealer | 2 Water Storage (salt and freshwater) Part number:7 |
| Active Aqua 1/10th HP Hydroponic or Aquarium Chiller 2018 Model | WayWe | 719574198463 | For cooling water continuously Part number:8 |
| ALAZCO 2 Soft-Grip Handle Heavy-Duty Tile Grout Brush | ALAZCO | B06W2FT5V5 | Tank Cleaning Part number:9 |
| Ammonia Testing Kit | Aquarium Pharmaceuticals | 33D | For water testing Part number:10 |
| Apex system WiFi | Neptune Systems | Local Dealer | System connection for off site monitoring Part number:11 |
| API Aquarium Test Kit | Amazon | B001EUE808 | For water testing Part number:12 |
| API Copper Test Kit | Amazon | B0006JDWH8 | For water testing Part number:13 |
| Aqua Ultraviolet Classic UV 25 Watt Series Units | Aqua Ultraviolet | A00028 | For removing bacteria leaving sump system Part number:14 |
| AquaClear 50 Foam Filter Inserts, 3 pack | Aquaclear | A1394 | Food Tank Carbon Filter Inserts Part number:15 |
| Aqueon QuietFlow LED PRO Aquarium Power Filter 30 | Aqueon | 100106082 | Food tank filtering units Part number:16 |
| Auto Top Off Kit (ATK) (Each includes 1 FMM module, 2 optical sensors and 1 float) | Neptune Systems | Local Dealer | For freshwater tank Part number:17 |
| Automatic top off from RODI (LLC) | Neptune Systems | Local Dealer | From water storage to octopus tanks Part number:18 |
| Banded Trochus Snail | LiveAquaria | CN-112080 | For algae bin Part number:19 |
| Chaetomorpha Algae, Aquacultured | LiveAquaria | BVJ-76354 | For algae bin Part number:20 |
| Clams - Live, Hard Shell, Cherrystone, Wild, USA Dozen | Fulton Fish Market | N/A | Live food Part number:21 |
| Classic Sea Salt Mix - Tropic Marin | Bulk Reef Supply | 211813 | Salt for tank water Part number:22 |
| Clear Masterkleer Soft PVC Plastic Tubing, for Air and Water, 3/4" ID, 1" OD | McMaster | 5233K71 | Cleaning tool Part number:23 |
| Continuum Aquablade-P Acrylic Safe Algae Scraper W/ Plastic Blade - 15 Inch | Marine Depot | 4C31001 | Cleaning tool Part number:24 |
| Copper Testing Kit | Aquarium Pharmaceuticals | 65L | For water testing Part number:25 |
| Curve Refugium CREE LED Aquarium Light | Eshopps | 6500K | Algae bin light Part number:26 |
| Eheim 1262 return pumps | EHEIM | 1250219 | Pump for storage tanks Part number:27 |
| Eshopps R-100 Refugium Sump GEN 3 | Eshopps | 15000 | Sump system Part number:28 |
| Ethyl Alcohol, 200 Proof | Sigma-Aldrich | 64-17-5 | Anesthesia Part number:29 |
| Extech DO600 ExStik II Dissolved Oxygen Meter | Extech | DO600 | Oxygen measurement Part number:30 |
| Fiddler Crabs; live; dozen | NORTHEAST BRINE SHRIMP | N/A | Live food Part number:31 |
| Filter Cartridges | Aqueon | 100106087 | Food tank filters Part number:32 |
| Florida Crushed Coral Dry Sand - CaribSea | Bulk Reef Supply | 212959 | Sediment for bottom of tank Part number:33 |
| FMM module | Neptune Systems | Local Dealer | Controller for apex system Part number:34 |
| Fritz-Zyme TurboStart 900 - Fritz | Bulk Reef Supply | 213036 | Bacteria start Part number:35 |
| Hand Operated Drum Pump, Siphon, Basic Pump with Spout, For Container Type Bucket, Pail | Grainger | 38Y789 | Water Hand Pump Part number:36 |
| High pH Testing Kit | Aquarium Pharmaceuticals | 27 | For water testing Part number:37 |
| Imagitarium Fine Mesh Net for Shrimp | Petco | 2580993 | Shrimp and fish transfer net Part number:38 |
| Leak Detection Kit (LDK) - Includes FMM module plus 2 ALD sensors | Neptune Systems | Local Dealer | Placed on floor to detect water Part number:39 |
| Lee`S Algae Scrubber Pad Jumbo - Glass | Marine Depot | LE12007 | Cleaning tool Part number:40 |
| Live rocks | Preuss Pets | Local Dealer | Habitat for octopus Part number:41 |
| Long Bottle Cleaning Brush 17" Extra Long | Haomaomao | B07FS7J7PN | Tank Cleaning Part number:42 |
| Magnesium chloride | Sigma-Aldrich | M1028-100ML | Euthanasia Part number:43 |
| Magnetic Probe Rack | Neptune Systems | Local Dealer | For holding apex sensor probes Part number:44 |
| Marine Ghost Shrimp | NORTHEAST BRINE SHRIMP | N/A | Live food Part number:45 |
| Marineland C-Series Canister Carbon Bags Filter Media, 2 count | Chewy | 98331 | For elevated copper levels Part number:46 |
| Nitra-Zorb Bag | Aquarium Pharmaceuticals | AP2213 | Absorbs nitrogen compounds Part number:47 |
| Nitrate Testing Kit | Aquarium Pharmaceuticals | LR1800 | For water testing Part number:48 |
| Nitrite Testing Kit | Aquarium Pharmaceuticals | 26 | For water testing Part number:49 |
| Pawfly 2 Inch Air Stones Cylinder 6 PCS Bubble Diffuser Airstones for Aquarium Fish Tank Pump Blue | Amazon | B076S56XWX | Aerate water Part number:50 |
| Penn Plax Airline Tubing for Aquariums –Clear and Flexible Resists Kinking, 8 Feet Standard | Amazon | B0002563MM | Tubing for connecting air pump to air stone Part number:51 |
| Plumbing with unions/valves plus 3/4" flex hose | Preuss Pets | Local Dealer | Water transport Part number:52 |
| PM1 module | Neptune Systems | Local Dealer | Power control module for apex Part number:53 |
| Protein skimmer | Reef Octopus | AC20284 | Removes biowaste from system Part number:54 |
| PVC Apex Mounting board, grommets, wire mounts | Neptune Systems | Local Dealer | Helps ensure organization for wires and tubing within system Part number:55 |
| PVC Regular Cement and 4-Ounce NSF Purple Primer | Amazon | Oatey - 30246 | For connecting PVC pipes Part number:56 |
| RODI unit | Neptune Systems | Local Dealer | RO Water Part number:57 |
| Salinity Probes | HANNA probes | HI98319 | Measures salinity of water Part number:58 |
| Seachem Pristine Aquarium Treatment | Seachem | 1438 | Provides bacteria that break down excess food, waste and detritus Part number:59 |
| Seachem Stability Fish Tank Stabilizer | Seachem | 116012607 | Seachem Stability will rapidly and safely establish the aquarium biofilter in freshwater and marine systems Part number:60 |
| Set of lexan tops | Preuss Pets | Local Dealer | Aquarium tank lids Part number:61 |
| Set of Various extended length aquabus cables | Neptune Systems | Local Dealer | Cables for Apex system Part number:62 |
| SLSON Aquarium Algae Scraper Double Sided Sponge Brush Cleaner Long Handle Fish Tank Scrubber for Glass Aquariums | Amazon | B07DC2TZCJ | Cleaning tool Part number:63 |
| Standard-Wall PVC Pipe Fitting for Water, 45 Degree Elbow Adapter, 3/4 Socket Female x 3/4 Socket Male | McMaster | 4880K189 | PVC pipe Part number:64 |
| Standard-Wall PVC Pipe Fitting for Water, 90 Degree Elbow Adapter, 1 Socket Female x 1 Socket Male | McMaster | 4880K773 | PVC pipe Part number:65 |
| Standard-Wall PVC Pipe Fitting for Water, Adapter, 1 Socket-Connect Female x 1 Barbed Male | McMaster | 4880K415 | PVC pipe Part number:66 |
| Standard-Wall PVC Pipe Fitting for Water, Straight Reducer, 2 Socket Female x 3/4 Socket Female | McMaster | 4880K008 | PVC pipe Part number:67 |
| Standard-Wall PVC Pipe Fitting for Water, Tee Connector, White, 1 Size Socket-Connect Female | McMaster | 4880K43 | PVC pipe Part number:68 |
| Standard-Wall Unthreaded Rigid PVC Pipe for Water, 1 Pipe Size, 10 Feet Long | McMaster | 48925K13 | PVC pipe Part number:69 |
| Standard-Wall Unthreaded Rigid PVC Pipe for Water, 3/4 Pipe Size, 5 Feet Long | McMaster | 48925K92 | PVC pipe Part number:70 |
| Structural FRP Fiberglass Sheet, 48" Wide x 96" Long, 1/2" Thick | McMaster | 8537K15 | Table top material Part number:71 |
| Structural FRP Fiberglass Square Tube, 10 Feet Long, 2" Wide x 2" High Outside, 1/8" Wall Thickness | McMaster | 8548K33 | Structural table material Part number:72 |
| Tank Sediment | TopDawg Pet Supply | 8479001207 | Sediment for bottom of fiddler crab tank Part number:73 |
| Temperature probe | Neptune Systems | Local Dealer | Temperature probe for tanks Part number:74 |
| Tetra TetraMarine Large Saltwater Flakes for all Marine Fish | Amazon | B00025K0US | Fish, shrimp, and crab food Part number:75 |
| Tetra Whisper Aquarium Air Pump for 10 gallon Aquariums | Petco | 2335234 | Air pump for smaller tanks Part number:76 |
| Thick-Wall Through-Wall Pipe Fitting, for Water, PVC Connector, 1 Socket-Connect Female | McMaster | 36895K843 | PVC pipe Part number:77 |
| Vectra s2 pump | Bulk Reef Supply | 212141 | Aquarium Pump Part number:78 |
| Water Pump | TACKLIFE | GHWP1A | Pump for cleaning tanks Part number:79 |
| Wyze Cam v2 1080p HD Indoor WiFi Smart Home Camera with Night Vision | Amazon | B076H3SRXG | DeepLabCut Recording Part number:80 |
Referenzen
- Wet, J. R., Wood, K. V., DeLuca, M., Helinski, D. R., Subramani, S. Firefly luciferase gene: structure and expression in mammalian cells. Molecular and Cellular Biology. 7 (2), 725-737 (1987).
- Han, X., Boyden, E. S. Multiple-color optical activation, silencing, and desynchronization of neural activity, with single-spike temporal resolution. PLoS One. 2 (3), 299 (2007).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446 (7136), 633-639 (2007).
- Li, N., et al. Optogenetic-guided cortical plasticity after nerve injury. Proceedings of the National Academy of Sciences of the United States of America. 108 (21), 8838-8843 (2011).
- Airan, R. D., Li, N., Gilad, A. A., Pelled, G. Genetic tools to manipulate MRI contrast. NMR Biomedicine. 26 (7), 803-809 (2013).
- Cywiak, C., et al. Non-invasive neuromodulation using rTMS and the electromagnetic-perceptive gene (EPG) facilitates plasticity after nerve injury. Brain Stimulation. 13 (6), 1774-1783 (2020).
- Hwang, J., et al. Regulation of Electromagnetic Perceptive Gene Using Ferromagnetic Particles for the External Control of Calcium Ion Transport. Biomolecules. 10 (2), (2020).
- Lu, H., et al. Transcranial magnetic stimulation facilitates neurorehabilitation after pediatric traumatic brain injury. Scientific Reports. 5, 14769 (2015).
- Krishnan, V., et al. Wireless control of cellular function by activation of a novel protein responsive to electromagnetic fields. Bioscience Reports. 8 (1), 8764 (2018).
- Mitra, S., Barnaba, C., Schmidt, J., Pelled, G., Gilad, A. A. Functional characterization of an electromagnetic perceptive protein. bioRxiv. , 329946 (2020).
- Hunt, R. D., et al. Swimming direction of the glass catfish is responsive to magnetic stimulation. PLoS One. 16 (3), 0248141 (2021).
- Kandel, E. R., Krasne, F. B., Strumwasser, F., Truman, J. W. Cellular mechanisms in the selection and modulation of behavior. Neurosciences Research Program bulletin. 17, 521 (1979).
- Carew, T. J., Castellucci, V. F., Kandel, E. R. An analysis of dishabituation and sensitization of the gill-withdrawal reflex in Aplysia. International Journal of Neuroscience. 2 (2), 79-98 (1971).
- Kandel, E. R. The molecular biology of memory storage: a dialog between genes and synapses. Bioscience Reports. 21 (5), 565-611 (2001).
- Forsythe, J. W., Hanlon, R. T. Effect of temperature on laboratory growth, reproduction and life-span of octopus-bimaculoides. Marine Biology. 98 (3), 369-379 (1988).
- Forsythe, J. W., Hanlon, R. T. Behavior, body patterning and reproductive-biology of octopus-bimaculoides from California. Malacologia. 29 (1), 41-55 (1988).
- Pickford, B. M. The Octopus bimaculatus problem: A study in sibling species. Bulletin of the Bingham Oceanographic Collection. 12, 1-66 (1949).
- Sumbre, Y., Fiorito, G., Flash, T. Control of octopus arm extension by a peripheral motor program. Science. 293 (5536), 1845-1848 (2001).
- Gutfreund, Y., et al. Organization of octopus arm movements: a model system for studying the control of flexible arms. Journal of Neuroscience. 16 (22), 7297-7307 (1996).
- Gutfreund, Y., Matzner, H., Flash, T., Hochner, B. Patterns of motor activity in the isolated nerve cord of the octopus arm. The Biological Bulletin. 211 (3), 212-222 (2006).
- Hague, T., Florini, M., Andrews, P. L. R. Preliminary in vitro functional evidence for reflex responses to noxious stimuli in the arms of Octopus vulgaris. Journal of Experimental Marine Biology and Ecology. 447, 100-105 (2013).
- Hochner, B., Brown, E. R., Langella, M., Shomrat, T., Fiorito, G. A learning and memory area in the octopus brain manifests a vertebrate-like long-term potentiation. Journal of Neurophysiology. 90 (5), 3547-3554 (2003).
- Hochner, B., Glanzman, D. L. Evolution of highly diverse forms of behavior in molluscs. Current Biology. 26 (20), 965-971 (2016).
- Hvorecny, L. M., et al. Octopuses (Octopus bimaculoides) and cuttlefishes (Sepia pharaonis, S. officinalis) can conditionally discriminate. Animal Cognition. 10 (4), 449-459 (2007).
- Kier, W. M., Stella, M. P. The arrangement and function of octopus arm musculature and connective tissue. Journal of Morphology. 268 (10), 831-843 (2007).
- Levy, G., Hochner, B. Embodied organization of octopus vulgaris morphology, vision, and locomotion. Frontiers in Physiology. 8, 164 (2017).
- Giorgio-Serchi, F., Arienti, A., Laschi, C. Underwater soft-bodied pulsed-jet thrusters: Actuator modeling and performance profiling. The International Journal of Robotics Research. 35 (11), 1308-1329 (2016).
- Han, S., Kim, T., Kim, D., Park, Y., Jo, S. Use of deep learning for characterization of microfluidic soft sensors. IEEE Robotics and Automation Letters. 3 (2), 873-880 (2018).
- Hanassy, S., Botvinnik, A., Flash, T., Hochner, B. Stereotypical reaching movements of the octopus involve both bend propagation and arm elongation. Bioinspiration and Biomimetics. 10 (3), 035001 (2015).
- Hochner, B., Shomrat, T., Fiorito, G. The octopus: a model for a comparative analysis of the evolution of learning and memory mechanisms. The Biological Bulletin. 210 (3), 308-317 (2006).
- Imperadore, P., Fiorito, G. Cephalopod tissue regeneration: consolidating over a century of knowledge. Frontiers in Physiology. 9, 593 (2018).
- Imperadore, P., et al. Nerve regeneration in the cephalopod mollusc Octopus vulgaris: label-free multiphoton microscopy as a tool for investigation. Journal of the Royal Society, Interface. 15 (141), 20170889 (2018).
- Levy, G., Flash, T., Hochner, B. Arm coordination in octopus crawling involves unique motor control strategies. Current Biology. 25 (9), 1195-1200 (2015).
- Li, F., et al. Chromosome-level genome assembly of the East Asian common octopus (Octopus sinensis) using PacBio sequencing and Hi-C technology. Molecular Ecology Resources. 20 (6), 1572-1582 (2020).
- Lopes, V. M., Rosa, R., Costa, P. R. Presence and persistence of the amnesic shellfish poisoning toxin, domoic acid, in octopus and cuttlefish brains. Marine Environmental Research. 133, 45-48 (2018).
- Mazzolai, B., Margheri, L., Dario, P., Laschi, C. Measurements of octopus arm elongation: Evidence of differences by body size and gender. Journal of Experimental Marine Biology and Ecology. 447, 160-164 (2013).
- McMahan, W., et al. . Proceedings 2006 IEEE International Conference on Robotics and Automation, 2006. , 2336-2341 (2006).
- Meisel, D. V., Kuba, M., Byrne, R. A., Mather, J. The effect of predatory presence on the temporal organization of activity in Octopus vulgaris. Journal of Experimental Marine Biology and Ecology. 447, 75-79 (2013).
- Nesher, N., Levy, G., Grasso, F. W., Hochner, B. Self-recognition mechanism between skin and suckers prevents octopus arms from interfering with each other. Current Biology. 24 (11), 1271-1275 (2014).
- Wells, M. J. . Octopus : Physiology and behaviour of an advanced invertebrate. , (1978).
- Young, J. Z. . The anatomy of the nervous system of Octopus vulgaris. , (1971).
- Zullo, L., Sumbre, G., Agnisola, C., Flash, T., Hochner, B. Nonsomatotopic organization of the higher motor centers in octopus. Current Biology. 19 (19), 1632-1636 (2009).
- Albertin, C. B., et al. The octopus genome and the evolution of cephalopod neural and morphological novelties. Nature. 524 (7564), 220-224 (2015).
- Albertin, C. B., Simakov, O. Cephalopod Biology: At the intersection between genomic and organismal novelties. Annual Review if Animal Biosciences. 8, 71-90 (2020).
- Baik, S., et al. A wet-tolerant adhesive patch inspired by protuberances in suction cups of octopi. Nature. 546 (7658), 396-400 (2017).
- Pikul, J. H., et al. Stretchable surfaces with programmable 3D texture morphing for synthetic camouflaging skins. Science. 358 (6360), 210 (2017).
- Wehner, M., et al. An integrated design and fabrication strategy for entirely soft, autonomous robots. Nature. 536 (7617), 451-455 (2016).
- McMahan, W., et al. Field trials and testing of the OctArm continuum manipulator. Proceedings 2006 IEEE International Conference on Robotics and Automation, 2006. ICRA. , 2336-2341 (2006).
- Hochner, B., Brown, E. R., Langella, M., Shomrat, T., Fiorito, G. A learning and memory area in the octopus brain manifests a vertebrate-like long-term potentiation. Journal of Neurophysiology. 90 (5), 3547-3554 (2003).
- Tapia-Vasquez, A. E., et al. Proteomic identification and physicochemical characterisation of paramyosin and collagen from octopus (Octopus vulgaris) and jumbo squid (Dosidicus gigas). International Journal of Food Science & Technology. 55 (10), 3246-3253 (2020).
- Kim, B. -. M., et al. The genome of common long-arm octopus Octopus minor. GigaScience. 7 (11), (2018).
- Zarrella, I., et al. The survey and reference assisted assembly of the Octopus vulgaris genome. Scientific data. 6 (1), 13 (2019).
- Forsythe, J. W., Hanlon, R. T. Effect of temperature on laboratory growth, reproduction and life span of Octopus bimaculoides. Marine Biology. 98 (3), 369-379 (1988).
- Stoskopf, M. K., Oppenheim, B. S. Anatomic features of Octopus bimaculoides and Octopus digueti. Journal of Zoo and Wildlife Medicine. 27 (1), 1-18 (1996).
- Ramos, J. E., et al. Body size, growth and life span: implications for the polewards range shift of Octopus tetricus in south-eastern Australia. PLoS One. 9 (8), 103480 (2014).
- Hanlon, R. T., Forsythe, J. W. Advances in the laboratory culture of octopuses for biomedical research. Lab Animal Science. 35 (1), 33-40 (1985).
- Moltschaniwskyj, N. A., Carter, C. G. Protein synthesis, degradation, and retention: mechanisms of indeterminate growth in cephalopods. Physiological and Biochemical Zoology. 83 (6), 997-1008 (2010).
- Fiorito, G., et al. Guidelines for the care and welfare of Cephalopods in Research -A consensus based on an initiative by CephRes, FELASA and the Boyd Group. Lab Animal. 49, 1-90 (2015).
- Valverde, J. C., Garcia, B. G. Suitable dissolved oxygen levels for common octopus (Octopus vulgaris cuvier, 1797) at different weights and temperatures: analysis of respiratory behaviour. Aquaculture. 244 (1-4), 303-314 (2005).
- Cardeilhac, P. T., Whitaker, B. R. Copper Treatments: Uses and Precautions. Veterinary Clinics of North America: Small Animal Practice. 18 (2), 435-448 (1988).
- Hodson, P. V., Borgman, U., Shear, H. Toxicity of copper to aquatic biota. Copper in the Environment. (2), 307-372 (1979).
- Poole, B. M. Techniques for the culture of ghost shrimp (palaemonetes pugio). Environmental Toxicology and Chemistry. 7 (12), 989-995 (1988).
- Burggren, W. W. Respiration and circulation in land crabs: novel variations on the marine design. American Zoologist. 32 (3), 417-427 (1992).
- Reitsma, J., Murphy, D. C., Archer, A. F., York, R. H. Nitrogen extraction potential of wild and cultured bivalves harvested from nearshore waters of Cape Cod, USA. Marine Pollution Bulletin. 116 (1), 175-181 (2017).
- Messenger, J. B. Cephalopod chromatophores: neurobiology and natural history. Biological Reviews. 76 (4), 473-528 (2001).
- Morgan Holst, M. M., Miller-Morgan, T. The Use of a species-specific health and welfare assessment tool for the giant pacific octopus, enteroctopus dofleini. Journal of Applied Animal Welfare Science. 24 (3), 272-291 (2021).
- Rosas, C., et al. Energy balance of Octopus maya fed crab or an artificial diet. Marine Biology. 152 (2), 371-381 (2007).
- Anderson, R. C., Wood, J. B., Byrne, R. A. Octopus Senescence: The Beginning of the end. Journal of Applied Animal Welfare Science. 5 (4), 275-283 (2002).
- Butler-Struben, H. M., Brophy, S. M., Johnson, N. A., Crook, R. J. In vivo recording of neural and behavioral correlates of anesthesia induction, reversal, and euthanasia in cephalopod molluscs. Frontiers in Physiology. 9, 109 (2018).
- Jiang, X., et al. Octopus visual system: A functional MRI model for detecting neuronal electric currents without a blood-oxygen-level-dependent confound. Magnetic Resonance in Medicine. 72 (5), 1311-1319 (2014).
- Hennig, J., Nauerth, A., Friedburg, H. RARE imaging: a fast imaging method for clinical MR. Magnetic Resonance in Medicine. 3 (6), 823-833 (1986).
- Brant-Zawadzki, M., Gillan, G. D., Nitz, W. R. MP RAGE: a three-dimensional, T1-weighted, gradient-echo sequence--initial experience in the brain. Radiology. 182 (3), 769-775 (1992).
- Bertapelle, C., Polese, G., Di Cosmo, A. Enriched environment increases PCNA and PARP1 Levels in Octopus vulgaris central nervous system: first evidence of adult neurogenesis in Lophotrochozoa. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution. 328 (4), 347-359 (2017).
- Maselli, V., Polese, G., Soudy, A. -. S. A., Buglione, M., Cosmo, A. D. Cognitive stimulation induces differential gene expression in Octopus vulgaris: The key role of protocadherins. Biology. 9, (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten