Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Generierung von 3D-Tumorsphäroiden für Wirkstoffevaluierungsstudien
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieser Artikel demonstriert eine standardisierte Methode zur Konstruktion dreidimensionaler Tumorsphäroide. Eine Strategie zur Sphäroidbeobachtung und bildbasierten Deep-Learning-Analyse unter Verwendung eines automatisierten Bildgebungssystems wird ebenfalls beschrieben.
Zusammenfassung
In den letzten Jahrzehnten wurden neben monolayerkultivierten Zellen auch dreidimensionale Tumorsphäroide als potenziell leistungsfähiges Werkzeug für die Evaluierung von Krebsmedikamenten entwickelt. Den herkömmlichen Kulturmethoden fehlt jedoch die Möglichkeit, die Tumorsphäroide auf dreidimensionaler Ebene homogen zu manipulieren. Um diese Einschränkung zu beheben, stellen wir in dieser Arbeit eine bequeme und effektive Methode zur Konstruktion von Tumorsphäroiden mittlerer Größe vor. Darüber hinaus beschreiben wir eine Methode der bildbasierten Analyse unter Verwendung einer auf künstlicher Intelligenz basierenden Analysesoftware, die die gesamte Platte scannen und Daten über dreidimensionale Sphäroide erhalten kann. Es wurden mehrere Parameter untersucht. Durch die Verwendung einer Standardmethode zur Konstruktion von Tumorsphäroiden und eines Hochdurchsatz-Bildgebungs- und Analysesystems kann die Effektivität und Genauigkeit von Arzneimitteltests, die an dreidimensionalen Sphäroiden durchgeführt werden, drastisch gesteigert werden.
Einleitung
Krebs ist eine der am meisten gefürchteten Krankheiten, nicht zuletzt wegen seiner hohen Sterblichkeitsrate1. In den letzten Jahren hat sich die Möglichkeit, Krebs zu behandeln, durch die Einführung neuer Therapien erhöht 2,3,4,5. Zweidimensionale (2D) und dreidimensionale (3D) In-vitro-Modelle werden verwendet, um Krebs im Labor zu untersuchen. 2D-Modelle können jedoch nicht alle wichtigen Parameter, die auf eine Antitumorsensitivität hinweisen, sofort und genau beurteilen. Daher können sie die In-vivo-Wechselwirkungen in der Arzneimitteltherapieprüfungnicht vollständig abbilden 6.
Seit 2020 hat der globale Markt für dreidimensionale (3D) Kulturen stark zugenommen. Laut einem Bericht von NASDAQ OMX wird der globale Wert des Marktes für 3D-Zellkulturen bis Ende 2025 2,7 Milliarden US-Dollar übersteigen. Im Vergleich zu 2D-Kulturmethoden weist die 3D-Zellkultivierung vorteilhafte Eigenschaften auf, die nicht nur für Proliferation und Differenzierung, sondern auch für das Langzeitüberleben optimiert werden können 7,8. Auf diese Weise können zelluläre Mikroumgebungen in vivo simuliert werden, um eine genauere Tumorcharakterisierung sowie ein metabolisches Profiling zu erhalten, so dass genomische und Proteinveränderungen besser verstanden werden können. Aus diesem Grund sollten 3D-Testsysteme nun in die allgemeine Arzneimittelentwicklung einbezogen werden, insbesondere in solche, die sich auf das Screening und die Bewertung neuartiger Antitumormedikamente konzentrieren. Dreidimensionale Wucherungen von immortalisierten etablierten Zelllinien oder primären Zellkulturen in Sphäroidstrukturen besitzen in vivo Merkmale von Tumoren wie Hypoxie und Wirkstoffpenetration sowie Zellinteraktion, -antwort und -resistenz und können als stringentes und repräsentatives Modell für die Durchführung von In-vitro-Wirkstoff-Screenings angesehen werden9,10,11.
Diese 3D-Kulturmodelle leiden jedoch auch unter mehreren Problemen, deren Lösung einige Zeit in Anspruch nehmen kann. Zellsphäroide können unter Verwendung dieser Protokolle gebildet werden, aber sie unterscheiden sich in bestimmten Details, wie z.B. der Kulturzeit oder dem Einbetten von Gelen12, so dass diese konstruierten Zellsphäroide unter einem begrenzten Größenbereich nicht gut kontrolliert werden können. Die Größe der Sphäroide kann die Konsistenz des Viabilitätstests und der bildgebenden Analyse beeinflussen. Die Wachstumsmikroumgebungen und Wachstumsfaktoren variieren ebenfalls, was aufgrund von Unterschieden in der Differenzierung zwischen den Zellen zu unterschiedlichen Morphologien führen kann13. Es besteht nun ein offensichtlicher Bedarf an einer standardisierten, einfachen und kostengünstigen Methode zur Konstruktion aller Arten von Tumoren mit kontrollierter Größe.
Aus einer anderen Perspektive betrachtet, bleibt das Hochdurchsatz-Screening von 3D-Modellen aus verschiedenen Gründen, wie z. B. der mangelnden Einheitlichkeit in der Position, Größe und Morphologie von Tumorsphäroiden, eine Herausforderung, obwohl homogene Assays und High-Content-Bildgebungsansätze entwickelt wurden, um Morphologie, Viabilität und Wachstumsrate zu bewerten14,15,16.
In dem hier vorgestellten Protokoll listen wir jeden Schritt in der Konstruktion von 3D-Tumorsphäroiden auf und beschreiben eine Methode zur Beobachtung und Analyse von Sphäroiden unter Verwendung eines High-Content-Bildgebungssystems mit hohem Durchsatz, das unter anderem Autofokus, Auto-Imaging und Analyse umfasst. Wir zeigen, wie mit dieser Methode 3D-Tumorsphäroide einheitlicher Größe hergestellt werden können, die für die Hochdurchsatz-Bildgebung geeignet sind. Diese Sphäroide zeigen auch eine hohe Sensitivität gegenüber der Behandlung von Krebsmedikamenten, und morphologische Veränderungen in den Sphäroiden können mit Hilfe von High-Content-Bildgebung beobachtet werden. Zusammenfassend demonstrieren wir die Robustheit dieser Methodik als Mittel zur Generierung von 3D-Tumorkonstrukten für die Wirkstoffbewertung.
Protokoll
1. Sphäroide-Konstruktion
- Anti-Adhäsions-Behandlung der Kulturplatte
- Pipettieren Sie 100 μl Antihaftreagenz in jede Vertiefung einer 48-Well-Platte mit U-förmigem Well-Boden und bewahren Sie sie 10 Minuten lang auf. Nach 10 Minuten das Beschichtungsreagenz absaugen und zweimal mit sterilisiertem PBS waschen.
- Legen Sie die Kulturplatte bis zur Verwendung in einen Inkubator (37 °C in befeuchteter Luft mit 5 % CO2).
- Zellvorbereitung, -entnahme und -zählung
- Verwenden Sie das für die Zellen spezifische Nährmedium, um die Zellen in Zellkulturflaschen zu kultivieren (Ergänzende Tabelle 2). Zum Beispiel werden NCI-H23- und CT-26-Zellen in RPMI 1640 und HT-29-Zellen in McCoys 5A-Medium kultiviert. Diese beiden Medien werden mit 10 % wärmeinaktiviertem FBS bzw. 1 % P/S ergänzt.
- Halten Sie alle Zellen während der Proliferation unter Standardkulturbedingungen (37 °C in befeuchteter Luft mit 5 % CO2). Hier wird in den folgenden Schritten beispielhaft die NCI-H23-Zelllinie verwendet.
- Waschen Sie die in einem T25-Kolben kultivierten Zellen zweimal mit 1x PBS, um das Nährmedium zu entfernen (es ist besser, Zellen in der logarithmischen Phase auszuwählen und die Zellen mit einer Konfluenz von 80%-90% zu passieren).
- Behandeln Sie die expandierten Zellen mit 1 ml 0,25% Trypsin/EDTA für 1-2 min in einem Inkubator bei 37 °C, 5% CO2. Bestätigen Sie die Zellform (in diesem Fall normalerweise kreisförmig) unter dem Mikroskop und beenden Sie dann die Trypsinbehandlung. Dazu wird die gebrauchte Trypsin/EDTA-Suspension in den T25-Kolben abgesaugt und die Zellen mit 4 ml frischem Medium gewaschen.
- Übertragen Sie die gesamte Suspension (5 ml) in ein 15-ml-Röhrchen. Verwenden Sie 1 ml frisches Medium, um die verbleibenden Zellen abzuspülen, und geben Sie es in das Röhrchen. Zentrifugieren Sie die Zellen bei 186,48 x g für 5 min bei Raumtemperatur.
- Entfernen Sie den Überstand und geben Sie 10 ml frisches Medium in das Zellpellet, gefolgt von einem sanften Pipettieren, bis sich die Zellen in einer homogenen Suspension befinden.
- Aspirieren Sie 0,1 ml Zellsuspension in ein neues Zentrifugenröhrchen, fügen Sie 0,9 ml frisches Medium hinzu und pipettieren Sie dann die Suspension in eine Welle.
- Extrahieren Sie 10 μl der Zellsuspension für die Zellzählung. Führen Sie diesen Vorgang zwei- oder dreimal durch und nehmen Sie einen Durchschnittswert.
- Die Suspension wird verdünnt, um eine endgültige Aussaatdichte von 50.000 Zellen/ml zu erreichen, entsprechend der Konzentration, die bei der Zellzählung in Schritt 1.2.7 erhalten wurde.
- Zellkultur und Sphäroidbildung
- Geben Sie 200 μl der Zellsuspension in jede Vertiefung einer 48-Well-U-Bodenplatte.
- Wickeln Sie die Siegelfolie um die Platte und zentrifugieren Sie sie bei 119,35 x g für 5 min bei Raumtemperatur.
- Nehmen Sie die Platte vorsichtig aus der Zentrifuge und ziehen Sie die Schutzfolie ab. Geben Sie dann 5-8 ml sterilisiertes Wasser in den Wasserkanal, der die Brunnen umgibt (um eine Verdunstung zu verhindern) und inkubieren Sie es 5 Tage lang bei 37 °C. Wechseln Sie während des Zeitraums kein Wasser in den Wasserkanal.
- Beobachten Sie die Zellaggregation während der folgenden 5 Tage.
HINWEIS: Im Allgemeinen beginnen die Zellen innerhalb von 5 Tagen als Kolonien zu verklumpen. Der Prozess der Sphäroidkonstruktion kann jedoch bei unterschiedlichen Zelltypen und Zelldichten schneller oder langsamer sein. Aus diesem Grund müssen die Zellen jeden Tag mit einer von drei möglichen Methoden beobachtet werden. Zunächst können die Zellen durch den Boden der Well-Platte beobachtet werden. Wenn die Zellen noch kein Sphäroid gebildet haben, ist unten eine einzelne Zellschicht zu sehen. Wenn die Zellen ein Sphäroid bilden, kann ein dichtes 3D-Konstrukt am U-Boden jeder Vertiefung beobachtet werden. Eine andere Methode besteht darin, die Zellen unter dem Mikroskop zu überprüfen. Wenn die Zellen zu einem Tumorsphäroid werden, besteht die Konstruktion aus drei Schichten (einer proliferierenden Schicht, einer inaktiven Schicht und einem nekrotischen Kern von außen nach innen des Sphäroids), die einen Transparenzgradienten aufweisen. Schließlich kann die Farbe des Nährmediums auch zu Beobachtungszwecken verwendet werden. Dies kann hilfreich sein, wenn der dreischichtige Aufbau auch mit einem Digitalmikroskop nicht deutlich zu erkennen ist. Wenn sich das Medium von violett-rot zu gelb verfärbt, kann der Prozess der Einbettung der Sphäroide in das Gel beginnen. Das Medium sollte während der Zellaggregationsphase nicht ausgetauscht werden.
- Gel-Einbettung
HINWEIS: Die Gele müssen bei einer Temperatur unter −20 °C gelagert werden. Insbesondere sollten Gele weit von der Kühlschranktür entfernt platziert werden, um Temperaturschwankungen zu vermeiden. Beachten Sie, dass sich die Gele in dieser Phase des Prozesses in einem gefrorenen Zustand befinden.- Nehmen Sie das gefrorene Gel aus dem −20 °C warmen Kühlschrank und legen Sie es während des Experiments für die gesamte Zeit auf eine Eisbox.
- Beobachten Sie die Zellsphäroide unter dem Mikroskop. Bevor die Geleinbettung beginnt, sollte der Status der Sphäroide noch einmal mit einem Digitalmikroskop überprüft werden.
- Entfernen Sie vorsichtig 150 μl des Mediums. Der Teller sollte auch auf die Eisbox gestellt werden.
- Betten Sie jedes Sphäroid in das Gel ein, indem Sie das flüssige Gel langsam von der Wandseite der Vertiefung hinzufügen, während Sie die vorgekühlte Pipettenspitze um und in der Vertiefung bewegen. Warten Sie 5 Minuten und wenn sich das Gel nicht gleichmäßig verteilt, pipettieren Sie das Gel vorsichtig mit einer 10-μl-Pipettenspitze. Jede Vertiefung enthält ein Tumorsphäroid, 25 μl 3,5 mg/ml Gel und 50 μl komplettes Nährmedium. Fügen Sie den Kontrollen auch 75 μl Medium hinzu.
HINWEIS: Jede Vertiefung enthält ein Sphäroid. - Inkubieren Sie die Platte bei 37 °C für 30 Minuten, bis die Hydrogelierung vollständig abgeschlossen ist. Bestätigen Sie den Gelierstatus unter dem Mikroskop.
- Legen Sie 125 μl des frischen Mediums auf jede Probe.
- Kultur der Sphäroide für weitere 7-10 Tage. Bereiten Sie Gruppen von Sphäroiden mit jeweils vier bis sechs Vertiefungen vor und wählen Sie mindestens drei davon für die Analyse aus.
HINWEIS: Wenn Sie einen Drogentest durchführen, bereiten Sie zwei Gruppen für eine Probe vor. Eine Gruppe wird für Viabilitätstests verwendet, während die andere für die Bildaufnahme und -analyse verwendet wird.
2. Medikamentöse Behandlung
- Lösen Sie das Medikament gemäß den Anweisungen des Herstellers auf. Bereiten Sie 100x funktionierende Lösungen mit DMSO vor. Bereiten Sie mindestens fünf Dosen des Arzneimittels in serieller Verdünnung vor. Als Beispiel dient hier das Lungenkrebs-Therapeutikum AMG 510. Die Zusammensetzung ist in der ergänzenden Tabelle 1 dargestellt.
- Verwenden Sie 0,1 % DMSO als Positivkontrolle.
- Geben Sie 125 μl medikamentös behandeltes Medium in jede Vertiefung und stellen Sie die Platte wieder in den Inkubator (37 °C in befeuchteter Luft mit 5 % CO2). In diesem Stadium enthält jede Vertiefung ein Tumorsphäroid, 25 μl 3,5 mg/ml Gel und 175 μl des Mediums. Die Kontrollen enthalten 200 μL des Mediums.
3. Lebensfähigkeit des Sphäroids
- Messen Sie die Lebensfähigkeit des Sphäroids mit einem Alamarblau-Assay-Kit gemäß den Richtlinien des Herstellers. Messung der Viabilität mit einem Mikrotiterplatten-Photometer (Absorption bei 570 nm und 600 nm) nach der Behandlung mit Alamar Blue.
- Messen Sie die Viabilität an Tag 1, Tag 4, Tag 7 und Tag 10 nach dem Einbetten der Sphäroide in das Gel bzw. wie angegeben.
HINWEIS: Bei Verwendung eines Alamarblau-Assays ist eine Reaktionszeit von mindestens 16 Stunden erforderlich. Fügen Sie daher an den Nachmittagen von Tag 0, Tag 3, Tag 6 und Tag 9 20 μl Alamar Blue hinzu. - Aspirieren Sie 100 μl des überstehenden Mediums aus jeder Vertiefung in eine neue Testplatte und fügen Sie 80 μl frisches Medium in jede Vertiefung der Kulturplatte hinzu. Ersetzen Sie dann weitere 100 μl des medikamentös behandelten Mediums. Stellen Sie sicher, dass sich keine Überreste von Alamar Blue im Brunnen befinden.
HINWEIS: Der Austausch des Mediums wird bei jedem Test der Lebensfähigkeit durchgeführt, und das medikamentös behandelte Medium der Bildgebungs- und Analysegruppen muss am selben Tag ausgetauscht werden.
4. Sphäroid-Beobachtung und Deep-Learning-Analyse durch Bilder im Drogentest
- Bildgebung
- Aspirieren Sie 100 μl des Mediums vor der Bildgebung ab.
- Stellen Sie den Teller auf die Bühne. Erhalten Sie digitale Bilder der Sphäroide mit einem automatisierten Mikroskop mit einem 10-fachen Objektiv (2-fach-Objektiv zuerst). Das Mikroskop kann diese Sphäroide automatisch fokussieren und zentralisieren.
HINWEIS: Die Autofokus-Funktion und der verwendete Algorithmus wurden bereits von Yazdanfar et al.17 beschrieben. - Warten Sie auf die automatische Bildgebung. Für jedes Sphäroid werden vier Bilder aufgenommen. Ein integriertes Bild wird mit der an das High-Content-Imaging-System angeschlossenen Software erstellt und verarbeitet.
- Klicken Sie auf die Schaltfläche "Image-Patch-Prozess" und wählen Sie die eingebundenen Bilder in der Software aus.
- Wählen Sie "U-NET-Modell" und geben Sie die Konvertierungsrate ein (10x objektive Bilder haben eine Konvertierungsrate von 3,966). Klicken Sie unten auf den Bildschirm, um die Bildverarbeitung zu starten. Speichern Sie dann die Daten zu Durchmesser, Umfang und Rauheit in einer Tabellenkalkulationssoftware.
- Berechnen Sie den Excess Perimeter Index (EPI). Der EPI ist das Verhältnis zwischen dem Sphäroidumfang (P 0) und dem äquivalenten Umfang (Pe), berechnet durch Gleichung 1. Messen Sie die Fläche des Sphäroids in der Fokusebene (S) mit Bild J. Berechnen Sie dann den äquivalenten Umfang des Sphäroids mit Gleichung 2.
EPI = (P o− P e)/Pe (Gl. 1)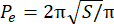 (Gl. 2)
(Gl. 2)
HINWEIS: Der Sphäroidumfang wird von der Software mit Deep-Learning-Algorithmen generiert, die auf dem entwickelten U-NET-Modell basieren. - Fügen Sie dem Medikament 100 μl frisches Medium hinzu und stellen Sie die Platte wieder in den Inkubator (37 °C in befeuchteter Luft mit 5% CO2).
- Sphäroid-Hemmung
- Berechnen Sie die Tumorwachstumshemmung (TGI) mit Gl. 3. Das relative Sphäroidvolumen (RTV) ist das Endvolumen über dem ursprünglichen Volumen (Gl. 4). Das Sphäroidvolumen (V) wird von der Software automatisch mit Gl. 5 entsprechend dem ausgegebenen Sphäroiddurchmesser berechnet.
TGI = (RTV-Kontrolle−RTV-Behandlung)/RTV-Kontrolle × 100 % (Gl. 3)
RTV =V-Klemme/VOriginal (Gl. 4)
V = 4/3π(d/2)3 (Gl. 5)
HINWEIS: Der TGI wird unter Bezugnahme auf die In-vivo-Wachstumshemmung ermittelt und die Tumorgewichte werden durch RTV ersetzt. Die RTV-Kontrolle ist das relative Sphäroidvolumen der Kontrollgruppe, dieRTV-Behandlung ist das relative Sphäroidvolumen der medikamentös getesteten Gruppe, Vterminal ist das Volumen des Sphäroids am letzten Tag, Voriginal ist das Volumen des Sphäroids am ersten Kulturtag und d steht für den Sphäroiddurchmesser.
- Berechnen Sie die Tumorwachstumshemmung (TGI) mit Gl. 3. Das relative Sphäroidvolumen (RTV) ist das Endvolumen über dem ursprünglichen Volumen (Gl. 4). Das Sphäroidvolumen (V) wird von der Software automatisch mit Gl. 5 entsprechend dem ausgegebenen Sphäroiddurchmesser berechnet.
Ergebnisse
Abbildung 1A,B zeigt den Prozess, der in dieser Studie zur Konstruktion von Tumorsphäroiden verwendet wird. Wir haben die Zellen zunächst in einer 48-Well-U-Bodenplatte ausgesät. Dieser Schritt ist fast derselbe wie bei der 2D-Zellkultur. Wir hielten die Platte in einem gemeinsamen Inkubator mit Wasser, das die Brunnen umgab, so dass die abgelagerten Zellen begannen, in einem Selbstorganisationsprozess Sphäroide zu bilden. Unter normalen Betriebsbedingungen bildeten sic...
Diskussion
Die Mikroumgebung spielt eine wichtige Rolle beim Tumorwachstum. Es kann die Bereitstellung extrazellulärer Matrices, Sauerstoffgradienten, Ernährung und mechanische Interaktion beeinflussen und damit die Genexpression, Signalwege und viele Funktionen von Tumorzellen beeinflussen 19,20,21. In vielen Fällen erzeugen 2D-Zellen solche Effekte nicht oder sogar gegenteilige Effekte, was die Bewertung von medikamentösen Behandlung...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken allen Mitgliedern unserer Labore für ihre kritischen Anregungen und Anregungen. Diese Forschung wurde durch das Schlüsselprojekt der Jiangsu Commission of Health (K2019030) unterstützt. Die Konzeptualisierung wurde von C.W. und Z.C. durchgeführt, die Methodik wurde von W.H. und M.L. durchgeführt, die Untersuchung wurde von W.H. und M.L. durchgeführt, die Datenkuratierung wurde von W.H., Z.Z., S.X. und M.L. durchgeführt, die ursprüngliche Entwurfserstellung wurde von Z.Z., J.Z., S.X., W.H. durchgeführt. und X.L., die Überprüfung und Redaktion wurde von Z.C. durchgeführt, die Projektverwaltung von C.W. und Z.C. und die Mittelakquise von C.W. Alle Autoren haben die veröffentlichte Version des Manuskripts gelesen und sind damit einverstanden.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Pipette tips | AXYGEN | T-300 | |
| 1.5 mL Boil proof microtubes | Axygen | MCT-150-C | |
| 100-1000μL Pipette tips | KIRGEN | KG1313 | |
| 15 mL Centrifuge Tube | Nest | 601052 | |
| 200 μL Pipette tips | AXYGEN | T-200-Y | |
| 3D gel | Avatarget | MA02 | |
| 48-well U bottom Plate | Avatarget | P02-48UWP | |
| 50 mL Centrifuge Tube | Nest | 602052 | |
| Alamar Blue | Thermo | DAL1100 | |
| Anti-Adherence Rinsing Solution | STEMCELL | #07010 | |
| Certified FBS | BI | 04-001-1ACS | |
| Deionized water | aladdin | W433884-500ml | |
| DMEM (Dulbecco's Modified Eagle Medium) | Gibco | 11965-092 | |
| DMSO | sigma | D2650-100ML | |
| Excel sofware | Microsoft office | ||
| Graphpad prism sofware | GraphPad software | ||
| High Content Imager and SMART system | Avatarget | 1-I01 | |
| Image J software | National Institutes of Health | ||
| Insulin-Transferrin-Selenium-A Supplement (100X) | Gibco | 51300-044 | |
| Parafilm | Bemis | PM-996 | |
| PBS | Solarbio | P1020 | |
| Penicillin/streptomycin Sol | Gibco | 15140-122 | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scientific Fluoroskan Ascent | Thermo | Fluoroskan Ascent | |
| T25 Flask | JET Biofil | TCF012050 | |
| Trypsin, 0.25% (1X) | Hyclone | SH30042.01 |
Referenzen
- Carioli, G., et al. European cancer mortality predictions for the year 2021 with focus on pancreatic and female lung cancer. Annals of Oncology. 32 (4), 478-487 (2021).
- Katti, A., Diaz, B. J., Caragine, C. M., Sanjana, N. E., Dow, L. E. CRISPR in cancer biology and therapy. Nature Reviews Cancer. 22 (5), 259-279 (2022).
- Abrantes, R., Duarte, H. O., Gomes, C., Walchili, S., Reis, C. A. CAR-Ts: New perspectives in cancer therapy. FEBS Letter. 596 (4), 403-416 (2022).
- Shokooohi, A., et al. Effect of targeted therapy and immunotherapy on advanced nonsmall-cell lung cancer outcomes in the real world. Cancer Medicine. 11 (1), 86-93 (2022).
- Chen, K., Zhang, Y., Qian, L., Wang, P. Emerging strategies to target RAS signaling in human cancer therapy. Journal of Hematology & Oncology. 14 (1), 116 (2021).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Qin, Y., Hu, X., Fan, W., Yan, J. A stretchable scaffold with electrochemical sensing for 3D culture, mechanical loading, and real-time monitoring of cells. Advanced Science. 8 (13), 2003738 (2021).
- Wartenberg, M., et al. Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxia-inducible factor (HIF-1) ad reactive oxygen species. FASEB Journal. 17 (3), 503-505 (2003).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nature Reviews Cancer. 6 (8), 583-592 (2006).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: How 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Brüningk, S. C., Rivens, I., Box, C., Oelfke, U., Ter Haar, G. 3D tumour spheroids for the prediction of the effects of radiation and hyperthermia treatments. Scientific Reports. 10, 1653 (2020).
- Graves, E. E., Maity, A., Thu Le, Q. The tumor microenvironment in non-small-cell lung cancer. Seminars in Radiation Oncology. 20 (3), 156-163 (2010).
- Kunz-Schughart, L. A., Frreyer, J. P., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Carragher, N., et al. Concerns, challenges and promises of high-content analysis of 3D cellular models. Nature Review Drug Discovery. 17 (8), 606 (2018).
- Huang, Y., et al. Longitudinal morphological and physiological monitoring of three-dimensional tumor spheroids using optical coherence tomography. Journal of Visualized Experiments. (144), e59020 (2019).
- Yazdanfar, S., et al. Simple and robust image-baed autofocusing for digital microscopy. Optics Express. 16 (12), 8670-8677 (2008).
- Chen, Z., et al. Automated evaluation of tumor spheroid behavior in 3D culture using deep learning-based recognition. Biomaterials. 22 (272), 120770 (2021).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Frontiers in Immunology. 11, 603640 (2020).
- Anastasiou, D., et al. Microenvironment factors shaping the cancer metabolism landscape. British Journal of Cancer. 116 (3), 277-286 (2017).
- Zhou, H., et al. Functions and clinical significance of mechanical tumor microenvironment: Cancer cell sensing, mechanobiology and metastasis. Cancer Communications. 43 (5), 374-400 (2022).
- Zhu, G. G., et al. Targeting KRAS cancers: From druggable therapy to druggable resistance. Molecular Cancer. 21 (1), 159 (2022).
- Ando, Y., Mariano, C., Shen, K. Engineered in vitro tumor models for cell-based immunotherapy. Acta Biomaterialia. 132, 345-359 (2021).
- Timmins, N. E., Dietmair, S., Nielsen, L. K. Hanging-drop multicellular spheroids as a model of tumor angiogenesis. Angiogenesis. 7 (2), 97-103 (2004).
- Costa, E. C., et al. 3D tumor spheroids: An overview on the tools and techniques used for their analysis. Biotechnology Advances. 34 (8), 1427-1441 (2016).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today. Technologies. 23, 27-36 (2017).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten