Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Génération de sphéroïdes tumoraux 3D pour des études d’évaluation de médicaments
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cet article démontre une méthode standardisée pour construire des sphéroïdes tumoraux tridimensionnels. Une stratégie d’observation des sphéroïdes et d’analyse d’apprentissage profond basée sur l’image à l’aide d’un système d’imagerie automatisé est également décrite.
Résumé
Au cours des dernières décennies, en plus des cellules cultivées en monocouche, des sphéroïdes tumoraux tridimensionnels ont été développés comme un outil potentiellement puissant pour l’évaluation des médicaments anticancéreux. Cependant, les méthodes de culture conventionnelles n’ont pas la capacité de manipuler les sphéroïdes tumoraux de manière homogène au niveau tridimensionnel. Pour remédier à cette limitation, dans cet article, nous présentons une méthode pratique et efficace de construction de sphéroïdes tumoraux de taille moyenne. De plus, nous décrivons une méthode d’analyse basée sur l’image utilisant un logiciel d’analyse basé sur l’intelligence artificielle qui peut scanner la plaque entière et obtenir des données sur les sphéroïdes tridimensionnels. Plusieurs paramètres ont été étudiés. En utilisant une méthode standard de construction sphéroïde tumorale et un système d’imagerie et d’analyse à haut débit, l’efficacité et la précision des tests de médicaments effectués sur des sphéroïdes tridimensionnels peuvent être considérablement augmentées.
Introduction
Le cancer est l’une des maladies les plus redoutées par les êtres humains, notamment en raison de son taux de mortalité élevé1. Au cours des dernières années, la possibilité de traiter le cancer a augmenté à mesure que de nouvelles thérapies ont été introduites 2,3,4,5. Des modèles in vitro bidimensionnels (2D) et tridimensionnels (3D) sont utilisés pour étudier le cancer en laboratoire. Cependant, les modèles 2D ne peuvent pas évaluer immédiatement et avec précision tous les paramètres importants qui indiquent une sensibilité antitumorale; Par conséquent, ils ne représentent pas pleinement les interactions in vivo dans les essais de pharmacothérapie6.
Depuis 2020, le marché mondial de la culture tridimensionnelle (3D) a été considérablement stimulé. Selon un rapport du NASDAQ OMX, la valeur mondiale du marché de la culture cellulaire 3D dépassera 2,7 milliards de dollars d’ici la fin de 2025. Par rapport aux méthodes de culture 2D, la culture cellulaire 3D présente des propriétés avantageuses, qui peuvent être optimisées non seulement pour la prolifération et la différenciation, mais aussi pour la survie à long terme 7,8. Par de tels moyens, les microenvironnements cellulaires in vivo peuvent être simulés pour obtenir une caractérisation plus précise de la tumeur, ainsi qu’un profilage métabolique, afin que les altérations génomiques et protéiques puissent être mieux comprises. Pour cette raison, les systèmes de test 3D devraient maintenant être inclus dans les opérations de développement de médicaments traditionnelles, en particulier celles axées sur le dépistage et l’évaluation de nouveaux médicaments antitumoraux. Les croissances tridimensionnelles de lignées cellulaires établies immortalisées ou de cultures cellulaires primaires dans des structures sphéroïdes possèdent des caractéristiques in vivo de tumeurs telles que l’hypoxie et la pénétration de médicaments, ainsi que l’interaction, la réponse et la résistance cellulaires, et peuvent être considérées comme un modèle rigoureux et représentatif pour effectuer un dépistage in vitro de médicaments 9,10,11.
Cependant, ces modèles de culture 3D souffrent également de plusieurs problèmes qui peuvent prendre un certain temps à résoudre. Les sphéroïdes cellulaires peuvent être formés à l’aide de ces protocoles, mais ils diffèrent par certains détails, tels que le temps de culture ou l’incorporation de gels12, de sorte que ces sphéroïdes cellulaires construits ne peuvent pas être bien contrôlés dans une plage de taille restreinte. La taille des sphéroïdes peut influencer la cohérence du test de viabilité et de l’analyse d’imagerie. Les microenvironnements de croissance et les facteurs de croissance varient également, ce qui peut conduire à des morphologies différentes en raison des différences de différenciation entre les cellules13. Il existe maintenant un besoin évident d’une méthode standard, simple et rentable pour construire tous les types de tumeurs avec des tailles contrôlées.
D’un autre point de vue, bien que des tests homogènes et des approches d’imagerie à haut contenu aient été développés pour évaluer la morphologie, la viabilité et le taux de croissance, le criblage à haut débit des modèles 3D reste un défi pour diverses raisons rapportées dans la littérature, telles que le manque d’uniformité dans la position, la taille et la morphologie des sphéroïdes tumoraux14,15,16.
Dans le protocole présenté ici, nous énumérons chaque étape de la construction de sphéroïdes tumoraux 3D et décrivons une méthode d’observation et d’analyse des sphéroïdes à l’aide d’un système d’imagerie à haut débit et à contenu élevé qui implique l’autofocus, l’auto-imagerie et l’analyse, entre autres caractéristiques avantageuses. Nous montrons comment cette méthode peut produire des sphéroïdes tumoraux 3D de taille uniforme qui conviennent à l’imagerie à haut débit. Ces sphéroïdes démontrent également une grande sensibilité au traitement médicamenteux du cancer, et les changements morphologiques dans les sphéroïdes peuvent être surveillés à l’aide d’une imagerie à haut contenu. En résumé, nous démontrons la robustesse de cette méthodologie comme moyen de générer des constructions tumorales 3D à des fins d’évaluation de médicaments.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Construction sphéroïde
- Traitement anti-adhérence de la plaque de culture
- Pipeter 100 μL de réactif anti-adhérence dans chaque puits d’une plaque de 48 puits avec un fond de puits en forme de U, et conserver pendant 10 min. Après 10 min, aspirer le réactif de revêtement et laver deux fois avec du PBS stérilisé.
- Mettre la plaque de culture dans un incubateur (37 °C dans de l’air humidifié avec 5% de CO2) jusqu’à utilisation.
- Préparation, collecte et comptage des cellules
- Utiliser le milieu de culture spécifique aux cellules pour cultiver les cellules dans des flacons de culture cellulaire (tableau supplémentaire 2). Par exemple, les cellules NCI-H23, CT-26 sont cultivées dans RPMI 1640, et les cellules HT-29 sont cultivées dans le milieu 5A de McCoy. Ces deux milieux sont complétés par 10% FBS inactivé par la chaleur et 1% P/S, respectivement.
- Maintenir toutes les cellules dans des conditions de culture standard (37 °C dans de l’air humidifié avec 5% de CO2) pendant la prolifération. Ici, la lignée cellulaire NCI-H23 est utilisée comme exemple dans les étapes suivantes.
- Laver deux fois les cellules cultivées dans une fiole T25 avec 1x PBS pour éliminer le milieu de culture (il est préférable de choisir les cellules dans la phase logarithmique et de faire passer les cellules à une confluence de 80%-90%).
- Traiter les cellules expansées avec 1 mL de trypsine/EDTA à 0,25 % pendant 1 à 2 min dans un incubateur à 37 °C, 5 % de CO2. Confirmez la forme de la cellule (normalement circulaire dans ce cas) au microscope, puis arrêtez le traitement par trypsine. Pour ce faire, aspirez la suspension trypsine/EDTA utilisée dans la fiole T25 et lavez les cellules avec 4 mL de milieu frais.
- Transférer toute la suspension (5 ml) dans un tube de 15 ml. Utilisez 1 mL de milieu frais pour laver les cellules résiduelles et l’ajouter au tube. Centrifuger les cellules à 186,48 x g pendant 5 min à température ambiante.
- Retirer le surnageant et ajouter 10 ml de milieu frais à la pastille cellulaire, puis pipeter doucement jusqu’à ce que les cellules soient dans une suspension homogène.
- Aspirer 0,1 mL de suspension cellulaire dans un nouveau tube à centrifuger, ajouter 0,9 mL de milieu frais, puis bien pipeter la suspension.
- Extraire 10 μL de la suspension cellulaire pour le comptage cellulaire. Effectuez ce processus deux ou trois fois et prenez une valeur moyenne.
- Diluer la suspension pour atteindre une densité finale d’ensemencement de 50 000 cellules/mL, selon la concentration obtenue par le procédé de comptage cellulaire à l’étape 1.2.7.
- Culture cellulaire et formation de sphéroïdes
- Ajouter 200 μL de la suspension cellulaire à chaque puits d’une plaque de fond en U de 48 puits.
- Enrouler le film d’étanchéité autour de la plaque et le centrifuger à 119,35 x g pendant 5 min à température ambiante.
- Retirez délicatement la plaque de la centrifugeuse et retirez le film protecteur. Ensuite, ajoutez 5 à 8 mL d’eau stérilisée dans le canal d’eau entourant les puits (pour éviter l’évaporation) et incuber à 37 °C pendant 5 jours. Ne changez pas / complétez pas d’eau dans le canal d’eau pendant la période.
- Observez l’agrégation cellulaire pendant les 5 jours suivants.
REMARQUE: En général, les cellules commencent à s’agglutiner en colonies dans les 5 jours. Cependant, le processus de construction sphéroïde peut être plus rapide ou plus lent avec différents types de cellules et densités cellulaires. Pour cette raison, les cellules doivent être observées tous les jours en utilisant l’une des trois méthodes possibles. Tout d’abord, les cellules peuvent être observées à travers le fond de la plaque de puits. Lorsque les cellules n’ont pas encore formé de sphéroïde, une seule couche de cellules peut être vue au fond. Lorsque les cellules forment un sphéroïde, une construction 3D dense peut être observée au fond en U de chaque puits. Une autre méthode consiste à vérifier les cellules au microscope. Lorsque les cellules deviennent un sphéroïde tumoral, la construction implique trois couches (une couche proliférante, une couche inactive et un noyau nécrotique, de l’extérieur vers l’intérieur du sphéroïde), qui ont un gradient de transparence. Enfin, la couleur du milieu de culture peut également être utilisée à des fins d’observation. Cela peut être utile lorsque la structure à trois couches ne peut pas être clairement vue, même à l’aide d’un microscope numérique. Lorsque le milieu passe du rouge violet au jaune, le processus d’incorporation des sphéroïdes dans le gel peut commencer. Le milieu ne doit pas être remplacé pendant la période d’agrégation cellulaire.
- Intégration de gel
REMARQUE: Les gels doivent être conservés à une température inférieure à -20 ° C. En particulier, les gels doivent être placés loin de la porte du réfrigérateur pour éviter les fluctuations de température. Notez que les gels sont à l’état congelé à ce stade du processus.- Prenez le gel congelé du réfrigérateur à −20 °C et placez-le sur une glacière pendant toute la durée de l’expérience.
- Observez les sphéroïdes cellulaires au microscope. Avant le début de l’enrobage du gel, l’état des sphéroïdes doit à nouveau être vérifié au microscope numérique.
- Retirer délicatement 150 μL du milieu. La plaque doit également être placée sur la glacière.
- Intégrez chaque sphéroïde dans le gel en ajoutant lentement le gel liquide du côté de la paroi du puits tout en déplaçant l’embout de la pipette prérefroidie autour et à l’intérieur du puits. Attendez 5 minutes et si le gel ne se répand pas uniformément, pipeter doucement le gel avec un embout de pipette de 10 μL. Chaque puits contient un sphéroïde tumoral, 25 μL de gel de 3,5 mg/mL et 50 μL de milieu de culture complet. Ajoutez également 75 μL de milieu aux témoins.
NOTE: Chaque puits contient un sphéroïde. - Incuber la plaque à 37 °C pendant 30 min jusqu’à ce que l’hydrogélification soit complètement terminée. Confirmez l’état de gélification au microscope.
- Superposez 125 μL du milieu frais sur chaque échantillon.
- Culture des sphéroïdes pendant encore 7-10 jours. Préparez des groupes de sphéroïdes avec quatre à six puits chacun et choisissez-en au moins trois pour analyse.
REMARQUE : Si vous effectuez un test de dépistage de drogues, préparez deux groupes pour un échantillon. Un groupe est utilisé pour les tests de viabilité, tandis que l’autre est utilisé pour la capture et l’analyse d’images.
2. Traitement de la toxicomanie
- Dissoudre le médicament selon les instructions du fabricant. Préparez des solutions de travail 100x avec DMSO. Préparez au moins cinq doses du médicament en dilution en série. Ici, le médicament thérapeutique contre le cancer du poumon, AMG 510, est utilisé comme exemple. La composition est indiquée dans le tableau supplémentaire 1.
- Utilisez 0,1 % de DMSO comme témoin positif.
- Ajouter 125 μL de milieu médicamenteux à chaque puits et remettre la plaque dans l’incubateur (37 °C dans de l’air humidifié avec 5% de CO2). À ce stade, chaque puits contient un sphéroïde tumoral, 25 μL de gel de 3,5 mg / mL et 175 μL du milieu. Les commandes contiennent 200 μL du milieu.
3. Viabilité des sphéroïdes
- Mesurez la viabilité du sphéroïde à l’aide d’un kit de dosage Alamar Blue conformément aux directives du fabricant. Mesurer la viabilité à l’aide d’un photomètre à microplaques (absorbance à 570 nm et 600 nm) après le traitement Alamar Blue.
- Mesurer la viabilité au jour 1, au jour 4, au jour 7 et au jour 10 après avoir incorporé les sphéroïdes dans le gel, respectivement, ou comme indiqué.
REMARQUE: Lors de l’utilisation d’un test Alamar Blue, au moins 16 heures de temps de réaction sont nécessaires. Par conséquent, ajoutez 20 μL de bleu d’alamar dans les après-midi du jour 0, du jour 3, du jour 6 et du jour 9. - Aspirer 100 μL du milieu surnageant de chaque puits vers une nouvelle plaque d’essai et ajouter 80 μL de milieu frais à chaque puits de la plaque de culture. Ensuite, remplacez un autre 100 μL du milieu traité par le médicament. Assurez-vous qu’il n’y a pas de restes d’Alamar Blue dans le puits.
REMARQUE: Le remplacement du milieu est effectué chaque fois que la viabilité est testée, et le milieu traité par le médicament des groupes d’imagerie-analyse doit être remplacé le même jour.
4. Observation des sphéroïdes et analyse de l’apprentissage profond à travers des images dans le test de dépistage de drogue
- Imagerie
- Aspirer 100 μL du milieu avant l’imagerie.
- Placez l’assiette sur la scène. Obtenez des images numériques des sphéroïdes à l’aide d’un microscope automatisé avec un objectif 10x (objectif 2x premier). Le microscope peut focaliser et centraliser ces sphéroïdes automatiquement.
REMARQUE: La fonction de mise au point automatique et l’algorithme utilisé ont déjà été signalés par Yazdanfar et al.17. - Attendez l’imagerie automatique. Quatre images sont acquises pour chaque sphéroïde. Une image intégrée est formée et traitée avec le logiciel connecté au système d’imagerie à haut contenu.
- Cliquez sur le bouton « Image patch process » et choisissez les images intégrées dans le logiciel.
- Choisissez « Modèle U-NET » et tapez le taux de conversion (10x les images objectives ont un taux de conversion de 3,966). Cliquez en bas de l’écran ci-dessous pour lancer le traitement de l’image. Ensuite, enregistrez les données de diamètre, de périmètre et de rugosité dans un tableur.
- Calculez l’indice de périmètre excédentaire (EPI). L’EPI est le rapport entre le périmètre sphéroïde (P 0) et le périmètre équivalent (Pe), tel que calculé par Eq. 1. Mesurez l’aire du sphéroïde au plan focal (S) à l’aide de l’image J. Ensuite, calculez le périmètre équivalent du sphéroïde à l’aide de l’équation 2.
PEV = (P o− P e)/Pe (Eq. 1)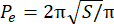 (Éq. 2)
(Éq. 2)
REMARQUE: Le périmètre sphéroïde est généré par le logiciel avec des algorithmes d’apprentissage profond basés sur le modèle U-NET développé. - Ajouter 100 μL de milieu frais avec le médicament et remettre la plaque dans l’incubateur (37 °C dans de l’air humidifié avec 5% de CO2).
- Inhibition sphéroïde
- Calculer l’inhibition de la croissance tumorale (TGI) en utilisant Eq. 3. Le volume sphéroïde relatif (RTV) est le volume terminal sur le volume d’origine (Eq. 4). Le volume sphéroïde (V) est calculé automatiquement par le logiciel à l’aide de l’équation 5 en fonction de la sortie du diamètre du sphéroïde.
IGC = (contrôle RTV −traitement RTV)/contrôle RTV × 100 % (Eq. 3)
RTV =borne V/Voriginal (Eq. 4)
V = 4/3π(d/2)3 (Eq. 5)
NOTE: Le TGI est obtenu en référence à l’inhibition de la croissance in vivo , et les poids tumoraux sont remplacés par RTV. Lecontrôle RTV est le volume sphéroïde relatif du groupe témoin, letraitement RTV est le volume sphéroïde relatif du groupe testé sur le médicament, Vterminal est le volume du sphéroïde le dernier jour, Voriginal est le volume du sphéroïde le premier jour de culture et d représente le diamètre du sphéroïde.
- Calculer l’inhibition de la croissance tumorale (TGI) en utilisant Eq. 3. Le volume sphéroïde relatif (RTV) est le volume terminal sur le volume d’origine (Eq. 4). Le volume sphéroïde (V) est calculé automatiquement par le logiciel à l’aide de l’équation 5 en fonction de la sortie du diamètre du sphéroïde.
Access restricted. Please log in or start a trial to view this content.
Résultats
La figure 1A,B montre le processus utilisé pour construire des sphéroïdes tumoraux dans cette étude. Nous avons d’abord ensemencé les cellules dans une plaque de fond en U de 48 puits. Cette étape est presque la même que celle utilisée en culture cellulaire 2D. Nous avons conservé la plaque dans un incubateur commun avec de l’eau entourant les puits afin que les cellules déposées commencent à former des sphéroïdes dans un processus d’auto-assemblage. Dan...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le microenvironnement joue un rôle important dans la croissance tumorale. Il peut affecter la fourniture de matrices extracellulaires, les gradients d’oxygène, la nutrition et l’interaction mécanique et, par conséquent, affecter l’expression des gènes, les voies de signalisation et de nombreuses fonctions des cellules tumorales 19,20,21. Dans de nombreux cas, les cellules 2D ne produisent pas de tels effets ou même p...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions tous les membres de nos laboratoires pour leurs commentaires critiques et leurs suggestions. Cette recherche a été soutenue par le projet clé de la Commission de la santé du Jiangsu (K2019030). La conceptualisation a été effectuée par C.W. et Z.C., la méthodologie a été effectuée par W.H. et M.L., l’enquête a été effectuée par W.H. et M.L., la conservation des données a été effectuée par W.H., Z.Z., S.X. et M.L., la préparation de l’ébauche originale a été effectuée par Z.Z., J.Z., S.X., W.H., et X.L., l’examen et la révision ont été effectués par Z.C., l’administration du projet a été effectuée par C.W. et Z.C., et l’acquisition du financement a été effectuée par C.W. Tous les auteurs ont lu et accepté la version publiée du manuscrit.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 0.5-10 μL Pipette tips | AXYGEN | T-300 | |
| 1.5 mL Boil proof microtubes | Axygen | MCT-150-C | |
| 100-1000μL Pipette tips | KIRGEN | KG1313 | |
| 15 mL Centrifuge Tube | Nest | 601052 | |
| 200 μL Pipette tips | AXYGEN | T-200-Y | |
| 3D gel | Avatarget | MA02 | |
| 48-well U bottom Plate | Avatarget | P02-48UWP | |
| 50 mL Centrifuge Tube | Nest | 602052 | |
| Alamar Blue | Thermo | DAL1100 | |
| Anti-Adherence Rinsing Solution | STEMCELL | #07010 | |
| Certified FBS | BI | 04-001-1ACS | |
| Deionized water | aladdin | W433884-500ml | |
| DMEM (Dulbecco's Modified Eagle Medium) | Gibco | 11965-092 | |
| DMSO | sigma | D2650-100ML | |
| Excel sofware | Microsoft office | ||
| Graphpad prism sofware | GraphPad software | ||
| High Content Imager and SMART system | Avatarget | 1-I01 | |
| Image J software | National Institutes of Health | ||
| Insulin-Transferrin-Selenium-A Supplement (100X) | Gibco | 51300-044 | |
| Parafilm | Bemis | PM-996 | |
| PBS | Solarbio | P1020 | |
| Penicillin/streptomycin Sol | Gibco | 15140-122 | |
| RPMI 1640 | Gibco | 11875-093 | |
| Scientific Fluoroskan Ascent | Thermo | Fluoroskan Ascent | |
| T25 Flask | JET Biofil | TCF012050 | |
| Trypsin, 0.25% (1X) | Hyclone | SH30042.01 |
Références
- Carioli, G., et al. European cancer mortality predictions for the year 2021 with focus on pancreatic and female lung cancer. Annals of Oncology. 32 (4), 478-487 (2021).
- Katti, A., Diaz, B. J., Caragine, C. M., Sanjana, N. E., Dow, L. E. CRISPR in cancer biology and therapy. Nature Reviews Cancer. 22 (5), 259-279 (2022).
- Abrantes, R., Duarte, H. O., Gomes, C., Walchili, S., Reis, C. A. CAR-Ts: New perspectives in cancer therapy. FEBS Letter. 596 (4), 403-416 (2022).
- Shokooohi, A., et al. Effect of targeted therapy and immunotherapy on advanced nonsmall-cell lung cancer outcomes in the real world. Cancer Medicine. 11 (1), 86-93 (2022).
- Chen, K., Zhang, Y., Qian, L., Wang, P. Emerging strategies to target RAS signaling in human cancer therapy. Journal of Hematology & Oncology. 14 (1), 116(2021).
- Pinto, B., Henriques, A. C., Silva, P. M. A., Bousbaa, H. Three-dimensional spheroids as in vitro preclinical models for cancer research. Pharmaceutics. 12 (12), 1186(2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33(2020).
- Qin, Y., Hu, X., Fan, W., Yan, J. A stretchable scaffold with electrochemical sensing for 3D culture, mechanical loading, and real-time monitoring of cells. Advanced Science. 8 (13), 2003738(2021).
- Wartenberg, M., et al. Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxia-inducible factor (HIF-1) ad reactive oxygen species. FASEB Journal. 17 (3), 503-505 (2003).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nature Reviews Cancer. 6 (8), 583-592 (2006).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: How 3D culture microenvironments alter cellular cues. Journal of Cell Science. 125 (13), 3015-3024 (2012).
- Brüningk, S. C., Rivens, I., Box, C., Oelfke, U., Ter Haar, G. 3D tumour spheroids for the prediction of the effects of radiation and hyperthermia treatments. Scientific Reports. 10, 1653(2020).
- Graves, E. E., Maity, A., Thu Le, Q. The tumor microenvironment in non-small-cell lung cancer. Seminars in Radiation Oncology. 20 (3), 156-163 (2010).
- Kunz-Schughart, L. A., Frreyer, J. P., Ebner, R. The use of 3-D cultures for high-throughput screening: The multicellular spheroid model. Journal of Biomolecular Screening. 9 (4), 273-285 (2004).
- Carragher, N., et al. Concerns, challenges and promises of high-content analysis of 3D cellular models. Nature Review Drug Discovery. 17 (8), 606(2018).
- Huang, Y., et al. Longitudinal morphological and physiological monitoring of three-dimensional tumor spheroids using optical coherence tomography. Journal of Visualized Experiments. (144), e59020(2019).
- Yazdanfar, S., et al. Simple and robust image-baed autofocusing for digital microscopy. Optics Express. 16 (12), 8670-8677 (2008).
- Chen, Z., et al. Automated evaluation of tumor spheroid behavior in 3D culture using deep learning-based recognition. Biomaterials. 22 (272), 120770(2021).
- Boucherit, N., Gorvel, L., Olive, D. 3D tumor models and their use for the testing of immunotherapies. Frontiers in Immunology. 11, 603640(2020).
- Anastasiou, D., et al. Microenvironment factors shaping the cancer metabolism landscape. British Journal of Cancer. 116 (3), 277-286 (2017).
- Zhou, H., et al. Functions and clinical significance of mechanical tumor microenvironment: Cancer cell sensing, mechanobiology and metastasis. Cancer Communications. 43 (5), 374-400 (2022).
- Zhu, G. G., et al. Targeting KRAS cancers: From druggable therapy to druggable resistance. Molecular Cancer. 21 (1), 159(2022).
- Ando, Y., Mariano, C., Shen, K. Engineered in vitro tumor models for cell-based immunotherapy. Acta Biomaterialia. 132, 345-359 (2021).
- Timmins, N. E., Dietmair, S., Nielsen, L. K. Hanging-drop multicellular spheroids as a model of tumor angiogenesis. Angiogenesis. 7 (2), 97-103 (2004).
- Costa, E. C., et al. 3D tumor spheroids: An overview on the tools and techniques used for their analysis. Biotechnology Advances. 34 (8), 1427-1441 (2016).
- Sant, S., Johnston, P. A. The production of 3D tumor spheroids for cancer drug discovery. Drug Discovery Today. Technologies. 23, 27-36 (2017).
- Zanoni, M., et al. 3D tumor spheroid models for in vitro therapeutic screening: A systematic approach to enhance the biological relevance of data obtained. Scientific Reports. 6, 19103(2016).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon