Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Closed-Loop-Neurostimulation zur Biomarker-gesteuerten, personalisierten Behandlung schwerer depressiver Störungen
In diesem Artikel
Zusammenfassung
Die Tiefe Hirnstimulation, die durch einen patientenspezifischen neuronalen Biomarker eines hochgradigen Symptomzustands ausgelöst wird, kann die Symptome einer schweren depressiven Störung besser kontrollieren als eine kontinuierliche Open-Loop-Stimulation. Dieses Protokoll bietet einen Arbeitsablauf zur Identifizierung eines patientenspezifischen neuronalen Biomarkers und zur Steuerung der Verabreichung der therapeutischen Stimulation auf der Grundlage des identifizierten Biomarkers.
Zusammenfassung
Bei der Tiefen Hirnstimulation wird eine elektrische Stimulation an bestimmte Hirnregionen verabreicht, um einen therapeutischen Nutzen zu erzielen. Im Zusammenhang mit der Major Depressive Disorder (MDD) haben die meisten Studien bisher eine kontinuierliche oder Open-Loop-Stimulation mit vielversprechenden, aber gemischten Ergebnissen durchgeführt. Ein Faktor, der zu diesen gemischten Ergebnissen beiträgt, kann darauf zurückzuführen sein, wann die Stimulation angewendet wird. Die Verabreichung einer Stimulation, die spezifisch für Zustände mit hohen Symptomen in einer personalisierten und reaktionsschnellen Weise ist, kann bei der Verringerung der Symptome wirksamer sein als eine kontinuierliche Stimulation und kann verminderte therapeutische Effekte im Zusammenhang mit der Gewöhnung vermeiden. Darüber hinaus ist eine kürzere Gesamtdauer der Stimulation pro Tag vorteilhaft, um den Energieverbrauch des Geräts zu senken. Dieses Protokoll beschreibt einen experimentellen Arbeitsablauf mit einem chronisch implantierten Neurostimulationsgerät, um eine Closed-Loop-Stimulation für Personen mit behandlungsrefraktärer MDD zu erreichen. Dieses Paradigma beruht auf der Bestimmung eines patientenspezifischen neuronalen Biomarkers, der mit Zuständen hoher Symptome in Verbindung steht, und der Programmierung der Gerätedetektoren, so dass durch dieses Auslesen des Symptomzustands eine Stimulation ausgelöst wird. Zu den beschriebenen Verfahren gehört, wie neuronale Aufzeichnungen gleichzeitig mit Patientensymptomberichten erhalten werden, wie diese Daten in einem Zustandsraummodellansatz verwendet werden, um Zustände mit niedrigen und hohen Symptomen und entsprechende neuronale Merkmale zu unterscheiden, und wie das Gerät anschließend programmiert und abgestimmt wird, um eine Closed-Loop-Stimulationstherapie zu liefern.
Einleitung
Die Major Depressive Disorder (MDD) ist eine neuropsychiatrische Erkrankung, die durch abnorme Aktivität und Konnektivität auf Netzwerkebene gekennzeichnet ist1. Die Krankheit zeigt eine Vielzahl von Symptomen, die von Person zu Person variieren, im Laufe der Zeit schwanken und von verschiedenen neuronalen Schaltkreisen herrühren können 2,3. Etwa 30 % der Patienten mit MDD sind refraktär gegenüber Standardbehandlungen4, was die Notwendigkeit neuer Ansätze unterstreicht.
Die Tiefe Hirnstimulation (THS) ist eine Form der Neuromodulation, bei der elektrischer Strom an bestimmte Bereiche des Gehirns abgegeben wird, um die Aktivität zu modulieren. Die THS zur Behandlung von MDD war in einigen Anwendungen sehr erfolgreich5,6, konnte sich aber auch in größeren Studien nicht replizieren 7,8. In allen zitierten Studien wurde die Open-Loop-Stimulation9 verwendet, bei der die Verabreichung der vermeintlichen therapeutischen Stimulation mit festen Parametern kontinuierlich erfolgte. Im Gegensatz dazu liefert die Closed-Loop-Stimulation eine Stimulation auf der Grundlage eines programmierten Biomarkers oder eines neuronalen Aktivitätsmusters, das mit dem Symptomzustand verbunden ist10. Es gibt zwei Hauptimplementierungen der Closed-Loop-Stimulation: die responsive Stimulation und die adaptive Stimulation11. Die reaktionsschnelle Stimulation liefert Stimulationsschübe mit konstanten Parametern (z. B. Frequenz, Amplitude, Pulsbreite), wenn die programmierten Kriterien erfüllt sind. Bei der adaptiven Stimulation ändern sich die Stimulationsparameter dynamisch in Abhängigkeit vom gemessenen Biomarker, je nach Algorithmus, der mehrere Fixpunkte oder eine automatische kontinuierliche Anpassung haben kann. Die Stimulation kann kontinuierlich oder intermittierend mit adaptiver Stimulation erfolgen. Die adaptive Stimulation hat eine überlegene Wirksamkeit gegenüber der Open-Loop-Stimulation bei der Kontrolle der Symptome der Parkinson-Krankheit gezeigt12. Die responsive Neurostimulation bei Epilepsie 13 ist von der Food and Drug Administration (FDA) zugelassen, während frühe Untersuchungen der responsiven Stimulation bei MDD 14 und der adaptiven Stimulation bei Tourette-Syndrom15 und essentiellem Tremor16 ebenfalls einen therapeutischen Nutzen zeigen.
Um eine Closed-Loop-Stimulation zu implementieren, muss ein physiologisches Signal ausgewählt und verfolgt werden, um zu erfahren, wann die Stimulation verabreicht werden sollte. Dieses Feedback ist der Hauptunterschied zwischen Open-Loop- und Closed-Loop-Stimulation und wird durch die Auswahl eines Biomarkers realisiert. Dieses Protokoll bietet ein Verfahren zur Bestimmung eines personalisierten Biomarkers entsprechend der Konstellation von Symptomen, die eine bestimmte Person erlebt. Zukünftige Metaanalysen bei Patienten werden zeigen, ob es gemeinsame Biomarker für alle Individuen gibt oder ob die heterogene Darstellung der MDD-Symptome und der zugrunde liegenden Schaltkreise einen personalisierten Ansatz erfordert17,18. Die Verwendung von THS-Geräten, die sowohl neuronale Aktivität erfassen als auch elektrische Stimulation abgeben können, ermöglicht sowohl die Entdeckung dieses Biomarkers als auch die anschließende Implementierung einer Closed-Loop-Neuromodulation. Dieser Ansatz setzt einen engen zeitlichen Zusammenhang zwischen neuronaler Aktivität und spezifischen Symptomzuständen voraus und ist möglicherweise nicht für alle Indikationen oder Symptome anwendbar.
Während Indikationen wie die Parkinson-Krankheit und der essentielle Tremor Symptome aufweisen, die mit peripheren Sensoren gemessen werden können (z. B. Tremor, Rigidität), werden die Symptome einer MDD in der Regel vom Patienten berichtet oder von einem Kliniker anhand standardisierter Fragen und Beobachtungen beurteilt. Im Zusammenhang mit der Anhäufung ausreichender Daten zur Berechnung eines personalisierten Biomarkers sind klinische Beurteilungen nicht praktikabel, und daher werden Patientenberichte über Symptome durch Bewertungsskalen verwendet. Zu diesen Skalen gehören visuelle Analogskalen für Depression (VAS-D), Angst (VAS-A) und Energie (VAS-E)19 sowie die Sechs-Fragen-Form der Hamilton Depression Rating Scale (HAMD-6)20. Gleichzeitige Aufzeichnungen der neuronalen Aktivität und das Ausfüllen dieser Selbstberichts-Symptombewertungen liefern einen gepaarten Datensatz, der verwendet werden kann, um Beziehungen zwischen spektralen Merkmalen des neuronalen Signals zu untersuchen, die mit Zuständen mit hohen Symptomen zusammenhängen oder diese vorhersagen.
Computergestützte Ansätze, wie z. B. die Zustandsraummodellierung, können verwendet werden, um Beziehungen zwischen Symptomzuständen und neuronalen Merkmalen aufzudecken. Graphentheoretische Methoden sind für die Charakterisierung eines Zustandsraums21 attraktiv, da sie die Entdeckung von Zuständen über verschiedene Zeitskalen ermöglichen, indem sie die zeitliche Nähe zwischen Messungen22 explizit modellieren. Ein Symptom-Zustandsraum-Modell identifiziert Zeiträume, in denen es einen gemeinsamen Phänotyp der Symptome des Patienten gibt, und kann Symptom-Unterzustände lokalisieren, in denen sich die Bewertungen bestimmter Dimensionen der Depression des Patienten je nach Umgebung oder Kontext unterscheiden. Ein Closed-Loop-Ansatz beruht auf der Erkennung von Symptomzuständen auf der Grundlage der zugrunde liegenden Gehirnaktivität. Die Klassifizierung durch maschinelles Lernen ist ein letzter Schritt, der dabei hilft, eine Kombination statistischer Merkmale zu identifizieren, die aus Gehirnaktivitätssignalen abgeleitet werden und zwei oder mehr Symptomzustände am besten unterscheiden14. Dieser zweistufige Ansatz erklärt die Variabilität der Symptome eines Patienten im Laufe der Zeit und verknüpft systematische Muster der Symptomvariation mit der Gehirnaktivität.
Das vorliegende Protokoll verwendet das NeuroPace Responsive Neurostimulationssystem (RNS)13,23. Verfahren zur Bestimmung der optimalen Stimulationsstelle(n) und Parameter liegen außerhalb des Geltungsbereichs dieses Protokolls. Es ist jedoch wichtig, die Stimulationsfähigkeiten eines bestimmten Geräts bei der Entwicklung der Closed-Loop-Neurostimulation zu berücksichtigen. Bei dem in diesem Protokoll verwendeten Gerät wird die Stimulation stromgesteuert und zwischen der Anode(n) und der Kathode(n) abgegeben. Ein oder mehrere Elektrodenkontakte oder der Can (implantierbarer Neurostimulator [INS]) können als Anode(n) oder Kathode(n) ausgewählt werden. Stimulationsfrequenz (1-333,3 Hz), Amplitude (0-12 mA), Pulsbreite (40-1000 μs pro Phase) und Dauer (10-5000 ms, pro Stim) sind vorprogrammiert. Die vorherigen Parameter können für bis zu fünf Stimulationstherapien unabhängig voneinander eingestellt werden; Diese Therapien werden nacheinander verabreicht, wenn die Nachweiskriterien weiterhin erfüllt sind. Es ist nicht möglich, mehrere Stimulationswellenformen gleichzeitig zu liefern (z. B. kann man nicht zwei verschiedene Stimulationsfrequenzen gleichzeitig liefern). Die Stimulationswellenform ist eine symmetrische zweiphasige Rechteckwelle und kann nicht verändert werden.
Protokoll
Dieses Protokoll wurde vom Institutional Review Board der University of California, San Francisco, geprüft und genehmigt.
1. Geräteeinrichtung für Patientenaufzeichnungen zu Hause
- Arbeiten Sie mit einem Vertreter des Geräteherstellers zusammen, um vier konfigurierte Kanäle für die Erfassung festzulegen, zwei von jeder implantierten Elektrode.
HINWEIS: Jeder Kanal nimmt eine bipolare Aufnahme auf. Konfigurierte Kanäle können benachbarte (z. B. 1-2, 3-4) oder überlappende (z. B. 1-3, 2-4) Elektrodenkontakte verwenden. Wenn Elektroden mit einem Abstand von 10 mm implantiert werden, werden in der Regel benachbarte Kontakte verwendet. Bei der Implantation von Elektroden mit einem Abstand von 3,5 mm werden entweder benachbarte oder verschachtelte Kontakte verwendet. Dies wird durch die Untersuchung der Rekonstruktion der Position des Elektrodenimplantats relativ zu anatomischen Zielen und die Untersuchung der Amplitude der Signale bestimmt. Wenn benachbarte Kontakte Signale mit niedriger Amplitude erzeugen, sind verschachtelte Kontakte vorzuziehen. Jeder Kontakt kann nur einmal in der Montage verwendet werden. - Stellen Sie sicher, dass sich der Patient nach der Implantation des Implantats mit kortikalen und/oder Tiefenanschlüssen vollständig von der Operation erholt hat (siehe24 für zusätzliche Informationen zur Implantationstechnik).
- Schließen Sie den Telemetriestab an das Programmiergerät (Tablet des Arztes) an und lassen Sie den Patienten den Stab über sein INS halten oder an einem Tethering-Hut befestigen (Sonderanfertigung, nicht Teil des Gerätesystems; siehe Abbildung 1).
- Melden Sie sich mit dem Programmierer beim Patientendatenmanagementsystem (PDMS; https://pdms.neuropace.com/login.php) an, navigieren Sie zum richtigen Patienten und wählen Sie Programmierung und dann ECoG-Erfassung ändern. Stellen Sie das Aufnahmefenster über die Dropdown-Auswahl auf das Maximum von 240 s für die vier konfigurierten Kanäle ein.
HINWEIS: Die Abtastrate des Geräts beträgt 250 Hz. - Legen Sie auf derselben Einstellungsseite die Option Speicherplatz für Magnetreservierungen auf zwei und für alle anderen Triggertypen auf Null fest, indem Sie die Dropdown-Auswahl verwenden. Dies ermöglicht das priorisierte Speichern von zwei Aufnahmen, die durch Magnetwischbewegungen ausgelöst werden.
HINWEIS: Die geplante Speicherung kann auch aktiviert werden, um neuronale Aufzeichnungen zu festgelegten Tageszeiten automatisch und nicht priorisiert zu speichern. Diese Aufzeichnungen werden nicht zur Bestimmung eines Biomarkers verwendet, können aber für andere Zwecke nützlich sein. - Synchronisieren Sie die neu programmierten Einstellungen mit dem INS des Patienten, indem Sie die Schaltfläche " Überprüfen und programmieren " auswählen, die in der angezeigten Tabelle angezeigten Änderungen bestätigen und die Schaltfläche "Programmierung bestätigen " auswählen.
HINWEIS: Erkennung und Stimulation sollten beide auf Deaktiviert eingestellt sein.
2. Symptomerfassung bei Patientenaufzeichnungen zu Hause
- Bereiten Sie die webbasierte Umfrage für den Patientensymptombericht (z. B. REDCap25) vor, einschließlich Schiebereglern für VAS-D, VAS-A, VAS-E und Auswahlantworten für jede Frage des HAMD-6. Stellen Sie sicher, dass die Uhrzeit des Beginns und Abschlusses der Umfrage protokolliert wird.
- Stellen Sie dem Patienten die von REDCap generierte eindeutige URL zur Verfügung, um entweder per SMS oder E-Mail auf die Symptomumfragen zuzugreifen
3. Verfahren für gleichzeitige Symptomberichte zu Hause und neuronale Aufzeichnungen
- Weisen Sie den Patienten an, das Gerät einzurichten, einschließlich eines Fernmonitors (Patienten-Laptop) und eines Stabs, eines Magneten und eines Geräts zum Ausfüllen der Umfrage (z. B. Smartphone, Tablet oder Computer) (Abbildung 1). Die Schritte 3.2-3.8 werden vom Patienten durchgeführt.
HINWEIS: Die meisten Patienten lernen dieses Verfahren schnell. Persönliche Schulungen, während sich der Patient nach der Implantation noch im Krankenhaus befindet, sind hilfreich, um sich mit den Komponenten vertraut zu machen. Nachdem der Patient nach Hause zurückgekehrt ist, kann ein Videoanruf, während der Patient zu Hause eine Aufzeichnung macht, als nützliche Auffrischung dienen. - Schalten Sie den Remote-Monitor ein und befragen Sie das Gerät mit dem Zauberstab, indem Sie Elektrokortikographie-Aufzeichnungen (ECoG), die seit der letzten Abfrage stattgefunden haben, auf den Remote-Monitor herunterladen.
- Wischen Sie mit dem Magneten über das INS, um eine Magnetaufnahme auszulösen.
HINWEIS: Der Magnet-Swipe löst eine Aufnahme mit einem Vorher-Nachher-Verhältnis von 2:1 aus. Im Falle einer ECoG-Erfassung, die auf 240 s programmiert ist, bedeutet dies, dass 160 s Daten vor dem Wischen und 80 s nach dem Wischen gespeichert werden. - Starten Sie einen Timer. Verwenden Sie die eindeutige URL, um eine Symptomumfrage auszufüllen.
- Nachdem 4 Minuten verstrichen sind oder der Patient die Befragung beendet hat (je nachdem, was später eintritt), wischen Sie den Magneten erneut über das INS, um eine weitere Aufzeichnung auszulösen.
- Verwenden Sie nach mindestens 80 s den Stab, um das Gerät erneut abzufragen und die Daten von den beiden Magnetwischbewegungen auf den Remote-Monitor zu übertragen.
HINWEIS: Aufgrund des begrenzten On-Board-Speichers des INS (bis zu 53 Kanalminuten Daten, je nach Konfiguration13) ist es wünschenswert, diese ECoG-Aufzeichnungen sofort auf den Remote-Monitor zu übertragen, damit sie nicht durch nachfolgende Aufzeichnungen überschrieben werden. - Führen Sie die Schritte 3.1 bis 3.6 mindestens zweimal täglich aus.
- Verbinden Sie den Remote-Monitor mindestens einmal täglich über Ethernet mit dem Internet und wählen Sie Daten übertragen und Synchronisieren auf dem Remote-Monitor aus, um Daten an die Cloud zu senden.
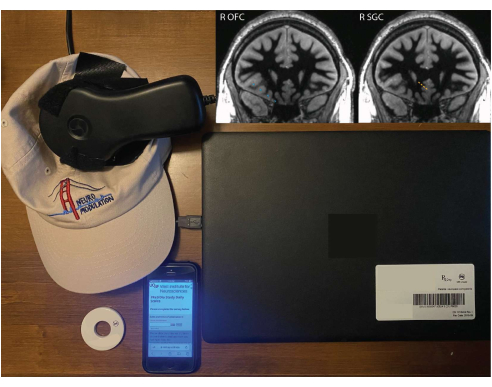
Abbildung 1: Patientenausstattung für Aufzeichnungen zu Hause. Ein Remote-Monitor, der an einem Hut, einem Magneten und einem Smartphone mit REDCap-Vermessung befestigt ist. Intarsienbilder zeigen die Positionen der rechten OFC- (blau) und rechten SGC-Elektrodenimplantate (orange), überlagert mit einer isotropen T1-Sequenz der weißen Substanz von 1 mm aus der präoperativen Magnetresonanztomographie (MRT). Die dargestellte koronale Schicht befindet sich in der Ebene des tiefsten Kontakts, so dass die anderen Kontakte möglicherweise nicht genau auf dieser Scheibe zentriert sind (aufgrund der Tatsache, dass die Elektrodentrajektorie nicht in der koronalen Ebene liegt). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Bestimmung eines personalisierten Biomarkers
- Erstellen Sie einen Datenrahmen mit selbstberichteten Antworten auf Symptomumfragen (z. B. JOVE. PR03_Symptoms.pkl).
- Berechnen Sie spektrale Leistungsprofile für jeden Kanal der ECoG-Aufzeichnung, indem Sie die ECoG-Aktivität mit einer Familie von Morlet-Wavelets (40 Kerne, 12 Zyklen, logarithmisch zwischen 1 und 120 Hz) falten und einen neuen Datenrahmen erstellen (z. B. JOVE. PR03_NeuralPower.pkl).
- Verknüpfen Sie ECoG-Aufzeichnungen mit Symptomberichten, die innerhalb eines Zeitfensters von 5 Minuten vor bis 5 Minuten nach der Initiierung des Symptomberichts aufgetreten sind, indem Sie das Feld trial_id im NeuralPower-Datenrahmen verwenden.
- Identifizieren von Symptomzuständen (Abbildung 2)
- Installieren Sie mit Python 3.10 die in der Datei requirements.txt (Supplementary Folder 1) aufgeführten Anforderungen in einer neuen Umgebung. Dies kann mit pip install -r requirements.txt erfolgen.
- Öffnen Sie die Datei JOVE-Symptom_State_and_Biomarker_Analysis.ipynb (Ergänzungsordner 1) mithilfe von Jupyter Notebook.
- Stellen Sie sicher, dass der Kernel auf die Umgebung eingestellt ist, in der die Anforderungen.txt installiert wurden, und führen Sie JOVE-Symptom_State_and_Biomarker_Analysis.ipynb aus.
HINWEIS: JOVE-Symptom_State_and_Biomarker_Analysis.ipynb berechnet die statistische Ähnlichkeit zwischen den Ergebnissen von Patientenbefragungen mithilfe der Kosinus-Ähnlichkeitsmetrik, die von 0 (keine Ähnlichkeit) bis 1 (identisch) reicht, und erstellt ein Symptomzustandsdiagramm, indem die Ähnlichkeitswerte für alle möglichen Paare von Patientensymptomberichten für zu Hause aggregiert werden. Die spektralen Leistungsmerkmale für jeden Symptomzustand werden berechnet, indem die spektralen Leistungsprofile aggregiert werden, die jedem abgeleiteten Symptomzustand zugeordnet sind. Dieses Verfahren ergibt eine Verteilung von spektralen Leistungsprofilen, die mit jedem Symptomzustand verknüpft sind (Abbildung 3).
- In Szenarien, in denen mehr als zwei Symptomzustände identifiziert werden, werden die Verteilungen der spektralen Leistung, die dem schwersten Symptomzustand und dem am wenigsten schweren Symptomzustand entsprechen, statistisch verglichen.
- Verwenden Sie einen clusterbasierten Permutations-t-Test, um spektrale Frequenzen zu identifizieren, bei denen die spektrale Leistung des schweren Symptomzustands signifikant größer ist als die spektrale Leistung des am wenigsten schweren Symptomzustands. Der Bereich der zusammenhängenden Spektralfrequenzen, die die Symptomzustände differenzieren, wird als ein einziger Biomarker betrachtet.
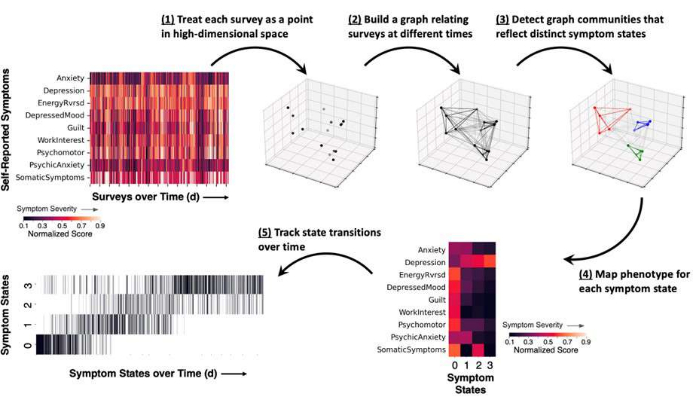
Abbildung 2: Schematische Darstellung des methodischen Vorgehens zur Messung von Symptomzuständen anhand eines repräsentativen Beispiels. Es werden selbstberichtete Patientenbefragungen erhoben und aufgeschlüsselte Symptomwerte werden auf einen Bereich zwischen 0 und 1 normalisiert (dunklere Farben stehen für einen geringeren Schweregrad der Symptome und hellere Farben für einen höheren Schweregrad der Symptome). (1) Jeder ausgefüllte Fragebogen stellt eine Momentaufnahme der Symptome des Patienten dar und wird als Punkt (schwarz) im hochdimensionalen Raum dargestellt. (2) Zeitpunkte werden in einem Symptom-Survey-Graphen miteinander verknüpft, der die Kosinus-Ähnlichkeit zwischen Survey-Berichten (Linien zwischen Punkten) in Beziehung setzt. (3) Die Graph-Community-Erkennung weist jedem Zeitpunkt einen Community- oder Symptomzustand zu (farbige Punkte und Linien), basierend auf dem Muster der Graph-Verbindungen. (4) Die Schweregrade der Symptome werden je nach Zustandszuordnung gemittelt und liefern einen allgemeinen Symptomphänotyp für jeden Zustand. (5) Das Auftreten jedes Zustands kann im Laufe der Zeit als Rasterdiagramm verfolgt werden (vertikale Linien spiegeln einen Symptombericht wider, der einem Zustand zugewiesen ist). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Programmierung der Gerätedetektoreinstellungen
- Melden Sie sich mit dem Programmierer am PDMS an und wählen Sie den richtigen Patienten, die Programmierung und die Änderungserkennung aus.
- Wählen Sie basierend auf dem ausgewählten personalisierten Biomarker den richtigen Kanal für die Erkennung der Aktivität aus.
- Wenn Sie zum ersten Mal ein Muster erstellen, wählen Sie zunächst eine ECoG aus, indem Sie auf eine der unten gezeigten klicken, auf einen Kanal, der aus dieser ECoG ausgewählt wurde, und auf einen markierten Zeitraum.
- Wenn Sie ein Muster aus einem bereits vorhandenen erstellen, ändern Sie den Kanal, indem Sie auf Muster klicken und die Schaltfläche Kanal ändern auswählen.
- Wählen Sie für Detect (Erkennen) die Option Rhythmic Activity (Rhythmische Aktivität) aus, was einen Bandpassdetektor bezeichnet.
- Klicken Sie auf Weitere Steuerelemente und ADV-Einstellungen. Wählen Sie die gewünschte Mindestfrequenz und Maximalfrequenz aus. Stellen Sie sicher, dass die Einstellungen wie folgt lauten: Bandpass: Ein; Leitungslänge: Aus; Bereich: Aus; Inversionslogik: nicht invertiert.
- Programmieren Sie die Mindestamplitude und die Mindestdauer für den Detektor. Beginnen Sie mit einer Mindestamplitude von 0,8 % und einer Mindestdauer von 0,64 s (entspricht einem Bandpassschwellenwert von fünf und einer Größe des Erkennungsanalysefensters von 1280 ms).
HINWEIS: Die minimale Amplitude ist ein Prozentsatz der gesamten Signalamplitude, die die erkannte Aktivität überschreiten muss. Nur Amplituden oberhalb dieser Schwelle können für die Detektion verwendet werden. Die Mindestdauer gibt an, wie lange das Signal mit hoher Amplitude aufrechterhalten werden muss. Dies wird als Anzahl der Zeitabschnitte mit fester Dauer nachverfolgt. Insbesondere x von y 128 ms Zeitabschnitten müssen diese Kriterien erfüllen, wobei x der Bandpassschwellenwert und y [ Größe des Analysefensters erkennen/128] ist, wie in den technischen Parametern angezeigt. Eine Episode (d.h. das Auslösen des Detektors) muss beendet werden, bevor ein nachfolgender Trigger erfolgen kann. Einige Einstellungen können zu empfindlich sein und dazu führen, dass eine Episode auf unbestimmte Zeit verharrt, wodurch nachfolgende Auslöser verhindert werden. - Sobald alle Meldereinstellungen ausgewählt sind, klicken Sie auf Fertig , um alle Programmierfenster zu schließen.
HINWEIS: Es können mehrere Detektoren programmiert werden. Die Detektion kann basierend auf der UND/ODER-Logik zwischen diesen Detektoren ausgelöst werden. Beginnen Sie mit einem Detektor, um das Verhalten zu verstehen, bevor Sie einen zweiten Detektor einführen. - Platzieren Sie den Stab über dem INS des Patienten, wählen Sie Überprüfen und Programmieren und klicken Sie sich durch die Bestätigungsmeldungen, um diese Detektoreinstellung zu initialisieren.
6. Titrieren der Gerätedetektoreinstellungen
- Nachdem der Gerätedetektor programmiert und auf dem Gerät initialisiert wurde, führen Sie Testaufzeichnungen durch, um zu beurteilen, ob die Empfindlichkeit des Detektors angepasst werden sollte, um die gewünschte Auslösefrequenz zu erreichen. Dies kann mit Hilfe von Live-ECoGs oder dem Vernehmungsprotokoll erreicht werden. Anpassungen der Empfindlichkeit des Detektors werden empirisch auf der Grundlage von Patientensymptomberichten, Nebenwirkungen und Ergebnissen ermittelt. Diese Anpassungen können während des gesamten Behandlungsverlaufs erforderlich sein. 30 Minuten Stimulation pro Tag können als konservativer Ausgangspunkt verwendet werden, um die klinische Wirksamkeit zu beurteilen und gleichzeitig die Batterielebensdauer zu schonen.
- Live-ECoGs
- Halten Sie den Stab über dem INS des Patienten und wählen Sie Live ECOGs auf dem Programmiergerät aus.
- Zählen Sie während der Live-Aufzeichnung die Anzahl der Erkennungen, die für die Dauer der Aufzeichnung auftreten. Dies gibt einen Hinweis darauf, wie oft der Melder ausgelöst wird.
HINWEIS: Einige Detektoren können zustandsabhängig sein, insbesondere Detektoren, die auf niedrige Frequenzen eingestellt sind (z. B. während Schlafphasen oder Schläfrigkeit aktiver). Daher haben Live-Aufzeichnungen Einschränkungen bei der Abschätzung, wie oft ein Detektor auslösen kann. Live-Aufnahmen können auch unter elektromagnetischen Interferenzen (z. B. Leitungsrauschen) oder schlechter Positionierung des Stabs leiden.
- Vernehmungsprotokoll
- Minuten bis Stunden nach dem Einstellen des Detektors legen Sie den Stab über das INS des Patienten, um das Gerät abzufragen.
- Navigieren Sie im PDMS zu Aktivität, wählen Sie Ereignisliste und klicken Sie ab dem Zeitpunkt der Aufzeichnung auf Erstabfrage . Die Tabelle am unteren Rand enthält eine Liste mit Uhrzeiten aller Erkennungsereignisse. Dieses Dokument kann im PDF-Format exportiert und zur Quantifizierung analysiert werden.
- Basierend auf der Anzahl der Detektionen pro aufgezeichneter Zeiteinheit im Vergleich zur gewünschten Stimulationsdichte passen Sie die Detektordauer und die Amplitudenparameter bei Bedarf an. Stellen Sie sicher, dass Sie nach jedem Satz von Änderungen auf Überprüfung und Programm klicken, um diese auf dem INS des Patienten zu initialisieren.
7. Programmierung der Stimulationseinstellungen des Geräts
- Melden Sie sich mit dem Programmiergerät am PDMS an und wählen Sie den richtigen Patienten, Programmierung und Änderungsstimulation aus.
- Wählen Sie die gewünschten Anschlusskontakte oder Dosen (INS) als Anode(n) und Kathode(n) aus. Wählen Sie den gewünschten Stimulationsstrom, die Impulsbreite, die Dauer und die Frequenz aus.
HINWEIS: Es können bis zu fünf Stimulationstherapien programmiert werden. Jede Therapie besteht aus zwei Stimulationsausbrüchen, die gleich oder unterschiedlich programmiert werden können. Ein bestimmter Detektorauslöser kann zu einer variablen Anzahl von Stimulationstherapien führen, abhängig von der anhaltenden Dauer der Episode. Programmieren Sie nur Therapie 1, wobei beide Bursts die gleichen Parameter haben, was dazu führt, dass bei jedem Auslösen des Detektors eine gleichbleibende Stimulationsdauer abgegeben wird. In dieser Konfiguration ist die Gesamtdauer der Stimulation, die beim Auslösen des Detektors abgegeben wird, die Summe aus Stim 1 Burst 1 und Stim 1 Burst 2. Wenn mehrere Therapien programmiert und verabreicht werden, können maximal fünf Therapien während einer bestimmten Episode verabreicht werden. Die Episode muss beendet und eine neue Episode ausgelöst werden, damit die nachfolgende Stimulation verabreicht werden kann. - Wenn Sie die Gesamtmenge der pro Tag verabreichten Stimulation begrenzen möchten, wählen Sie einen Wert für Therapielimit pro Tag und eine Zeit zum Zurücksetzen des Therapielimits aus.
HINWEIS: Die Zeitzone für das Zurücksetzen des Therapielimits ist auf das primäre Zentrum des Patienten eingestellt. Wenn Patienten umgezogen sind, kann diese von der Heimatzeitzone des Patienten abweichen. - Wenn keine nächtliche Stimulation gewünscht wird, stellen Sie das Therapielimit pro Tag und die Rücksetzzeit des Therapielimits so ein, dass der Detektor das Therapielimit zwischen der Reset-Zeit und der Schlafenszeit des Patienten erreicht.
- Platzieren Sie den Stab über dem INS des Patienten, wählen Sie Überprüfung & Programm und klicken Sie sich durch die Bestätigungsmeldungen, um die Stimulationseinstellungen zu initialisieren.
Ergebnisse
Die hier erhobenen und präsentierten Daten stammen von einem einzigen Patienten mit Vierkanal-Elektroden, die in den rechten orbitofrontalen Kortex (OFC) und das rechte subgenuale Cingulum (SGC) implantiert wurden (Abbildung 1). Für den OFC wurde ein Kabel mit einem Abstand von 10 mm von Mitte zu Mitte verwendet, um sowohl den medialen als auch den lateralen Aspekt zu erreichen, während für den SGC ein Kabel mit einem Rastermaß von 3,5 mm verwendet wurde, um eine räumlich konzentrierte...
Diskussion
Die Tiefe Hirnstimulation hat sich zu einer etablierten Therapie für die Parkinson-Krankheit, essentiellen Tremor, Dystonie und Epilepsie entwickelt und wird aktiv bei zahlreichen anderen neuropsychiatrischen Erkrankungen untersucht26,27,28,29. Die überwiegende Mehrheit der THS wird im Open-Loop-Modus verabreicht, in dem die Stimulation kontinuierlich erfolgt. Bei paroxysmalen Symptomen kann ...
Offenlegungen
ADK berät Eisai, Evecxia Therapeutics, Ferring Pharmaceuticals, Galderma, Harmony Biosciences, Idorsia, Jazz Pharmaceuticals, Janssen Pharmaceuticals, Merck, Neurocrine Biosciences, Pernix Pharma, Sage Therapeutics, Takeda Pharmaceutical Company, Big Health, Millennium Pharmaceuticals, Otsuka Pharmaceutical und Neurawell Therapeutics. ADK bedankt sich für die Unterstützung von Janssen Pharmaceuticals, Jazz Pharmaceuticals, Axsome Therapeutics (Nr. AXS-05-301) und Reveal Biosensors. KWS ist Mitglied des Beirats von Nesos. UCSF und EFC verfügen über Patente im Zusammenhang mit der Hirnstimulation zur Behandlung neuropsychiatrischer Erkrankungen. Die anderen Autoren erklären, dass es keine konkurrierenden Interessen gibt.
Danksagungen
Diese Arbeit wurde vom Ray and Dagmar Dolby Family Fund durch die Abteilung für Psychiatrie der UCSF (KKS, ANK, NS, JF, VRR, KWS, EFC, ADK), durch einen National Institutes of Health Award Nr. K23NS110962 (KWS), NARSAD Young Investigator Grant der Brain & Behavior Research Foundation (KWS) und 1907 Trailblazer Award (KWS).
Materialien
| Name | Company | Catalog Number | Comments |
| Depth Lead | Neuropace | DL-330-3.5 | 30 cm length, 3.5 mm contact spacing |
| Depth Lead | Neuropace | DL-330-10 | 30 cm length, 10 mm contact spacing |
| Depth Lead | Neuropace | DL-344-3.5 | 44 cm length, 3.5 mm contact spacing |
| Depth Lead | Neuropace | DL-344-10 | 44 cm length, 10 mm contact spacing |
| Hat with velcro | Self-assembled | NA | Optional |
| Jupyter Notebook | Project Jupyter | NA | |
| Magnet | Neuropace | M-01 | |
| Programmer | Neuropace | PGM-300 | Clinician tablet |
| Python 3.10 | Python | NA | |
| Remote Monitor | Neuropace | 5000 | Patient laptop |
| Responsive Neurostimulation System (RNS) | Neuropace | RNS-320 | |
| Wand | Neuropace | W-02 |
Referenzen
- Kaiser, R. H., Andrews-Hanna, J. R., Wager, T. D., Pizzagalli, D. A. Large-scale network dysfunction in major depressive disorder: A meta-analysis of resting-state functional connectivity. JAMA Psychiatry. 72 (6), 603-611 (2015).
- Goldstein-Piekarski, A. N., et al. Mapping neural circuit biotypes to symptoms and behavioral dimensions of depression and anxiety. Biological Psychiatry. 91 (6), 561-571 (2022).
- Williams, L. M. Precision psychiatry: a neural circuit taxonomy for depression and anxiety. The Lancet Psychiatry. 3 (5), 472-480 (2016).
- Ionescu, D. F., Rosenbaum, J. F., Alpert, J. E. Pharmacological approaches to the challenge of treatment-resistant depression. Dialogues in Clinical Neuroscience. 17 (2), 111-126 (2015).
- Mayberg, H. S., et al. Deep brain stimulation for treatment-resistant depression. Neuron. 45 (5), 651-660 (2005).
- Kennedy, S. H., et al. Deep brain stimulation for treatment-resistant depression: follow-up after 3 to 6 years. The American Journal of Psychiatry. 168 (5), 502-510 (2011).
- Holtzheimer, P. E., et al. Subcallosal cingulate deep brain stimulation for treatment-resistant depression: a multisite, randomised, sham-controlled trial. The Lancet Psychiatry. 4 (11), 839-849 (2017).
- Dougherty, D. D., et al. A randomized sham-controlled trial of deep brain stimulation of the ventral capsule/ventral striatum for chronic treatment-resistant depression. Biological Psychiatry. 78 (4), 240-248 (2015).
- Morishita, T., Fayad, S. M., Higuchi, M., Nestor, K. A., Foote, K. D. Deep brain stimulation for treatment-resistant depression: systematic review of clinical outcomes. Neurotherapeutics. 11 (3), 475-484 (2014).
- Lo, M. -. C., Widge, A. S. Closed-loop neuromodulation systems: next-generation treatments for psychiatric illness. International Review of Psychiatry. 29 (2), 191-204 (2017).
- Hoang, K. B., Cassar, I. R., Grill, W. M., Turner, D. A. Biomarkers and stimulation algorithms for adaptive brain stimulation. Frontiers in Neuroscience. 11, 564 (2017).
- Little, S., et al. Adaptive deep brain stimulation in advanced Parkinson disease. Annals of Neurology. 74 (3), 449-457 (2013).
- Jarosiewicz, B., Morrell, M. The RNS system: brain-responsive neurostimulation for the treatment of epilepsy. Expert Review of Medical Devices. 18 (2), 129-138 (2021).
- Scangos, K. W., et al. Closed-loop neuromodulation in an individual with treatment-resistant depression. Nature Medicine. 27 (10), 1696-1700 (2021).
- Cagle, J. N., et al. Embedded human closed-loop deep brain stimulation for Tourette syndrome: a nonrandomized controlled trial. JAMA Neurology. 79 (10), 1064-1068 (2022).
- He, S., et al. Closed-loop deep brain stimulation for essential tremor based on thalamic local field potentials. Movement Disorders. 36 (4), 863-873 (2021).
- Drysdale, A. T., et al. Resting-state connectivity biomarkers define neurophysiological subtypes of depression. Nature Medicine. 23 (1), 28-38 (2017).
- Siddiqi, S. H., et al. Brain stimulation and brain lesions converge on common causal circuits in neuropsychiatric disease. Nature Human Behaviour. 5 (12), 1707-1716 (2021).
- Ahearn, E. P. The use of visual analog scales in mood disorders: A critical review. Journal of Psychiatric Research. 31 (5), 569-579 (1997).
- Bech, P., et al. The Hamilton depression scale. Evaluation of objectivity using logistic models. Acta Psychiatrica Scandinavica. 63 (3), 290-299 (1981).
- Khambhati, A. N., Sizemore, A. E., Betzel, R. F., Bassett, D. S. Modeling and interpreting mesoscale network dynamics. NeuroImage. 180, 337-349 (2018).
- Zamani Esfahlani, F., Bertolero, M. A., Bassett, D. S., Betzel, R. F. Space-independent community and hub structure of functional brain networks. NeuroImage. 211, 116612 (2020).
- Kleen, J. K., Rao, V. R. Managing neurostimulation for epilepsy. Deep Brain Stimulation Management. , 177-197 (2022).
- Krucoff, M. O., Wozny, T. A., Lee, A. T., Rao, V. R., Chang, E. F. Operative technique and lessons learned from surgical implantation of the NeuroPace Responsive Neurostimulation® system in 57 consecutive patients. Operative Neurosurgery. 20 (2), E98-E109 (2021).
- Harris, P. A., et al. The REDCap consortium: Building an international community of software platform partners. Journal of Biomedical Informatics. 95, 103208 (2019).
- Krauss, J. K., et al. Technology of deep brain stimulation: current status and future directions. Nature Reviews Neurology. 17 (2), 75-87 (2021).
- Dougherty, D. D. Deep brain stimulation: clinical applications. The Psychiatric Clinics of North America. 41 (3), 385-394 (2018).
- Drobisz, D., Damborská, A. Deep brain stimulation targets for treating depression. Behavioural Brain Research. 359, 266-273 (2019).
- Lee, D. J., Lozano, C. S., Dallapiazza, R. F., Lozano, A. M. Current and future directions of deep brain stimulation for neurological and psychiatric disorders. Journal of Neurosurgery. 131 (2), 333-342 (2019).
- Sun, F. T., Morrell, M. J. Closed-loop neurostimulation: the clinical experience. Neurotherapeutics. 11 (3), 553-563 (2014).
- Malone, D. A., et al. Deep brain stimulation of the ventral capsule/ventral striatum for treatment-resistant depression. Biological Psychiatry. 65 (4), 267-275 (2009).
- Zuo, X. -. N., Xu, T., Milham, M. P. Harnessing reliability for neuroscience research. Nature Human Behaviour. 3 (8), 768-771 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten