Method Article
Nicht-invasive Überwachung der mikrovaskulären Sauerstoffversorgung und reaktiven Hyperämie mit hybrider, diffuser optischer Nahinfrarotspektroskopie für die Intensivpflege
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Protokoll zur nicht-invasiven und kontinuierlichen Messung des absoluten mikrovaskulären Blutflussindex und der Blutsauerstoffsättigung mit einem multimodalen Gerät, das auf einer diffusen Nahinfrarotoptik basiert. Anschließend bewerten wir die Stoffwechselrate des Sauerstoffverbrauchs und der reaktiven Hyperämie mit einem Gefäßverschlusstest.
Zusammenfassung
Die Erkennung von Beeinträchtigungen des mikrovaskulären Sauerstoffverbrauchs und der reaktiven Hyperämie ist in der Intensivmedizin von entscheidender Bedeutung. Es gibt jedoch keine praktischen Mittel für eine robuste und quantitative Bewertung. In diesem Artikel wird ein Protokoll zur Bewertung dieser Beeinträchtigungen unter Verwendung eines hybriden diffusen optischen Nahinfrarotgeräts beschrieben. Das Gerät enthält Module für die zeitaufgelöste und diffuse Korrelationsspektroskopie im nahen Infrarot und die Pulsoximetrie. Diese Module ermöglichen die nicht-invasive, kontinuierliche und Echtzeitmessung der absoluten, mikrovaskulären Blut-/Gewebesauerstoffsättigung (StO2) und des Blutflussindex (BFI) zusammen mit der peripheren arteriellen Sauerstoffsättigung (SpO2). Dieses Gerät verwendet ein integriertes, computergesteuertes Tourniquet-System, um ein standardisiertes Protokoll mit optischer Datenerfassung aus dem Musculus brachioradialis durchzuführen. Der standardisierte Gefäßverschlusstest (VOT) berücksichtigt die in der Literatur berichteten Schwankungen der Verschlussdauer und des Drucks, während die Automatisierung Unterschiede zwischen den Bedienern minimiert. Das von uns beschriebene Protokoll konzentriert sich auf eine 3-minütige Okklusionsphase, aber die in diesem Artikel beschriebenen Details können leicht an andere Dauern und Manschettendrücke sowie andere Muskeln angepasst werden. Die Einbeziehung einer erweiterten Baseline- und Post-Okklusions-Erholungsperiodenmessung ermöglicht die Quantifizierung der Baseline-Werte für alle Parameter und der Blut-/Gewebe-Desoxygenierungsrate, die der metabolischen Rate des Sauerstoffverbrauchs entspricht. Sobald die Manschette gelöst ist, charakterisieren wir die Gewebereoxygenierungsrate, das Ausmaß und die Dauer der hyperämischen Reaktion bei BFI und StO2. Diese letzteren Parameter entsprechen der Quantifizierung der reaktiven Hyperämie, die Aufschluss über die Endothelfunktion gibt. Darüber hinaus liefern die oben genannten Messungen der absoluten Konzentration von sauerstoffhaltigem und desoxygeniertem Hämoglobin, BFI, der abgeleiteten Stoffwechselrate des Sauerstoffverbrauchs, StO2 und SpO2 einen noch zu erforschenden reichhaltigen Datensatz, der den Schweregrad der Erkrankung, personalisierte Therapeutika und Managementinterventionen aufzeigen kann.
Einleitung
Kritisch kranke Patienten, insbesondere solche mit Sepsis und anderen ähnlichen Erkrankungen, weisen häufig eine beeinträchtigte reaktive Hyperämie und mikrovaskuläre Sauerstoffversorgung auf 1,2,3. Während der ersten Wellen der COVID-19-Pandemie benötigte eine unvorhergesehene Anzahl von Patienten ein intensivmedizinisches Management, bei dem die Auswirkungen des Virus auf das Endothel offensichtlich wurden, jedoch ohne eine klare Strategie zur Bewertungund Behandlung 4,5,6. Infolgedessen wurde zunehmend anerkannt, wie wichtig es ist, eine endotheliale Dysfunktion, die indirekt durch reaktive Hyperämie bewertet werden kann, in der Intensivstation, d. h. auf der Intensivstation, zu erkennen7. Es wird erwartet, dass eine praktische, robuste und weit verbreitete Bewertung der Sauerstoffzufuhr und des Sauerstoffverbrauchs an das Gewebe von größter Bedeutung ist, um Wiederbelebungsstrategien zu optimieren und Mikrozirkulationsprobleme direkt anzugehen. Studien haben durchweg gezeigt, dass anhaltende mikrozirkulatorische Veränderungen und mangelnde Kohärenz zwischen Makrozirkulation und Mikrozirkulation bis zu einem gewissen Grad ein Organversagen und ungünstige Ergebnisse bei Patienten vorhersagen, die unter anderem von septischem Schock oder hämorrhagischem Schock betroffen sind, selbst wenn systemische Parameter als normal angesehen werden 8,9,10. Es hat sich gezeigt, dass es unzureichend ist, sich ausschließlich auf makrozirkulatorische Parameter zu verlassen, da die Mikrozirkulation eine entscheidende Rolle für die Sauerstoffversorgung des Gewebes und die Organfunktion spielt 11,12,13. Dieses Papier beschreibt ein Protokoll, das ein neues multimodales Gerät verwendet, das auf diffusen optischen Nahinfrarottechnologien basiert und innerhalb eines internationalen Konsortiums entwickelt wurde, das sich auf Intensivpatienten konzentriert. Das Projekt VASCOVID (https://vascovid.eu) wurde durch die COVID-19-Pandemie motiviert, die mikrovaskuläre Gesundheit der peripheren Muskeln auf der Intensivstation zu bewerten. Wir haben ein Protokoll mit dem entwickelten VASCOVID-Gerät entwickelt, das darauf abzielt, unser Verständnis dieser Parameter zu verbessern und zu zeigen, wie diese Parameter bei der Behandlung kritisch kranker Patienten mit einem viel breiteren Spektrum als COVID-19-Patienten nützlich sein können.
Die Nahinfrarotspektroskopie (NIRS) wird seit Jahrzehnten zur nicht-invasiven Beurteilung der Mikrozirkulation in einem breiten Spektrum klinischer Anwendungen eingesetzt, einschließlich der Patienten auf der Intensivstation 14,15,16,17. Es ist wichtig zu beachten, dass die einfachste Anwendung von NIRS, d. h. kontinuierliches NIRS (CW-NIRS), in weit verbreiteten und klinisch zugelassenen Geräten17,18 implementiert ist, die zur Messung der absoluten Konzentrationen von Oxy- (HbO) und Desoxyhämoglobin (HbR) zur Berechnung der Blut-/Gewebesauerstoffsättigung (StO2) des Mikrogefäßsystems verwendet werden. Während diese Geräte im klinischen Management Nischenanwendungen gefunden haben, z. B. bei Herzoperationen, haben sie aufgrund der Physik der Photonenausbreitung in Geweben klare Grenzen. Dies bedeutet, dass ihre Genauigkeit, Präzision und Wiederholbarkeit fraglich sind, weshalb sie häufig als Trendmonitore verwendet werden19,20. Darüber hinaus werden ihre Ergebnisse stark von oberflächlichen Geweben wie den darüber liegenden Fett- und Hautschichten beeinflusst.
Zeitaufgelöstes NIRS (TRS) verwendet kurze Laserpulse im Pikosekundenbereich bei mehreren Wellenlängen, um deren Verzögerung und Verbreiterung nach dem Durchqueren eines Gewebeszu bewerten 21. Dies ermöglicht es TRS, die Auswirkungen der Absorption von der Streuung zu trennen, um robuste, genaue und präzise Schätzungen zu erhalten und auch die Gesamthämoglobinkonzentration (HbT) zu berechnen. Da TRS auch Pfadlängen auflöst, kann es verwendet werden, um oberflächliche Signale besser von den tiefen Signalen von Interessezu trennen 18,21. Dies geht auf Kosten von Komplexität, Preis und Sperrigkeit. In den letzten Jahren haben TRS-Systeme jedoch an Komplexität und Kosten verloren, was zu zugänglicheren und benutzerfreundlicheren Geräten geführt hat. Dieses Manuskript beschreibt eine Vorrichtung, die ein kompaktes kommerzielles TRS-Modul 22,23 des Erstausrüsters(OEM) verwendet.
Die diffuse Korrelationsspektroskopie (DCS) ist eine weitere Nahinfrarot-Technologie, die die zeitliche Statistik diffuser Speckles nutzt, um die Bewegung von lichtstreuenden Partikeln zu quantifizieren, die von roten Blutkörperchen in Geweben dominiert werden16,24. Dies wiederum ist bekanntlich ein Indikator für den mikrovaskulären Blutfluss, den wir als Blutflussindex (BFI) bezeichnen25. Die gleichzeitige Verwendung von TRS und DCS in einem hybriden optischen Gerät bietet Einblicke in den Sauerstoffstoffwechsel, indem gängige Modelle verwendet werden, um den lokalen Sauerstoffextraktionsanteil abzuleiten und mit dem Blutfluss zu multiplizieren 15,26,27.
Um die Mikrozirkulation auf der Intensivstation zu beurteilen, wird NIRS häufig mit einem Gefäßverschlusstest (VOT) verwendet, bei dem es sich um eine ischämische Herausforderung handelt, bei der die Blutversorgung des sondierten peripheren Muskels für eine bestimmte Dauer (einige Minuten) blockiert wird28,29,30,31,32. Am häufigsten wird sie durch Aufblasen eines um den Oberarm gewickelten Tourniquets oberhalb des systolischen Drucks33 ausgeführt. Während der VOT beurteilen die Kliniker die Reaktion der mikrovaskulären Blutoxygenierung auf Veränderungen des Blutflusses, um den Sauerstoffstoffwechsel in Ruhe und die reaktive Hyperämieabzuleiten 34. Es wird davon ausgegangen, dass während der VOT, wenn die Manschette weit über dem Verschlussdruck der Gliedmaßen aufgeblasen ist, kein Blut zu- oder abfließt. Daher zeigt der Beginn der VOT eine Abwärtsneigung von StO2, d.h. eine Desoxygenierung (DeO 2), da Sauerstoff vom Gewebe verbraucht wird, was eine Abschätzung der Stoffwechselrate des Sauerstoffverbrauchs ermöglicht. Wenn die VOT endet und die Manschette entleert ist, strömt Blut herein, um ihre Erschöpfung auszugleichen, was zu einer hyperämischen Reaktion führt. Dieser Ansturm erzeugt eine steile Steigung von StO2, d.h. eine Reoxygenierung (ReO2). Die hyperämische Reaktion, die einen Anstieg über den ursprünglichen Ausgangswert hinaus mit einer langsamen Erholung zurück zum Ausgangswert darstellt, schätzt die reaktive Hyperämie. Die Kombination von NIRS mit einem VOT hat aufgrund seiner Benutzerfreundlichkeit und seines Potenzials zur Vorhersage unerwünschter Ergebnisse und sogar der Mortalität bei kritischen Erkrankungen wie Sepsis zunehmend an Interesse in der Intensivmedizin gewonnen 35,36,37.
Während der COVID-19-Pandemie haben unsere Gruppen ein weltweites Konsortium initiiert und kürzlich die sogenannte HEMOCOVID-19-Studie abgeschlossen, die einen Zusammenhang zwischen peripheren mikrozirkulatorischen Veränderungen und dem Schweregrad des akuten Atemnotsyndroms bei COVID-19-Patienten zeigt6. Dies wurde auch durch andere Werke gestützt 7,38. Alle diese Studien wurden mit den oben genannten CW-NIRS-Systemen durchgeführt und litten daher unter deren Mängeln. Darüber hinaus war die Durchführung der VOT in verschiedenen Studien nicht standardisiert und wird von verschiedenen Parametern wie Okklusionsdauer, Tourniquetdruck und operatorbasierten Variationen beeinflusst 29,39,40. Eine Literaturrecherche zeigt deutlich, dass es wichtig ist, den Blutfluss zu messen, standardisierte Protokolle zu haben und über ein robustes NIRS-System zu verfügen, damit VOT und NIRS in den Kliniken an Bedeutung gewinnenkönnen 11. Daher haben wir vorgeschlagen, dass durch die Verwendung einer fortschrittlicheren Form von NIRS (TRS), die Messung des Blutflusses und die Standardisierung der Manschettenkontrolle während der VOT eine bessere Unterscheidung zwischen pathologischen und gesunden Zuständen erreicht werden könnte. Zu diesem Zweck haben wir dieses hybride diffuse optische Gerät entwickelt, das mehrere Module integriert, darunter zwei diffuse optische Nahinfrarotmodule von TRS und DCS, Pulsoximetrie und ein automatisiertes Tourniquet. Das Pulsoximetrie-Modul liefert die Herzfrequenz (HF), den Perfusionsindex und den Prozentsatz der arteriellen Sauerstoffsättigung (SpO2). Im Gerät wird ein schnelles Tourniquet verwendet, das für die Durchführung von VOT entscheidend ist. Das Gerät wird mit einer optionalen Zubehörbox geliefert, die es uns ermöglicht, während des Einsatzes zusätzliche Informationen für eine erweiterte und kontinuierliche Qualitätskontrolle zu erhalten, wie z. B. die routinemäßige und praktische Messung der Instrumentenantwortfunktion (IRF) für TRS und die Messung an einem gewebeähnlichen Phantom zur Bewertung der Längsstabilität. Das Gerät wird in Abbildung 1 auf der Intensivstation eingesetzt.
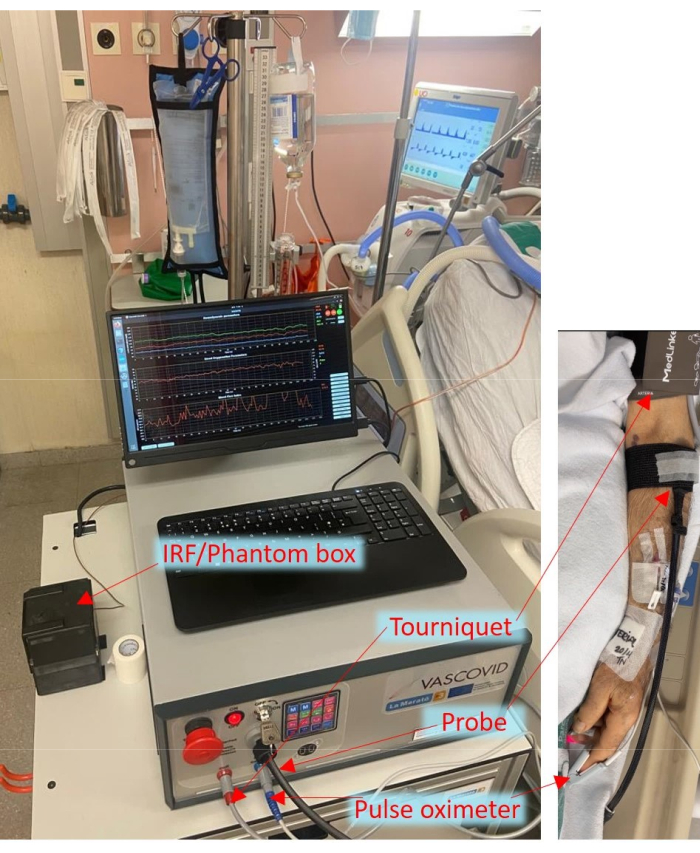
Abbildung 1: Anordnung des tragbaren Geräts am Krankenbett auf der Intensivstation mit den Sonden und der Manschette, die am Patienten befestigt sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die multimodale intelligente Sonde enthält Lichtwellenleiter für Quelle und Detektor für TRS und DCS mit optischen Filtern im Inneren des Geräts, die Interferenzen zwischen DCS und TRS verhindern. Der in diesem System verwendete Quellen-Detektor-Abstand beträgt 25 mm. Darüber hinaus verfügt die Sonde über einen kapazitiven Berührungssensor, der eine wertvolle Sicherheitsfunktion zur Vermeidung von Lasergefahren gemäß der Lasersicherheitsnorm (IEC 60601-2-22:2019)41 bietet. Das Lasersicherheitssystem im Gerät stellt sicher, dass die Laseremission nur dann erfolgt, wenn die Sonde mit dem Gewebe in Kontakt kommt. Wenn eine Ablösung der Sonde festgestellt wird, werden die Laser sofort abgeschaltet, um die Sicherheit von Patienten und Bedienern zu gewährleisten. Darüber hinaus ist die Sonde mit einem Beschleunigungsmesser, einem Lastsensor und einem Lichtsensor für zusätzliche Funktionen und Datenerfassungszwecke integriert.
Dieser Artikel beschreibt das automatisierte Protokoll, bei dem wir den Brachioradialis-Muskel gleichzeitig mit einer VOT mit dem entwickelten Gerät untersuchen. Die Zeitachse des Protokolls ist in Abbildung 2 dargestellt. Das Protokoll ist vollständig automatisiert und es sind während der gesamten Ausführung keine Bedienereingriffe erforderlich. Durch die Nutzung der Fähigkeiten dieses neuartigen Geräts wollen wir wertvolle Erkenntnisse gewinnen, die es den Ärzten ermöglichen, die Physiopathologie des peripheren Sauerstoffverbrauchs besser zu verstehen und auch das Verhältnis von Sauerstoffverbrauch und -abgabe zu beurteilen, um die Patientenversorgung umfassend und effizient zu verbessern.
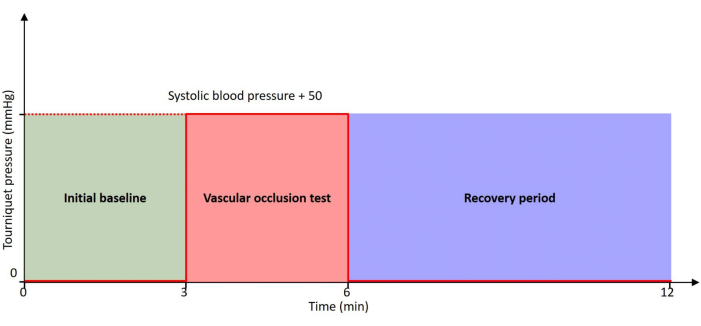
Abbildung 2: Zeitleiste des Protokolls. Der Patient ruht während der gesamten Zeitachse mit einem Druck von 0 mmHg zu Beginn und in der Erholungsphase. Die VOT wird mit einem Tourniquet durchgeführt, das auf einen Druck von 50 mmHg über dem systolischen Blutdruck des Patienten aufgeblasen wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Protokoll
Die Studie wurde von der lokalen Ethikkommission des Parc Tauli Hospital Universitari genehmigt. Die informierte und unterschriebene Zustimmung wurde von den Patienten oder ihren nächsten Angehörigen eingeholt. Absolute Kontraindikationen für die Aufnahme in das Protokoll waren: klinischer Verdacht oder echographische Bestätigung einer Venenthrombose im untersuchten Arm, andere vaskuläre oder traumatische Verletzungen im untersuchten Arm, Hautintegritätsverlust oder Läsionen, die die Sondenplatzierung behindern könnten.
1. Geräte-Selbsttest
- Schalten Sie das Gerät ein. Das Gerät startet mit einer eigens entwickelten Software.
- Drehen Sie den Sicherheitsschlüssel in die Position ON , legen Sie die Sonde vollständig in die IRF-Box (Instrument Response Function) und drücken Sie die Reset-Taste an der Sonde, wenn sie leuchtet.
- Drücken Sie die OK-Taste im Popup-Dialogfeld und warten Sie, bis das Gerät bereit ist.
Anmerkungen: Das Gerät führt Selbsttests durch, um ein stabiles Arbeiten zu gewährleisten. Der Benutzer wird durch eine Popup-Meldung benachrichtigt, wenn das Gerät bereit ist.
2. Optionale IRF- und Phantommessung
- Drücken Sie OK , wenn das Gerät bereit ist.
- Drücken Sie Ja , wenn Sie aufgefordert werden, einen IRF zu messen. Das Gerät passt die Laserintensität automatisch an, um die gewünschte Zählrate von 1 Million zu erreichen.
- Drücken Sie die Stop-Taste, wenn eine stabile Zählrate und DTOF beobachtet werden. Diese IRF wird sowohl in Dateien gespeichert als auch in die Software geladen, um für Echtzeitberechnungen verwendet zu werden.
- Führen Sie die Sonde richtig in das Phantomfeld ein, so dass die Anzeige für die angebrachte Sonde leuchtet.
- Drücken Sie die Phantom-Taste , um das Phantomprotokoll zu starten.
HINWEIS: Der Qualitätskontrolltest überprüft, ob eine ausreichende Anzahl von Photonen von den DCS- und TRS-Detektoren empfangen wird, und prüft auch, ob die Dunkelzählungen innerhalb der gewünschten Grenzen liegen. - Setzen Sie die Aufzeichnung nach der Qualitätskontrolle mindestens 30 s fort, um eine ausreichende Datenmenge für die weitere Offline-Analyse zu speichern.
3. Vorbereitung der Messung am Krankenbett
- Befestigen Sie das Tourniquet am Oberarm oberhalb des Ellenbogens wie bei einer Blutdruckmessung. Wickeln Sie die Manschette nicht locker oder sehr fest um den Arm.
HINWEIS: Das lose Anbringen des Tourniquets erfordert mehr Luft, um den gewünschten Druck zu erreichen. Langsames Aufblasen ermöglicht es dem Körper, seine Physiologie neu anzupassen. - Befestigen Sie das Pulsoximeter am Zeigefinger desselben Arms. Wenn es nicht möglich ist, ihn am Zeigefinger zu befestigen, befestigen Sie ihn an einem anderen Finger.
- Lokalisieren Sie den zu untersuchenden Brachioradialis-Muskel, der sich im seitlichen Unterarm direkt unter dem Ellbogen befindet. Bitten Sie den Patienten, eine Faust zu öffnen und zu schließen, um den Muskel zu spüren, indem Sie die Finger auf den Unterarm legen. Bei sedierten Patienten oder wenn sie sich nicht bewegen können, zeichnen Sie den Muskel nach, indem Sie den Arm mit einer Hand leicht drehen. Fühle den Muskel zwischen Daumen und Fingern der anderen Hand.
- Messen Sie den Armumfang um den lokalisierten Muskel mit einem weichen Maßband, wie in Abbildung 3 gezeigt.
- Messen Sie die ungefähre Fettgewebedicke auf der Oberseite des Muskels mit einem digitalen Körperfettmessschieber, wie in Abbildung 4 gezeigt.
- Befestigen Sie den Sondenkopf am Muskel, wobei die optischen Fasern und Kabel zur Hand führen, wie in Abbildung 5 gezeigt.
Anmerkungen: Befestigen Sie die Sonde nicht fest; Es kann die Gewebephysiologie beeinflussen. Stellen Sie sicher, dass die Fasern keine beweglichen Objekte berühren, da dies zu Artefakten in den Daten führen kann. - Decken Sie die Sonde mit einem schwarzen Tuch ab, um das externe Licht zu blockieren.
HINWEIS: Wenn der Patient wach ist, informieren Sie ihn, dass die VOT ein Kribbeln verursachen kann und er den Arm nicht bewegen sollte.
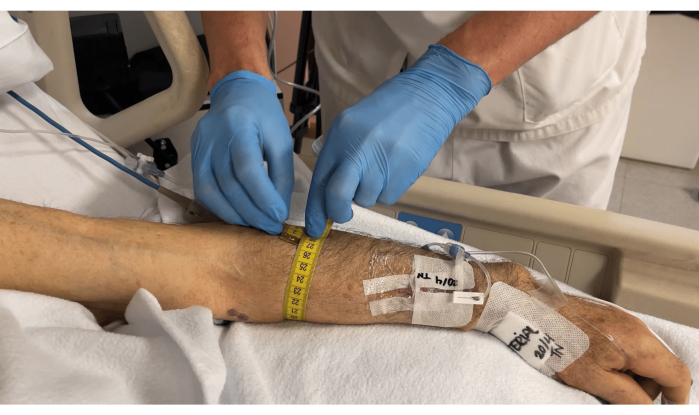
Abbildung 3: Messung des Armumfangs um den Musculus brachioradialis. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
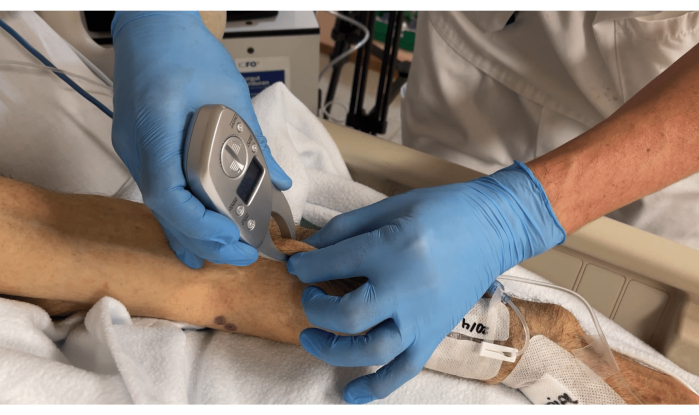
Abbildung 4: Messung der Fettgewebsdicke auf dem Muskel mit einem Körperfettmessschieber. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
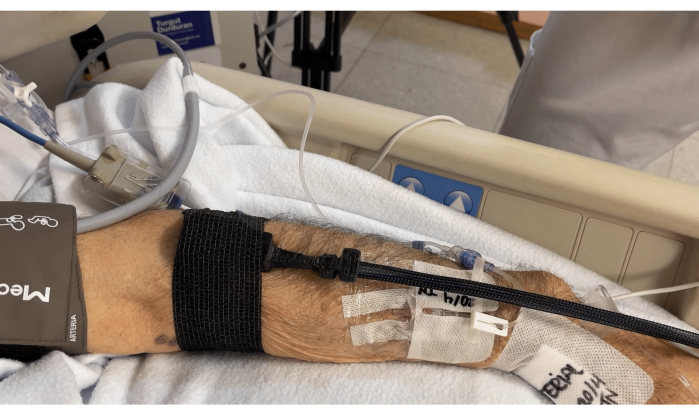
Abbildung 5: Sonde, die mit Fasern und Kabeln zur Hand am Muskel befestigt ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Datenerfassung
- Stellen Sie sicher, dass die an der Sonde angebrachte LED-Anzeige auf der Vorderseite des Geräts leuchtet und das Touch-Symbol in der Software grün leuchtet, um anzuzeigen, dass die Sonde angeschlossen ist.
- Drücken Sie die zeitgesteuerte Protokolltaste. Stellen Sie sicher, dass ein neues Dialogfeld geöffnet wird, wie in Abbildung 6 dargestellt. Geben Sie die Probanden-ID, die Bediener-ID und den Zieldruck von 50 mmHg über dem systolischen Blutdruck ein.
- Drücken Sie OK , um das automatisierte Protokoll zu starten. Echtzeitdaten werden in den Diagrammen angezeigt. Das Protokoll beginnt mit einer Qualitätskontrolle, die die Laserleistung automatisch anpasst und die Photonenzahl und die Interferenz zwischen den Modalitäten überprüft. Die Qualitätsprüfung ist innerhalb von 2 Minuten abgeschlossen. Beachten Sie die kreisförmigen Symbole mit der Bezeichnung TRS und DCS, die am Ende der Datenqualitätsprüfung grün werden müssen.
HINWEIS: Die grünen Symbole zeigen an, dass die Photonenzählrate innerhalb des gewünschten Bereichs liegt, kein externes Licht in die Sonde eindringt und es kein Übersprechen zwischen den Modalitäten gibt. Somit kann die Messung fortgesetzt werden. Die Diagramme werden am Ende der Qualitätsphase zurückgesetzt und Signale, die Patientendaten darstellen, werden in Echtzeit dargestellt. - Fahren Sie mit Schritt 2.6 fort, wenn die TRS- und DCS-Symbole nicht grün werden und am Ende der Qualitätsprüfung rot bleiben. Drücken Sie die Stopp-Taste, um das Protokoll abzubrechen, wenn der Patient instabil ist oder zu irgendeinem Zeitpunkt während des Protokolls einen plötzlichen klinischen Eingriff erfordert.
- Drücken Sie die Schaltfläche Verlängern , um die Dauer vor der Okklusion um 30 s zu verlängern, wenn der Patient den Arm bewegt und keine stabilen Ausgangssignale hat.
HINWEIS: Der Bediener kann die Extend-Taste so oft und in jeder Phase wie nötig drücken. Jeder Tastendruck fügt 30 s hinzu. - Stellen Sie sicher, dass sich das Tourniquet automatisch auf den gewünschten Druck aufbläst, um die VOT zu starten. Drücken Sie die Tasten + oder - , um den gewünschten Okklusionsdruck in Schritten von 5 mmHg zu erhöhen oder zu verringern, wenn sich der Blutdruck des Patienten nach Beginn des Protokolls ändert. Start und Stopp des VOT werden automatisch mit gelben vertikalen Linien markiert.
HINWEIS: Die Software ist so eingestellt, dass sie kontinuierlich Daten erfasst und nach 3 Minuten Ausgangswert automatisch 3 Minuten VOT durchführt. Das vordefinierte Standardprotokoll dauert nach Abschluss der VOT weitere sechs Minuten, um die Genesung zu bewerten, nachdem die hyperämische Reaktion des Patienten vorbei ist und ein stabiler Zustand erreicht ist. - Drücken Sie OK , wenn der Bediener nach Abschluss des Protokolls durch eine Popup-Benachrichtigung benachrichtigt wird, die den erfolgreichen Abschluss des Protokolls markiert.
- Entfernen Sie die Sonden und die Manschette vom Patienten und reinigen Sie sie mit einem Alkoholtupfer oder einem gleichwertigen Gerät.
- Notieren Sie die klinischen und demografischen Informationen (gemäß den vordefinierten Studienprotokollen) zusammen mit dem Armumfang an der Sondenstelle und der Dicke des darüber liegenden Fettgewebes manuell im Patientendatenformular.
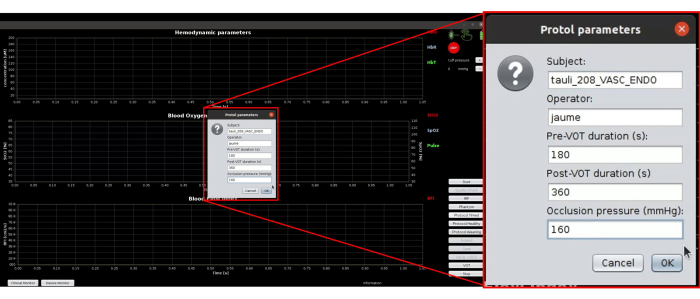
Abbildung 6: Screenshot der Protokollparameter, die für die automatische Ausführung des gesamten Protokolls verwendet werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Datenanalyse
- Verwenden Sie ein Skript/Programm, das in Ihrer bevorzugten Sprache (z. B. Python oder MATLAB) geschrieben ist, um aufgezeichnete Binärdaten zu öffnen und zu visualisieren.
- Berechnen Sie den Sauerstoffverbrauchsindex, der den Gewebestoffwechsel darstellt und wie folgt definiert ist:

wobei Hb der Hämatokrit ist, der aus klinischen Diagrammen des Patienten im Patientendatenformular aufgezeichnet wird. - Berechnen Sie die Rate von DeO2 (Steigung von StO2 vom Beginn der VOT bis 1 min), die Amplitude von DeO2 (Ausgangswert StO2 - minimales StO2), die Rate von ReO2 (Steigung von StO2 vom Abschluss der VOT bis zum Erreichen des Spitzenwerts), die Amplitude des hyperämischen Peaks von StO2 und BFI (Spitzenwerte) und die Fläche unter der Kurve (AUC) der reaktiven Reaktion nach VOT sowohl für StO2 als auch für BFI.
HINWEIS: Die Berechnung der Echtzeit-Absolutwerte von HbO, HbR, HbT und StO2 erfolgt durch einen Anpassungsalgorithmus unter Verwendung der Verteilung der Flugzeitkurven (DTOF) von TRS beider Wellenlängen. Die theoretischen Details finden sich in Torricelli et al. und Contini et al.18,21. Die Berechnung des BFI in Echtzeit erfolgt durch den Anpassungsalgorithmus unter Verwendung der Autokorrelationskurven von DCS. Die theoretischen Details finden sich in Durduran und Yodh16.
Ergebnisse
In den laufenden klinischen Studien wurde das Gerät über 300 Stunden lang von mehreren geschulten Anwendern eingesetzt, um Messungen an Intensivpatienten und gesunden Kontrollpersonen durchzuführen, klinisch relevante Ergebnisse abzuleiten und die In-vivo-Leistung des Systems in einer realen Umgebung zu charakterisieren. Hier zeigen wir einige beispielhafte Zeitspuren der Daten eines einzelnen Subjekts, die für den Benutzer sichtbar sind. Die vorläufigen Ergebnisse des Protokolls werden in Echtzeit gemessen und angezeigt, wie z. B. HbO, HbR, HbT, StO2, SpO2 und BFI. Verschiedene abgeleitete Parameter, wie MRO2, DeO2,ReO 2 und AUC, werden beschrieben.
Abbildung 7 zeigt den Gerätemonitor während Schritt 3.3, der die Datenqualität zeigt, bei der Laserleistungen angepasst, Photonenzahlen und Übersprechen zwischen Modalitäten automatisch getestet werden. Der Gerätemonitor zeigt zwei Intensitätsautokorrelationskurven (g2) an, da das Gerät über zwei DCS-Detektorfasern verfügt, die mit Einzelphotonenzählmodulen gekoppelt sind, und den DTOF für beide Wellenlängen des TRS-Geräts. Die Wellenlänge des für DCS verwendeten Lasers beträgt 785 nm, während das OEM-TRS-Modul Laser mit 685 nm und 830 nm leuchtet. Die Autokorrelationskurven im oberen Diagramm scheinen bei geringeren Verzögerungszeiten verrauscht zu sein. Dies kann in diesem speziellen Beispiel teilweise auf die geringe Lichtintensität zurückzuführen sein. Erhöhte Lichtintensität und unabhängige/parallele Detektionsfasern wurden empfohlen, um das Signal-Rausch-Verhältnis für DCS 42,43 zu erhöhen. Daher sind durchschnittlich zwei DCS-Kanäle geplant, um den Effekt des Rauschens zu reduzieren und anschließend einen besseren BFI zu berechnen.
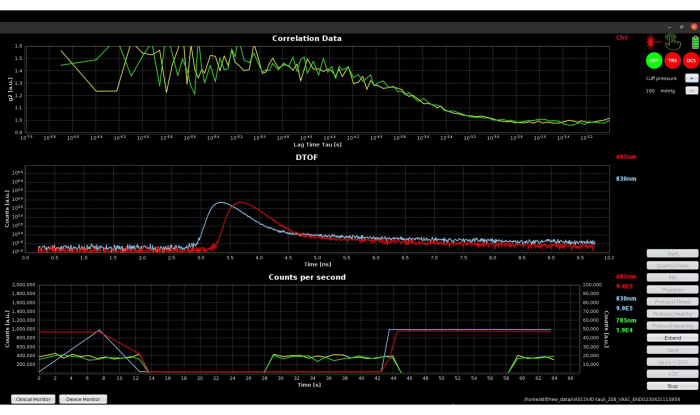
Abbildung 7: Screenshot des Geräteüberwachungsmodus der Software während der Datenqualitätsprüfungsphase. Das obere Diagramm zeigt die Autokorrelationskurven von zwei DCS-Kanälen. Das mittlere Diagramm zeigt den DTOF für TRS-Wellenlängen. Das untere Diagramm zeigt die Photonenzahlen für DCS und TRS. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die anfängliche Baseline-Periode mit klinischem Monitor, dargestellt in Abbildung 8, weist grüne Symbole für DCS und TRS auf, die den Erfolg der Qualitätstests anzeigen. Die angezeigten Signale sehen sehr stabil aus, und daher war die in Schritt 3.5 beschriebene Extend-Funktion in diesem Fall nicht erforderlich. Wenn die anfängliche Baseline wie in Abbildung 9 dargestellt angezeigt wird, muss die Funktion "Erweitern" verwendet werden. Diese Funktion erweitert die Basislinienerfassung, um 3 Minuten stabile Daten zu erhalten, die zur Berechnung der genauen Basiswerte für alle Parameter verwendet werden können.
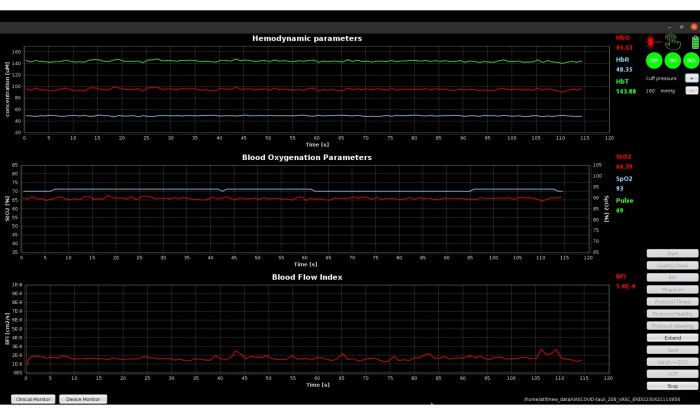
Abbildung 8: Screenshot des klinischen Monitormodus der Software während der anfänglichen Baseline-Phase mit stabilen Baseline-Signalen. Das obere Diagramm zeigt den absoluten Wert der hämodynamischen Parameter, die mit TRS gemessen wurden, das mittlere Diagramm zeigt die Sauerstoffsättigungssignale und den Pulswert, die mit TRS und Pulsoximeter gemessen wurden, und das untere Diagramm zeigt den mit DCS gemessenen BFI. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
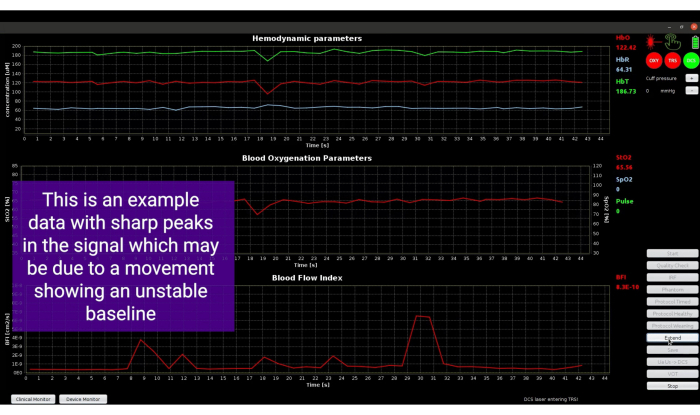
Abbildung 9: Screenshot zeigt Spitzen in den Signalen aufgrund der Bewegung der Sonde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Der Anfang und das Ende des Verschlussteils der Manschette sind mit gelben vertikalen Linien markiert, wie in Abbildung 10 dargestellt. Die Pulsform und dieSpO2-Werte haben in dieser Phase keine klinische/physiologische Bedeutung, da der Finger desselben Arms, der verschlossen wird, für die Pulsoximetrie verwendet wird. Dies wird durch das rote OXY-Symbol angezeigt, das unzuverlässige Daten des Pulsoximeters ausdrückt. Um diese Situation zu umgehen, könnten wir das Pulsoximeter an der nicht betroffenen Hand des Patienten anbringen, die nicht dem Tourniquet ausgesetzt ist und ungehindert bleibt. Wir möchten jedoch den Perfusionsindex des sondierten Arms mit dem Pulsoximeter für die anfängliche Baseline- und die letzte Erholungsphase erhalten, um die Auswirkungen von VOT zu analysieren. Daher haben wir uns dafür entschieden, das Pulsoximeter am selben Arm wie das Tourniquet zu verwenden.
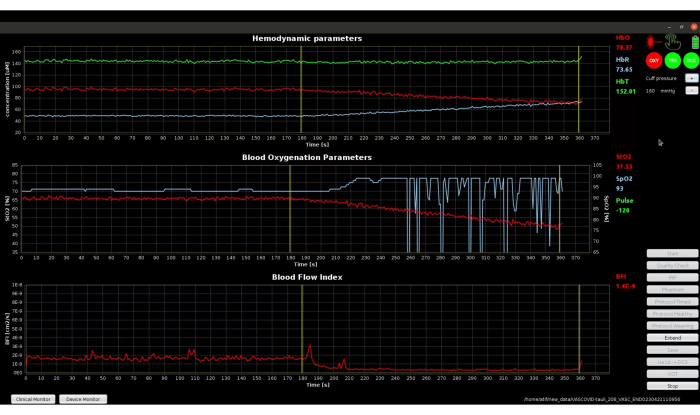
Abbildung 10: Software-Screenshot mit gelben vertikalen Linien, die den Start- und Endzeitpunkt von VOT markieren. Die SpO2 - und Pulswerte sind unbedeutend, da der Blutfluss eingeschränkt ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Abbildung 11 zeigt die vollständige Protokollzeitleiste wie in Schritt 3.6 angegeben, einschließlich der letzten Erholungsphase, die das hyperämische Ansprechen und die Rückkehr der klinischen Parameter zu den Ausgangswerten veranschaulicht. Die obere Grafik von Abbildung 11 zeigt die absoluten hämodynamischen Parameter. Der Beginn der VOT markiert einen rückläufigen Trend bei HbO und einen steigenden Trend bei HbR, da sowohl der Zu- als auch der Abfluss von Blut durch den Manschettenverschluss blockiert werden. Der Trend kehrt sich zum Zeitpunkt des Abschlusses der VOT um, geht über die ursprünglichen Ausgangswerte hinaus und kehrt in der Erholungsphase zu den Ausgangswerten zurück. Die mittlere und untere Grafik zeigen, dass das BFI-Signal etwas verrauschter ist als StO2. Dies ist naturgemäß auf die Tatsache zurückzuführen, dass das DCS tendenziell ein höheres Kontrast-Rausch-Verhältnis aufweist, was aus der großen hyperämischen Reaktion in BFI42,44 hervorgeht. Unter Verwendung des reichhaltigen Datensatzes dieses neuartigen Geräts wurden die Oszillationen in BFI als potenzielle Biomarker zur Diagnose septischer Patienten verwendet45.
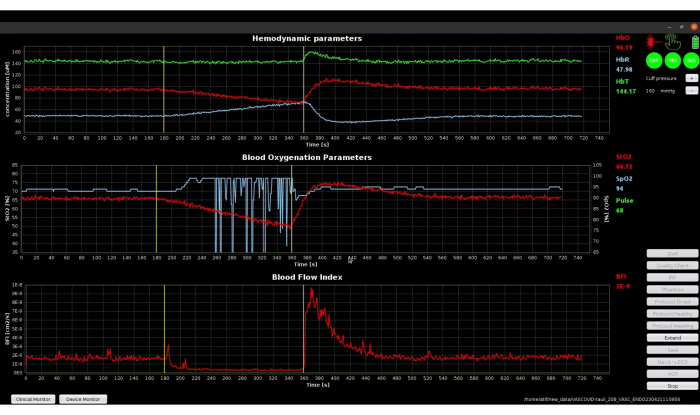
Abbildung 11: Screenshot des klinischen Monitors, der die Signale während der gesamten Protokollzeitleiste zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Mit diesem Protokoll kann der vom Muskel verbrauchte Sauerstoff während der VOT isoliert überwacht werden. Die Steigung von DeO2 während der ischämischen Herausforderung zeigt an, wie das Gewebe Sauerstoff verbraucht. Die frühe Abnahme vonStO 2 während der VOT spiegelt die Sauerstoffverbrauchsrate für das Gewebe wider. Der hyperämische Peak und die anschließenden Abklingtrends in StO2 und BFI stehen in direktem Zusammenhang mit hyperämischer und mikrovaskulärer Reaktivität. Abgesehen von diesen offensichtlichen Ergebnissen können wir mehrere potenzielle Biomarker verwenden, um eine bestimmte Gruppe von Intensivpatienten zu klassifizieren. Die vorhandenen Biomarker sind die Desoxygenierungsrate, der Mindestwert von StO2 während der VOT, die Reoxygenierungsrate, der hyperämische Spitzenwert und die Fläche unter der Kurve von StO2 und BFI. Diese Biomarker können verwendet werden, um Patientenpopulationen und die Schwere ihrer Krankheiten zu identifizieren. Die Ergebnisse eines Beispieldatensatzes eines Patienten sind in Abbildung 12 dargestellt. Der Begriff "DATA QC" bezeichnet die anfängliche Qualitätsprüfung, die sich nicht auf Patientendaten bezieht. Daher wird es in der Darstellung nicht angezeigt. Die Durchschnittswerte von StO2, BFI und MRO2 für den Basiszeitraum werden zum Vergleich mit den Phasen der VOT und der Erholung nach der VOT berechnet. Die während dieses Protokolls erzielten Ergebnisse können sich von den Daten aus diesem Beispiel unterscheiden. Die Basiswerte aller Parameter können höher oder niedriger sein, und die Rate von DeO2 kann schneller oder langsamer sein. Die hyperämische Reaktion kann eine höhere oder niedrigere Rate vonReO 2 und Spitzenwerten aufweisen, oder es kann ein Fehlen von Spitzenwerten geben. Die Erholungsphase kann eine schnellere oder langsamere Normalisierung der Werte zeigen. Diese Variationen sind repräsentativ für den Zustand des Patienten, der an einer bestimmten oder einer Reihe von Krankheiten leidet.
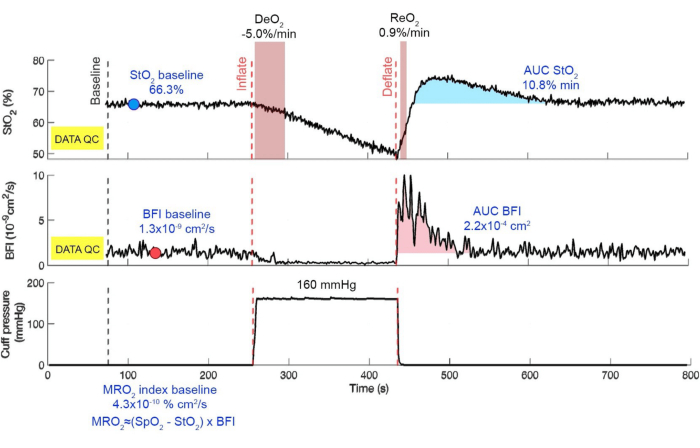
Abbildung 12: Zusammenfassung der offline kompilierten Ergebnisse. Die schwarze gestrichelte Linie markiert den Beginn von drei Minuten des Basiszeitraums, während die rote gestrichelte Linie die Aufblas- und Entleerungsereignisse markiert. Die obere Grafik zeigt das StO2-Signal mit markierten Bereichen zur Berechnung vonDeO 2 und ReO2. Das mittlere Diagramm zeigt den BFI, während das untere Diagramm den Tourniquetdruck zeigt. Die Ausgangswerte und die AUC sind in ihren jeweiligen Phasen blau dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Wir haben ein vollautomatisches, robustes, nicht-invasives Gerät zur kontinuierlichen Messung und Überwachung der Skelettmuskulatur unter Verwendung einer diffusen Hybridoptik zur Bewertung der mikrovaskulären Sauerstoffversorgung, der Blutperfusion und der reaktiven Hyperämie demonstriert. Mit diesem Protokoll mit dem VASCOVID-Gerät können wir gleichzeitig die absoluten hämodynamischen Parameter von HbO, HbR und HbT messen. Sauerstoffsättigung von StO2 und SpO2; DeO 2 und ReO2; und BFI. Die angezeigten Echtzeit-StO2 und BFI werden aus den Rohdaten der vorherigen Sekunde von den TRS- bzw. DCS-Modulen gewonnen. Das Anpassungsverfahren ist nicht zeitaufwändig, da moderne Prozessoren Standardmodelle eines halbunendlichen, homogenen Mediums verwenden. Die erfassten Parameter zeichnen nicht das vollständige Bild der Endothelfunktion. Die gemessene reaktive Hyperämie hat jedoch bei mehreren akuten Erkrankungen, bei denen die endotheliale Beeinträchtigung eine wichtige Rolle spielt, wie z. B. septischer Schock oder COVID-19, einen prognostischen Wert gezeigt. 6,28 Das Protokoll enthält auch eine automatisierte Qualitätsprüfung, die die Geräteparameter aufzeichnet, die für ein Forschungsprotokoll nützlich sind, falls später eine unerklärliche Anomalie in den Daten eines Patienten entdeckt wird.
Die Quantifizierung der überlagernden Fettschicht und des Armumfangs ist bei der Messung des Brachioradialis-Muskels in diesem Protokoll wichtig, da die Photonen bei der Injektion und beim Nachweis hauptsächlich durch das überlagernde Gewebe hindurchgehen. In der diffusen Optik ist bekannt, dass es einen damit verbundenen partiellen Volumeneffekt gibt. Daher sollten die oberflächlichen Informationen aufgezeichnet und bei der Analyse der Daten verwendet werden, um die Auswirkungen von Variationen im Fettgewebe zu berücksichtigen 46,47. Dies wird in diesen Patientenpopulationen von Interesse noch verstärkt, da es bei Patienten auf der Intensivstation üblich ist, Ödeme zu entwickeln, bei denen die Gliedmaßen geschwollen sind, da Wasser aufgrund von Immobilisierung und anderen Gründen eingeschlossen wird48. Bei solchen Patienten kann die Variation des Umfangs während des Aufenthalts auf der Intensivstation Aufschluss über die Schwere des Ödems geben. Der Weg der Lichtquelle zu den Detektoren muss durch alle oberflächlichen Schichten verlaufen.
Die Manschette sollte bequem um den Arm gewickelt sein, um eine enge Passform zu gewährleisten. Es ist jedoch wichtig, übermäßige Enge zu vermeiden, die allein durch das Umwickeln der Manschette49 einen übermäßigen Druck auf den Arm ausüben könnte. Ziel ist es, eine sichere und bequeme Passform zu erreichen, ohne unnötige Kompression zu verursachen, die die hämodynamischen Ausgangsparameter verändern kann. Wenn der Arm komprimiert wird, wird die Datenqualität für das gesamte Protokoll beeinträchtigt und der ausgeübte Druck wird effektiv zum Zieldruck von VOT addiert. Wenn die Manschette locker um den Arm gewickelt ist, wird mehr Luft benötigt, um den Zieldruck zu erreichen, und somit wird mehr Zeit benötigt. Dies kann dem Gewebe Zeit geben, die Physiologie anzupassen, da die Sauerstoffzufuhr langsam reduziert wird, was vermieden werden sollte50.
Es ist wichtig, die intelligente Sonde so zu befestigen, dass der richtige Kontakt aufrechterhalten wird, ohne übermäßigen Druck auf das Gewebe auszuüben. Dies ermöglicht zuverlässige Messungen und vermeidet gleichzeitig das Risiko einer lokalen Ischämie. Eine lokale Ischämie tritt auf, wenn der Blutfluss in den Bereich eingeschränkt ist, was zu einer Beeinträchtigung der Durchblutung führt und möglicherweise die Messungen beeinträchtigt51.
Der kapazitive Berührungssensor an der Sonde wird vom Lasersicherheitssystem verwendet, um sicherzustellen, dass der Laser nur leuchtet, wenn die Sonde am Gewebe befestigt ist. Wenn der Patient eine hohe Haardichte am Arm hat, kann die Empfindlichkeit des Berührungssensors beeinträchtigt werden. Das Anbringen eines dünnen transparenten Doppelbandes auf der Sensorseite der Sonde kann das Problem des Berührungssensors effektiv entschärfen. Wenn die Sonde zusammen mit diesem Band am haarigen Arm befestigt ist, liefert sie ein zuverlässiges und stabiles Berührungssignal. Vordefinierte Schnitte dieses Bandes sind für die intelligente Sonde mit Trennung zwischen Lichtquellen und Detektoren verfügbar. Die Trennung ist unerlässlich, um die Bildung eines direkten Lichtkanals zwischen Quelle und Detektorfenster zu verhindern, der die Qualität der Messungen beeinträchtigen kann. Die Verwendung von transparentem Doppelband dient als praktische Lösung, um die Zuverlässigkeit der Berührungserkennung unter diesen Umständen zu erhöhen. Wenn die Berührungserkennung während des Protokolls verloren geht, werden die Laser ausgeschaltet und die Messung geht verloren. Die Sonde verfügt auch über einen Lastsensor, der in Zukunft als Backup-Sicherheitsmaßnahme eingesetzt werden könnte.
Wenn der Patient seinen Arm bewegt oder ein kleiner klinischer Eingriff die Stabilität der erfassten Signale während der Baseline-Phase stört, was zu starken Spitzen führt, ist es ratsam, die Extend-Funktion zu verwenden. Diese Funktion ermöglicht die Erfassung einer stabilen Basislinie für drei Minuten und gewährleistet eine konsistente und zuverlässige Signalmessung.
Es ist wichtig zu bedenken, dass sich der Blutdruck des Patienten nach Beginn des Protokolls erheblich ändern kann, was sich auf die Fähigkeit auswirken kann, den Zieldruck von 50 mmHg zu erreichen, der höher ist als der systolische Blutdruck für die VOT. Diese Blutdruckschwankungen können durch verschiedene Faktoren beeinflusst werden, wie z. B. die physiologische Reaktion des Patienten, die Wirkung von Medikamenten oder andere klinische Zustände52. Daher sollte der Zieldruck bei Bedarf durch Drücken der Tasten "+" oder "-" angepasst werden, um eine konsistente Verabreichung des VOT zu gewährleisten.
Die typische Ausführung von VOT hat Einschränkungen aufgrund der Variabilität des Operators, die in diesem Protokoll durch eine automatische VOT berücksichtigt wird. Wir verwenden die Strategie, um den Okklusionsdruck von 50 mmHg über dem systolischen Blutdruck einzustellen. Diese Methode stoppt den Blutfluss und wurde in früheren Studien zur Durchführung der VOT53,54 berichtet. Der individualisierte Zieldruck für VOT in diesem Protokoll hilft bei der Vermeidung von Vasokonstriktionen, die auftreten können, indem ein allgemeiner Zieldruck für VOT festgelegt wird. Schmerzen, die durch einen unnötig hohen Druck verursacht werden, können die Messung beeinflussen und eine Vasokonstriktion verursachen, z. B. bei einem Patienten mit einem systolischen Druck von 120 mmHg und einem Zieldruck von 200 mmHg oder 250 mmHg29. Wir stellen fest, dass Patienten, die auf Intensivstationen aufgenommen werden, einem erhöhten Thromboserisiko ausgesetzt sind, hauptsächlich aufgrund von Faktoren wie längerer Immobilität und Sedierung55. Dies bedeutet, dass dieses Protokoll zur Vermeidung von Risiken nicht bei Patienten mit Thrombose oder Thrombophlebitis angewendet werden kann.
Die Anwendung dieses Protokolls kann auf der Intensivstation nützlich sein, wo eine beeinträchtigte reaktive Hyperämie ein häufiges Merkmal ist und zu mikrovaskulären Anomalien beitragen kann 3,56. Die in diesem Protokoll erfassten Parameter, ohne Bedienereingriffe während der Messung, wurden zuvor in der Literatur einzeln oder in einer kleinen Kombination für Sepsis, Krebs, Schlaganfall usw. verwendet, um pathologische Zustände zu unterscheiden 1,11,15,31. Daher glauben wir, dass die Kombination dieser relevanten Parameter für mehrere klinische Anwendungen von Vorteil ist. Die von diesem Protokoll aufgezeichneten Daten können helfen, geeignete therapeutische Strategien zur Verbesserung der Gefäßgesundheit auszuwählen57. Die wertvollen Erkenntnisse über die Sauerstoffversorgung des Gewebes und die Dynamik des Blutflusses während der Okklusion und Reperfusion ermöglichen es uns, die Angemessenheit der Blutversorgung lebenswichtiger Organe zu beurteilen. Es kann helfen, Gewebehypoxie zu erkennen und Interventionen zur Optimierung der Organperfusion zu leiten58. Durch die Verwendung von Echtzeitinformationen über mikrovaskuläre Sauerstoffversorgung und reaktive Hyperämie hilft es als zusätzliches Instrument bei der Steuerung des hämodynamischen Managements, der Flüssigkeitswiederbelebung und der Vasopressortherapie 59,60. Dadurch wird sichergestellt, dass die Eingriffe auf die individuellen Bedürfnisse des Patienten zugeschnitten sind und die Sauerstoffversorgung und Perfusion des Gewebes optimiertwerden 61,62. Darüber hinaus können bei mechanisch beatmeten Patienten evolutive Veränderungen der mikrovaskulären Sauerstoffversorgung und des Blutflusses innerhalb eines Spontanatmungsversuchs von größter Bedeutung sein, wenn es darum geht, die kardiovaskuläre Toleranz zu bewerten, um die erhöhte metabolische Belastung zu bewältigen, die sich aus der Arbeit des Atmens ohne Hilfe ergibt2. In diesem Zusammenhang ist eine tägliche kritische und herausfordernde Entscheidung für die Patienten auf der Intensivstation bei der mechanischen Beatmung der Entwöhnungsprozess, der endet, wenn der Patient als in der Lage angesehen wird, selbst zu atmen, und der Endotrachealtubus entfernt wird. Die longitudinale Anwendung dieses Protokolls kann verwendet werden, um die Wirksamkeit von Interventionen zu bewerten, das Fortschreiten der Krankheit zu verfolgen und Behandlungsstrategien zu leiten.
Offenlegungen
Die Rolle aller beteiligten Unternehmen und ihrer Mitarbeiter im Projekt wurde durch die Projektziele, Aufgaben und Arbeitspakete definiert und von der Europäischen Kommission überprüft. MB, ML, DC, Alberto Tosi und Alessandro Toricelli sind Mitbegründer von PIONIRS s.r.l., einem Spin-off-Unternehmen des Politecnico di Milano (Italien). ICFO ist an der Ausgründung HemoPhotonics s.l. beteiligt. Potenzielle finanzielle Interessenkonflikte und die Objektivität der Forschung wurden von der Abteilung Wissens- und Technologietransfer des ICFO überwacht. UMW ist der CEO, hält eine Kapitalbeteiligung an HemoPhotonics s.l. und ist zusammen mit SP ein Angestellter des Unternehmens.
Danksagungen
Diese Forschung wurde finanziert von der Fundació CELLEX Barcelona, der Fundació Mir-Puig, dem Ajuntament de Barcelona, der Agencia Estatal de Investigación (PHOTOMETABO, PID2019-106481RB-C31/10.13039/501100011033), dem "Severo Ochoa"-Programm für Exzellenzzentren für Forschung und Entwicklung (CEX2019-000910-S), der Generalitat de Catalunya (CERCA, AGAUR-2017-SGR-1380, RIS3CAT-001-P-001682 CECH), FEDER EC, Fundación Joan Ribas Araquistain, l'FCRI (Convocatòria Joan Oró 2023), der Europäischen Kommission Horizon 2020 (Finanzhilfen Nr. 101016087 (VASCOVID), 101017113(TinyBrains), 871124 (LASERLAB-EUROPE V), 101062306 (Marie Skłodowska-Curie)), die Fundació La Marató de TV3 (2017,2020) und die Sonderprogramme LUX4MED/MEDLUX.
Materialien
| Name | Company | Catalog Number | Comments |
| Alcohol swabs | No specific | N/A | For cleaning the probes and cuff after measurement |
| Black cloth | No specific | N/A | For blocking ambient light |
| Blood pressure monitor | OMRON | N/A | Hopital ICU equipment or off the shelf product |
| Body fat Calliper | Healifty | 3257040-6108-1618385551 | For measuring the fat layer |
| Examination gloves | No specific | N/A | To be used for interacting with patients |
| Kintex tape | No specific | N/A | For attaching the probe on arm |
| Koban wrap | No specific | N/A | For attaching the probe on arm |
| Measuring tape | YDM Industries | 25-SB-30-150V3-19-1 | For measuring the arm circumference |
| Scissors | No specific | N/A | for cutting tapes |
| VASCOVID precommercial prototype | VASCOVID consortium | N/A | Integrated at ICFO |
Referenzen
- Mesquida, J., Masip, J., Gili, G., Artigas, A., Baigorri, F. Thenar oxygen saturation measured by near infrared spectroscopy as a noninvasive predictor of low central venous oxygen saturation in septic patients. Intensive Care Medicine. 35, 1106-1109 (2009).
- Mesquida, J., et al. Thenar oxygen saturation (StO2) alterations during a spontaneous breathing trial predict extubation failure. Annals of Intensive Care. 10 (1), 1-7 (2020).
- Mikacenic, C., et al. Biomarkers of endothelial activation are associated with poor outcome in critical illness. PloS One. 10 (10), e0141251 (2015).
- Varga, Z., et al. Endothelial cell infection and endotheliitis in COVID-19. The Lancet. 395 (10234), 1417-1418 (2020).
- Castro, P., et al. Is the endothelium the missing link in the pathophysiology and treatment of COVID-19 complications. Cardiovascular Drugs and Therapy. 36 (3), 547-560 (2022).
- Mesquida, J., et al. Peripheral microcirculatory alterations are associated with the severity of acute respiratory distress syndrome in COVID-19 patients admitted to intermediate respiratory and intensive care units. Critical Care. 25, 1-10 (2021).
- Fernández, S., et al. Distinctive biomarker features in the endotheliopathy of COVID-19 and septic syndromes. Shock (Augusta, Ga). 57 (1), 95 (2022).
- Sakr, Y., Dubois, M. J., De Backer, D., Creteur, J., Vincent, J. L. Persistent microcirculatory alterations are associated with organ failure and death in patients with septic shock). Critical Care Medicine. 32 (9), 1825-1831 (2004).
- Trzeciak, S., et al. Early microcirculatory perfusion derangements in patients with severe sepsis and septic shock: relationship to hemodynamics, oxygen transport, and survival. Annals of Emergency Medicine. 49 (1), 88-98 (2007).
- Tachon, G., et al. Microcirculatory alterations in traumatic hemorrhagic shock. Critical Care Medicine. 42 (6), 1433-1441 (2014).
- Duranteau, J., et al. The future of intensive care: the study of the microcirculation will help to guide our therapies. Critical Care. 27 (1), 1-13 (2023).
- Mason McClatchey, P., et al. Impaired tissue oxygenation in metabolic syndrome requires increased microvascular perfusion heterogeneity. Journal of Cardiovascular Translational Research. 10 (1), 69-81 (2017).
- Gurley, K., Shang, Y., Yu, G. Noninvasive optical quantification of absolute blood flow, blood oxygenation, and oxygen consumption rate in exercising skeletal muscle. Journal of Biomedical Optics. 17 (7), 075010 (2012).
- Lin, P. Y., et al. Non-invasive optical measurement of cerebral metabolism and hemodynamics in infants. Journal of Visualized Experiments. (73), e4379 (2013).
- Cortese, L., et al. The LUCA device: a multi-modal platform combining diffuse optics and ultrasound imaging for thyroid cancer screening. Biomedical Optics Express. 6 (6), 3392-3409 (2021).
- Durduran, T., Yodh, A. G. Diffuse correlation spectroscopy for non-invasive, micro-vascular cerebral blood flow measurement. Neuroimage. 85, 51-63 (2014).
- Hong, K. S., Yaqub, M. A. Application of functional near-infrared spectroscopy in the healthcare industry: A review. Journal of Innovative Optical Health Sciences. 12 (06), 1930012 (2019).
- Torricelli, A., et al. Time domain functional NIRS imaging for human brain mapping. Neuroimage. 85, 28-50 (2014).
- Tremblay, J. C., King, T. J. Near-infrared spectroscopy: can it measure endothelial function. Experimental Physiology. 101 (11), 1443-1444 (2016).
- Cortese, L., et al. Performance assessment of a commercial continuous-wave near-infrared spectroscopy tissue oximeter for suitability for use in an international, multi-center clinical trial. Sensors. 21 (21), 6957 (2021).
- Contini, D., et al. Multi-channel time-resolved system for functional near infrared spectroscopy. Optics Express. 14 (12), 5418-5432 (2006).
- Lacerenza, M., et al. Wearable and wireless time-domain near-infrared spectroscopy system for brain and muscle hemodynamic monitoring. Biomedical Optics Express. 11 (10), 5934-5949 (2020).
- Lacerenza, M., et al. Performance and reproducibility assessment across multiple time-domain near-infrared spectroscopy device replicas. Design and Quality for Biomedical Technologies XV - SPIE. 11951, 43-48 (2022).
- Durduran, T., Choe, R., Baker, W. B., Yodh, A. G. Diffuse optics for tissue monitoring and tomography. Reports on Progress in Physics. 73 (7), 076701 (2010).
- Boas, D. A., Campbell, L. E., Yodh, A. G. Scattering and imaging with diffusing temporal field correlations. Physical Review Letters. 75 (9), 1855 (1995).
- Giovannella, M., et al. BabyLux device: a diffuse optical system integrating diffuse correlation spectroscopy and time-resolved near-infrared spectroscopy for the neuromonitoring of the premature newborn brain. Neurophotonics. 6 (2), 025007-025007 (2019).
- Amendola, C., et al. A compact multi-distance DCS and time domain NIRS hybrid system for hemodynamic and metabolic measurements. Sensors. 21 (3), 870 (2021).
- Mesquida, J., Gruartmoner, G., Espinal, C. Skeletal muscle oxygen saturation (StO2) measured by near-infrared spectroscopy in the critically ill patients. BioMed Research International. (2013), (2013).
- Gerovasili, V., Dimopoulos, S., Tzanis, G., Anastasiou-Nana, M., Nanas, S. Utilizing the vascular occlusion technique with NIRS technology. International Journal of Industrial Ergonomics. 40 (2), 218-222 (2010).
- Siafaka, A., et al. Acute effects of smoking on skeletal muscle microcirculation monitored by near-infrared spectroscopy. Chest. 131 (5), 1479-1485 (2007).
- Donati, A., et al. Near-infrared spectroscopy for assessing tissue oxygenation and microvascular reactivity in critically ill patients: a prospective observational study. Critical Care. 20, 1-10 (2016).
- Iannetta, D., et al. Reliability of microvascular responsiveness measures derived from near-infrared spectroscopy across a variety of ischemic periods in young and older individuals. Microvascular Research. 122, 117-124 (2019).
- Niezen, C. K., Massari, D., Vos, J. J., Scheeren, T. W. L. The use of a vascular occlusion test combined with near-infrared spectroscopy in perioperative care: a systematic review. Journal of Clinical Monitoring and Computing. 36 (4), 933-946 (2022).
- Donati, A., et al. Recombinant activated protein C treatment improves tissue perfusion and oxygenation in septic patients measured by near-infrared spectroscopy. Critical Care. 5 (5), 1-7 (2009).
- Neto, A. S., et al. Association between static and dynamic thenar near-infrared spectroscopy and mortality in patients with sepsis: a systematic review and meta-analysis. Journal of Trauma and Acute Care Surgery. 76 (1), 226-233 (2014).
- Shapiro, N. I., et al. The association of near-infrared spectroscopy-derived tissue oxygenation measurements with sepsis syndromes, organ dysfunction and mortality in emergency department patients with sepsis. Critical Care. 15 (5), 1-10 (2011).
- Orbegozo, D., et al. Peripheral muscle near-infrared spectroscopy variables are altered early in septic shock. Shock. 50 (1), 87-95 (2018).
- Lu, S., et al. Comparison of COVID-19 induced respiratory failure and typical ARDS: similarities and differences. Frontiers in Medicine. 9, 829771 (2022).
- Parežnik, R., Knezevic, R., Voga, G., Podbregar, M. Changes in muscle tissue oxygenation during stagnant ischemia in septic patients. Intensive Care Medicine. 32, 87-92 (2006).
- Nanas, S., et al. Inotropic agents improve the peripheral microcirculation of patients with end-stage chronic heart failure. Journal of Cardiac Failure. 14 (5), 400-406 (2008).
- International electrical equipment - IEC. Medical electrical equipment - Part 2-22: Particular requirements for basic safety and essential performance of surgical, cosmetic, therapeutic and diagnostic laser equipment. International electrical equipment - IEC. , (2019).
- Cortese, L., et al. Recipes for diffuse correlation spectroscopy instrument design using commonly utilized hardware based on targets for signal-to-noise ratio and precision. Biomedical Optics Express. 12 (6), 3265-3281 (2021).
- Zhou, C., et al. Diffuse optical correlation tomography of cerebral blood flow during cortical spreading depression in rat brain. Optics Express. 14 (3), 1125-1144 (2006).
- Selb, J., et al. Sensitivity of near-infrared spectroscopy and diffuse correlation spectroscopy to brain hemodynamics: simulations and experimental findings during hypercapnia. Neurophotonics. 1 (1), 015005-015005 (2014).
- Amendola, C., et al. Assessment of power spectral density of microvascular hemodynamics in skeletal muscles at very low and low-frequency via near-infrared diffuse optical spectroscopies. Biomedical Optics Express. 14 (11), 5994-6015 (2023).
- Craig, J. C., Broxterman, R. M., Wilcox, S. L., Chen, C., Barstow, T. J. Effect of adipose tissue thickness, muscle site, and sex on near-infrared spectroscopy derived total-[hemoglobin+ myoglobin]. Journal of Applied Physiology. 123 (6), 1571-1578 (2017).
- Nasseri, N., Kleiser, S., Ostojic, D., Karen, T., Wolf, M. Quantifying the effect of adipose tissue in muscle oximetry by near infrared spectroscopy. Biomedical Optics Express. 7 (11), 4605-4619 (2016).
- Ahmadinejad, M., Razban, F., Jahani, Y., Heravi, F. Limb edema in critically ill patients: Comparing intermittent compression and elevation. International Wound Journal. 19 (5), 1085-1091 (2022).
- Van Vo, T., Hammer, P. E., Hoimes, M. L., Nadgir, S., Fantini, S. Mathematical model for the hemodynamic response to venous occlusion measured with near-infrared spectroscopy in the human forearm. IEEE Transactions on Biomedical Engineering. 54 (4), 573-584 (2007).
- Junejo, R. T., Ray, C. J., Marshall, J. M. Cuff inflation time significantly affects blood flow recorded with venous occlusion plethysmography. European Journal of Applied Physiology. 119, 665-674 (2019).
- Baker, W. B., et al. Pressure modulation algorithm to separate cerebral hemodynamic signals from extracerebral artifacts. Neurophotonics. 3 (3), 035004-035004 (2015).
- Martirosov, A. L., et al. Improving transitions of care for critically ill adult patients on pulmonary arterial hypertension medications. American Journal of Health-System Pharmacy. 77 (12), 958-965 (2020).
- Bezemer, R., Lima, A., Klijn, E., Bakker, J., Ince, C. Assessment of tissue oxygen saturation during a vascular occlusion test using near-infrared spectroscopy: Role of the probe spacing and measurement site studied in healthy volunteers. Critical Care. (13), 1-2 (2009).
- Futier, E., et al. Use of near-infrared spectroscopy during a vascular occlusion test to assess the microcirculatory response during fluid challenge. Critical Care. (15), 1-10 (2011).
- Attia, J. R., et al. Deep vein thrombosis and its prevention in critically ill adults. Archives of Internal Medicine. 161 (10), 1268-1279 (2001).
- Reinhart, K., Bayer, O., Brunkhorst, F., Meisner, M. Markers of endothelial damage in organ dysfunction and sepsis. Critical Care Medicine. 30 (5), S302-S312 (2002).
- Georger, J. F., et al. Restoring arterial pressure with norepinephrine improves muscle tissue oxygenation assessed by near-infrared spectroscopy in severely hypotensive septic patients. Intensive Care Medicine. 36, 1882-1889 (2010).
- Lipcsey, M., Woinarski, N. C., Bellomo, R. Near infrared spectroscopy (NIRS) of the thenar eminence in anesthesia and intensive care. Annals of Intensive Care. 2 (1), 1-9 (2012).
- Kazune, S., Caica, A., Luksevics, E., Volceka, K., Grabovskis, A. Impact of increased mean arterial pressure on skin microcirculatory oxygenation in vasopressor-requiring septic patients: an interventional study. Annals of Intensive Care. 9 (1), 1-10 (2019).
- Lima, A., van Bommel, J., Jansen, T. C., Ince, C., Bakker, J. Low tissue oxygen saturation at the end of early goal-directed therapy is associated with worse outcome in critically ill patients. Critical Care. 13 (5), 1-7 (2009).
- Rogers, C. A., et al. Randomized trial of near-infrared spectroscopy for personalized optimization of cerebral tissue oxygenation during cardiac surgery. BJA: British Journal of Anaesthesia. 119 (3), 384-393 (2017).
- Jozwiak, M., Chambaz, M., Sentenac, P., Monnet, X., Teboul, J. L. Assessment of tissue oxygenation to personalize mean arterial pressure target in patients with septic shock. Microvascular Research. 132, 104068 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten