Method Article
Ein in vitro Assay zur Untersuchung der Thrombozytenmigration mit RGD-funktionalisierten Avidin-Biotin-Ethern
In diesem Artikel
Zusammenfassung
Es wird ein detailliertes Protokoll für die Abbildung einzelner migrierender Thrombozyten unter Verwendung von RGD-funktionalisierten Avidin-Biotin-Ethern mit einstellbarer Dichte bereitgestellt, das zeigt, dass Thrombozyten genügend Kraft erzeugen, um die Avidin-Biotin-Bindung zu brechen.
Zusammenfassung
Obwohl es sich um kernhaltige Zellfragmente handelt, sind Blutplättchen heute weithin für ihre vielseitigen Fähigkeiten bekannt. Sie bilden nicht nur Blutgerinnsel, um Blutungen nach Verletzungen zu verhindern, sondern bekämpfen auch Infektionen und erhalten die Gefäßintegrität bei entzündlichen Erkrankungen. Während hämostatische Pfropfen die kollektive Aktivierung und Aggregation von Blutplättchen erfordern, wird ihre Rolle beim Schutz entzündeter Blutgefäße auf Einzelzellebene übernommen. In diesem Zusammenhang haben neuere Daten gezeigt, dass Blutplättchen autonom wandern können, ein Prozess, der von der Mechanosensorik ihrer adhäsiven Umgebung abhängt. Hier wird ein detailliertes Protokoll zur Abbildung der Migration einzelner Thrombozyten vorgestellt, wobei ein dreischichtiges Beschichtungssystem verwendet wird, das aus einem Poly-L-Lysin-Transplantat-Poly(ethylenglykol) (PLL-PEG)-Biotin-Rückgrat (1), einem fluoreszierenden Avidin-Linker (2) und Biotin-cyclischem Arg-Gly-Asp (cRGD) (3) als Thrombozyten-Integrin-Bindungsmotiv besteht. Dieser reduktionistische Ansatz ermöglicht eine präzise Kontrolle der Adhäsionseigenschaften des Substrats und dient als einfacher, standardisierter In-vitro-Assay , um die Mechanismen zu untersuchen, die der Thrombozytenmigration zugrunde liegen. Die Ergebnisse deuten darauf hin, dass migrierende Blutplättchen, die an cRGD binden, Kräfte ausüben, die in der Lage sind, die Avidin-Biotin-Bindung zu stören. Darüber hinaus beeinflusst die Dichte von Biotin-cRGD sowohl die Thrombozytenausbreitung als auch die Migration signifikant.
Einleitung
Blutplättchen sind kleine kernhaltige Zellfragmente, die aus Megakaryozyten im Knochenmark gewonnen werden. Aktivierte Blutplättchen lagern sich zu Aggregaten zusammen, die die Grundlage eines Blutgerinnsels bilden, um Gefäßläsionen in der physiologischen Blutstillung abzudichten oder kranke Blutgefäße bei pathologischer Thrombose zu verschließen1. In den letzten Jahrzehnten hat sich jedoch gezeigt, dass Blutplättchen auch eine zentrale Rolle in der Pathophysiologie von Entzündungen, Infektionen und Malignität spielen, wo vielfältige Interaktionen mit Immunzellen, Krebszellen und eindringenden Krankheitserregern entscheidend für die Gestaltung der Immunantwort des Wirts sind 2,3. Neuere Daten haben gezeigt, dass Blutplättchen die Fähigkeit haben, autonom zu wandern4. Als Reaktion auf eine systemische Bakteriämie werden Blutplättchen in die Sinusoide der Leber rekrutiert, wo sie anhaften und wandern. Die Migration ermöglicht es Blutplättchen, Bakterien zu fangen und zu binden, was wiederum die Leukozytenaktivierung unterstützt. Bemerkenswert ist, dass die Blutplättchen während dieses Prozesses intravaskulär bleiben und nicht in das subendotheliale Gewebe wandern4. Darüber hinaus sind Blutplättchen Wächter von Gefäßentzündungen, indem sie entzündete Blutgefäße auf Mikroverletzungen untersuchen, die durch extravasierende Immunzellen verursacht werden5 und Migration einsetzen, um entzündete Blutgefäße zu schützen 6,7. Hier binden Blutplättchen mit ihren Integrinen das auf dem entzündeten Endothel abgelagerte Fibrinogen. Die Blutplättchen bilden dann lamelipodide Ausstülpungen, die es ihnen ermöglichen, die adhäsiven Eigenschaften ihrer Umgebung zu scannen. Die Blutplättchen polarisieren dann und wandern in Richtung höherer Dichten von Fibrinogen, ein Prozess, der als Haptotaxis bekannt ist. Die gerichtete Thrombozytenmigration unterstützt letztendlich die Positionierung an endothelialen Mikroläsionen, die Blutungen in entzündetem Gewebe, einschließlich Muskeln und Lunge, verhindern.
Die Thrombozytenmigration hängt entscheidend von den mechanischen Eigenschaften des adhäsiven Substratsab 4,8. Die Aufgabe, die mechanischen Eigenschaften der Umgebung zu erfassen und zu übertragen, wird in erster Linie durch Integrinrezeptoren vermittelt, bei denen es sich um transmembranheterodimere Proteine handelt, die aus einer α- und β-Untereinheit bestehen, wobei die extrazelluläre Domäne an den Liganden auf der extrazellulären Matrix bindet und die intrazelluläre Domäne über Adapterproteine an das Aktin-Zytoskelettbindet 9,10. Das am häufigsten vorkommende Thrombozytenintegrin ist αIIbβ3, und sein Hauptligand ist Fibrin(ogen)11. Die Integrin-Liganden-Interaktion löst Signalereignisse aus, die in der Bildung eines Arp2/3-getriebenen Lamellipodiums gipfeln, das die Vorderkante eines adhärenten Thrombozyten7 bildet. Adhärente Blutplättchen untersuchen sofort die mechanischen Eigenschaften ihrer adhäsiven Umgebung, indem sie daran ziehen4. Wenn Myosin-IIa-abhängige Zugkräfte die mechanische Stabilität der extrazellulären Matrix (z. B. Fibrin(ogen)) überwinden, brechen die Blutplättchen mechanisch die geschwächten Liganden auf und nutzen ihre lamellipodalen Vorsprünge, um die Mikroumgebung nach adhäsiven Liganden abzusuchen, neue Substratbindungen zu etablieren und aus der ligandenarmen Umgebung wegzuwandern6. Die Zellmigration, die durch nicht-proteolytische, mechanische Ligandendepletion angetrieben wird, spielt wahrscheinlich eine Rolle, die über die Thrombozytenfunktion hinausgeht, da es sich um ein allgemeines Phänomen zu handeln scheint, das bei Zellen beobachtet wird, die in der Lage sind, ihre adhäsive Matrix mechanisch umzubauen8. Die Rate der Ligandenverarmung bestimmt die Migrationsgeschwindigkeit und hängt sowohl von der Ligandenstabilität als auch von der Ligandendichte des Substratsab 8. Thrombozyten mit niedriger Ligandendichte sind in der Lage, technisch hergestellte Integrin-Liganden (zyklisches Arg-Gly-Asp (cRGD))6,7 mechanisch aufzubrechen, die an Glasdeckgläser mit Biotin-Avidin-Fesseln gebunden sind, die eine Bindungskraft von etwa 160 Piconewton (pN)12,13,14,15 aufweisen.
Hier werden diese Beobachtungen genutzt, um ein einfaches in vitro-Protokoll zur Erzeugung ligandenlabiler Adhäsionsflächen zu entwickeln, das die Untersuchung der Thrombozytenmigrationsmechanismen erleichtert. Die in diesem Protokoll beschriebene adhäsive Beschichtung besteht aus drei wesentlichen Elementen: (1) einem PLL-PEG-Biotin-Rückgrat und (2) einem Neutravidin-Fluorescein-Isothiocyanat (NA-FITC)-Linker, der die Bindung von (3) Biotin-cRGD (einem adhäsiven Liganden) an das PLL-PEG-Biotin-Rückgrat erleichtert (siehe auch Abbildung 1B). Die Stabilität dieses Konstrukts hängt von der Stärke der Biotin-Avidin-Bindung ab, die entweder an der (A) PLL-PEG-biotin-NA-FITC oder (B) FITC-NA-biotin-cRGD-Grenzfläche brechen kann. Darüber hinaus kann die Dichte der adhäsiven Liganden durch Anpassung des Verhältnisses von PLL-PEG-Biotin zu PLL-PEG in der unteren Schicht eingestellt werden. Die Unterbrechung der Bindung (A) führt zur Freisetzung von FITC aus der Beschichtung, was zu einer Abnahme des Fluoreszenzsignals unter den migrierenden Blutplättchen führt. Zusammen ermöglicht die in diesem Protokoll beschriebene Beschichtung daher eine präzise Abstimmbarkeit der mechanischen und adhäsiven Substrateigenschaften und ermöglicht eine einfache fluoreszenzbasierte Auslesung der Thrombozytenmigration.
Protokoll
Die in dieser Studie durchgeführten Tierversuche wurden unter Einhaltung aller relevanten ethischen Vorschriften für Studien mit Mäusen durchgeführt und durch die lokale Gesetzgebung zum Schutz von Tieren genehmigt (Regierung von Oberbayern, München, 190-15, 2015). In dieser Studie wurden weibliche und männliche C57BL/6-Mäuse im Alter von 8-10 Wochen (Körpergewicht 20-25 g) verwendet. Die Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Biotin-Neutravidin-Biotin-cRGD-Beschichtung
- Glasdeckgläser (24 mm x 24 mm; # 1,5) werden 1 min lang mit einem Gehalt von 20 % HNO3 beschallt, gefolgt von einer Beschallung mit Isopropanol, Ethanol und H2O für 1 min. Spülen Sie die Deckgläser nach jeder Beschallung ausgiebig in destilliertem Wasser (ddH2O) ab und trocknen Sie sie abschließend im Inkubator.
- Vorgereinigte Deckgläser werden 2 min lang mit O2 -Plasma in einem Plasmareiniger behandelt und anschließend mit klebrigen Objektträgern wie zuvor beschrieben zusammengebaut16. Klebrige Objektträger und Glasdeckgläser bilden einen Kanal zwischen ihnen (wie in Abbildung 1A gezeigt).
HINWEIS: Eine effiziente Plasmabehandlung ist wichtig. Verwenden Sie O2 als Plasmaquelle. - Füllen Sie den Kanal mit 2,5 μl PLL-PEG-Biotin (1 mg/ml), verdünnt in 97,5 μl PLL-PEG (1 mg/ml), und inkubieren Sie ihn 30 Minuten lang bei Raumtemperatur (RT), dann waschen Sie ihn dreimal mit PBS. PLL-PEG-Biotin bindet im folgenden Schritt Neutravidin, während das PLL-PEG-Rückgrat ein inertes Substrat bildet, das die unspezifische Bindung von Proteinen und Blutplättchen verhindert.
HINWEIS: Die Konzentration von PLL-PEG-Biotin in den Beschichtungslösungen definiert die endgültige Dichte der cRGD-Liganden. - 100 μl Neutravidin-FITC (25 μg/ml) zugeben und 30 min im Dunkeln bei RT inkubieren, dann dreimal mit PBS waschen.
HINWEIS: Die Neutravidin-FITC-Konzentration ist an die PLL-PEG-Biotin-Konzentration anzupassen. Erhöhen Sie die Neutravidin-FITC-Konzentration, wenn höhere PLL-PEG-Biotin-Dichten beschichtet werden. - 100 μl cyclo [Arg-Gly-Asp-D-Phe-Lys (Biotin-PEG-PEG)] (cRGD-biotin) (0,1-1 μM) zugeben, 30 min bei RT inkubieren und dreimal mit PBS waschen. Deckgläser sind gebrauchsfertig. Ein Schema der Beschichtung ist in Abbildung 1B dargestellt.
2. Isolierung von Mausplättchen aus dem Blut
- Bereiten Sie den modifizierten Tyrode-Puffer vor, der 136,9 mM NaCl, 12,1 mM NaHCO3, 2,6 mM KCl, 5,5 mM Glukose und 10 mM HEPES enthält, und stellen Sie den pH-Wert auf 7,4 und 6,5 ein.
- Anästhesieren Sie die Mäuse (gemäß institutionell anerkannten Protokollen) durch intraperitoneale Injektion von 0,5 mg/kg Fentanyl, 5 mg/kg Midazolam und 0,05 mg/kg Medetomidin. Nachdem Sie die Narkosetiefe durch Zehenkneifen bestätigt haben, entfernen Sie die Brusthaut mit einer Schere.
- Bereiten Sie eine 2-ml-Spritze (26 g Nadel) mit 150 μl Säure-Citrat-Dextrose (ACD) als Antikoagulans vor. Führen Sie die Nadel zwischen der zweiten und dritten Rippe auf der linken Seite des Brustbeins ein, um Blut aus dem Herzen zu entnehmen. Anschließend wird die Maus durch Zervixluxation eingeschläfert.
ANMERKUNG: (1) Zusammensetzung des ACD-Puffers: 85 mM tribasisches Natriumcitrat-Dehydrat und 65 mM Zitronensäuremonohydrat in 111 mM Glukose. (2) Die Blutabnahme sollte reibungslos durchgeführt werden, um die Bildung von Blutgerinnseln zu vermeiden. Etwa 1 ml Blut kann von 8-10 Wochen alten Mäusen gewonnen werden. - Mischen Sie das Blut mit 1 mL Tyrode-Puffer (pH 6,5) in einem 5 mL FACS-Röhrchen (Polystyrol mit rundem Boden) und zentrifugieren Sie bei 70 x g für 20 min bei RT bei ausgeschalteter Bremse.
- Nach der Zentrifugation nehmen Sie den oberen Teil (ca. 1 ml) mit plättchenreichem Plasma (PRP). Mischen Sie es mit 3 ml Tyrode-Puffer (pH 6,5) und fügen Sie 100 ng/ml Prostacyclin (PGI2) hinzu, um eine Thrombozytenaktivierung zu verhindern.
- Zentrifugieren Sie bei 1200 x g für 5 min bei RT, verwerfen Sie den Überstand, resuspendieren Sie das Pellet in 500 μl Tyrode-Puffer (pH 6,5) und messen Sie die Thrombozytenzahl mit einem Hämozytometer.
3. Maus-Thrombozytenmigration auf Biotin-Neutravidin-Biotin-cRGD-Beschichtung
- Ergänzen Sie den modifizierten Tyrode-Puffer (pH 7,4) mit 10 x 103/μl Mausplättchen, 1 mM CaCl2, 2 μM U46619 und 4 μM Adenosin-5'-diphosphat-Natriumsalz (ADP) und pipettieren Sie ein Gesamtvolumen von 240 μl in die in Schritt 1 vorbereiteten Kanäle.
- Erfassen Sie die Migration lebender Blutplättchen mit einem inversen Mikroskop, das mit einem Tischinkubator ausgestattet ist. Alternativ können Sie den Kanal 1 h bei 37 °C in einem Inkubator inkubieren.
- Fixieren Sie die Probe 10 min lang mit 4% Paraformaldehyd bei RT und waschen Sie sie fünfmal mit PBS.
- Permeabilisieren Sie die Blutplättchen 5 Minuten lang mit Triton-X (0,2 % in PBS) und waschen Sie sie fünfmal mit PBS.
- Verdünnen Sie 2,5 μl Alexa Fluor 594 Phalloidin (40x methanolisches Stamm) in 100 μl PBS. 30 Minuten lang dunkel mit Blutplättchen inkubieren, dann fünfmal mit PBS waschen.
- Bilden Sie die Objektträger unter einem Fluoreszenzmikroskop ab.
4. Quantifizierung
HINWEIS: Blutplättchen, die Filopodien (fingerartige Ausstülpungen) oder Lamellipodien (blattartige Ausstülpungen) bilden, wurden als adhärente Blutplättchen gezählt4. Blutplättchen mit einem Migrationsabstand von mehr als einem ihres Durchmessers wurden als wandernde Blutplättchen definiert.
- Anteil der migrierenden Blutplättchen: Zählen Sie die Adhäsions- oder Migrationszahlen der Blutplättchen mit dem Multi-Point-Tool in Fidschi. Klicken Sie mit der rechten Maustaste auf das Dropdown-Menü von Punktwerkzeug in der Symbolleiste, um das Mehrpunktwerkzeug auszuwählen. Berechnen Sie den Anteil der migrierenden Blutplättchen, indem Sie die Anzahl der migrierenden Blutplättchen durch die Anzahl der adhäsiven Blutplättchen dividieren.
- Mittlere Migrationsdistanz: Extrahieren Sie die Migrationsdistanz aus fixierten Proben, indem Sie die Länge des Migrationspfads messen, der in der Neutravidin-FITC-Beschichtung mit dem Free Hand Line Tool "eingeprägt" ist. Klicken Sie mit der rechten Maustaste auf das Dropdown-Menü "Gerade Linie " in der Symbolleiste, um das Werkzeug "Freihandlinie " auszuwählen.
- Deskriptoren der Thrombozytenform: Generieren Sie binäre Masken, indem Sie fluoreszierende Blutplättchen (Alexa594-Phalloidin) mit der Schwellenwertfunktion segmentieren. Wählen Sie in der Symbolleiste Bild > > Schwellenwert anpassen .
- Formdeskriptoren wie Fläche, Umfang, Zirkularität und Seitenverhältnis können in der Analyse von Partikeln abgerufen werden. Wählen Sie unter "Analysieren" > "Messwerte festlegen" die Option "Formdeskriptoren" aus und wählen Sie dann unter "Analysieren" > "Partikel analysieren" die Option "Ergebnisse anzeigen" aus.
Ergebnisse
Aktivierte Thrombozyten haften und verteilen sich leicht auf PLL-PEG-Biotin-Neutravidin-FITC-Biotin-cRGD-beschichteten Objektträgern (Abbildung 1C und Abbildung 2A; 0 min und 5 min) und polarisieren anschließend, indem sie ein Lamellipodium an der Vorderkante bilden (Abbildung 2A; 10 min). Während dieses Prozesses wanderte der Pseudokern (dunkler Bereich in der Mitte der Blutplättchen) von der Mitte zur Rückseite der Blutplättchen (Abbildung 2A). Polarisierte Blutplättchen beginnen dann ohne offensichtliche Richtungsabhängigkeit zu wandern (Abbildung 2A; 15 min und 20 min und Abbildung 2B). Wir beobachteten, dass Thrombozyten, die auf PLL-PEG-Biotin-Neutravidin-FITC-Biotin-cRGD-Beschichtungen migrieren, die Neutravidin-FITC-Biotin-PLL-PEG-Bindung aufbrechen können, was sich in der Verringerung der Fluoreszenzintensität entlang des Migrationspfads zeigt (Abbildung 1C und Abbildung 2A,B). Darüber hinaus reichert sich der gestörte Neutravidin-FITC-Biotin-cRGD-Komplex auf der Thrombozytenoberfläche an (Abbildung 2A,B). Dieses Phänomen ähnelt früheren Befunden, bei denen wandernde Blutplättchen Fibrinogen aus dem Substrat entfernten und es in ihrem offenen kanalikulären System (OCS) akkumulierten4.
Um zu untersuchen, wie die Ligandendichte die Thrombozytenmigration beeinflusst, wurde die cRGD-Dichte durch Variation des Verhältnisses von PLL-PEG-Biotin zu PLL-PEG in der ersten Beschichtungsschicht angepasst. Diese Daten zeigen, dass Mausplättchen bei einer Konzentration von 2,5 % PLL-PEG-Biotin eine optimale Migration erreichen. Die Migration ist sowohl bei niedrigeren (1%) als auch bei höheren (10%) Konzentrationen von PLL-PEG-Biotin reduziert (Abbildung 3A,B). Diese substratabhängigen Veränderungen des Migrationsverhaltens gehen mit Veränderungen in der Thrombozytenmorphologie einher (Abbildung 3C). Bei niedrigen Ligandendichten (1 %) breiten sich die Thrombozyten nicht ausreichend aus, was durch eine geringe projizierte Thrombozytenfläche und einen geringen Thrombozytenumfang belegt wird (Abbildung 3C). Dies deutet auf eine unzureichende Integrinaktivierung und Outside-In-Signalgebung hin7. Folglich sind die Blutplättchen nicht in der Lage, Kräfte auf die cRGD-Liganden auszuüben, das Substrat nicht umzugestalten und migrieren nicht (Abbildung 3A,B).
Bei einer mittleren Ligandendichte (2,5 %) kommt es zu einer signifikanten Zunahme der Thrombozytenfläche und des Thrombozytenumfangs (Abbildung 3C). Die Blutplättchen breiten sich effektiv aus, zerstören mechanisch die labilen cRGD-Liganden und migrieren (Abbildung 3A,B). Bei hohen Ligandendichten (10 %) nimmt die Spreizung jedoch zu, die Thrombozyten polarisieren jedoch nicht, was durch ein reduziertes Aspektverhältnis angezeigt wird (Abbildung 3C). Unter diesen Bedingungen bleiben die Blutplättchen an das klebrige Substrat gebunden und wandern nicht, da sie die labilen cRGD-Liganden nicht brechen können (Abbildung 3A,B).
Diese Ergebnisse zeigen, dass die Thrombozytenmigration entscheidend von den Hafteigenschaften des Substrats abhängt. Plättchen können nur wandern, wenn sie ausreichend mit adhäsiven Liganden interagieren und gleichzeitig Zugkräfte erzeugen, die stark genug sind, um die Zugtoleranz des adhäsiven Substratszu überwinden 4,6,7,8.
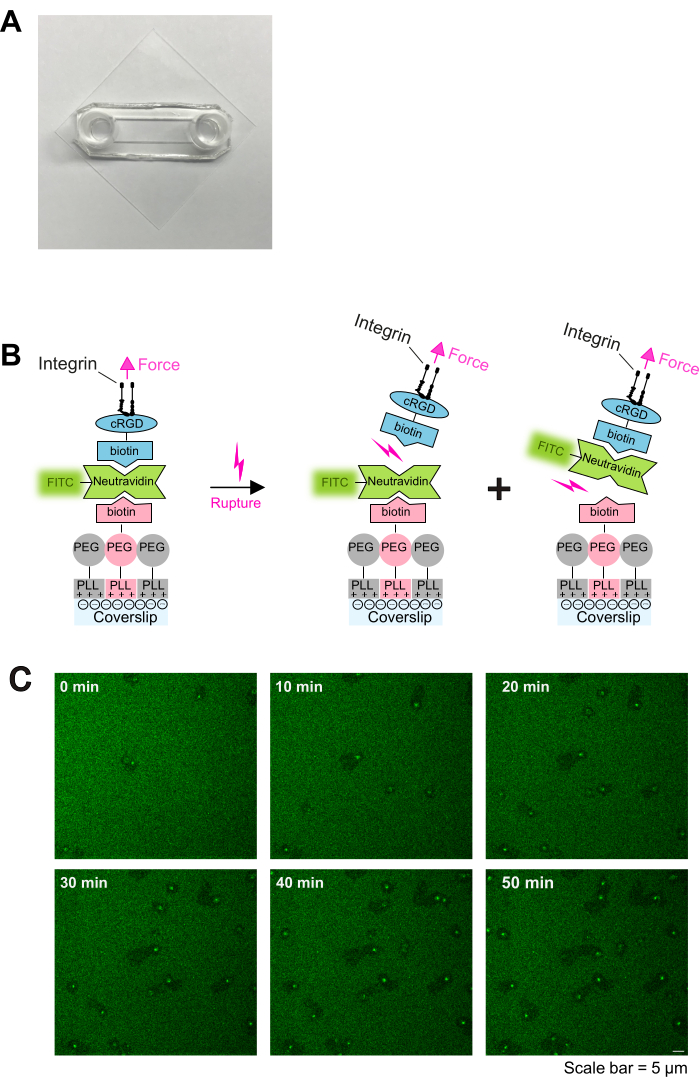
Abbildung 1: Beschichtungsverfahren und Live-Bildgebung der Thrombozyten-Substrat-Interaktion. (A) Foto der zusammengesetzten Kammer. (B) Grundsatz des Protokolls. Links: Schematische Darstellung der Beschichtung. Plasmabehandelte Glasdeckgläser wurden mit drei Schichten beschichtet. Die erste Schicht ist das Gemisch aus PLL-PEG und PLL-PEG-Biotin (das PLL-PEG-Rückgrat ist inert für die Zellen und verhindert eine unspezifische Bindung). Die zweite Schicht besteht aus Neutravidin-FITC und die dritte Schicht aus Biotin-cRGD. Neutravidin-FITC überbrückt PLL-PEG-Biotin und Biotin-cRGD. Blutplättchen binden über Integrine in der Plasmamembran an das Biotin-cRGD. Rechts: Illustration der Entbindung von Biotin-Avidin durch Thrombozytenintegrine. Blutplättchen üben durch Integrin-cRGD-Bindung Kräfte auf das Substrat aus und brechen entweder die obere cRGD-Biotin - Neutravidin-FITC - Bindung oder die untere Neutravidin-FITC - PLL-PEG-biotin - Bindung. Ein Bruch der unteren Bindung zwischen Neutravidin-FITC und Biotin-PLL-PEG führt zu einem verminderten Fluoreszenzsignal, während ein Bruch der oberen Bindung zwischen Biotin-cRGD und Neutravidin-FITC dies nicht tut. (C) Zeitreihen, die die Thrombozytenmigration und den Abbau labiler cRGD-Liganden zeigen. Bereiche mit reduzierter Fluoreszenz zeigen die Migrationsspuren von Blutplättchen an (siehe auch Abbildung 2A), und Bereiche mit erhöhter Fluoreszenz deuten auf eine FTIC-Neutravidin-Biotin-cRGD-Akkumulation auf migrierenden Blutplättchen hin. Maßstabsleiste: 5 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Immunfluoreszenz-Bildgebung der Thrombozytenmigration, die durch das remodellierte Substrat kodiert wird. (A) Repräsentative Filmsequenz der einzelnen Thrombozytenmigration. Links: Phasenkontrastbilder von wandernden Blutplättchen. Blutplättchen polarisieren, indem sie an der Vorderkante ein Lamellipodium bilden und anschließend migrieren. Rechts: Neutravidin-FITC wurde vom Substrat entfernt, so dass der "Fußabdruck" der Thrombozytenmigration zurückblieb. Rupturiertes cRGD-Biotin-Neutravidin-FITC reichert sich im Zentrum der wandernden Blutplättchen an. (B) Repräsentative Bilder der Thrombozytenmigration auf ligandenlabilen cRGD-Biotin-Avidin-Beschichtungen. Ober: Mit Phalloidin (Alexa FluorTM 594) gefärbte Blutplättchen zeigten eine große Lamellipodiumbildung und eine polarisierte Form, die an wandernde Blutplättchen erinnerte. Migrierende Blutplättchen brechen die cRGD-Biotin-Neutravidin-FITC-Bindung auf, wodurch Migrationswege auf dem Substrat entstehen, die durch ein reduziertes FITC-Signal angezeigt werden. Unten: beschnittenes Bild mit größerer Vergrößerung. (C) Die Migrationspfade wurden in Fidschi manuell mit gelben Linien gezeichnet. Maßstabsbalken: 5 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Das Verhältnis von PLL-PEG-Biotin zu PLL-PEG bestimmt die Thrombozytenmigration und -form. (A) Repräsentative Bilder von Thrombozyten auf 1%, 2,5% und 10% PLL-PEG-Biotin-Beschichtungen, Maßstabsbalken: 5μm. (B) Quantifizierung der Thrombozytenadhäsion, der Migrationseffizienz und des Migrationsabstands, n = 4 unabhängige Experimente; Mittelwert/SD; One-Way-ANOVA/Tukey; **p < 0,01; p < 0,001; p < 0,0001, ns: nicht signifikant (C) Quantifizierung der Deskriptoren der Thrombozytenform (Fläche, Umfang, Zirkularität und Aspektverhältnis), n = 4 unabhängige Experimente; Mittelwert/Min-Max; One-Way-ANOVA/Tukey; **p < 0,01; p < 0,001; p < 0,0001, ns: nicht signifikant. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In diesem Protokoll wird ein dreischichtiges Beschichtungsverfahren vorgestellt, das aus (1) einem PLL-PEG-Biotin-Rückgrat und (2) einem Neutravidin-FITC-Linker besteht, der die Bindung von (3) Biotin-cRGD (einem adhäsiven Liganden) an das PLL-PEG-Biotin-Rückgrat erleichtert (siehe auch Abbildung 1B), was eine präzise Abstimmbarkeit der mechanischen und adhäsiven Substrateigenschaften durch Variation des Verhältnisses von PLL-PEG-Biotin zu PLL-PEG ermöglicht und eine einfache fluoreszenzbasierte Auslesung der Thrombozytenmigration ermöglicht. Während dieses Protokoll FITC-konjugiertes Neutravidin und Alexa Fluor 594-konjugiertes Phalloidin verwendet, um die Migration und Form der Blutplättchen zu verfolgen, können andere Fluorophor-konjugierte Avidin und Phalloidin verwendet werden. Da alle Beschichtungsreagenzien, einschließlich PLL-PEG, PLL-PEG-Biotin, Neutravidin-FITC und cRGD-Biotin, sowie die Thrombozytenaktivatoren kommerziell verfügbar sind, kann dieses Experiment ohne großen zusätzlichen Aufwand durchgeführt werden. Der kritische Schritt ist die Plasmabehandlung, da eine ineffiziente Plasmabehandlung zu einer unzureichenden Bindung von PLL-PEG/PLL-PEG-Biotin an das Substrat führt, was zu einem Versagen der Thrombozytenadhäsion und -migration führt. Die Leistung des Plasmareinigers ist wichtig. In der Regel schneiden Plasmareiniger mit 13,6 MHz Generatoren besser ab als solche mit 40 KHz oder 100 KHz. Darüber hinaus ist eine Sauerstoffplasmaquelle besser geeignet als Umgebungsluft. Nach erfolgreicher Plasmabehandlung sind die Beschichtungsschritte nahezu nicht fehleranfällig.
Es wurde bereits gezeigt, dass Blutplättchen den mesenchymalen Migrationsmodus verwenden, der stark von den Substratadhäsionen abhängt 4,17. Analog zu Fibroblasten behindern niedrige Ligandendichten die Migration, da Blutplättchen Schwierigkeiten haben, am Substrat zu haften, während hohe Ligandendichten die Migration behindern, indem sie das Lösen fester Adhäsionen verhindern18 (Abbildung 3). Bei mittleren Dichten haften die Blutplättchen an, während Myosin-IIA-abhängige Zugkräfte pro Integrinbindung immer noch ausreichen, um die Adhäsionen aufzubrechen. Bemerkenswert ist, dass die hohe Affinität zwischen Integrin αIIbβ3 und seinem Liganden Fibrin(ogen) zum Abbau von Adhäsionen nicht durch die Freisetzung des adhäsiven Liganden führt, sondern vielmehr durch dessen Bruch oder Ablösung vom darunter liegenden Substrat, wie z. B. Endothelzellen in vivo oder Deckgläsern in vitro 4,6. Die Bindungskraft, die erforderlich ist, um Fibrinogen vom darunter liegenden Substrat zu lösen, wird stark von physikalischen und (bio-)chemischen Eigenschaften beeinflusst, die oft schwer zu kontrollieren sind, was zu einer erheblichen Variabilität der Migrationseffizienz führen kann. Der hier vorgestellte Assay bietet einen reduktionistischen Ansatz, um dieses Problem anzugehen. Die Bruchkraft der Avidin-Biotin-Bindung ist jedoch auf etwa 160 pN festgelegt, so dass ausgefeiltere Zugsensoren, wie z. B. solche, die auf einem doppelsträngigen DNA-Gurt basieren, verwendet werden müssen, um die Thrombozytenadhäsion in niedrigeren Kraftbereichenzu untersuchen 19.
Frühere Studien zeigten, dass die Thrombozytenmigration an bakteriellen Infektionen und Gefäßentzündungen in vivo beteiligt ist. Folglich zeigen Blutplättchen mit Migrationsdefekten, wie z. B. einer gestörten Myosinkontraktilität, Aktinpolymerisation oder Integrin-Outside-in-Signalgebung, eine beeinträchtigte Bakterienclearance und vaskuläre Integrität 4,6,7. Der hier vorgestellte Assay ist einfach, stabil und daher geeignet für das Screening von kleinen molekularen Inhibitoren und deren Auswirkungen auf die Thrombozytenmigration. Es bietet ein neuartiges In-vitro-Werkzeug zur Erforschung therapeutischer Ziele bei Entzündungen oder Thrombosen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde gefördert von der Deutschen Forschungsgemeinschaft (DFG; Deutsche Forschungsgemeinschaft) Projektnummern 514478744 und 514477451 an F.G. Das Projekt wird von der Europäischen Union (ERC, MEKanics, 101078110) gefördert. Die geäußerten Ansichten und Meinungen sind nur die des Autors/der Autoren und spiegeln nicht unbedingt die Ansichten und Meinungen der Europäischen Union oder der Exekutivagentur des Europäischen Forschungsrats wider. Weder die Europäische Union noch die Bewilligungsbehörde können für sie verantwortlich gemacht werden.
Materialien
| Name | Company | Catalog Number | Comments |
| Adenosine 5′-diphosphate sodium salt (ADP) | Sigma-Aldrich | A2754 | |
| Alexa Fluor 594 phalloidin | Thermofisher | A12381 | |
| Blood counter | Sysmex | XN-1000 | |
| Bottomless 6 channel sticky slide | IBIDI, sticky slides VI0.4 | 80608 | |
| Centrifuge | Eppendorf | 5804 | |
| Confocal microscope | Zeiss | LSM880 | |
| cyclo [Arg-Gly-Asp-D-Phe-Lys(Biotin-PEG-PEG)] | Peptide international | PCI-3697-PI | |
| FACS tubes | Corning Brand | 352052 | |
| FITC conjugate neutravidin | Thermofisher | A2662 | |
| Formaldehyde | Thermofisher | 28908 | |
| HEPES solution | Sigma-Aldrich | H0887 | |
| Phase contrast and epifluorescent microscope | Olympus | IX83 | |
| Plasma cleaner | Diener | 116531 | |
| PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin(50%) | Susos | PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin (50%) | |
| Poly(L-lysine)-graft-poly(ethylene glycol) co-polymer | Susos | PLL(20)-g[3.5]-PEG(2) | |
| Prostaglandin I2 sodium salt (PGI2) | Abcam | ab120912 | |
| Sonicator | BANDELIN | SONNOREX RK514M | |
| Ttriton X-100 20% v/v | Cayman Chemical | 600217 | |
| U46619 | Enzo Life Sciences | BML-PG023-0001) |
Referenzen
- Jackson, S. P. Arterial thrombosis--insidious, unpredictable and deadly. Nat Med. 17, 1423-1436 (2011).
- Kaiser, R., Escaig, R., Nicolai, L. Hemostasis without clot formation: how platelets guard the vasculature in inflammation, infection, and malignancy. Blood. 142 (17), 1413-1425 (2023).
- Gaertner, F., Massberg, S. Patrolling the vascular borders: Platelets in immunity to infection and cancer. Nat Rev Immunol. 19 (12), 747-760 (2019).
- Gaertner, F., et al. Migrating platelets are mechano-scavengers that collect and bundle bacteria. Cell. 171 (6), 1368-1382.e23 (2017).
- Gros, A., et al. Single platelets seal neutrophil-induced vascular breaches via GPVI during immune-complex-mediated inflammation in mice. Blood. 126 (8), 1017-1026 (2015).
- Nicolai, L., et al. Vascular surveillance by haptotactic blood platelets in inflammation and infection. Nature Comm. 11, 5778 (2020).
- Kaiser, R., et al. Mechanosensing via a GpIIb/Src/14-3-3zeta axis critically regulates platelet migration in vascular inflammation. Blood. 141 (24), 2973-2992 (2023).
- Sarkar, A., LeVine, D. N., Kuzmina, N., Zhao, Y., Wang, X. Cell migration driven by self-generated integrin ligand gradient on ligand-labile surfaces. Curr Biol. 30 (20), 4022-4032 (2020).
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nat Rev Mol Cell Biol. 20, 457-473 (2019).
- Shattil, S. J., Newman, P. J. Integrins: Dynamic scaffolds for adhesion and signaling in platelets. Blood. 104 (6), 1606-1615 (2004).
- Yuan, C., Chen, A., Kolb, P., Moy, V. T. Energy landscape of streptavidin-biotin complexes measured by atomic force microscopy. Biochemistry. 39 (33), 10219-10223 (2000).
- Florin, E. L., Moy, V. T., Gaub, H. E. Adhesion forces between individual ligand-receptor pairs. Science. 264 (5157), 415-417 (1994).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397, 50-53 (1999).
- Jurchenko, C., Chang, Y., Narui, Y., Zhang, Y., Salaita, K. S. Integrin-generated forces lead to streptavidin-biotin unbinding in cellular adhesions. Biophys J. 106 (7), 1436-1446 (2014).
- Fan, S., Lorenz, M., Massberg, S., Gaertner, F. Platelet migration and bacterial trapping assay underflow. Bio-Protocol. 8 (18), e3018 (2018).
- Lauffenburger, D. A., Horwitz, A. F. Cell migration: A physically integrated molecular process. Cell. 84 (3), 359-369 (1996).
- Palecek, S. P., Loftus, J. C., Ginsberg, M. H., Lauffenburger, D. A., Horwitz, A. F. Integrin-ligand binding properties govern cell migration speed through cell-substratum adhesiveness. Nature. 385, 537 (1997).
- Zhao, Y., Wetter, N. M., Wang, X. Imaging integrin tension and cellular force at submicron resolution with an integrative tension sensor. J Vis Exp. (146), e59476 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten