El equilibrio entre un líquido y su vapor depende de la temperatura del sistema; un aumento de la temperatura provoca un aumento correspondiente de la presión de vapor de su líquido. La ecuación de Clausius-Clapeyron proporciona la relación cuantitativa entre la presión de vapor de una sustancia (P) y su temperatura (T); predice la velocidad a la que aumenta la presión de vapor por unidad de aumento de temperatura.
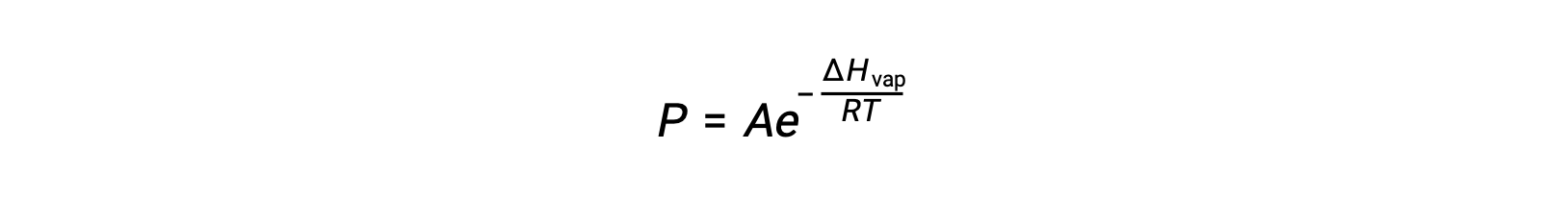
Donde ΔHvap es la entalpía de la vaporización del líquido, R es la constante de gas, y A es una constante cuyo valor depende de la identidad química de la sustancia. La temperatura (T) debe estar en kelvin en esta ecuación. Sin embargo, dado que la relación entre la presión de vapor y la temperatura no es lineal, la ecuación a menudo se reorganiza en forma logarítmica para producir la ecuación lineal:
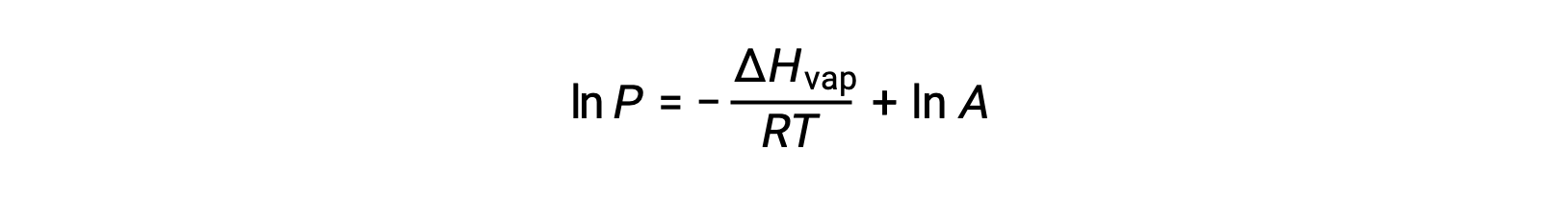
Para cualquier líquido, si se conoce la entalpía de la vaporización y la presión de vapor a una temperatura determinada, la ecuación de Clausius-Clapeyron permite determinar la presión de vapor del líquido a una temperatura diferente. Para ello, la ecuación lineal se puede expresar en un formato de dos puntos. Si a temperatura T1, la presión de vapor es P1, y a temperatura T2, la presión de vapor es P2, las ecuaciones lineales correspondientes son:
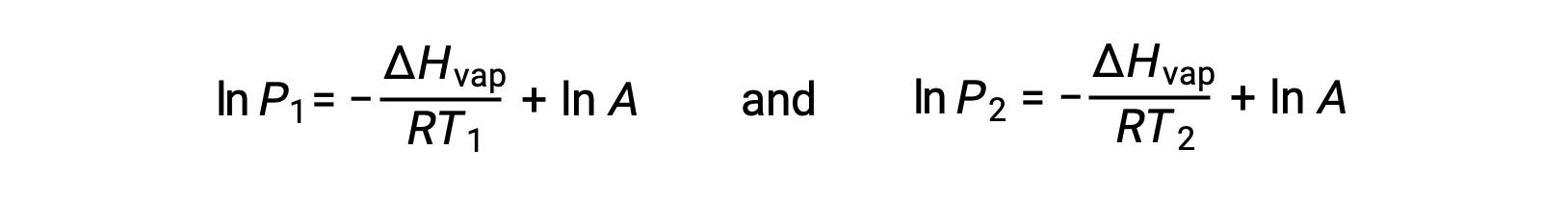
Dado que la constante, A, es la misma, estas dos ecuaciones se pueden reorganizar para aislar ln A y, a continuación, igualarlas entre sí:
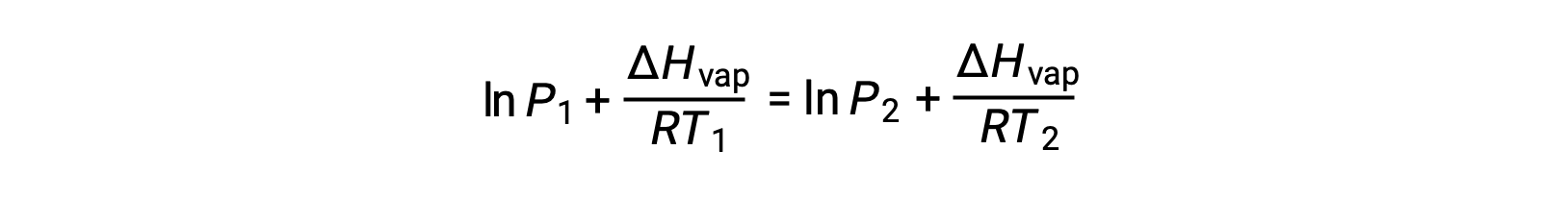
que se puede combinar en:
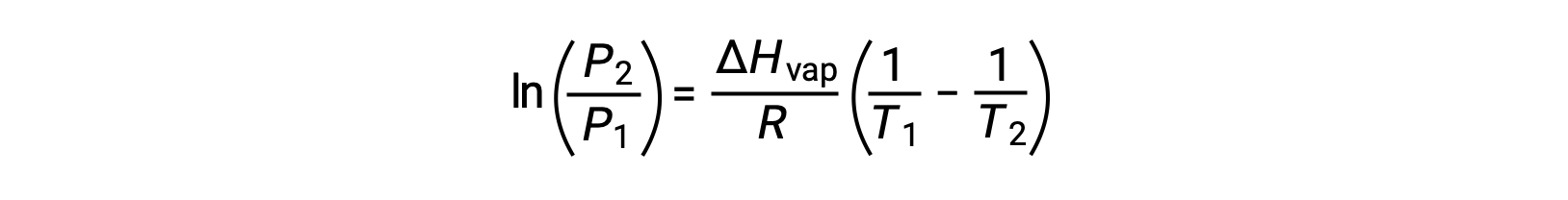
Este texto es adaptado de Openstax, Química 2e, Sección 10.3: Transiciones de Fase.
Del capítulo 11:

Now Playing
11.9 : Ecuación de Clausius-Clapeyron
Líquidos, sólidos y fuerzas intermoleculares
54.5K Vistas

11.1 : Comparación Molecular de Gases, Líquidos y Sólidos
Líquidos, sólidos y fuerzas intermoleculares
39.6K Vistas

11.2 : Fuerzas Intermoleculares Vs Intramoleculares
Líquidos, sólidos y fuerzas intermoleculares
83.4K Vistas

11.3 : Fuerzas Intermoleculares
Líquidos, sólidos y fuerzas intermoleculares
54.8K Vistas

11.4 : Comparando Fuerzas Intermoleculares: Punto de Fusión, Punto de Ebullición y Miscibilidad
Líquidos, sólidos y fuerzas intermoleculares
43.2K Vistas

11.5 : Tensión Superficial, Acción Capilar y Viscocidad
Líquidos, sólidos y fuerzas intermoleculares
27.1K Vistas

11.6 : Transiciones de Fase
Líquidos, sólidos y fuerzas intermoleculares
18.4K Vistas

11.7 : Transiciones de Fase: Vaporización y Condensación
Líquidos, sólidos y fuerzas intermoleculares
16.7K Vistas

11.8 : Presión de Vapor
Líquidos, sólidos y fuerzas intermoleculares
33.6K Vistas

11.10 : Transiciones de Fase: Punto de Fusión y Punto de Congelación
Líquidos, sólidos y fuerzas intermoleculares
12.1K Vistas

11.11 : Transiciones de Fase: Sublimación y Deposición
Líquidos, sólidos y fuerzas intermoleculares
16.4K Vistas

11.12 : Curvas de Calentamiento y Enfriamiento
Líquidos, sólidos y fuerzas intermoleculares
21.7K Vistas

11.13 : Diagramas de fase
Líquidos, sólidos y fuerzas intermoleculares
38.0K Vistas

11.14 : Estructuras de los Sólidos
Líquidos, sólidos y fuerzas intermoleculares
13.3K Vistas

11.15 : Sólidos Moleculares e Iónicos
Líquidos, sólidos y fuerzas intermoleculares
16.3K Vistas
See More
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados