11.9 : Equação de Clausius-Clapeyron
O equilíbrio entre um líquido e o seu vapor depende da temperatura do sistema; um aumento da temperatura provoca um aumento correspondente da pressão de vapor do seu líquido. A equação de Clausius-Clapeyron fornece a relação quantitativa entre a pressão de vapor de uma substância (P) e a sua temperatura (T); ela prevê a taxa à qual a pressão de vapor aumenta por unidade de aumento da temperatura.
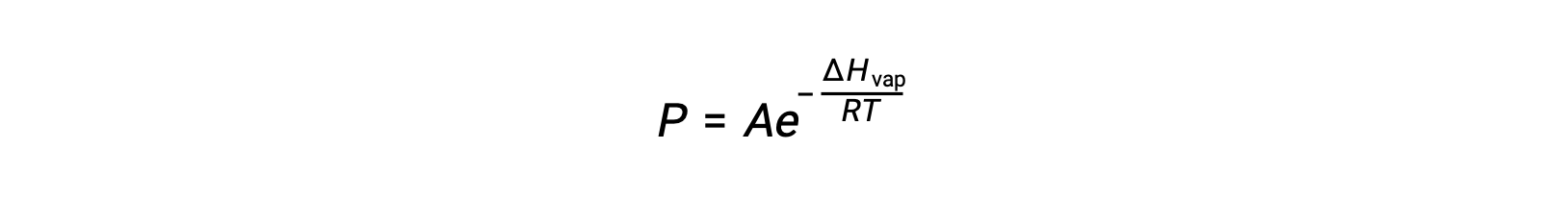
onde ΔHvap é a entalpia de vaporização para o líquido, R é a constante de gás, e A é uma constante cujo valor depende da identidade química da substância. A temperatura (T) deve estar em kelvin nesta equação. No entanto, como a relação entre pressão de vapor e temperatura não é linear, a equação é frequentemente rearranjada em forma logarítmica para produzir a equação linear:
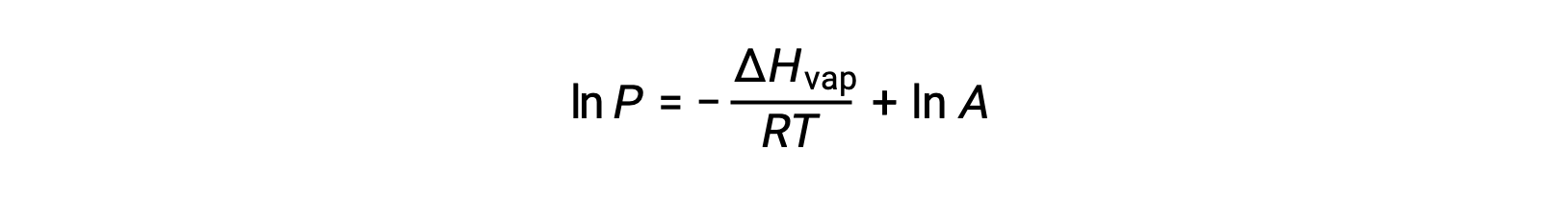
Para qualquer líquido, se for conhecida a entalpia da vaporização e a pressão de vapor a uma determinada temperatura, a equação de Clausius-Clapeyron permite determinar a pressão de vapor do líquido a uma temperatura diferente. Para isso, a equação linear pode ser expressa em formato de dois pontos. Se, à temperatura T1, a pressão de vapor for P1, e à temperatura T2, a pressão de vapor for P2, as equações lineares correspondentes são:
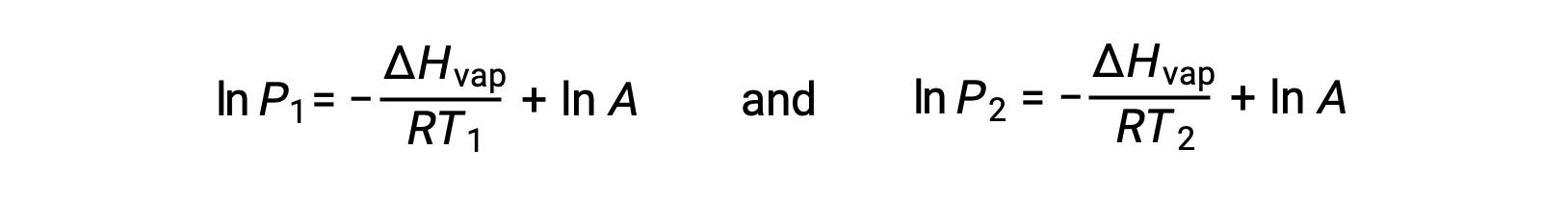
Como a constante, A, é a mesma, essas duas equações podem ser rearranjadas para isolar ln A e defini-las então iguais uma à outra:
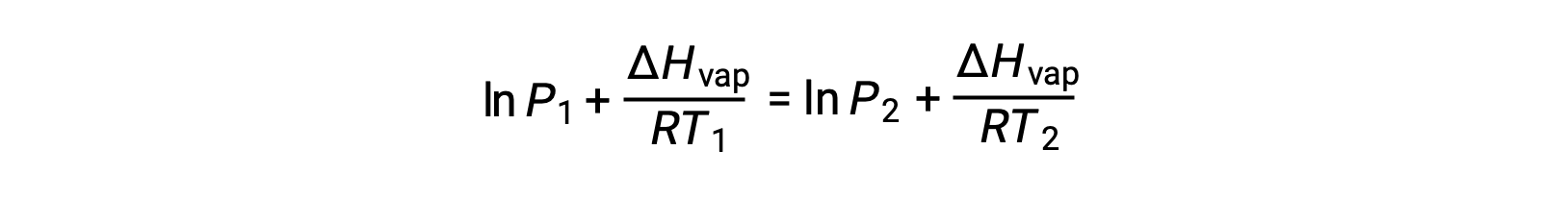
o que pode ser combinado em:
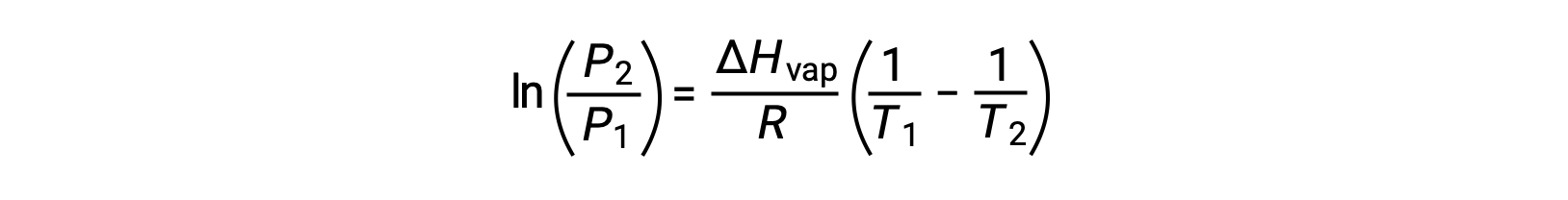
Este texto é adaptado de Openstax, Chemistry 2e, Section 10.3: Phase Transitions.
Do Capítulo 11:

Now Playing
11.9 : Equação de Clausius-Clapeyron
Líquidos, Sólidos e Forças Intermoleculares
55.2K Visualizações

11.1 : Comparação Molecular de Gases, Líquidos, e Sólidos
Líquidos, Sólidos e Forças Intermoleculares
40.2K Visualizações

11.2 : Forças Intermoleculares vs Intramoleculares
Líquidos, Sólidos e Forças Intermoleculares
84.9K Visualizações

11.3 : Forças Intermoleculares
Líquidos, Sólidos e Forças Intermoleculares
56.3K Visualizações

11.4 : Comparação de Forças Intermoleculares: Ponto de Fusão, Ponto de Ebulição e Miscibilidade
Líquidos, Sólidos e Forças Intermoleculares
43.6K Visualizações

11.5 : Tensão Superficial, Ação Capilar e Viscosidade
Líquidos, Sólidos e Forças Intermoleculares
27.3K Visualizações

11.6 : Transições de Fase
Líquidos, Sólidos e Forças Intermoleculares
18.6K Visualizações

11.7 : Transições de Fase: Vaporização e Condensação
Líquidos, Sólidos e Forças Intermoleculares
17.0K Visualizações

11.8 : Pressão de Vapor
Líquidos, Sólidos e Forças Intermoleculares
34.0K Visualizações

11.10 : Transições de Fase: Fusão e Solidificação
Líquidos, Sólidos e Forças Intermoleculares
12.2K Visualizações

11.11 : Transições de Fase: Sublimação e Deposição
Líquidos, Sólidos e Forças Intermoleculares
16.6K Visualizações

11.12 : Curvas de Aquecimento e Resfriamento
Líquidos, Sólidos e Forças Intermoleculares
22.3K Visualizações

11.13 : Diagramas de Fase
Líquidos, Sólidos e Forças Intermoleculares
39.0K Visualizações

11.14 : Estruturas de Sólidos
Líquidos, Sólidos e Forças Intermoleculares
13.6K Visualizações

11.15 : Sólidos Moleculares e Iônicos
Líquidos, Sólidos e Forças Intermoleculares
16.6K Visualizações
See More
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados