13.5 : Las Leyes de Velocidad Integrada: Dependencia entre la Concentración y el Tiempo
Mientras que la ley de velocidad diferencial relaciona la velocidad y las concentraciones de los reactivos, una segunda forma de ley de velocidad llamada ley de velocidad integrada relaciona las concentraciones de los reactivos y el tiempo. Las leyes de velocidad integrada se pueden utilizar para determinar la cantidad de reactivo o producto presente después de un período de tiempo o para estimar el tiempo necesario para que una reacción proceda en cierta medida. Por ejemplo, una ley de velocidad integrada ayuda a determinar el tiempo que debe almacenarse un material radiactivo para que su radiactividad decaiga hasta un nivel seguro.
Usando el cálculo, la ley de velocidad diferencial para una reacción química puede ser integrada con respecto al tiempo para obtener una ecuación que relacione la cantidad de reactivo/producto con el tiempo transcurrido de la reacción.
Reacciones de primer orden
La integración de la ley de velocidad para una reacción simple de primer orden (velocidad = k[A]) resulta en una ecuación que describe la variación en la concentración de los reactivos con el tiempo:
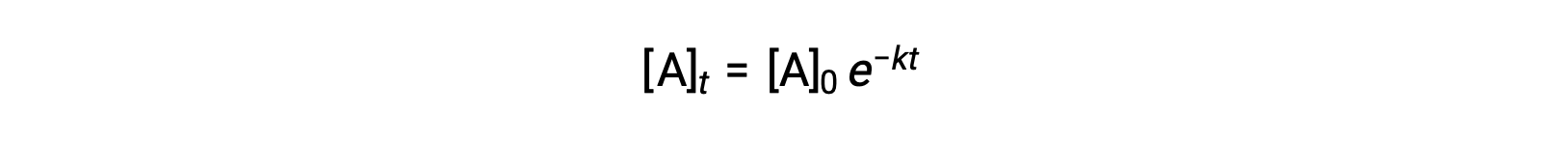
Aquí, [A]t es la concentración de A en cualquier momento t, [A]0 es la concentración inicial de A, y k es la constante de velocidad de primer orden. Para mayor comodidad matemática, esta ecuación se reorganiza a un formato que muestra una dependencia lineal entre la concentración y el tiempo que toma la forma de una ecuación de linea recta (y =mx +< em>b):
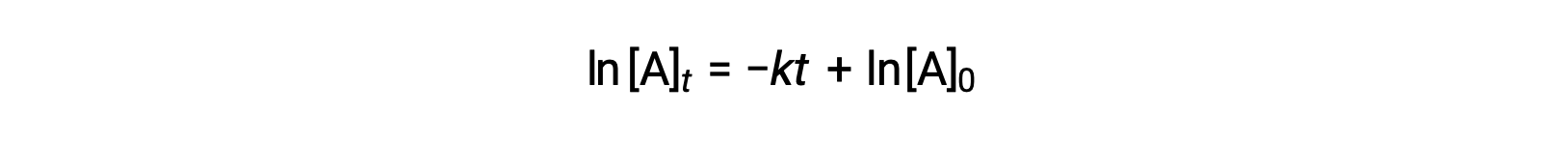
La ecuación sugiere que un gráfico de ln[A]t versus t para una reacción de primer orden es una línea recta con una pendiente de −k y una intercepción y de ln[A]0. Si un conjunto de datos de velocidad se grafican de esta manera pero no dan como resultado una línea recta, la reacción no es de primer orden en A.
Reacciones de segundo orden
La ley de velocidad diferencial para una reacción de segundo orden simple es, velocidad = k[A]2, y la ley de velocidad integrada es:
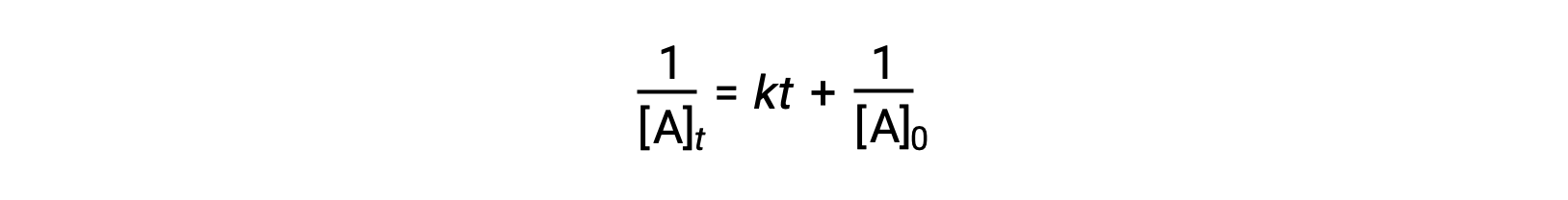
La ley de velocidad integrada de segundo orden también toma la forma de la ecuación para una línea recta. Según la ecuación, un gráfico de 1/[A]t versus t para una reacción de segundo orden es una línea recta con una pendiente de k y una intersección y de 1/[A]0. Si el gráfico no es una línea recta, la reacción no es de segundo orden.
Reacciones de orden cero
Para las reacciones de orden cero, la ley de velocidad diferencial es, velocidad = k. Una reacción de orden cero muestra una velocidad de reacción constante, independientemente de la concentración de sus reactivos. La cinética de orden cero se observa para algunas reacciones sólo en determinadas condiciones específicas. Estas mismas reacciones muestran diferentes comportamientos cinéticos cuando no se cumplen las condiciones específicas, y por esta razón, a veces se utiliza el término pseudo-orden cero más prudente.
La ley de velocidad integrada para una reacción de orden cero también es una función lineal, tomando la forma de y =mx + b:
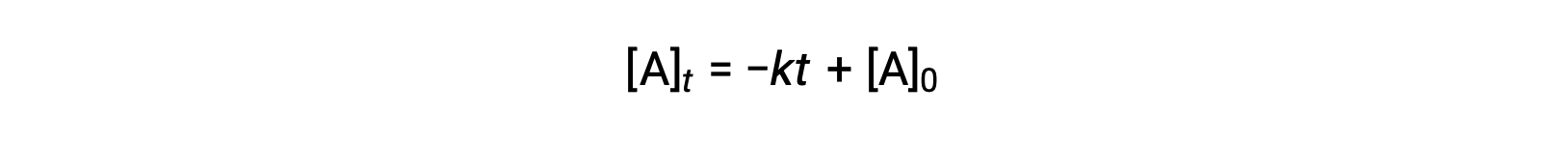
Un gráfico de [A] frente al tiempo t para una reacción de orden cero es una línea recta con una pendiente de −k y una intercepción y de [A]0.
Este texto es adaptado de Openstax, Química 2e, Sección 12.4: Leyes de Velocidades Integradas.
Del capítulo 13:

Now Playing
13.5 : Las Leyes de Velocidad Integrada: Dependencia entre la Concentración y el Tiempo
Cinética química
34.1K Vistas

13.1 : Velocidad de Reacción
Cinética química
50.6K Vistas

13.2 : Midiendo las Velocidades de Reacción
Cinética química
24.2K Vistas

13.3 : Concentración y Ley de Velocidad
Cinética química
29.6K Vistas

13.4 : Determinando el Orden de Reacción
Cinética química
54.6K Vistas

13.6 : Vida Media de una Reacción
Cinética química
33.9K Vistas

13.7 : Dependencia de la Temperatura en la Velocidad de Reacción
Cinética química
80.7K Vistas

13.8 : Los Gráficos de Arrhenius
Cinética química
37.9K Vistas

13.9 : Mecanismos de Reacción
Cinética química
25.0K Vistas

13.10 : Pasos Determinantes de la Velocidad
Cinética química
31.4K Vistas

13.11 : Catálisis
Cinética química
26.4K Vistas

13.12 : Enzimas
Cinética química
80.2K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados