Alors que la loi de vitesse différentielle relie la vitesse et les concentrations de réactifs, une seconde forme de la loi de vitesse appelée loi de vitesse intégrée relie les concentrations de réactifs et le temps. Les lois de vitesse intégrées peuvent être utilisées pour déterminer la quantité de réactif ou de produit présente au bout d'une période de temps ou pour estimer le temps nécessaire pour qu'une réaction se poursuive jusqu'à un certain point. Par exemple, une loi de vitesse intégrée permet de déterminer la durée de stockage d'une matière radioactive pour que sa radioactivité diminue à un niveau qui soit sûr.
En utilisant le calcul, la loi de vitesse différentielle pour une réaction chimique peut être intégrée par rapport au temps pour donner une équation reliant la quantité de réactif/produit au temps écoulé de la réaction.
Réactions de premier ordre
L'intégration de la loi de vitesse pour une réaction simple de premier ordre (vitesse = k[A]) conduit à une équation décrivant la variation de la concentration du réactif avec le temps :
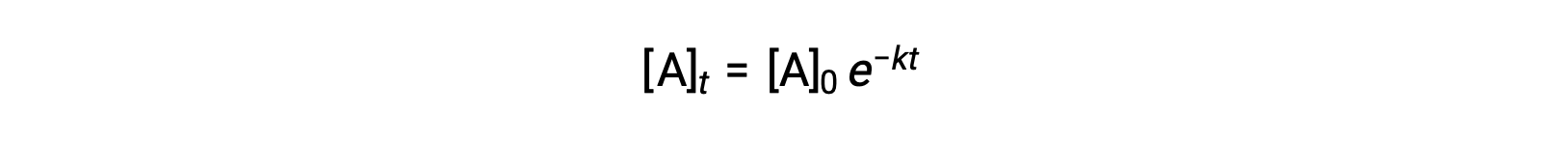
Ici, [A]t est la concentration de A à tout moment t, [A]0 est la concentration initiale de A et k est la constante de vitesse de premier ordre. Pour des raisons mathématiques, cette équation est réorganisée dans un format montrant une dépendance linéaire entre la concentration et le temps qui prend la forme de l'équation d'une ligne droite (y = mx + b) :
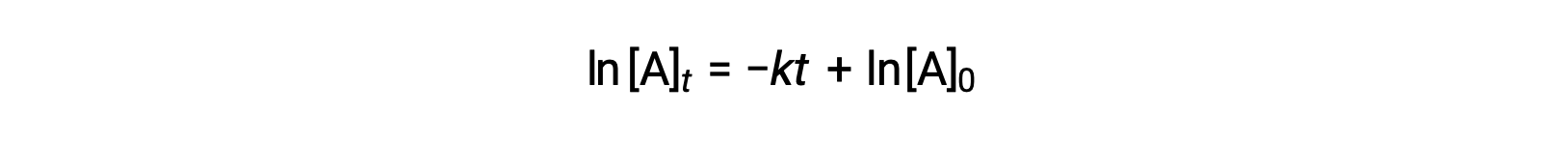
L'équation indique qu'un tracé de ln[A]t par rapport à t pour une réaction de premier ordre est une ligne droite avec une pente de −k et un y à l'origine de ln[A]0. Si un ensemble de données de vitesse est tracé de cette façon mais ne donne pas par une ligne droite, la réaction n'est pas du premier ordre pour A.
Réactions de deuxième ordre
La loi de vitesse différentielle pour une simple réaction de deuxième ordre est vitesse = k[A]2, et la loi de vitesse intégrée est :
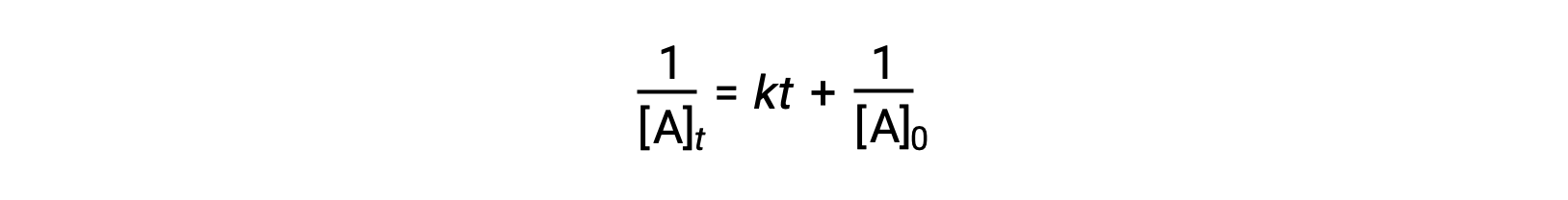
La loi de vitesse intégrée de deuxième ordre prend également la forme de l'équation d'une ligne droite. Selon l'équation, un tracé de 1/[A]t par rapport à t pour une réaction de deuxième ordre est une ligne droite avec une pente de k et une ordonnée à l'origine de 1/[A]0. Si le tracé n'est pas une ligne droite, la réaction n'est pas du deuxième ordre.
Réactions d'ordre zéro
Pour les réactions d'ordre zéro, la loi de vitesse différentielle est vitesse = k. Une réaction d'ordre zéro présente une vitesse de réaction constante, quelle que soit la concentration de son ou de ses réactifs. Des cinétiques d'ordre zéro sont observées pour certaines réactions seulement dans certaines conditions spécifiques. Ces mêmes réactions présentent des comportements cinétiques différents lorsque les conditions spécifiques ne sont pas remplies, et pour cette raison, le terme plus prudent de pseudo-ordre zéro est parfois utilisé.
La loi de vitesse intégrée pour une réaction d'ordre zéro est également une fonction linéaire, qui prend la forme de y = mx + b :
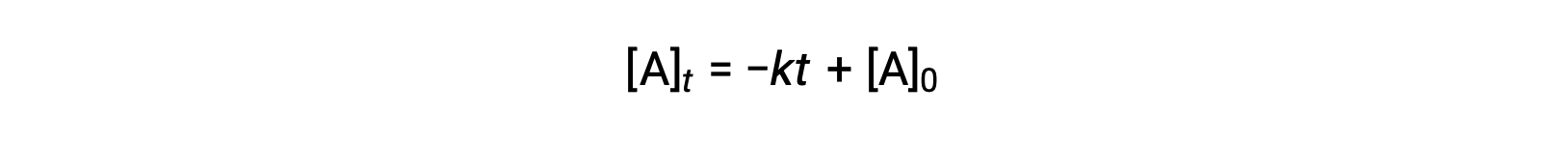
Un tracé de [A] par rapport au temps t pour une réaction d'ordre zéro est une ligne droite avec une pente de −k et un y à l'origine de [A]0.
Ce texte est adapté de Openstax, Chimie 2e, Section 12.4 : Lois de vitesse intégrées.
Du chapitre 13:

Now Playing
13.5 : Loi de vitesse intégrée : dépendance de la concentration sur le temps
Cinétique chimique
34.0K Vues

13.1 : Vitesse de réaction
Cinétique chimique
50.5K Vues

13.2 : Mesure des vitesses de réaction
Cinétique chimique
24.1K Vues

13.3 : Concentration et loi des vitesses de réaction
Cinétique chimique
29.6K Vues

13.4 : Détermination de l'ordre de réaction
Cinétique chimique
54.5K Vues

13.6 : Demi-vie d'une réaction
Cinétique chimique
33.8K Vues

13.7 : La vitesse de réaction dépend de la température
Cinétique chimique
80.7K Vues

13.8 : Tracés d'Arrhenius
Cinétique chimique
37.8K Vues

13.9 : Mécanismes de réaction
Cinétique chimique
24.9K Vues

13.10 : Étape cinétiquement déterminantes
Cinétique chimique
31.3K Vues

13.11 : Catalyse
Cinétique chimique
26.4K Vues

13.12 : Enzymes
Cinétique chimique
80.2K Vues