Method Article
Ingeniería penetran en las células de proteínas
En este artículo
Resumen
Transducción de la proteína permite la entrega directa de proteínas biológicamente activas en las células. En contraste con los métodos convencionales, tales como la transfección de ADN o transducción viral de este paradigma no invasiva permite la manipulación celular de alta eficiencia de una manera valorable eludir la toxicidad celular y el riesgo de la transformación oncogénica de la modificación genética permanente.
Resumen
La técnica de la transducción de la proteína permite la entrega directa de material biológicamente activo en células de mamífero [para una revisión véase 1,2]. Para esto se puede hacer uso de la capacidad de translocación de los péptidos de células llamadas penetrantes (CPP), designado también como dominios de la proteína de transducción (PTDs). El TAT-CPP derivan del tipo de virus de inmunodeficiencia humana 1 (VIH-1) Tat (trans-activador de la transcripción) de la proteína ha sido ampliamente utilizado. La carga positiva TAT promueve la permeabilidad celular superando así las barreras de la membrana celular por endocitosis y / o penetración de la membrana directa 2. En combinación con una señal de localización nuclear (NLS) de proteínas de fusión son capaces de entrar en el núcleo de la funcionalidad de exhibición. Nuestra presentación en video demuestra, como un ejemplo para la ingeniería de proteínas penetran en las células, la construcción, producción y aplicación de una versión penetran en las células del ADN Cre-modificando la enzima.
Cre recombinasa es un sitio específico que es capaz de reconocer y recombinar base de 34 sitios loxP par en células de mamíferos in vitro e in vivo. Por lo tanto el sistema Cre / loxP es ampliamente utilizado para inducir condicional mutaciones en el genoma de 3,4 células vivas. La entrega de los activos de la recombinasa Cre en las células, sin embargo, representa una limitación.
Se describe el sistema de vectores pSESAME, lo que permite una inserción directa del gen de interés, y ofrece una plataforma para clonar rápidamente los diferentes dominios y las etiquetas utilizadas en el vector de una manera conveniente y estandarizada. Reordenación de las diferentes etiquetas se ha demostrado que modificar las propiedades bioquímicas de las proteínas de fusión proporciona la posibilidad de lograr un mayor rendimiento y una mejor solubilidad. Demostramos cómo expresar y purificar recombinante de células permeables en proteínas y de E. coli. La funcionalidad de la proteína recombinante Cre es finalmente validada en el cultivo celular mediante la evaluación de su actividad recombinasa intracelular.
Protocolo
La construcción del vector de expresión y la expresión:
El vector de expresión pSESAME-Cre se construyó mediante la inserción de un fragmento de Cre-codificación en pSESAME a través de sitios de restricción NheI AvrII y con los métodos estándar de clonación. pSESAME codifica una proteína de fusión que consiste en una etiqueta de histidina, TAT-dominio, la secuencia NLS y Cre, abreviado HTNCre. Para la expresión de la HTNCre pSESAME Cre-se transformó en TUNER (DE3) Placi y se utiliza para preparar un stock de glicerol.
- Una cultura durante la noche fueron inoculados con una punta de pipeta recubiertas con bacterias transformadas a partir de las acciones de glicerol. La cultura a lo largo de la noche consistió en medio LB suplementado con 0,5% de glucosa [v / v] y carbenicilina a una concentración final de 50 mcg / ml y se dejó crecer a 37 ° C durante 16 horas.
- Al día siguiente, la densidad crecido durante la noche cultural se utilizó para inocular la cultura de expresión en una proporción de 1 a 40, y fue colocado en una incubadora a 37 ° C. La cultura la expresión de los medios de comunicación consistió en TB suplementado con 0,5% de glucosa [v / v] y la ampicilina a una concentración final de 100 mg / ml.
- En una OD 595 de 1,5 expresión de la cultura fue inducida con IPTG 0,5 mM durante 1 h.
- Posteriormente, las bacterias se recogieron por centrifugación a 5000 rpm durante 10 minutos en un rotor SLA3000.
- Pellets de bacterias fueron almacenadas a -20 ° C hasta la purificación.
Purificación de proteínas penetran en las células:
- Pellets de bacterias congeladas se resuspendieron en 10 ml de solución amortiguadora de lisis por la cultura frasco de litro por 15 minutos a temperatura ambiente.
- La suspensión se incubó con 1 mg / ml de lisozima para otros 15 minutos mientras se mezcla a temperatura ambiente.
- 25 U / mL benzonasa se añadió más tarde y se incubaron durante la mezcla durante 15 minutos a temperatura ambiente.
- Después de sonificación en hielo durante 1,5 minutos a 0,5 s pulsos a 45% de la potencia, 1 ml de tampón enfriado sal tartárico (TSB) por ml de suspensión se añadió cuidadosamente mientras se mezcla y se incubó durante 5 min en hielo. SDS-PAGE de muestras de la fracción de lisado (L) fue tomada.
- Lisado aclarado se obtuvo por centrifugación a 4 º C durante 30 minutos a 30.000 g. SDS-PAGE de muestras de las fracciones soluble (S) e insoluble (I) se tomaron.
- El sobrenadante fue transferido a nuevos tubos Falcon de 50 ml y se mezcla suavemente durante 1 hora a 4 ° C con 2 ml de 50% de Ni-NTA suspensión por litro de cultivo expresión inicial.
- La suspensión se empaquetó en una columna de flujo por gravedad EconoPac (SDS-PAGE muestra de flujo a través de la fracción (FT) fue tomada) y se lavó dos veces con 5 cama volúmenes de tampón de lavado. SDS-PAGE de muestras de las dos fracciones de lavado (W1 y W2) se recogieron.
- HTNCre que contienen fracciones se eluyeron con 3 dormitorios, volúmenes de tampón de elución de la muestra y de la fracción de eluido (E) para el análisis de SDS-PAGE fue tomada.
- Imidazol fue eliminado por diálisis frente a tampón de elución de la fracción de sal dos veces.
- La solución de proteína se concentró aún más por diálisis frente a tampón de glicerol en dos ocasiones. En todas las etapas de diálisis la relación de amortiguamiento para la muestra fue por lo menos 50. Este procedimiento dio lugar a una solución madre que contiene glicerol HTNCre a una concentración normal de entre 200 y 450 micras, es decir, 1 litro de cultivo de la expresión se traducirá en aproximadamente 12 mg de proteína. Muestra de las acciones de glicerol (GS) para análisis SDS-PAGE se recogieron. HTNCre solución de archivo puede ser almacenado a menos 20 ° C.
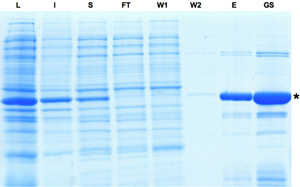
Figura 1: SDS-PAGE análisis de las muestras recogidas durante el proceso de purificación de la recombinasa Cre. Inducción de la expresión de Cre se indica por la banda dominante en la fracción de lisado. Aunque una parte de la proteína es la proteína insoluble Cre puede enriquecer como se ve en eluido y fracciones de glicerol de valores. L: Lisado, I: S insoluble,: sobrenadante, FT: de flujo continuo, W: Lavado, E: eluido, GS: Foto Gylcerol. Por favor, haga clic aquí para ver una versión ampliada de la figura 1.
Proteína de transducción en madre embrionarias murinas (ES) las células:
- Células madre embrionarias que lleva un condicional β-galactosidasa reportero construir cinco fueron sembradas como células individuales usando TrypLE ™ Express para la disociación de las células adherentes. Después de 4 a 6 horas, las células se habían re-unido y el medio fue removido.
- Posteriormente, las células ES fueron incubadas con HTNCre medio que contiene de 16 horas.
- Una cantidad adecuada de proteínas HTNCre (correspondiente a 10 M) de las acciones de glicerol se diluyó en medio de ES y se filtró posteriormente estéril (0,22 m).
- Después de medio proteína de transducción fue cambiado de nuevo al medio de crecimiento normal.
- Después de dos días las células fueron lavadas con PBS y fijadas con 4% paraformaldehído (PFA) durante 10 minutos.
- Dos aditradicionales etapas de lavado con PBS fueron ejecutados antes de X-Gal tinción se realizó.
- Las células fijadas fueron cubiertos con una capa de solución de tinción X-Gal 6, y se incubó durante la noche a 37 ° C.
Los resultados representativos:
Al día siguiente, X-Gal solución de tinción fue aspirado y las células se cubrieron con una capa de PBS para el análisis de microscopía. 80 a 100% de las células recombinadas se puede observar dentro de las células madre embrionarias murinas juzgar por la actividad β-galactosidasa.
Discusión
Durante el proceso de purificación de la proteína de fusión Cre que es importante no omitir la adición de hielo frío buffer TBS antes de la centrifugación. De lo contrario la recombinasa Cre tiende a precipitar en el búfer de glicerol.
Si la fracción de eluido parece enturbiarse debido a la alta concentración de tampón de elución de proteínas de fusión se debe agregar hasta que la solución haya desaparecido de nuevo.
La aplicación de 10 mM de proteína de fusión Cre generalmente resulta en una eficiencia de la recombinación de 80 a 100%. Suero fetal bovino (FCS) es un componente importante del medio de células ES inhibe fuertemente la transducción de las proteínas. Por lo tanto, alta concentración de la recombinasa Cre tuvo que ser utilizado. Cuando se trabaja en condiciones libres de suero menos proteínas (0,5 a 2 M) se puede utilizar para lograr eficiencias similares recombinación.
Con el sistema de vector pSESAME a mano se puede aplicar la técnica de la transducción de la proteína con otras proteínas incluyendo factores de transcripción como Oct4 y Sox2 7 y 8 Scl/Tal1.
Agradecimientos
Damos las gracias a Oliver Brüstle y todos los miembros del Grupo de Ingeniería madre Celular de la Universidad de Bonn, de apoyo y las valiosas discusiones. Damos las gracias a Sabine Schenk para la preparación de la SDS-PAGE y el apoyo permanente durante todo el proyecto. Nicole Russ y Magerhans Anna proporcionan un excelente soporte técnico. Además, nos gustaría agradecer a Andreas Bär y Sheila Mertens para la producción de la película. Este trabajo fue apoyado por becas de la Fundación Volkswagen (Az I/77864) y el Ministerio Alemán de Educación e Investigación (BMBF, 01 GN 0813).
Materiales
| Name | Company | Catalog Number | Comments |
| TUNER (DE3) pLacI | Novagen, EMD Millipore | 70625 | |
| Glycerol | Carl Roth GmbH | 3783.2 | |
| Na2HPO4 | Carl Roth Gmbh | T876.1 | |
| Trizma Base | Sigma-Aldrich | T1503 | |
| HCl | Carl Roth Gmbh | 4625.1 | |
| Imidazol | Carl Roth Gmbh | X998.4 | |
| NaCl | Carl Roth Gmbh | 9265.2 | |
| Yeast Extract | Carl Roth Gmbh | 2363.4 | |
| Trypton/Pepton | Carl Roth Gmbh | 8952.4 | |
| K2HPO4 | Carl Roth Gmbh | P749.2 | |
| KH2PO4 | Carl Roth Gmbh | 3904.1 | |
| Ampicillin | Sigma-Aldrich | A9518 | |
| Carbenicillin | Sigma-Aldrich | 6344.2 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Lysozyme | Sigma-Aldrich | 62971 | |
| Benzonase | Novagen, EMD Millipore | ||
| L-Tartaric acid, disodium salt | Sigma-Aldrich | ||
| 50% Ni-NTA slurry | Invitrogen | R901-15 | |
| EconoPac columns | Bio-Rad | 732-1010 | |
| Sterile filter 0,22μm | Whatman, GE Healthcare | ||
| Paraformaldehyde (PFA) | Sigma-Aldrich | ||
| LB medium | Yeast extract, Trypton/Pepton, NaCl | ||
| TB medium | Yeast extract, Trypton/Pepton, Glycerol, K2HPO4, KH2PO4 | ||
| Lysis Buffer | 50 mM Na2HPO4, 5 mM Tris, pH 7.8 | ||
| Tartaric Salt Buffer (TSB) | PTB containing 2 M L-Tartaric acid, disodium salt, and 20 mM Imidazol | ||
| Washing Buffer | PTB, 500 mM NaCl, 15 mM Imidazol | ||
| Elution Buffer | PTB, 500 mM NaCl, 250 mM Imidazol | ||
| High Salt Buffer | 600 mM NaCl, 20 mM HEPES, pH 7.4 | ||
| Gylcerol Buffer | 50% glycerol, 500 mM NaCl, 20 mM HEPES, pH 7.4 | ||
| TrypLE™ Express | Invitrogen | ||
| ESGRO (LIF) | EMD Millipore | ||
| NEAA | GIBCO, by Life Technologies | 11140035 | |
| L-Glutamin | GIBCO, by Life Technologies | 25030024 | |
| β-Mercapt–thanol | GIBCO, by Life Technologies | 31350010 | |
| DMEM | GIBCO, by Life Technologies | 11960044 | |
| PBS | GIBCO, by Life Technologies | ||
| Fetal Calf Serum (FCS) | PAA Laboratories | ||
| X-Gal staining solution: | 4 mM K3(FeIII(CN)6), 4 mM K4(FeII(CN)6), 2mM MgCl2 0.4 mg/mL X-Gal solved in PBS | ||
| K3(FeIII(CN)6) | Sigma-Aldrich | P-3367 | |
| K4 (FeII(CN)6) | Sigma-Aldrich | P-9387 | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| X-Gal | Sigma-Aldrich | B4252 |
Referencias
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol Med. 13 (10), 443-448 (2007).
- Edenhofer, F. Protein transduction revisited: novel insights into the mechanism underlying intracellular delivery of proteins. Curr Pharm Des. 14 (34), 3628-3636 (2008).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6 (1), 7-28 (2004).
- Nolden, L. Site-specific recombination in human embryonic stem cells induced by cell-permeant Cre recombinase. Nat Methods. 3 (6), 461-467 (2006).
- Zhang, Y. Inducible site-directed recombination in mouse embryonic stem cells. Nucleic Acids Res. 24 (4), 543-548 (1996).
- Peitz, M. Enhanced purification of cell-permeant Cre and germline transmission after transduction into mouse embryonic stem cells. Genesis. 45 (8), 508-517 (2007).
- Bosnali, M., Edenhofer, F. Generation of transducible versions of transcription factors Oct4 and Sox2. Biol Chem. 389 (7), 851-861 (2008).
- Landry, J. R. Runx genes are direct targets of Scl/Tal1 in the yolk sac and fetal liver. Blood. 111 (6), 3005-3014 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados